膜诱导技术联合股前外侧穿支分叶嵌合组织瓣治疗肢体骨感染伴多处腔隙性创面
张广超 宋力 周树萍 胡智玉 宋德恩 杨涛 熊颖杰 陈佳 幸超峰 李士民 周明武
在创伤骨科领域,内固定术后骨感染、骨外露伴有多处腔隙性创面等并发症较常见,部分创面因骨髓炎死腔存在而经久不愈形成慢性感染,疗程长,易复发,治疗难度大,致残率高。膜诱导技术广泛应用于治疗感染、肿瘤或先天疾病等导致的骨缺损[1]。股前外侧穿支分叶嵌合组织瓣,皮瓣与肌瓣组合移植,可立体修复肢体多发腔隙创面并加强抗感染能力。我中心对28例内固定术后发生骨感染并伴肢体多发腔隙性创面病人采用膜诱导技术联合股前外侧穿支分叶嵌合组织瓣在保留内固定,同时行骨感染抗感染及创面修复治疗,取得良好效果。现报道如下。
对象与方法
一、对象
2016年1月~2019年6月收治内固定术后发生骨外露感染的肢体多处腔隙性创面病人28例,男性15例,女性13例;年龄17~58岁,平均38.3岁。致伤原因:车祸伤12例,机器绞伤8例,重物砸伤8例。损伤部位:足踝部8例,手部6例,小腿12例,前臂2例。均为内固定术后出现窦道入院,受伤至本次入院时间为 2~6周,平均28天。24例为2处邻近伴有骨感染腔隙创面,4例为3处邻近伴有骨感染腔隙创面。为降低术后皮瓣血管危象风险,术中将4例3处创面中的两处邻近创面切开合并为1处创面,创面范围4 cm×6 cm~8 cm×14 cm;经清创后骨折断端外露,骨缺损长度3~6 cm。本研究已获得本单位伦理委员会批准,所有病人均知情同意并签署知情同意书。
二、方法
1.创面清创:切除窦道周围1~2 cm皮肤及炎性组织,由浅及里彻底清除,逐层暴露直达骨折端周围,取出失效内固定螺钉,广泛切除硬化骨、坏死骨以及纤维化缺血软组织,直至骨面及软组织渗血良好为止,暨截骨面出现“红辣椒”征。取钢板周围分泌物、感染性死骨等做细菌培养, 6 000~10 000 ml生理盐水脉冲冲洗,再用0.1%新洁尔灭溶液浸泡30分钟,共3遍。术中记录骨感染病灶大小,清创后骨腔大小以及软组织缺损面积。骨水泥载万古霉素(两者比例10∶1~10∶2)植入占位骨缺损部位,同时骨水泥全程覆盖骨外露及外露钢板。术中也可在髓腔内植入载抗生素硫酸钙缓释链珠。一般局部抗感染治疗12周后,若再无窦道形成,且术前血象、红细胞沉降率、C反应蛋白等正常,取出骨水泥,在骨缺损部位充分植骨,如自体髂骨量不足,予以同种异体骨补充,重建骨连续性。术中根据骨折稳定情况,可再植入接骨板或克氏针内固定。若窦道再次形成,需再次扩创及更换载抗生素骨水泥,直至到达局部感染控制,再行修复骨缺损。
2.皮瓣切取:依据创面形状、大小、合并死腔大小以及所需血管蒂长度,选择对侧肢体设计旋股外侧动脉降支穿支分叶嵌合组织瓣。先于设计皮瓣外侧缘切开皮肤,探查找到皮瓣穿支;再于血管蒂部分离股直肌与股外侧肌间隙,顺间隙找到旋股外侧动脉降支血管,并沿旋股外侧动脉降支向远端分离,找到降支发出的皮瓣穿支及肌肉穿支,分别切取穿支肌瓣和穿支皮瓣,进行分离各个穿支,各独立组织瓣完全游离后逐一检查其血运,确定血运可靠后依据所需血管蒂长度断蒂。穿支肌瓣填塞腔隙,即可加强局部抗感染能力,同时有利于诱导膜的形成,穿支皮瓣覆盖创面,将旋股外侧动脉降支与受区主干动脉近端断端、端侧或Flow-through吻合,并吻合其伴行静脉。皮瓣供区创口直接闭合或植皮修复。
3.术后处理: 术后常规给予抗感染、抗凝血及抗血管痉挛药物治疗。即使培养出较为敏感的高级别限制级抗生素,如利奈唑胺、万古霉素等,考虑到其全身毒性、成本、细菌变异性等因素,使用一代或者二代头孢菌素1~2周即可。建议卧床、多重耐药病人,常规低分子量肝素钙使用7天。皮瓣下引流48~72小时,并监测皮瓣血液循环情况,术后2周拆线。同时早期规范进行肢体功能锻炼。
结果
所有病人术后获12~24个月,平均随访18个月,皮瓣成活良好,骨质愈合良好,均未出现骨感染复发。其中22例在术后12周感染控制,二期行植骨治疗;6例在术后12周因局部骨感染尚未控制,再行二次扩创及更换载抗生素骨水泥后骨感染控制,再行植骨治疗;在植骨术后6~18个月。复查X线,根据骨质愈合情况决定取出内固定。本组总治疗时间为9~18个月,平均12个月。
典型病例:男性,46岁,交通事故伤致左足开放性外伤,急诊于外院行内、外固定手术,术后4周左足形成2处伴骨感染外露的腔隙性创面。入院后一期予以膜诱导技术联合股前外侧穿支分叶嵌合组织瓣治疗,二期予以取自体髂骨植骨修复骨缺损。见图1~4。
讨 论
骨感染腔隙性创面的治疗包括骨感染的治疗和创面修复。骨感染治疗的关键是控制感染[2]。骨感染的特点:(1)感染细菌的多样性,标准剂量的抗生素可以杀死浮游状态的敏感菌株,但却对包裹在生物膜中的同种病原体效果有限甚至无效[3-4]。随着细菌谱的变化和细菌耐药性的增加、细菌 L型的存在,导致治疗难度增加[5]。(2)病灶周围微循环差,即使是敏感抗生素,经全身血液循环后输送到靶向区域的抗生素难以达到有效杀菌浓度,起不到杀死病原菌的作用,同时全身长期应用抗生素不良反应大。感染灶周围难以彻底清创,尚有细菌隐匿在病灶内,同时死腔填塞困难,又易造成细菌持续滋生。目前临床治疗创伤性骨感染的基本原则是:彻底清创,充分引流,有效抗生素治疗,坚强固定,消灭死腔,建立正常软组织覆盖改善局部血液循环[6]。临床治疗过程中发现,在骨感染病原菌检测中金黄色葡萄球菌占50%~75%[7]。万古霉素是治疗金黄色葡萄球菌常用敏感药物,其本身具有良好热稳定性,可溶于载体进行持续、缓慢释放,且全身或局部不良反应轻[8-9]。目前越来越多的文献报道,采用膜诱导技术,即聚甲基丙烯酸甲酯携带万古霉素植入骨感染骨缺损部位,可在局部持续释放高浓度抗生素长期、有效治疗骨髓炎,同时诱导生成诱导膜,为二期植骨提供良好的局部条件,是目前临床治疗骨髓炎骨缺损的有效方案[10-11]。

A.胫侧形成伴有肌腱坏死外露的创面;B.腓侧形成伴有钢板外露、外侧楔骨及第4、5跖骨基底部骨感染和骨缺损的深部死腔

A、B.术中设计并切取股前外侧嵌合分叶组织瓣;C.术中予以拆除胫侧外置钢板(因阻挡皮瓣覆盖),更换克氏针髓内固定,保留钢板内固定,载万古霉素骨水泥植入,并股前外侧嵌合分叶组织瓣修复深腔创面;D术后X线片示骨缺损区骨水泥填充
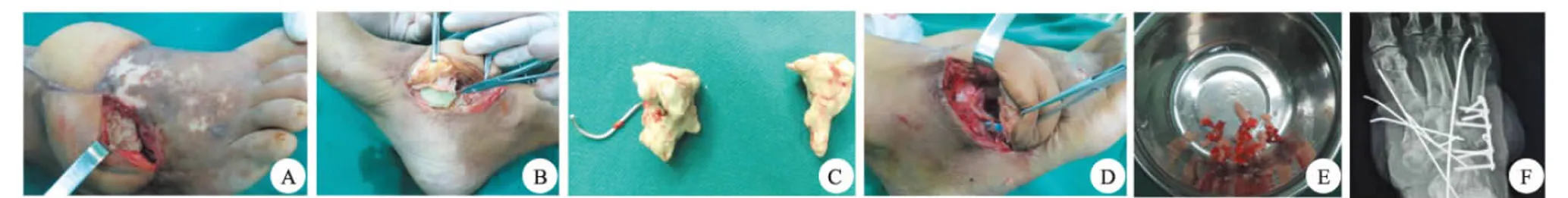
A、B、C、D.术后12周感染控制,取出骨水泥;E取自体髂骨+同种异体骨植骨修复骨缺损;F.术后X线示骨缺损处填植骨充分图3 二期手术情况

A.植骨术后12个月足部伤口愈合良好,再无出现窦道等感染情况,功能恢复可;B、C.复查X线片示骨质重建愈合良好
骨感染腔隙性创面的治疗不仅需要修复皮肤软组织缺损,还要填塞腔隙,这就需要皮瓣嵌合肌瓣或肌皮瓣修复[12]。股前外侧穿支皮瓣被称为临床“万能皮瓣”[13-15],供养股前外侧皮肤穿支一般为2~5支,同时主干动脉可发出多条肌肉穿支营养股直肌及股外侧肌,可根据穿支情况及受区创面切取分叶皮瓣,同时切取嵌合肌瓣,股外侧肌肌腹较大,进入肌肉的血管分支较多,可切取一个或多个嵌合肌瓣,肌肉切取后肌瓣血供好,修复腔隙缺损同时增加局部抗感染能力,切取股前外侧肌肌瓣后对大腿功能影响小,而且肌肉切取后也利于创面的直接闭合。穿支分叶皮瓣及肌瓣各有穿支血管蒂与血管蒂旋股外侧动脉降支相连,组织瓣可根据血管蒂长度进行灵活调整,肌瓣填充死腔,皮瓣覆盖创面,且仅需吻合旋股外侧动脉降支,既可实现各个创面的修复,该嵌合分叶皮瓣适用于肢体多发腔隙性创面的修复,同时也可切取为Flow-through嵌合分叶皮瓣修复伴有主干动脉缺损或避免牺牲肢体主干动脉的多发性腔隙创面[16]。
骨感染骨缺损治疗:(1)所有病例均在保留内固定装置的前提下进行治疗。内固定保留与否,一直是内固定术后发生骨感染治疗焦点,本组病例均为早、中期骨感染,自内固定手术至发现骨感染时间不超过10周,且内固定固定牢固,未失效,骨感染仅局限于骨折断端,感染灶尚未向远处软组织浸润[17-18]。(2)扩创是骨感染治疗的重中之重,彻底地清除坏死组织及无血运骨质,直至断端出现“红辣椒征”,采用远离骨折端区域开窗并有限扩髓,髓内大量生理盐水脉冲灌洗,利用机械方法完成较为彻底清除黏附的细菌生物膜。(3)根据术前细菌培养结果选用敏感抗生素。(4)由于抗生素骨水泥,或联合载抗生素硫酸钙链珠保驾护航,术后仅使用一代或者二代头孢菌素1~2周即可,避免使用高级别抗生素。感染控制标准:伤口愈合良好,术后8~12周内再无窦道形成,且间隔2周的血象、红细胞沉降率、C反应蛋白等3次检测均正常形成待感染控制后,可二期行植骨修复骨缺损。(5)植骨首选自体髂骨,若骨缺损较多时,可选择自体髂骨联合人工骨。
皮瓣切取:(1)术前常规行血管彩超对穿支血管进行定位,评估穿支情况;(2)术中需将各个组织瓣穿支进行仔细解剖,必要时可借助显微镜进行解剖;(3)术中需同时切取穿支皮瓣和穿支肌瓣,创伤相对较大,出血较多;(4)术中设计肌瓣时要同时考虑皮瓣和肌瓣的血管蒂长度,需根据创面情况及腔隙情况,尽量选择粗大且血管蒂相对长的肌支制备肌瓣,肌瓣的血管蒂宜长不宜短;(5)各组织瓣都有独立穿支营养血管,皮瓣移植时要注意理顺血管蒂,防止扭转与卡压,造成血运障碍;(6)合并有神经损伤的病人,可携带股前外侧皮神经进行神经功能重建。
股前外侧穿支分叶嵌合组织瓣可同时提供多个皮瓣并嵌合携带肌瓣,灵活、立体的修复创面及腔隙,联合膜诱导技术,局部植入载抗生素的骨水泥,即可增加局部抗感染能力,有效治疗骨感染,同时在骨缺损部位诱导形成诱导膜,待骨感染控制后,为二期植骨修复骨缺损提供一个良好环境。

