碱性亮氨酸拉链ATF样转录因子在肾透明细胞癌预后和免疫浸润细胞中的潜在价值
赵莹莹 何心辉 张丽 郑彩云 姜勇
肾细胞癌是泌尿系统常见的恶性肿瘤。2020年全球范围内约有43万例新发病例和14万死亡病例[1]。肾透明细胞癌(kidney renal clear cell carcinoma,KIRC)为肾癌的主要亚型,占所有病例的75%,是泌尿系恶性程度最高的肿瘤之一,也是泌尿生殖系统肿瘤中死亡率最高的肿瘤[2]。KIRC具有复杂的生物学特征,对放化疗不敏感;手术是治疗KIRC的主要方法[3],但20%~40%的病人在术后出现局部复发或远处转移,5年生存率约为20%~30%[4]。分子靶向治疗和免疫治疗能改善KIRC病人的预后,但潜在的分子机制及治疗靶点仍有待进一步研究。碱性亮氨酸拉链ATF样转录因子(the basic leucine zipper ATF-like transcription factor,BATF)位于人类染色体14q24.3上,转录本为NM_006399[5],编码碱性亮氨酸拉链蛋白,隶属于激活转录因子(Activating transcription factor,AP-1/ATF)超家族。近年来研究表明,BATF在树突状细胞、B细胞和T细胞的转录中起着积极的调控作用[6-7]。此外,BATF 在癌症中存在异常表达,参与癌症进展[8-11]。BATF在间变性大细胞淋巴瘤和肺癌组织中的表达水平增高[8-9]。敲除BATF会导致癌细胞生长停滞、凋亡加速,表明BATF可能在调控肿瘤细胞增殖和凋亡中起重要作用。本研究拟利用UALCAN、TISIDB、Kaplan-Meier plotter、OncoLnc及Sangerbox数据库数据库分析BATF在KIRC组织中的表达水平,探究BATF及甲基化水平与病人预后和临床病理学特征之间的关系,并分析BATF表达与肿瘤免疫浸润细胞及标志物水平的关系。
资料与方法
1.UALCAN(http://ualcan.path.uab.edu)数据库:是对TCGA基因表达数据进行深层次分析的公开数据库[12]。我们分析了BATF在各种类型癌症中的表达水平,包括在KIRC和正常样本的表达水平,及与KIRC临床病理学特征(肿瘤分级、肿瘤分期、淋巴结转移等)和预后之间的关系。

A.在UALCAN 数据库中,BATF在KIRC中表达水平明显高于正常癌旁组织;B~D.BATF表达水平随着临床分期、组织学分级增高及淋巴结转移逐渐增高;E~H.在KIRC中BATF甲基化水平与肿瘤临床分期、组织学分级及淋巴结转移密切相关
2.TISIDB ( http://cis.hku.hk/TISIDB/index.php)数据库:是从 TCGA 数据库收集大量人类癌症数据的在线综合数据库[13]。通过 TISIDB 数据库探讨 BATF表达与肿瘤浸润性免疫细胞或分子亚型之间的相关性。
3.Kaplan-Meier plotter 数据库、OncoLnc数据库及Sangerbox数据库:通过Kaplan-stageMeier plotter(http://kmplot.com/analysis/)、OncoLnc (http://www.oncolnc.org/) 及Sangerbox(http://sangerbox.com/)在线数据库分析 BATF的表达水平与 KIRC病人预后之间的相关性[14-16]。
结果
1.BATF表达水平与KIRC临床病理特征相关 :通过UALCAN 数据库分析发现BATF表达水平在KIRC病人中显著升高,并且和临床分期(stage1-vs-stage2、stage1-vs-stage3、stage1-vs-stage4、stage2-vs-stage4)、组织学分级(grade 1-vs-grade 3、grade 1-vs-grade 4、grade 2-vs-grade 3、grade 2-vs-grade 4、grade 3-vs-grade 4)以及淋巴结转移显著相关。此外,KIRC的肿瘤分级(stage1-vs-stage3、stage1-vs-stage4、stage2-vs-stage3、stage2-vs-stage4)、肿瘤分级越高及伴有淋巴结转移时BATF甲基化水平越低。表明 BATF表达水平与KIRC病人的发生发展密切相关。见图1,表1。
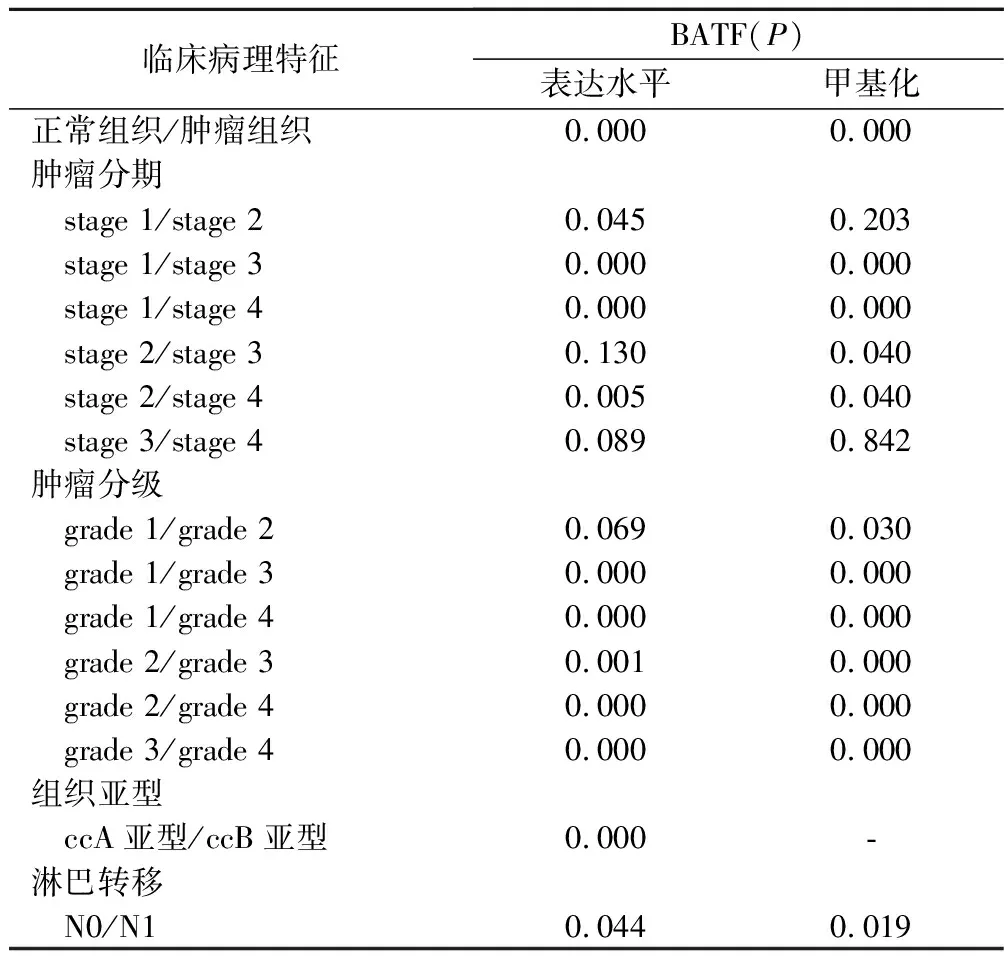
表1 BATF表达水平与KIRC病人的临床病理特征相关性分析(UALCAN)
2.BATF 在KIRC病人中的预后价值 :通过使用Kaplan-Meier-Plotter、Oncolnc、Sangerbox在线数据库评估BATF表达水平与OS之间的相关性。在Kaplan-Meier-Plotter、Oncolnc、Sangerbox数据库中,BATF 高表达水平与KIRC病人的短OS显著相关(图2),表明BATF高表达对KIRC病人的生存率有显著影响。
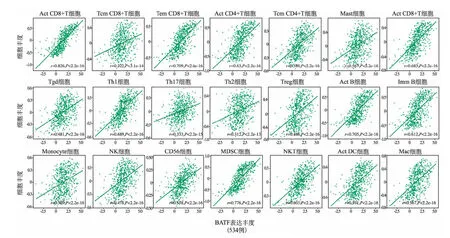
注:Act:Activated,活动性;Tcm:Central memory T cell,中心性记忆T细胞;Tem:Effector memory T cell,效应记忆T细胞;Mast cell:嗜碱性细胞;Tfh:T follicular helper cell,滤泡辅助T细胞;Tgd:Gamma delta T cell,γδT细胞;Th:Type T helper cell,辅助T细胞;Treg;Regulatory T cell,调节性T细胞;Imm B cell:Immature B cell,幼淋巴细胞;NK:natural killer,自然杀伤细胞;MDSC:Myeloid derived suppressor cell,髓源性抑制细胞;DC:dendritic cell,树突细胞;Mac:Macrophage,巨噬细胞
3.BATF表达水平与KIRC免疫浸润细胞的关系见图3。结果显示,BATF高表达与KIRC免疫细胞浸润相关。BATF表达水平与KIRC中CD8+T细胞(Act CD8和Tem CD8)、CD4+T细胞(Act CD4)、Tfh细胞、Th1、B细胞(Act B和Imm B)、MDSC细胞及NKT细胞之间呈强相关(r≥0.6,P<0.05)。
讨论
近年来,靶向治疗在KIRC的临床治疗过程中应用广泛。然而肿瘤的异质性及其对治疗的适应性(如细胞死亡相关信号通路的改变等)极大地限制了靶向药物的应用[17-18]。免疫疗法可刺激内源性T细胞攻击肿瘤细胞,在KIRC的治疗中有广阔的应用价值。BATF是转录调节因子AP-1家族的重要成员,可介导与AP-1因子的二聚化以及与异源因子的相互协同作用进而激活靶基因组[6-7],在多类肿瘤的发生及发展中起关键作用[8-11]。我们通过多数据库分析显示, BATF在KIRC组织中显著过表达,且与KIRC病人不良预后相关,随着肿瘤分期和分级的增加以及淋巴结转移中BATF表达水平逐渐增高。此外,KIRC组织中BATF的甲基化水平与肿瘤分期、分级及淋巴结转移呈负相关。Hu等[19]通过对KIRC组织甲基化分析显示,BATF为甲基化驱动的关键基因,与KIRC病人不良预后密切相关。表明BATF在KIRC进展中出现异常激活,可能是KIRC的一个有价值的预后生物标志物。
由肿瘤细胞、浸润性免疫细胞、成纤维细胞及众多细胞趋化因子组成的肿瘤微环境是一个复杂的动态生态系统,肿瘤细胞利用各种免疫细胞及因子进行增殖和扩散。因此,免疫浸润细胞在肿瘤的发生及发展中起重要作用,亦与免疫治疗的效果和临床结局密切相关[20-21]。我们发现,BATF表达水平与KIRC中CD8+T细胞(Act CD8和Tem CD8)、CD4+T细胞(Act CD4)、Tfh细胞、Th1、B细胞(Act B和Imm B)、MDSC细胞及NKT细胞的浸润程度显著相关。T细胞耗竭的特点是使效应细胞功能丧失、抑制性受体表达持续增高、表观遗传、转录谱及代谢方式改变,是导致癌症病人免疫功能障碍的主要因素之一[22]。Treg细胞在恶性肿瘤中妨碍机体免疫监测、介导免疫抑制,成为肿瘤免疫逃逸的重要机制[23]。癌细胞利用这些机制使肿瘤免疫浸润细胞失活,以逃避免疫监视并存活。
本研究表明,BATF高表达水平与KIRC病人预后不良相关,且与KIRC免疫细胞浸润相关,BATF有望成为KIRC预后生物标志物。本研究基于数据库数据分析所得的结果,有待进一步通过基础研究探索及验证BATF在KIRC进展中的作用和潜在的机制。

