肾癌根治术后同侧肾上腺肾透明细胞癌转移一例病例报告并文献复习
张园 曹满 安晔 孙健瑄 刘晨茜 徐金洲 胡嘏 王少刚 徐梦瑶
肾细胞癌(renal cell carcinoma ,RCC)是泌尿系统肿瘤中发病率仅次于膀胱癌的肿瘤。按照组织病理学可分为肾透明细胞癌、乳头状肾细胞癌(嗜色细胞癌)、嫌色细胞癌、集合管癌和肾髓质癌等,其早期症状并不明显。随着疾病的发展,病人会出现典型的肾癌三重综合征:血尿、腰痛和腹部肿块,甚至发生癌细胞转移,肾上腺转移较少[1]。我们报道肾癌根治术后同侧肾上腺肾透明细胞癌转移1例,并结合文献进行复习。
对象与方法
一、对象
我院就诊的肾上腺肾透明细胞癌转移1例。男性,54岁,2021年6月因左肾根治术后2年,检查发现左肾上腺区占位1年入院。病人双输尿管走行区无压痛,双肾区无叩痛,肛门、外生殖器无畸形。PET-CT检查提示左侧肾上腺肿瘤性病变,转移可能。以肾上腺肿物收入院。2019年4月体检发现左肾占位,行泌尿系CTU检查,提示左肾下极最大径约7.3 cm的肿瘤性病变。以左肾肿瘤收入院,无腰痛,无血尿,无尿频、尿急、尿痛,无发热。完善相关检查后,行腹腔镜左肾根治性切除术,术后1周出院。2020年8月,因左肾根治术后1年余,左侧腰部疼痛1周入院。左侧腰部可见腹腔镜手术瘢痕,无其他阳性体征。CT和磁共振检查提示左侧肾上腺区占位性病变,暂予以保守治疗。
二、方法
2019年4月,行泌尿系彩超和CTU检查,结果提示,左肾下部占位性病变,最大截面径线约56 mm×47 mm×73 mm,考虑为肿瘤性病变。TNM分期为T2aN0M0,临床分期为Ⅱ期。术中病理活检:左肾及肾占位肿块(图1)。病理诊断:左肾透明细胞癌(WHO/ISUP 3级)。免疫组化:PCK(+)、EMA(+)、CD10(+)、Pax-8(+)、CAIX(+)、P504s(+)、SDHB(+)。

A、B 左肾透明细胞癌
2019年5月,左肾根治性切除术后1周行腹部CT检查(图2),未发现左肾上腺占位性病变。2020年8月,磁共振-单脏器弥散加权(DWI)和磁共振平扫检查(图3):左肾术后;左侧肾上腺异常信号,考虑肿瘤性病变可能;右肾囊肿可能;肝脏多发囊肿可能。
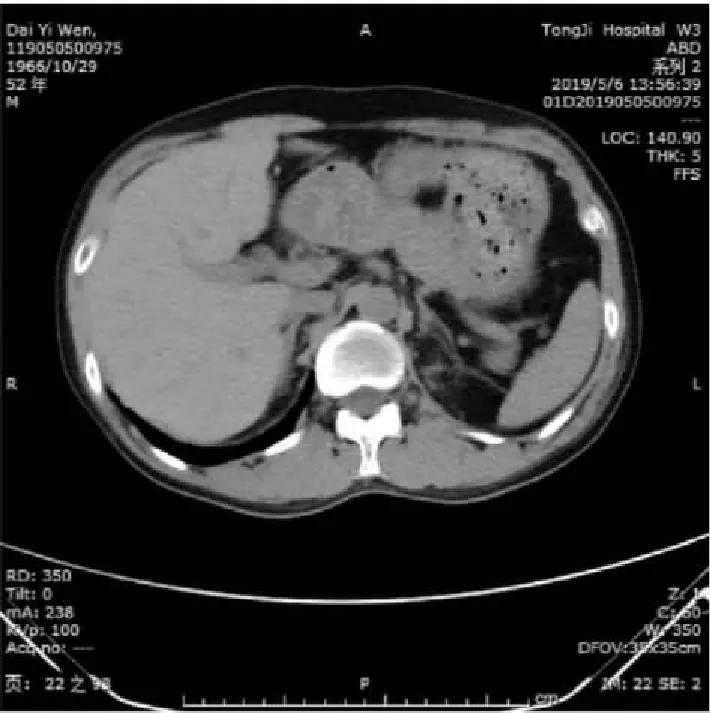
图2 左肾根治性切除术后1周腹部CT
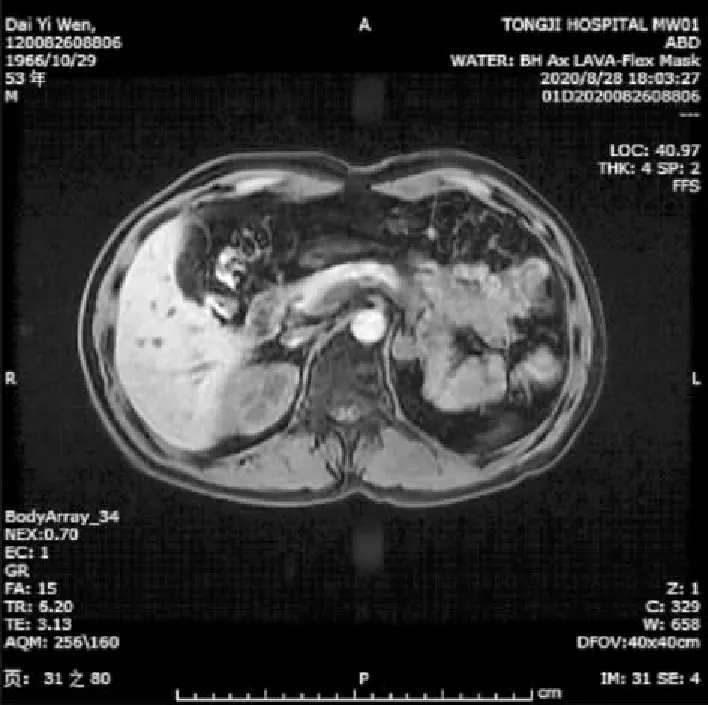
图3 腹部磁共振平扫检查,左肾上腺占位
2021年1月,PET/CT全身显像(融合+衰减校正) 检查:左肾术后:左侧肾上腺低密度结节,直径19 mm,糖代谢增高,考虑肿瘤性病变,转移可能。腹膜后小淋巴结增多,代谢无增高,建议观察。2021年6月,术中病理活检:左肾上腺(图4),病理诊断为:(左侧)肾上腺转移性透明细胞肾细胞癌,镜下可见肿瘤性坏死。免疫组化:PAX-8(+),CAⅨ(+),SF1(-),Ki-67(LI:热点区域约15%)。2021年6月复查:皮质醇7.8 μg/dl,促肾上腺皮质激素20.5 pg/ml。

A、B 左肾上腺转移性肾透明细胞癌
结果
1.诊断:结合病史、影像学检查和术中病理活检结果给予出院诊断:肾上腺继发性恶性肿瘤(肾透明细胞癌转移)。
2.鉴别诊断:转移性肾透明细胞癌的细胞质透明或呈嗜酸性,细胞核大小均匀,多数可见核仁。CK8、CK18、vimentin、CAIX、CD10、Pax-8和EMA等肾源性免疫组化标记物阳性表达有助于诊断肾细胞癌,且CAⅨ在肾透明细胞癌的阳性率明显高于其他肾癌[2]。本病例中的病人根治性肾切除术时病理活检免疫组化显示:EMA(+)、CD10(+)、Pax-8(+)、CAIX(+),左肾上腺切除术时病理活检免疫组化显示:Pax-8(+)、CAIX(+),支持转移性肾透明细胞癌的诊断。(1)肾上腺皮质肿瘤:常引起不同程度的血压升高。镜下细胞实性巢状排列,胞质内是空泡,细胞大小以及细胞核大小有明显差异。肾上腺皮质肿瘤的MelanA、类固醇生成转录因子、α-inhibin阳性表达[3-4]。(2)肾上腺嗜铬细胞瘤:常有高血压甚至高血压危象的临床表现。镜下可见肿瘤细胞的细胞巢、梁索状结构,胞浆丰富,可嗜碱、嗜双色、偶尔嗜酸,Melan-A表达阴性[5]。(3)血管周上皮样细胞肿瘤:镜下细胞片状排列,胞质透亮或呈嗜酸性。HMB-45大多阳性表达[3]。
3.治疗:病人于2019年4月首次入院,行腹腔镜左肾根治性切除术,术后1周出院。于2020年8月第2次入院,病人及家属经考虑后暂予以保守观察治疗。2021年6月第3次入院,行机器人辅助腹腔镜下左肾上腺切除术,术后给予抗感染、止痛、止血、补液等治疗。出院嘱咐病人服用:胸腺肽肠溶片(迪赛)30 mg@西安迪赛(10)*2.0盒 Sig:30 mg 口服3次/日;升血调元颗粒5 g@粤环球(8)*3.0盒 Sig:10 g口服 2次/日。建议术后1个月门诊首次复诊,行基因检测,可考虑术后药物辅助治疗。
4.治疗结果、随访及转归:治疗后病人情况良好,没有明显的并发症,术后4天出院。术后6个月电话随访时根据病人自述:术后1个月行基因检测,未发现异常;术后3个月,行MRI检查未发现异常。此后第1年每3个月复查腹部CT或MRI、胸部CT或胸片,肾功能等,第2~3年每半年复查1次,此后每年复查1次维持,必要时PET-CT或骨扫描。
讨论
肾上腺转移癌的来源包括骨、肺、肝脏和肾上腺等,其中肾癌肾上腺转移的发生率很低,约为2.2%~7.1%[6]。肿瘤在转移至别处的同时可伴随着转移至肾上腺同侧、对侧和双侧,或者罕见地发生孤立性转移肾上腺。肾上腺转移大多非孤立性地发生在同侧,发生时间从肾癌手术后2个月~7.5年不等[7],也可能与肾癌并存[8]。本例病人肾癌根治术后1年4个月发现同侧肾上腺转移癌。肾癌肾上腺转移的发生与原发肿瘤大小、TNM分期有关[9],引起肾癌肾上腺同侧转移的原因可能包括:(1)肾癌(尤其是肾上极)的直接转移;(2)肾癌沿着小血管丛转移至同侧肾上腺;(3)肾癌随着区域淋巴结转移;(4)肾癌栓沿着静脉系统逆行转移[10]。
本例在左肾根治性切除术后1年余出现左侧腰部疼痛,影像学检查结果提示左肾上腺有占位性病变。几乎所有肾上腺转移癌病人不表现出明显临床症状[11]。对于既往患有恶性肿瘤的病人,在术后常规复查中,若出现肾上腺占位性病变,要及时考虑肾癌肾上腺转移,并做进一步影像学和血清学检查,检测肾上腺内分泌功能以排除肾上腺功能性肿瘤[12]。
B超对于直径>1 cm的肿瘤有较好的诊断价值[11],CT是临床上最常用且有效的诊断方法,MRI也可发现肾上腺占位性病变。本病例中使用的MRI弥散加权成相可发现肿瘤位置,但对于诊断肾上腺肿瘤是否为恶性鉴别意义不大。肾上腺转移瘤病人的PET/CT常显示转移瘤密度均匀,FDG摄取均匀增高[13]。病人PET/CT结果提示:左侧肾上腺见类圆形低密度结节,放射性摄取增高,SUVmax 3.8 g/ml。当SUV临界值设定在3.1 g/ml时,考虑为恶性肿瘤[11]。
本例病人肾上腺肿块大小约为2 cm,采用机器人辅助腹腔镜下左肾上腺切除术,术中发现肾上腺与原肾周脂肪粘连并进行分离。腹腔镜下肾上腺切除术包括经腹腔和腹膜后两种方式,对于同侧肾癌肾上腺转移病人,经腹腔入路的方式可以尽量避免重新分离粘连的腹膜后间隙[14],便于切除更大的肾上腺肿块[11]。根据CSCO肾癌诊疗指南,对于寡转移或局部复发的肾癌术后转移,Ⅰ级推荐转移灶的手术切除和系统性药物治疗,Ⅱ级推荐局部消融和立体定向放疗。
2020年CSCO肾癌诊疗指南新增对于年龄小于等于45岁且患有双侧、多灶性及有肾癌家族史的病人行基因检测。临床上诊断的肾癌大多为散发性肾癌,超过50%的散发性肾透明细胞癌有Von Hippel-Lindau(VHL)基因缺失或失活,从而引起PDGF、VEGF、CaIX等基因过度表达。
目前,常规化疗与放疗对肾癌的敏感性不高,分子靶向治疗和免疫治疗有所进展。对于局限性肾癌和局部进展性肾癌,外科手术切除仍是主要的、首选的治疗方法。而对于有其他部位远处转移的病人,手术难以改善预后,可以采取多学科综合治疗。随着IFN-α,IL-2的应用,1992~2005年是细胞因子时代;接下来的十年是靶向治疗的黄金时代,现进入免疫联合时代[15]。
病人出院后,仍需定期随访。研究表明,无症状病人的预后比有症状的病人好,预后还和TNM分期、Fuhrman组织学肿瘤等级密切相关。2021年EUA肾癌指南指出,新的预后标志物有待研究,以确定病人随时间复发的风险。
肾癌根治术后同侧肾上腺肾透明细胞癌转移较为少见。诊断有赖于影像学检查和病理活检,以及行血清学检查以排除其他可能性。对于局限性肾癌和局部进展性肾癌病人,手术仍是主要治疗方式;对于肾癌术后转移病人的寡转移灶,优先推荐手术切除,非手术治疗则需按照预后等级进行分层治疗,靶向与免疫治疗联合逐渐成为晚期肾癌的一线治疗,并将不断取得进展。

