益生菌对慢性阻塞性肺疾病大鼠肠道菌群和炎症反应的影响*
程友静,张芸芸,廖世霞
(1.遵义医科大学第二附属医院 体检科,贵州 遵义 563006;2.遵义医科大学附属医院呼吸一科,贵州 遵义 563000)
慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)是一种慢性进展性的肺病理异质性疾病,其特征为持续性气流阻塞、气道炎症增加和肺组织破坏[1]。COPD 的发病率和病死率较高,已成为世界公共卫生问题[2]。目前,COPD 的治疗方法有限,主要是肺移植[3]、吸入氢气[4]、皮质类固醇和支气管扩张剂[5],存在治疗成本较高,免疫排斥和部分患者疗效欠佳等缺点。因此,寻找新型有效的治疗COPD 的药物已成为临床亟待解决的问题。
肠道菌群失调不仅降低胃肠道免疫反应,还会影响肝、肺等远端器官的免疫,进而危害身体健康。近年来,大量研究证实肠道菌群与呼吸系统疾病密切相关,尤其是哮喘、COPD、肺癌和呼吸道感染等[6-8]。此外,亦有学者指出益生菌治疗可调整慢性乙肝患者肠道菌群结构,改善肝功能[9]。然而,目前关于益生菌治疗COPD 的研究相对较少。仅有研究报道,短双歧杆菌和鼠李糖乳杆菌可抑制吸烟诱导的人巨噬细胞中的炎症反应[10],以及口服补充鼠李糖乳杆菌可减轻COPD 小鼠的肺泡损伤和气道炎症[11]。因此,本研究通过烟雾刺激和脂多糖(Lipopolysaccharide,LPS)灌胃复制COPD 大鼠模型,探讨益生菌对COPD 大鼠肠道菌群变化、炎症反应和肺损伤的影响,以期为临床防治COPD 提供参考。
1 材料与方法
1.1 实验动物及试剂
30 只Wister 雄性大鼠,(80±3)天龄,体重200~250 g,购自重庆市陆军军医大学实验动物中心。实验动物生产许可证号:SCXK(渝)2007-0005,实验动物使用许可证号:SYXK(黔)2021-0003。
Probiotic IMM(美国Pure Encapsulations 公司,批号:6030112A),红旗渠®过滤嘴香烟(河南中烟工业有限责任公司),苏木精-伊红(hematoxylin-eosin,HE)染色试剂盒、C 反应蛋白(C-reactive protein,CRP)和肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)酶联免疫吸附(enzyme linked immunosorbent assay,ELISA)检测试剂盒(上海碧云天生物技术有限公司,批号:C0105S、PC188、PT516),Masson 三色染色试剂盒、白细胞介素8(Interleukin-8,IL-8)ELISA 试剂盒(北京索莱宝科技有限公司,批号:G1340、SEKR-0071),α 平滑肌肌动蛋白(α smooth muscle actin,α-SMA)抗体(美国Cell Signaling 公司,批号:19245),Alexa Fluor®488 山羊抗大鼠免疫球蛋白G(immunoglobulin G,IgG)(H+L)、Alexa Fluor®555 山羊抗大鼠IgG(H+L)荧光标记二抗和Hoechst 33258(美 国Thermo Fisher公司,批 号:A11006、A21434、H3569)。
1.2 动物分组和COPD模型的复制
将30 只大鼠随机分为对照组、COPD 组和治疗组,每组10 只。COPD 组和治疗组参考文献[12]复制COPD 大鼠模型:第1 天和第14天,大鼠气道注射200 μL LPS 溶液;第2~13 天和第15~30天,将大鼠置于熏蒸箱并暴露于香烟烟雾中(烟雾浓度约为18%(υ/υ),暴露时长为20 min/次,2 次/d,间隔4 h)。对照组大鼠注射等量生理盐水,不予熏蒸。
采用等效剂量系数折算法计算出益生菌Probiotic IMM 的给药剂量为0.9 CFU/g/(kg·d)。按此剂量,治疗组大鼠灌胃1 次/d,持续28 d;对照组和COPD 组大鼠灌胃等量生理盐水。
1.3 方法
1.3.1 观察大鼠一般情况每天上午9:00 定时观察各组大鼠一般情况,包括饮食量、活动表现、气喘咳嗽症状、毛发光泽度和死亡等。
1.3.2 HE 染色观察大鼠肺组织病理变化腹腔注射4%戊巴比妥钠(2 mL/kg)麻醉各组大鼠。75%乙醇消毒后打开大鼠胸腔,剥离出完整的肺。将各组大鼠肺叶组织用4%多聚甲醛缓冲液固定过夜,脱水,石蜡包埋,制成4 μm 厚的切片。加苏木精和伊红染色,脱水,风干,封片,在光镜下观察各组大鼠肺组织病理变化。
1.3.3 Masson染色观察大鼠肺组织纤维化改变将载有4 μm 厚组织切片的载玻片置于65℃烘箱中烘干1 h,然后脱蜡。经苏木精和Masson 丽春红酸性复合液染色,将玻片放入1%磷钼酸水溶液中分化3 min,亮绿染色5 min,脱水封片,光镜下观察肺组织纤维化改变。
1.3.4 免疫荧光双染观察大鼠肺组织α-SMA 的表达分离获取大鼠肺组织,加4% 多聚甲醛固定,加0.3% Triton X-100封闭30 min。加入α-SMA 一抗(1∶200 稀释),4℃孵育过夜,磷酸盐缓冲溶液(phosphate buffer saline,PBS)清洗5次,加入山羊抗大鼠荧光标记二抗混合物(1∶1 000 稀释),37℃避光反应30 min,加入Hoechst 33258 孵育15 min,甘油封闭,在激光共聚焦显微镜下观察α-SMA 的表达。
1.3.5 ELISA 检测血清CRP、IL-8、TNF-α 水平大鼠腹主动脉取血,收集血液于采集管中,3 000 r/min离心12 min 得到血清。根据ELISA 试剂盒说明书,将血清样本加入96 孔板,分别加入抗大鼠CRP、IL-8 和TNF-α,室温下孵育30 min。PBS 清洗后,依次加过氧化物酶标记的生物素化二抗、TMB 和TMB 终止液。最后用酶标仪测量各样本在450 nm 处的光密度(optical density,OD)值,并根据标准曲线计算对应样品浓度。
1.3.6 肠道菌群预配置肠球菌Enter 培养基、肠杆菌EMB 培养基、乳酸杆菌LBS 培养基和双歧杆菌BS 培养基。收集各组大鼠新鲜粪便(1∶10~1∶1 000 000 000 稀释),吸取10 μL 标本接种于培养基上,每个稀释度接种3次,并选取合适的稀释度计算菌落均值(CFU/g)。
1.4 统计学方法
数据分析采用GraphPad Prism 8.0 统计软件。计量资料以均数±标准差()表示,比较t检验或方差分析,进一步两两比较用LSD-t检验。P<0.05为差异有统计学意义。
2 结果
2.1 各组大鼠一般情况
对照组大鼠饮食正常,动作迅捷,反应灵敏,皮毛顺滑。COPD 组大鼠在模型复制过程中及模型复制成功后都出现异常表现,如食欲不振,食量减少,呼吸急促,咳嗽频繁,毛发枯黄杂乱,反应迟缓等。进一步灌胃益生菌,治疗组大鼠症状有所减轻。其中,COPD 组和治疗组在模型复制过程中各死亡2只、1 只大鼠,对照组大鼠无死亡。
2.2 各组大鼠肺组织病理变化
对照组大鼠细支气管管腔结构和肺泡组织形态正常,无炎症细胞浸润。COPD 组大鼠细支气管管壁和基底层增厚,管腔狭窄变形甚至闭塞,其周围有大量炎症细胞浸润;上皮细胞紊乱增生,肺泡壁变薄,且部分肺泡破裂。但治疗组Probiotic IMM 灌胃后,大鼠肺组织形态得到明显改善,炎症浸润和管腔增厚等症状有所减轻,破损肺泡数量减少。见图1。
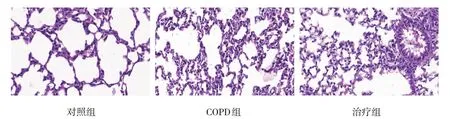
图1 各组大鼠肺组织(HE染色×400)
2.3 各组大鼠肺组织纤维化改变
对照组大鼠肺组织主要为红色肌纤维,而蓝色胶原纤维几乎不可见。COPD 组大鼠肺组织蓝染胶原纤维较对照组显著增加,提示胶原沉积增多,肺组织发生严重纤维化。治疗组Probiotic IMM 灌胃后,大鼠肺组织胶原纤维沉积明显减少,纤维增生得到抑制。见图2。
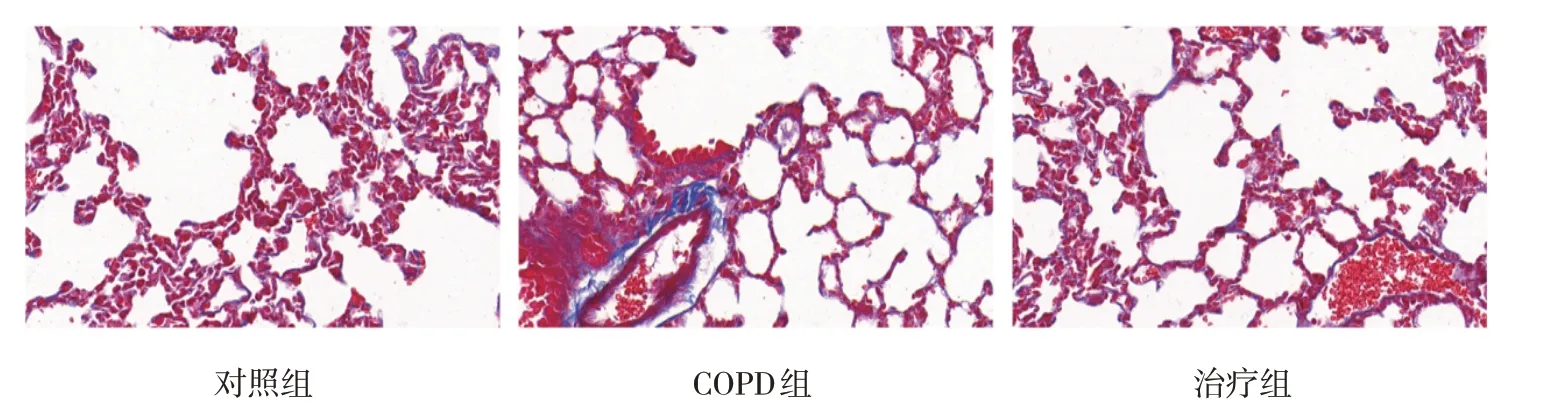
图2 各组大鼠肺组织(Masson染色×400)
2.4 各组大鼠肺组织α-SMA的表达
COPD 组大鼠肺支气管平滑肌α-SMA 阳性表达较对照组明显增加,但治疗组肺支气管平滑肌α-SMA 阳性表达较COPD 组有所减少。见图3。

图3 各组大鼠肺组织α-SMA的表达(免疫荧光双染×400)
2.5 各组大鼠血清CRP、IL-8和TNF-α水平比较
对照组、COPD 组、治疗组大鼠血清CRP、IL-8和TNF-α 水平比较,经单因素方差分析,差异有统计学意义(F=3 533.340、327.033 和2 338.562,均P=0.000)。进一步两两比较结果:COPD 组和治疗组大鼠血清CRP、IL-8 和TNF-α 水平高于对照组(P<0.05);而治疗组大鼠血清CRP、IL-8 和TNF-α 水平低于COPD 组(P<0.05)。见表1。
表1 各组大鼠血清CRP、IL-8和TNF-α水平比较(n=10,pg/mL,)
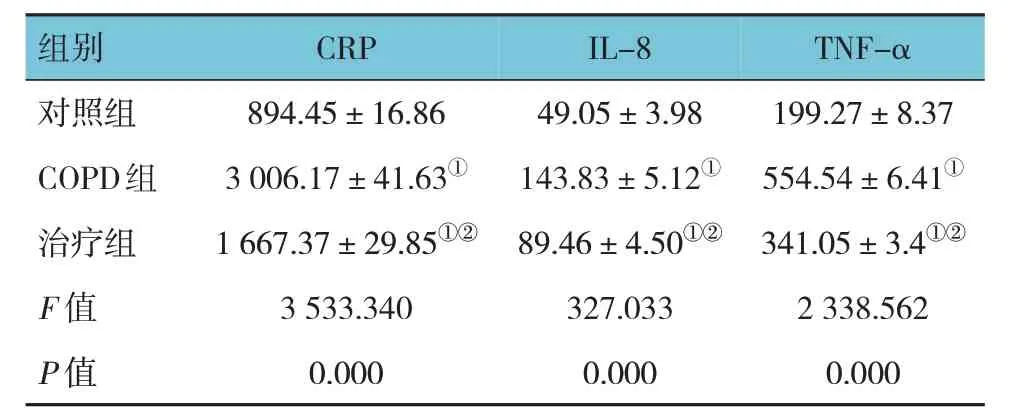
表1 各组大鼠血清CRP、IL-8和TNF-α水平比较(n=10,pg/mL,)
注:①与对照组比较,P <0.05;②与COPD组比较,P <0.05。
2.6 各组大鼠肠道菌群比较
对照组、COPD 组、治疗组大鼠肠球菌、肠杆菌含量比较,经单因素方差分析,差异有统计学意义(F=97.180 和225.778,均P=0.000)。进一步两两比较结果:COPD 组和治疗组肠球菌、肠杆菌含量高于对照组(P<0.05);治疗组肠球菌、肠杆菌含量低于COPD 组(P<0.05)。见表2。
对照组、COPD 组、治疗组大鼠乳酸杆菌、双歧杆菌含量比较,经单因素方差分析,差异有统计学意义(F=104.602 和114.833,均P=0.000)。进一步两两比较结果:COPD 组乳酸杆菌、双歧杆菌含量低于对照组(P<0.05);而治疗组乳酸杆菌、双歧杆菌含量高于COPD 组(P<0.05)。见表2。
表2 各组大鼠肠道菌群比较(n=10,CFU/g,)
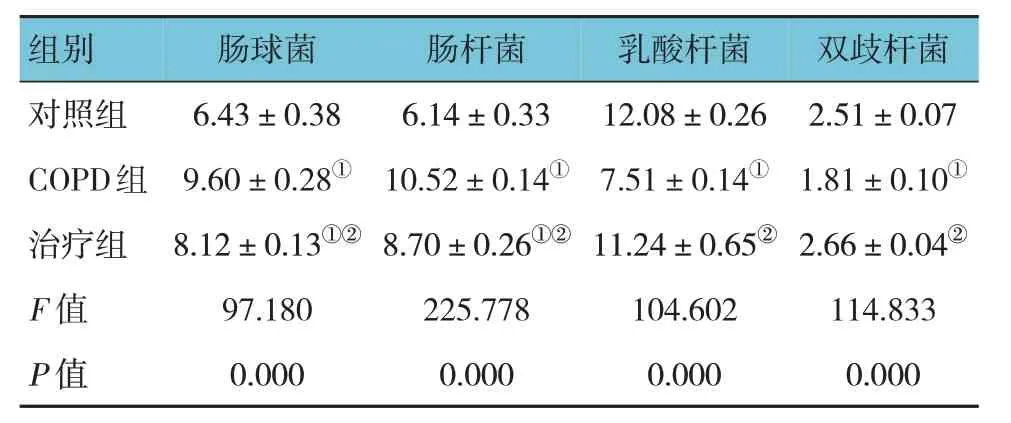
表2 各组大鼠肠道菌群比较(n=10,CFU/g,)
注:①与对照组比较,P <0.05;②与COPD组比较,P <0.05。
3 讨论
“肠-肺”轴是指胃肠道和肺的共同黏膜免疫系统[13],肠道和肺之间以及肠道菌群和宿主免疫之间存在复杂而重要的交互作用,暗示肠道菌群在调节慢性呼吸道疾病炎症中发挥至关重要的作用[14]。既往研究证实,肠道微生物失调不仅参与调节宿主对呼吸道感染的免疫反应[6],而且促进哮喘、COPD、肺癌和呼吸道感染等呼吸道疾病的发生、发展,加重COPD 病程,增加COPD 患者胃肠道紊乱的发生率,如克罗恩病和溃疡性结肠炎[15]。因此,肠道微生态的改变可作为评估COPD 发病程度的生物学指标[16]。
COPD 作为一种常见的慢性肺疾病,致病因素包括吸入香烟烟雾或其他有毒颗粒、慢性哮喘、职业性接触粉尘,主要特征为长期炎症、肺组织破坏和气流阻塞导致的肺功能下降[17]。本研究发现,COPD 组大鼠肺组织出现严重损伤,光镜下可见细支气管管壁增厚,胶原沉积增多,纤维增生,管腔狭窄变形且部分堵塞,肺泡壁变薄乃至破裂,存在大量炎症细胞浸润。而治疗组大鼠肺组织炎症浸润、胶原纤维沉积和管腔增厚等症状明显减轻,提示肺损伤有所好转。α-SMA 作为平滑肌细胞收缩的基础结构,可被转化生长因子β1刺激诱导,促进胶原沉积和纤维化形成,进而加重气道重塑[18]。本研究发现,COPD 组大鼠肺支气管α-SMA 阳性表达较对照组明显增加,但治疗组肺支气管α-SMA 阳性表达有所减少,提示益生菌治疗可改善COPD 大鼠肺损伤,减少胶原沉积,减轻气道重塑。
稳定期COPD 患者的粪便微生物组和代谢组均与健康人群有显著差异,其优势菌株主要为双歧杆菌科、真杆菌科、乳酸菌科、微球菌科、链球菌科和细绒毛杆菌科等[19]。本研究采用选择性培养基进行传统细菌培养,检测各组大鼠肠道菌群中条件致病菌肠球菌、肠杆菌,以及肠道共生菌乳酸杆菌和双歧杆菌的含量。结果发现,COPD 组大鼠肠道中肠球菌和肠杆菌含量较对照组大幅提升,但乳酸杆菌和双歧杆菌含量明显下降。此时,致病菌作为优势菌过度生长,引起菌群失调。相较于COPD组,治疗组大鼠肠道中肠球菌和肠杆菌含量有所降低,伴随着乳酸杆菌和双歧杆菌含量增加。即口服益生菌可有效改善COPD 大鼠的肠道菌群构成,降低条件致病菌丰度,并增加肠道共生菌含量,使之更接近于正常大鼠肠道微生态。肠道微生物群参与机体饮食成分的发酵,分解产生短链脂肪酸和氨基酸等。而这些微生物代谢产物可被肠黏膜组织吸收,与肺受体结合并激活免疫细胞[20]。
肠道微生态失衡导致呼吸道疾病恶化,致病菌产生的代谢物激发免疫细胞,通过淋巴和循环系统作用于肺黏膜,引起肺免疫反应失衡。JOSEFOWICZ等[21]在CNS1-小鼠胃肠道内发现了辅助型T 细胞2 型炎症,炎症因子水平升高,且Foxp3(+)调节性T 细胞也被激活。由于血清CRP、IL-8和TNF-α水平随着病情加重而呈上升趋势,故以上指标的联合检测对评估COPD 患者病情严重程度有较高的临床价值[22-23]。本研究发现,COPD组大鼠血清CRP、IL-8和TNF-α水平较对照组明显升高,表明机体免疫反应被激活。治疗组大鼠血清CRP、IL-8 和TNF-α 水平较COPD 组显著下调,即口服益生菌抑制COPD 大鼠炎症反应。虽然本课题检测了相关炎症因子水平以反映机体炎症程度,但参与调控该进程的潜在信号分子和机制尚待进一步研究。
综上所述,益生菌可有效改善COPD 大鼠肺损伤和肠道菌群结构,减轻炎症反应和气道重塑。

