盐酸纳美芬对大脑中动脉缺血再灌注模型大鼠脑组织的作用及其机制研究*
朱江,郭森,窦志杰,张弛
(承德医学院附属医院 神经内科,河北 承德 067000)
脑卒中又称脑血管意外,是一种常见的急性脑血管疾病,一般分为缺血性卒中和出血性卒中,具有较高的发病率、病死率和致残率[1]。近年来脑卒中发病率呈上升趋势,且逐渐年轻化[2]。临床上以溶栓和机械取栓为脑卒中的主要治疗手段,取栓后虽然能恢复脑组织血液灌注,但是缺血造成的脑神经损伤却无法修复,因此多数患者预后不良,伴有不同程度的身体残疾[3]。既往研究结果显示,在及时有效的治疗下,中枢神经元可以再生,脑组织损伤或可逆[4]。盐酸纳美芬是阿片受体拮抗剂,具有抗休克、脑保护和治疗脊髓损伤等作用。既往研究结果显示,盐酸纳美芬可以减少七氟烷麻醉大鼠神经元凋亡,提高认知能力[5]。目前关于盐酸纳美芬对大脑中动脉缺血再灌注(middle cerebral artery occlusion/reperfusion,MCAO/R)神经保护作用的报道很少,因此本研究采用盐酸纳美芬预注射,探究其对大脑中动脉缺血再灌注大鼠模型的神经保护作用,以期为临床治疗脑卒中提供实验基础。
1 材料与方法
1.1 实验动物
健康SPF级雄性SD大鼠36只,体重(220±20)g,购自斯贝福(北京)生物技术有限公司,实验动物生产许可证号:SCXK(京)2019-0010,实验动物使用许可证号:SYXK(冀)2021-004。适应性饲养1周,正常饲养供水。
1.2 主要试剂与仪器
1.2.1 主要试剂盐酸纳美芬注射液(1 mg/mL,国药准字H20080652,辽宁海思科制药有限公司),大鼠超氧化物歧化酶(superoxide dismutase,SOD)酶联免疫吸附试验(enzyme linked immunosorbent assay,ELISA)试剂盒(批 号:ml077379)、丙二醛(Malondialdehyde,MDA)ELISA 试剂盒(批 号:ml077384)(上海酶联生物科技有限公司),TUNEL 细胞凋亡检测试剂盒(批号:C1091,上海碧云天生物科技有限公司),脑组织蛋白提取试剂盒(批号:ml077391,上海酶联生物科技有限公司),Caspase-3、Bax、Bcl-2、GAPDH 兔抗大鼠一抗、羊抗兔HRP 标记二抗(美国Abcam 公司)。
1.2.2 主要仪器光学显微镜(日本Olympus 公司),酶标分析仪(美国Thermo 公司),Sigma 3-18K台式速冷冻离心机(德国Sigma 公司),Tissuelyser Ⅱ高通量组织研磨仪(德国Qiagen 公司),Gel Doc 凝胶成像系统(美国Bio-Rad 公司)。
1.3 方法
1.3.1 MCAO/R 模型的复制采用线栓法复制MCAO/R)模型[6],大鼠腹腔注射1%戊巴比妥钠麻醉,侧卧固定于手术台上,在颈部右侧做长约2 cm 切口,钝性分离颈总动脉(common carotid artery,CCA)与邻近肌肉和神经,暴露颈外动脉(external carotid artery,ECA)、颈内动脉(internal carotid artery,ICA),结扎CCA、ECA,动脉夹夹紧ICA,用眼科剪在ECA 与ICA 分叉处做1 mm 切口,置入外科手术尼龙线并轻轻向内推进,直至遇到明显阻力,则表明尼龙线已经到达大脑中动脉起始端,固定尼龙线。缺血2 h后,缓慢抽出尼龙线约10 min 形成缺血再灌注损伤,逐层缝合切口。整个过程中大鼠置于37℃恒温箱中保持体温。
1.3.2 实验分组与给药将36 只大鼠随机分为假手术组、模型组、盐酸纳美芬组,各12 只。盐酸纳美芬组大鼠复制MCAO/R 模型前10 min 尾静脉注射20 μg/kg 盐酸纳美芬注射液,假手术组和模型组注射等体积生理盐水。随后除假手术组(不进行CCA、ECA 结扎)外,其余两组采用线栓法复制MCAO/R 模型。
1.3.3 神经功能评分MCAO/R 模型复制完成后,放回鼠笼恢复24 h,参照Longa 评分标准进行大鼠神经功能评分[7]:正常(无神经损伤症状)计0 分;轻度(提尾时左前爪不张)计1 分;中度(行走时向左盘旋)计2 分;重度(行走困难,向左倾斜)计3 分;极严重(不能自发行走)计4 分。
1.3.4 ELISA检测脑组织SOD活性、MDA含量神经功能评分后,每组随机选取4 只大鼠,立即处死后取头,迅速于冰上解剖分离大鼠右侧脑组织,加入适量生理盐水,4℃匀浆脑组织,3 000 r/min离心10 min,取上清液,参照试剂盒说明书加入待测样本,最后在450 nm 波长下读取各孔光密度(optical density,OD)值,根据OD 值计算SOD 活性、MDA 含量。
1.3.5 苏木精-伊红(hematoxylin-eosin,HE)染色观察脑组织病理变化每组随机选取4 只大鼠,腹腔内注射1%戊巴比妥钠麻醉,开胸行主动脉插管,用200 mL 生理盐水快速冲洗,随后灌入4%多聚甲醛400 mL 固定,常规石蜡包埋,切片机切脑组织厚约5 μm。取切片烤干,加二甲苯脱蜡,重复1次,加乙醇脱苯,重复1次,洗净乙醇后常规HE染色,在显微镜下观察脑组织病理变化。
1.3.6 TUNEL染色观察细胞凋亡取1.3.5 中脑组织切片,加入二甲苯脱蜡10 min,重复1 次。加入无水乙醇5 min,90%乙醇2 min,70%乙醇2 min,蒸馏水冲干净。滴加不含DNase 的蛋白酶K 20 μg/mL,37℃、20 min。PBS 洗涤3次,除去蛋白酶K。加入内源性过氧化物酶强力封闭液,室温下孵育20 min,灭活切片中的内源过氧化物酶,PBS 洗涤3 次。参照TUNEL 试剂盒说明书,配制生物素标记液,现用现配。切片上滴加50 μL 生物素标记液,37℃避光孵育60 min。PBS 洗涤1次,再滴加0.2 mL 标记反应终止液,室温下孵育10 min。参照试剂盒说明书配制Streptavidin-HRP 工作液 和DAB 显色液。PBS 洗涤3次,滴加50 μL Streptavidin-HRP 工作液,室温孵育30 min,滴加0.3 mL DAB显色液,室温孵育20 min[8]。PBS 洗涤3次,在显微镜下观察细胞凋亡情况,随机选取5 个视野,计算每个视野中凋亡细胞数并记录平均值(视野中棕色为阳性凋亡细胞)。
1.3.7 Western blotting 检测Caspase-3、Bax、Bcl-2 蛋白的表达各组随机选取4 只大鼠,处死后取头,于冰上解剖分离右侧脑组织,加入组织蛋白提取液,组织匀浆器匀浆,4℃、12 000 r/min 离心5 min,取上清液,采用BCA法检测蛋白浓度。取蛋白20 μg,通过SDS-PAGE 分离蛋白并转移至PVDF 膜。5%脱脂牛奶封闭后,将PVDF 膜与Caspase-3、Bax、Bcl-2一抗体在4℃孵育过夜。缓冲液洗膜3次,PVDF 膜与二抗孵育1 h,洗膜3次,显色液显色。采用ImageJ软件定量分析蛋白相对表达量,以GAPDH 为内参。
1.4 统计学方法
数据分析采用SPSS 19.0 统计软件。计量资料以均数±标准差()表示,比较用方差分析或t检验,进一步两两比较用LSD-t检验。P<0.05 为差异有统计学意义。
2 结果
2.1 3组大鼠神经功能损伤情况
假手术组、模型组、盐酸纳美芬组大鼠神经功能评分分别为(0.00±0.00)分、(3.14±0.58)分和(2.21±0.41)分。假手术组分别与模型组、盐酸纳美芬组大鼠神经功能评分比较,经t检验,差异有统计学意义(t=18.754和18.672,均P=0.000),假手术组大鼠神经功能评分较低。模型组与盐酸纳美芬组大鼠神经功能评分比较,差异有统计学意义(t=4.536,P=0.000),盐酸纳美芬组大鼠神经功能评分低于模型组。
2.2 3组大鼠脑组织SOD活性、MDA含量比较
假手术组、模型组、盐酸纳美芬组大鼠脑组织SOD 活性、MDA 含量比较,经方差分析,差异有统计学意义(F=9.211 和15.625,均P=0.000)。进一步两两比较结果:模型组、盐酸纳美芬组SOD 活性低于假手术组(P<0.05),MDA 含量高于假手术组(P<0.05);与模型组相比,盐酸纳美芬组SOD 活性升高(P<0.05),MDA 含量降低(P<0.05)。见表1。
表1 3组大鼠脑组织SOD活性、MDA含量比较(n=4,)
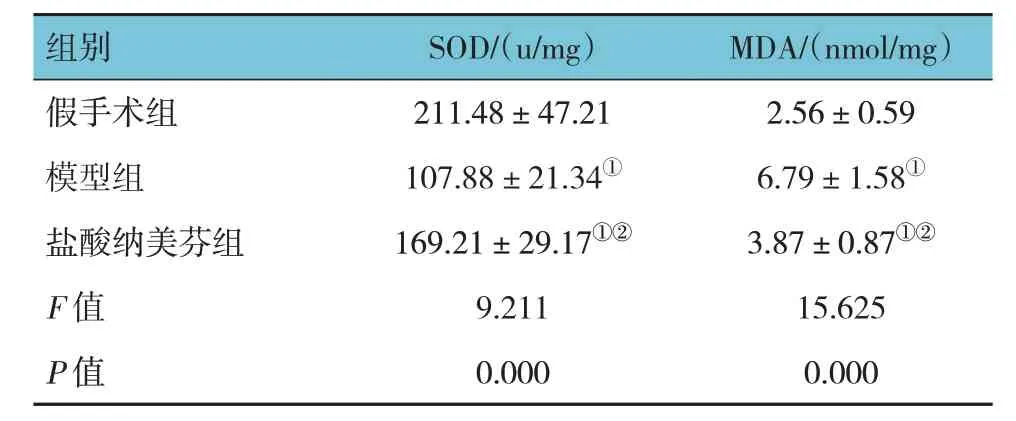
表1 3组大鼠脑组织SOD活性、MDA含量比较(n=4,)
注:①与假手术组比较,P <0.05;②与模型组比较,P <0.05。
2.3 3组大鼠脑组织病理变化
假手术组细胞轮廓清晰,排列有序。模型组细胞破损,数量减少,炎症浸润严重。盐酸纳美芬组细胞数量较多,轮廓清晰,炎症浸润减少(见图1)。
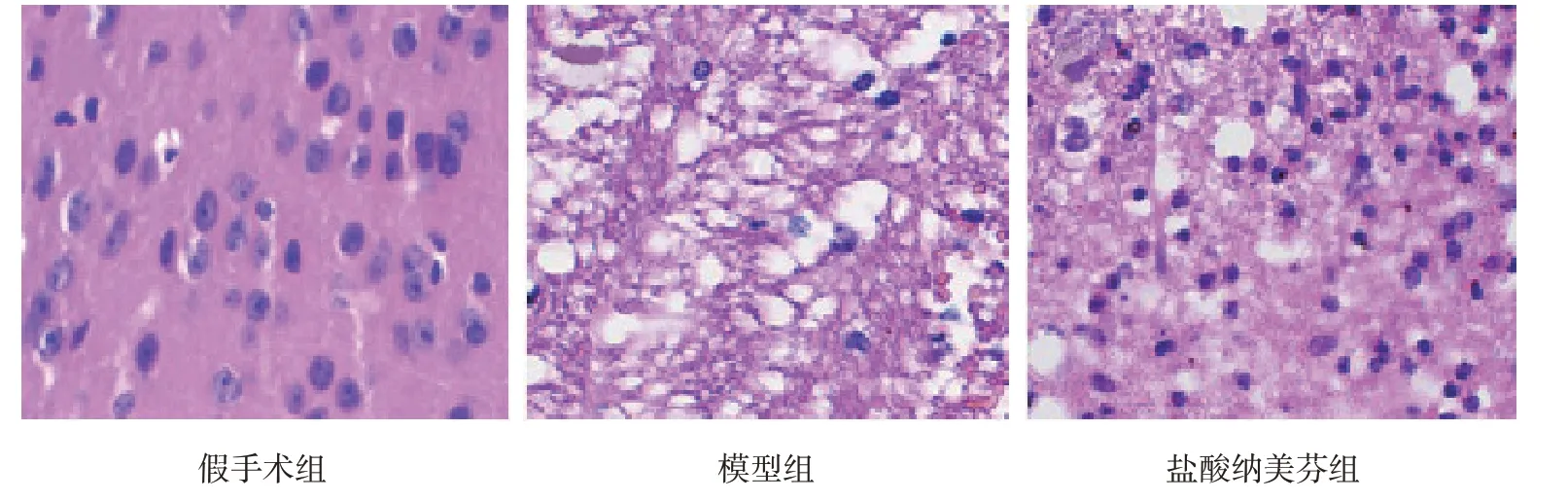
图1 3组大鼠脑组织病理变化(HE染色×400)
2.4 3组大鼠脑组织凋亡细胞数比较
假手术组、模型组、盐酸纳美芬组大鼠凋亡细胞数分别为(4.12±1.07)个/HP、(52.87±10.54)个/HP和(30.76±8.57)个/HP,经方差分析,差异有统计学意义(F=38.508,P=0.000)。进一步两两比较结果:模型组、盐酸纳美芬组凋亡细胞数多于假手术组(P<0.05);盐酸纳美芬组凋亡细胞数少于模型组(P<0.05)。见图2。

图2 3组大鼠脑组织细胞凋亡情况(TUNEL染色×200)
2.5 3 组大鼠脑组织Caspase-3、Bax、Bcl-2 蛋白相对表达量比较
假手术组、模型组、盐酸纳美芬组大鼠脑组织Caspase-3、Bax、Bcl-2 蛋白相对表达量比较,经方差分析,差异有统计学意义(F=29.871、33.992 和14.459,均P=0.000)。进一步两两比较结果:模型组、盐酸纳美芬组Caspase-3、Bax 蛋白相对表达量高于假手术组(P<0.05),Bcl-2 蛋白相对表达量低于假手术组(P<0.05);与模型组相比,盐酸纳美芬组Caspase-3、Bax 蛋白相对表达量降低(P<0.05),Bcl-2 蛋白相对表达量升高(P<0.05)。见 表2和图3。
表2 3组大鼠脑组织Caspase-3、Bax、Bcl-2蛋白相对表达量比较(n=4,)
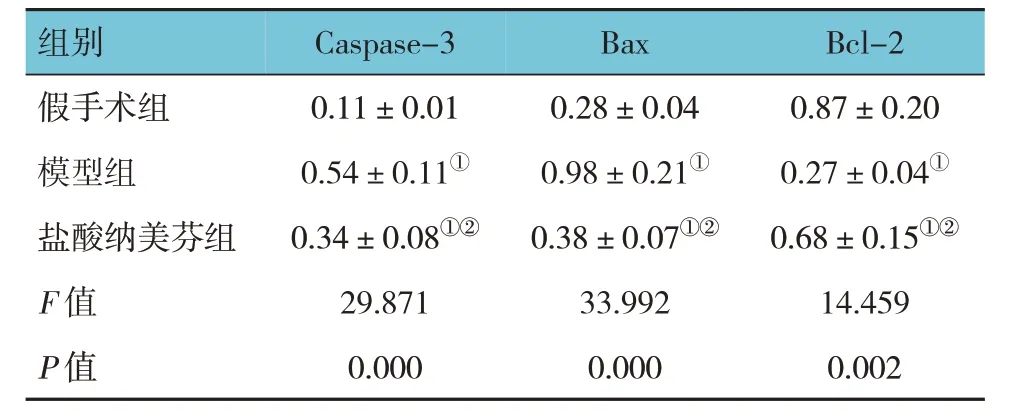
表2 3组大鼠脑组织Caspase-3、Bax、Bcl-2蛋白相对表达量比较(n=4,)
注:①与假手术组比较,P <0.05;②与模型组比较,P <0.05。

图3 3组大鼠脑组织Caspase-3、Bax、Bcl-2蛋白的表达
3 讨论
缺血性脑卒中是脑血管堵塞引起的脑损伤疾病,发病原因为大脑中动脉出现梗死,中断脑组织供血。即使在短时间内恢复供血,脑组织也会受到不同程度的损伤,使脑神经功能受损[9]。目前临床上常采用组织型纤溶酶原激活物(tissue-type plasminogen activator,t-PA)进行血栓溶解[10],但t-PA有效时间窗口狭窄(4.5 h 内),并且恢复血液灌注后,受损的脑组织神经元难以修复,因此寻找具有神经保护作用的药物对治疗脑组织缺血再灌注导致的神经损伤具有重要意义。盐酸纳美芬与其他阿片受体拮抗剂一样,具有抗昏迷、抗休克等作用。盐酸纳美芬可以透过血脑屏障,注射后可以迅速到达脑组织,促进损伤神经的修复,具有修复受损神经元的作用[11]。既往研究结果显示,临床上治疗急性脑梗死时,在常规治疗基础上加用盐酸纳美芬可以提高疗效[12]。
本研究结果显示,模型组大鼠出现行走困难,并向左倾斜的症状,说明右侧脑组织损伤严重;盐酸纳美芬组大鼠行走时虽向左盘旋,但行走障碍不明显,说明右脑神经功能得到部分修复。脑组织缺血再灌注过程会产生大量的氧自由基,导致脂质过氧化,破坏细胞膜,损伤神经元[13]。MDA 是脂质过氧化的终产物[14]。本研究结果显示,与假手术组相比,模型组大鼠MDA 含量升高,说明MCAO/R后,大鼠脑组织中脂质过氧化反应水平升高,脑组织氧化损伤严重。与模型组相比,预注射盐酸纳美芬后大鼠脑组织MDA 含量降低。SOD 参与氧自由基的清除,对抗机体氧化应激反应[15]。本研究中,与模型组相比,预注射盐酸纳美芬的大鼠脑组织SOD 活性升高,说明脑组织抗氧化水平提高。通过HE 染色发现,MCAO/R 对脑组织造成损害,细胞破损严重,炎症浸润增加,而预注射盐酸纳美芬后,大鼠脑组织炎症浸润减少,细胞数量增多,提示盐酸纳美芬具有一定脑组织保护作用。
脑组织缺血时,神经元会激活小胶质细胞,释放活性氧(reactive oxygen species,ROS)。ROS 刺激线粒体释放细胞色素C(cytochrome C,Cyt-C),与凋亡蛋白酶激活因子形成聚合物,激活细胞凋亡终末蛋白Caspase-3,促进凋亡的发生。Bcl-2 是细胞中重要的抗凋亡基因,其通过抑制细胞中蓄积的Cyt-C和Caspase-3,达到抑制细胞凋亡的作用。Bax属于Bcl-2基因家族,过表达拮抗Bcl-2 形成二聚体,抑制Bcl-2 的保护作用[16-17]。本研究中,与假手术组相比,模型组大鼠脑组织Caspase-3、Bax 蛋白相对表达量升高,Bcl-2 蛋白相对表达量降低,说明MCAO/R时脑组织发生氧化应激反应,造成脑组织损伤,大量细胞凋亡。当预注射盐酸纳美芬后,与模型组相比,盐酸纳美芬组大鼠脑组织Caspase-3、Bax 蛋白相对表达量降低,Bcl-2 蛋白相对表达量升高,提示盐酸纳美芬可以抑制氧化应激发生,具有神经保护作用;并且通过TUNEL 染色观察到,相比模型组,盐酸纳美芬组大鼠脑组织凋亡细胞减少。
综上所述,盐酸纳美芬具有抗氧化应激作用,可抑制细胞凋亡,保护脑神经。其作用机制与调控Caspase-3/Bcl-1/Bax 通路有关,但具体调控机制有待进一步研究证实。

