miR-143-3p通过调控CX3CL1/CX3CR1信号通路对脂多糖诱导肺泡上皮细胞损伤的影响
荆忻 邵萍 李学莉
1宁夏医科大学总医院心脑血管病医院重症医学科(银川 750001);宁夏银川市第一人民医院2呼吸与危重病医学科,3重症医学科(银川 750001)
急性肺损伤(acute lung injury,ALI)以进行性呼吸窘迫、顽固性低氧血症和非心源性肺水肿为临床特征,而重度的ALI即为急性呼吸窘迫综合征(acute respiratory distress syndrome,ARDS),具有较高的发病率和死亡率。ALI的特点是肺泡-毛细血管膜通透性增加,弥漫性肺泡损伤、水肿以及过度的肺部炎症和肺泡上皮细胞凋亡[1]。脂多糖(lipopolysaccharide,LPS)是细菌感染引起ALI的主要致病因素之一[2]。因此,LPS常被用来诱导肺泡上皮细胞损伤,来建立ALI的体外细胞模型,其特点是肺泡上皮细胞炎症和凋亡增强[3]。微小RNA(miRNA)通过负向调控蛋白编码基因的表达,参与各种细胞过程的调控,包括炎症反应[4-5]。近年来发现抑制miR-92a可以通过靶向TLR2/AP-1轴减轻ALI大鼠肺水肿,改善LPS诱导肺泡上皮细胞损伤[6]。miR-143-3p位于5q32染色体上,具有抗肿瘤、抗炎等作用[7-8]。近期研究[9]显示miR-143-3p过表达可改善支原体肺炎小鼠炎症因子水平,减少肺上皮细胞凋亡。但是,miR-143-3p是否在ALI中起作用仍不清楚。因此,本研究将观察miR-143-3p在ALI/ARDS患者外周血中的表达水平以及其对LPS诱导的肺泡上皮细胞损伤的影响,并探讨miR-143-3p与趋化因子(C-X3-C基元)配体1(chemokine(C-x3-C unit)ligand 1,CX3CL1)/趋化因子(C-X3-C基元)受体1/(chemokine(C-x3-C unit)receptor 1,CX3CR1)信号通路的关系,旨在为临床诊治ALI/ARDS提供新型指标监测及研究方向。
1 资料与方法
1.1 临床资料及样本收集 本研究获得宁夏医科大学总医院伦理委员会批准,批准号为2019.029,且遵循《赫尔辛基宣言》中涉及人体的医学研究的伦理原则。所有参与者均获得书面知情同意。根据ARDS柏林定义诊断ALI/ARDS。纳入标准如下:(1)年龄> 18且< 80岁;(2)诊断为ALI/ARDS。排除标准:(1)有肺纤维化;(2)肝肾功能异常;(3)临床肺部感染评分显示为肺炎;(4)心功能不全引起肺水肿;(5)需要体外膜氧合支持。2019年7月至2021年5月在本院急诊科就诊的符合上述标准的ALI/ARDS患者共46例,其中男24例,女22例,平均年龄(58.53±8.62)岁,记为ALI/ARDS组;同时选取在相同时间段进行体检的46例健康者,其中男25例,女21例,平均年龄(58.61±8.65)岁,记为Normal组。ALI/ARDS组患者在诊断ALI/ARDS后30 min内进行外周血采集,Normal组健康体检者在清晨空腹时采集外周血,所有样本离心后取上清液,获得外周血血清,并保存在-20℃冰箱中备用。
1.2 实验试剂与仪器 人肺泡上皮细胞A549购自美国ATCC公司。LPS购自北京索莱宝;Lipofectamine 2000转染试剂购自上海笃玛生物;模拟物阴性对照(NC mimic)、miR-143-3p模拟物(miR-143-3p mimic)、抑制物阴性对照(NC inhibitor)、miR-143-3p抑制剂(miR-143-3p inhibitor)、空载体质粒(pcDNA)、CX3CL1重组载体质粒(pc-CX3CL1)购自上海拓然生物;TRIzol、Annexin V-FITC/PI双染色流式细胞凋亡检测试剂盒、BCA试剂盒购自上海碧云天;SYBR Green Real-time PCR Master Mix购自上海欣百诺生物;MTT试剂盒及肿瘤坏死因子-α(TNF-α)、白介素1β(IL-1β)、白介素-6(IL-6)、血管内皮生长因子(VEGF)和降钙素原(PCT)ELISA试剂盒购自武汉默沙克;CX3CL1、CX3CR1和βactin的一抗、辣根过氧化物酶二抗购自艾博抗(上海);增强型化学发光试剂盒购自南京诺唯赞。酶标仪购自山东博科科学仪器有限公司;流式细胞仪购自伯乐生命医学产品(上海)有限公司。
1.3 双荧光素酶实验证实miR-143-3p与CX3CL1的靶向关系 TargetScan软件预测到miR-143-3p与CX3CL1 3'UTR之间存在互作关系。构建CX3CL1野生型和突变型(WT/MUT-CX3CL1)荧光素酶载体,并将其分别与miR-143-3p mimic或NC mimic转染至A549细胞中,48 h后采用双荧光素酶报告系统测量荧光素酶活性。
1.4 细胞培养、转染、LPS处理与分组 人肺泡上皮细胞A549在RPMI-1640培养基培养。细胞生长至对数期时使用1 mg/L的LPS[10]处理来诱发细胞损伤,并将其记为LPS组,不经LPS处理的A549细胞作为Control组。然后利用Lipofectamine 2000转染试剂将 NC mimic、miR-143-3p mimic、miR-143-3p mimic和pcDNA、miR-143-3p mimic和pc-CX3CL1转染至A549细胞,转染24 h后使用1 mg/L的LPS进行处理,分别标记为LPS+NC mimic组、LPS+miR-143-3p mimic组、LPS+miR-143-3p mimic+pcDNA组、LPS+miR-143-3p mimic+pc-CX3CL1组,继续培养24 h后收集各组细胞用于后续指标检测。LPS组在细胞培养24 h后进行造模,并在造模后培养24 h进行相关指标检测;Control组虽不进行造模,但培养时间与其他组相同,指标检测的时间与其他组也一致。
1.5 qRT-PCR检测miR-143-3p和CX3CL1、CX3CR1 mRNA表达水平 使用TRIzol提取外周血血清和各组肺泡上皮细胞的总RNA,并通过逆转录试剂盒合成cDNA。采用SYBR Green Real-time PCR Master Mix进行qRT-PCR扩增。采用2-ΔΔCt法对数据进行量化,以U6或β-actin为内参。qPCR引物:miR-143-3p正向:5'-GAGATGAAGCACTGTAGCT-3',反向:5'-GAACATGTCTGCGTATCTC-3';U6正向:5'-ACAGATCTGTCGGTGTGGCC-3',反向:5'-GGCCCCGGATTATCCGACATTC-3';CX3CL1正向:5'-TCCGATATCTCTGTCGTGGC-3',反向:5'-TGTCTCGTCTCCAAGCAGC-3';CX3CR1正向:5'-GACTTCTTCCACCATGAGCAG-3',反向:5'-CCTCTAGTCGCTGTGGTGTTC-3';β-actin正向:5'-AGAAAATCTGGCACCACACC-3',反向:5'-CCATCTCTTGCTCGAAGTCC-3'。
1.6 Western blot检测CX3CL1、CX3CR1蛋白表达 提取外周血血清和各组肺泡上皮细胞总蛋白。BCA试剂盒测定浓度。然后将40 μg蛋白用10%的SDS-PAGE凝胶溶解,然后转移到PVDF膜上。用脱脂奶粉在室温下封闭膜4 h后,用抗CX3CL1、CX3CR1和β-actin的一抗在4℃下孵育一夜。然后与辣根过氧化物酶二抗在室温孵育2 h。用增强型化学发光试剂盒检测该蛋白。用Image-Pro Plus 6.0软件对目的条带进行量化。
1.7 MTT检测细胞活力 将转染后的各组肺泡上皮细胞A549以1×103/孔的密度接种至96孔板,并与20 μL MTT试剂共同孵育2 h,然后使用酶标仪检测490 nm波长处的吸光度,并以实验组与空白组的吸光度的百分比表示各组细胞的细胞活力。
1.8 流式细胞术检测细胞凋亡 将收集的各组转染后的A549细胞分别加入100 μL 1×结合缓冲液,将其制成细胞悬液,然后依次加入Annexin V-FITC和PI,各5 μL,室温下静置30 min,再加入400 μL 1×结合缓冲液,最后上流式细胞仪检测细胞凋亡情况。
1.9 ELISA分析炎症指标水平 按照实验室购买的ELISA试剂盒说明书的操作步骤检测各组细胞上清液中炎症指标的水平,包括TNF-α、IL-1β、IL-6、VEGF和PCT。
1.10 统计学方法 实验结果以6次重复实验的均数±标准差表示。采用SPSS 16.0软件进行统计分析,采用单因素方差分析(ANOVA)或双尾studentt检验进行多组或两组间的差异比较,多组资料的两两事后比较采用SNK-q检验。以P<0.05为差异有统计学意义。
2 结果
2.1 miR-143-3p、CX3CL1和 CX3CR1在 ALI/ARDS患者外周血和LPS诱导的肺泡上皮细胞A549中的表达水平 与Normal组相比,ALI/ARDS组患者外周血中miR-143-3p表达降低,CX3CL1、CX3CR1的mRNA和蛋白表达升高(P<0.05),见图1。与Control组比较,LPS组A549细胞中miR-143-3p表达减小,CX3CL1和CX3CR1的mRNA和蛋白表达增加(P<0.05),见图2。
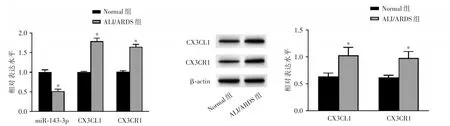
图1 miR-143-3p、CX3CL1和CX3CR1在ALI/ARDS患者外周血中的表达水平Fig.1 Expression levels of miR-143-3p,CX3CL1 and CX3CR1 in peripheral blood of patients with ALI/ARDS

图2 miR-143-3p、CX3CL1和CX3CR1在LPS诱导的肺泡上皮细胞A549中的表达水平Fig.2 Expression levels of miR-143-3p,CX3CL1 and CX3CR1 in LPS-induced alveolar epithelial cells A549
2.2 miR-143-3p过表达对LPS诱导的肺泡上皮细胞A549增殖、凋亡的影响 与Control组相比,LPS组miR-143-3p表达、细胞活力降低,凋亡率增加(P<0.05);与LPS组或LPS+NC mimic组比较,LPS+miR-143-3p mimic组miR-143-3p表达及细胞活力显著升高,凋亡率明显降低(P<0.05),见图3和表1。
表1 miR-143-3p过表达对LPS诱导的肺泡上皮细胞A549增殖、凋亡的影响Tab.1 Effect of miR-143-3p overexpression on proliferation and apoptosis of alveolar epithelial cells A549 induced by LPS ±s
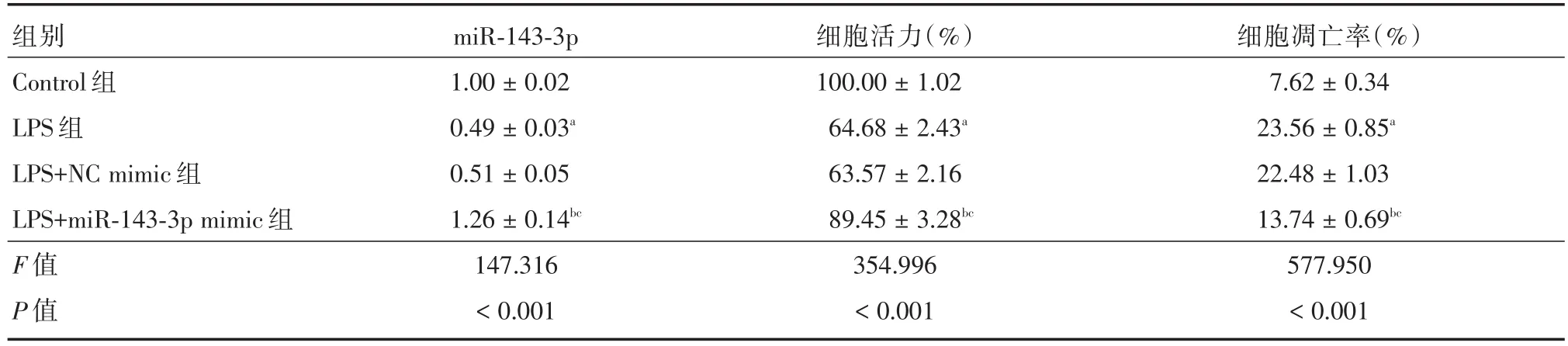
表1 miR-143-3p过表达对LPS诱导的肺泡上皮细胞A549增殖、凋亡的影响Tab.1 Effect of miR-143-3p overexpression on proliferation and apoptosis of alveolar epithelial cells A549 induced by LPS ±s
注:与Control组比较,aP <0.05;与LPS组比较,bP <0.05;与LPS+NC mimic组比较,cP <0.05
组别Control组LPS组LPS+NC mimic组LPS+miR-143-3p mimic组F值P值miR-143-3p 1.00±0.02 0.49±0.03a 0.51±0.05 1.26±0.14bc 147.316<0.001细胞活力(%)100.00±1.02 64.68±2.43a 63.57±2.16 89.45±3.28bc 354.996<0.001细胞凋亡率(%)7.62±0.34 23.56±0.85a 22.48±1.03 13.74±0.69bc 577.950<0.001

图3 miR-143-3p过表达对LPS诱导的肺泡上皮细胞A549凋亡的影响Fig.3 Effect of miR-143-3p overexpression on apoptosis of alveolar epithelial cells A549 induced by LPS
2.3 miR-143-3p过表达对LPS诱导的肺泡上皮细胞A549炎症指标的影响 图4显示,LPS组TNF-α、IL-1β、IL-6、VEGF、PCT含量明显比Control组高(P< 0.05);LPS+miR-143-3p mimic组TNF-α、IL-1β、IL-6、VEGF和PCT含量明显低于LPS+NC mimic组和LPS组(P<0.05)。
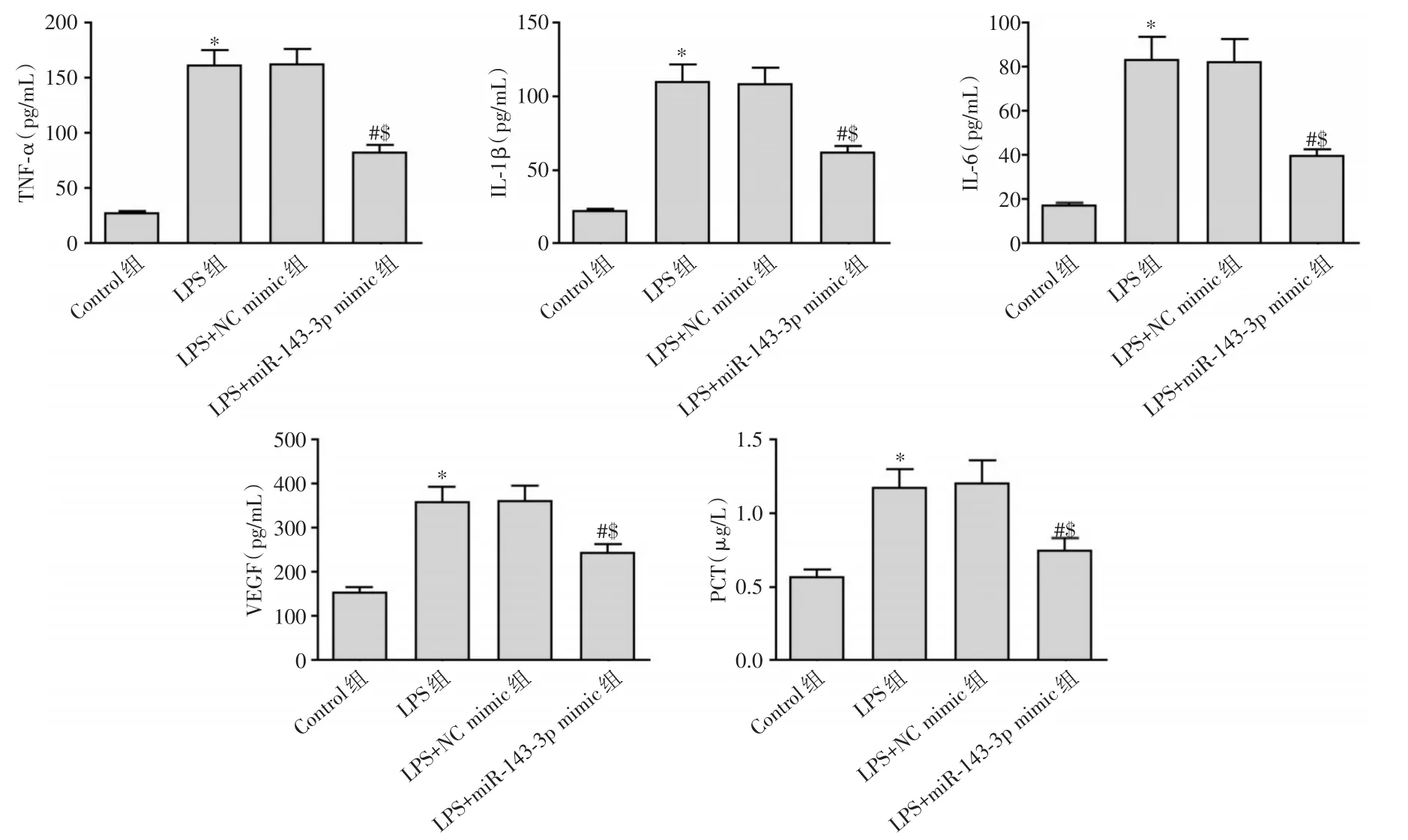
图4 miR-143-3p过表达对LPS诱导的肺泡上皮细胞A549炎症指标的影响Fig.4 Effect of miR-143-3p overexpression on inflammatory indicators in alveolar epithelial cells A549 induced by LPS
2.4 miR-143-3p靶向CX3CL1 TargetScan软件预测发现miR-143-3p和CX3CL1的3'UTR存在互补的核苷酸位点,见图5A。图5B显示,miR-143-3p mimics+WT-CX3CL1组相对荧光素酶活性比NC mimics+WT-CX3CL1组减小(P<0.05),miR-143-3p mimics+MUT-CX3CL1组相对荧光素酶活性与NC mimics+MUT-CX3CL1组差异无统计学意义(P>0.05)。与NC mimics组比较,miR-143-3p mimics组CX3CL1 mRNA和蛋白表达降低(P<0.05);与NC inhibitor组比较,miR-143-3p inhibitor组 CX3CL1 mRNA和蛋白表达升高(P<0.05),见图5C-D。

图5 双荧光素酶实验证实miR-143-3p靶向调控CX3CL1Fig.5 Dual luciferase assay confirmed that miR-143-3p targeted regulation of CX3CL1
2.5 CX3CL1过表达逆转miR-143-3p过表达对LPS诱导的肺泡上皮细胞A549细胞损伤的保护作用 与LPS+miR-143-3p mimic组、LPS+miR-143-3p mimic+pcDNA组相比,LPS+miR-143-3p mimic+pc-CX3CL1组CX3CL1蛋白上调表达,细胞活力下降,凋亡率升高,TNF-α、IL-1β、IL-6、VEGF、PCT水平增加(P<0.05),见图6-8、表2。

图6 各组A549细胞中CX3CL1的表达水平Fig.6 CX3CL1 expression level in A549 cells of each group

图7 miR-143-3p过表达对LPS诱导的肺泡上皮细胞A549凋亡的影响Fig.7 Effect of miR-143-3p overexpression on apoptosis of alveolar epithelial cells A549 induced by LPS
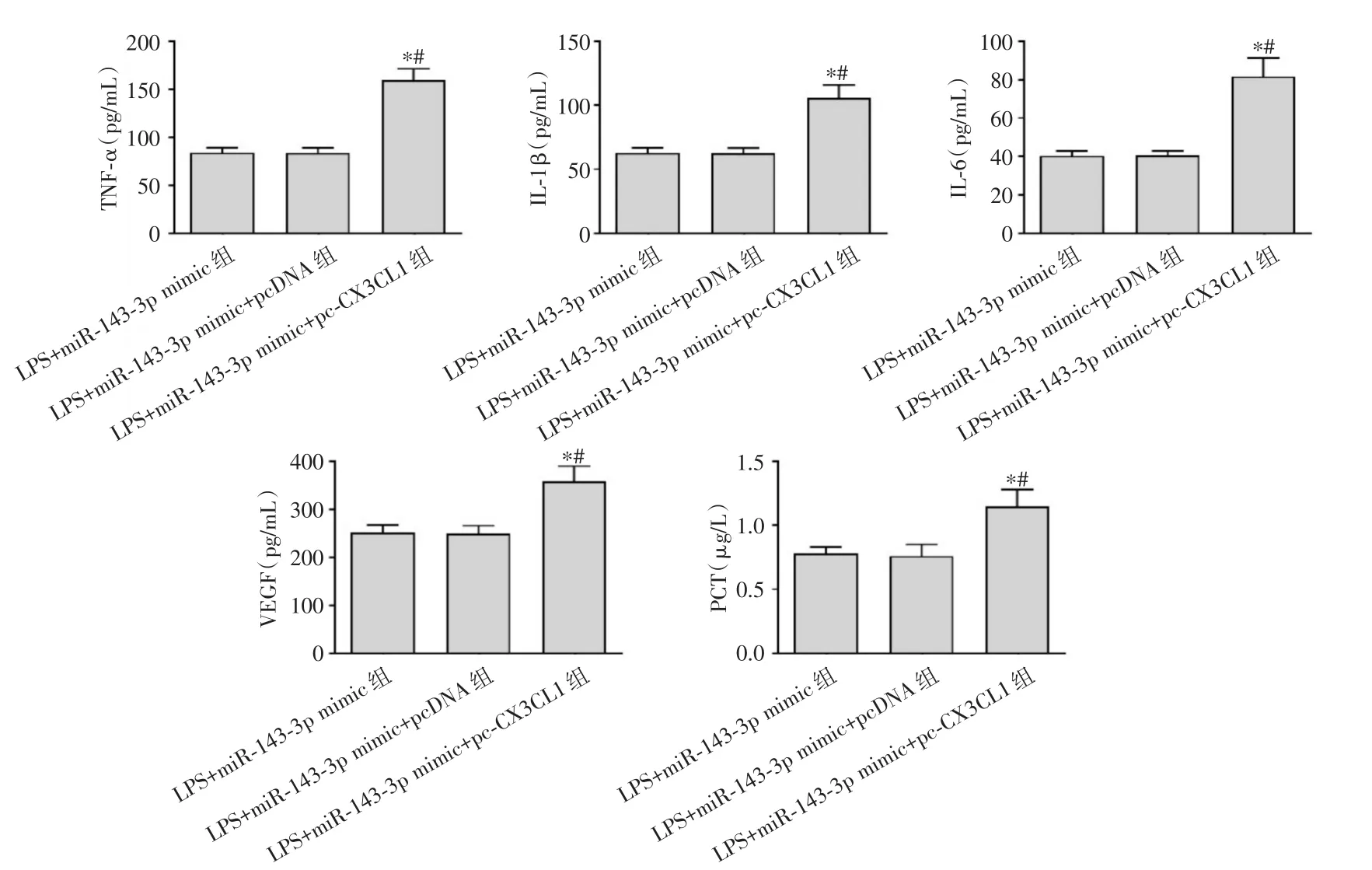
图8 CX3CL1过表达逆转miR-143-3p过表达对LPS诱导的肺泡上皮细胞A549炎症指标的影响Fig.8 Effect of CX3CL1 overexpression reversing miR-143-3p overexpression on inflammatory markers in alveolar epithelial cells A549 induced by LPS
表2 CX3CL1过表达逆转miR-143-3p过表达对LPS诱导的肺泡上皮细胞A549增殖、凋亡的影响Tab.2 Effect of CX3CL1 overexpression reversing miR-143-3p overexpression on proliferation and apoptosis of alveolar epithelial cells A549 induced by LPS ±s,n=6
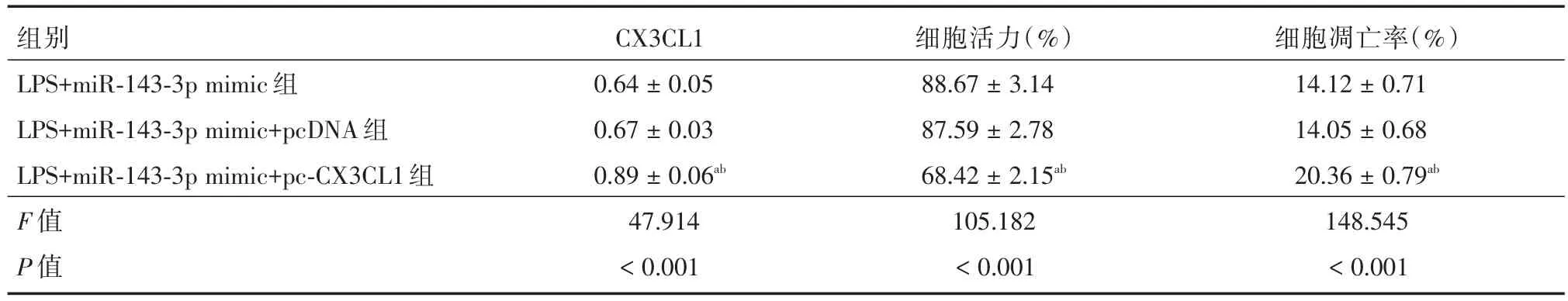
表2 CX3CL1过表达逆转miR-143-3p过表达对LPS诱导的肺泡上皮细胞A549增殖、凋亡的影响Tab.2 Effect of CX3CL1 overexpression reversing miR-143-3p overexpression on proliferation and apoptosis of alveolar epithelial cells A549 induced by LPS ±s,n=6
注:与LPS+miR-143-3p mimic组比较,aP<0.05;与LPS+miR-143-3p mimic+pcDNA组比较,bP<0.05
组别LPS+miR-143-3p mimic组LPS+miR-143-3p mimic+pcDNA组LPS+miR-143-3p mimic+pc-CX3CL1组F值P值CX3CL1 0.64±0.05 0.67±0.03 0.89±0.06ab 47.914<0.001细胞活力(%)88.67±3.14 87.59±2.78 68.42±2.15ab 105.182<0.001细胞凋亡率(%)14.12±0.71 14.05±0.68 20.36±0.79ab 148.545<0.001
2.6CX3CL1过表达逆转miR-143-3p过表达对LPS诱导的肺泡上皮细胞A549中CX3CR1表达的影响 LPS组CX3CR1 mRNA和蛋白表达高于Control组(P< 0.05);LPS+miR-143-3p mimic组 CX3CR1 mRNA和蛋白表达比LPS组和LPS+NC mimic组低(P<0.05);与LPS+miR-143-3p mimic组和LPS+miR-143-3p mimic+pcDNA组比较,LPS+miR-143-3p mimic+pc-CX3CL1组CX3CR1 mRNA和蛋白表达升高(P<0.05),见图9。

图9 CX3CL1过表达逆转miR-143-3p过表达对LPS诱导的肺泡上皮细胞A549中CX3CR1 mRNA和蛋白表达的影响Fig.9 Effect of CX3CL1 overexpression reversing miR-143-3p overexpression on CX3CR1 mRNA and protein expression in alveolar epithelial cells A549 induced by LPS
3 讨论
弥漫性肺泡损伤是ALI/ARDS的病理标志,而肺泡上皮细胞是抵抗机体感染的第一道屏障。在ALI/ARDS中,弥漫性肺泡损伤导致促炎细胞因子的释放,进一步招募中性粒细胞到肺部,加重局部和全身的炎症和组织损伤[11]。在本研究中,ALI/ARDS患者的外周血中均检测到miR-143-3p下降和CX3CL1、CX3CR1升高,这使得进一步在肺泡上皮细胞中探讨这三种因子的作用,从而通过体外实验解释miR-143-3p与CX3CL1、CX3CR1的调控关系及其对肺泡上皮细胞损伤的影响。
既往研究[12]表明,miRNA可作为多种疾病的生物标志物,如血清miR-150可作为ARDS筛查及预后预测因子,miR-122是心血管纤维化的早期预警生物标志物[13]。TIEDT等[14]研究表明,miR-143-3p与急性缺血性卒中相关,可能作为早期诊断标志物发挥临床应用价值。而在ALI/ARDS中尚没有关于miR-143-3p的研究。本研究发现,miR-143-3p在ALI/ARDS患者外周血中表达下调,说明其可能作为ALI/ARDS的诊断标志物。此外,LPS诱导的肺泡上皮细胞A549中miR-143-3p表达减小,细胞活力降低,凋亡率增加,提示细胞损伤模型构建成功。本研究通过转染miR-143-3p mimic上调miR-143-3p表达发现A549细胞活力升高,凋亡率降低,揭示miR-143-3p过表达可有效减轻LPS诱导的肺泡上皮细胞损伤。
研究[1]表明,ALI/ARDS的主要原因是炎症反应和抗炎反应之间的失衡,以及体液免疫和细胞免疫激活引起的不可控的全身炎症反应。炎症细胞因子如IL-6、IL-1β、TNF-α启动级联性炎症反应,导致炎症细胞因子浸润和病理改变[15]。VEGF水平增加有利于提高内皮细胞通透性,而降低VEGF表达可间接减轻肺泡上皮细胞损伤,从而缓解ALI/ARDS病情[16]。PCT是一种蛋白质,当机体发生感染时,促炎因子的分泌增多,从而使PCT升高,而且PCT水平随着ARDS患者病情的加重逐渐升高[17]。本研究结果显示,miR-143-3p过表达后LPS诱导的A549细胞上清液中TNF-α、IL-1β、IL-6、VEGF、PCT明显降低,提示miR-143-3p可改善LPS诱导的肺泡上皮细胞的炎症反应。
CX3CL1是CX3C家族的唯一成员,通过结合唯一受体CX3CR1参与炎症的发生、诱导和活化,参与了诸多炎性疾病的发生与发展[18]。以往研究[19]显示,CX3CL1在急性肺损伤大鼠肺组织中表达升高。本研究显示,CX3CL1、CX3CR1 mRNA和蛋白水平在ALI/ARDS患者和LPS诱导的A549细胞中均表现上调,这与DING等[20]的研究一致,说明CX3CL1、CX3CR1参与调控ALI/ARDS进展。本研究通过TargetScan软件预测和实验证实miR-143-3p直接靶向调节CX3CL1表达。此外,本研究发现,在过表达miR-143-3p的基础上上调CX3CL1蛋白表达可显著抑制A549细胞活力,促进细胞凋亡和炎症因子表达,同时增加了CX3CR1的表达水平,提示miR-143-3p过表达可通过抑制CX3CL1/CX3CR1表达减轻LPS诱导的肺泡上皮细胞损伤。
综上所述,本研究首次发现miR-143-3p在ALI/ARDS患者和LPS诱导的肺泡上皮细胞中表达降低,并可能通过靶向抑制CX3CL1/CX3CR1通路改善LPS诱导的肺泡上皮细胞损伤,提示miR-143-3p可能作为ALI/ARDS的诊断标志物,也为ALI/ARDS的治疗提供新的分子治疗靶点。

