丘脑脑源性神经生长因子-酪氨酸激酶受体B信号介导脑缺血诱发的痛觉过敏
金博文 李东娜 庄朋伟 郭虹 张艳军
1天津中医药大学(天津 301617);2天津中医药大学第一附属医院(天津 300193)
脑卒中后中枢性疼痛(central post-stroke pain,CPSP)是继发于脑卒中之后的慢性中枢性神经病理性疼痛,其临床症状主要为卒中后自发性疼痛、痛觉过敏、痛觉超敏和感觉异常[1],是导致患者脑卒中后焦虑抑郁的主要原因之一,严重影响了患者卒中后恢复期的生存质量[2]。随着脑卒中发病率和存活率的逐年上升[3],CPSP患者数量逐渐增加,目前关于CPSP发病机制的研究主要集中在神经炎症、中枢敏化和去抑制三个方面[4],尽管近年来取得了一定进展,但CPSP的发病机制仍不完全明确,对临床有效药物的研发带来了一定困难。
脑源性神经生长因子(brain-derived neurotrophic bactor,BDNF)是中枢神经系统中广泛存在的一种基础神经营养蛋白[5]。BDNF与其受体酪氨酸激酶受体B(tyrosine kinase receptor B,TrkB)结合后,自身产生磷酸化,经过磷酸化的TrkB可激活下游多种信号传导途径而发挥生物学功能[6],研究表明,慢性疼痛过程中BDNF-TrkB通路的异常激活与痛觉过敏有着密切联系[7],是疼痛传导过程中的关键调节因子,但关于BDNF在脑卒后中枢性疼痛的发病过程中起到的作用,目前尚无研究。本研究拟基于丘脑BDNF信号揭示脑卒中后中枢性疼痛的发病机制,为脑卒中后中枢性疼痛的防治提供一定线索。
1 材料与方法
1.1 材料
1.1.1 仪器 大鼠MCAO线栓(2838A5),北京西浓科技有限公司;小动物麻醉机,美国Matrx公司;石蜡包埋机,转轮切片机,德国Leica公司;倒置荧光显微镜,日本Olympus公司;电泳槽,美国伯乐公司;凝胶成像仪,和信伟业科技有限公司。
1.1.2 实验动物 SPF级8周龄雄性wistar大鼠60只,体质量270~300 g,购自北京维通利华实验动物技术有限公司,动物合格证号SCXK(京)2019-0008。饲养于天津中医药大学动物中心。
1.1.3 试剂 Neun抗体(ab177487),驴抗山羊IgG H&L(Alexa Fluor®488)(ab150129),驴抗兔 IgG H&L(Alexa Fluor®647),英国Abcam公司;Iba1抗体(NB100-1028),Novus Biologicals;BDNF抗体(PB9075),TrkB抗体(BM4759),武汉博士德生物工程有限公司;β-actin抗体(GB15001),武汉赛维尔生物科技有限公司;GABAA Rα(sc-376282),圣克鲁斯生物技术;HRP标记的山羊抗兔IgG H&L(A0208),上海碧云天生物技术有限公司;2,3,5氯化三苯基四氮唑TTC(T8170),尼氏染色试剂盒(G1432),北京索莱宝科技有限公司。
1.2 实验方法
1.2.1 动物分组和造模 脑卒中后中枢性疼痛动物模型的造模方法参考HYAKKOKU等[8]的造模方法并在此基础上加以改进。大鼠随机分为假手术组(SHAM组)10只,脑卒中模型组(CPSP组)50只。术前1 d运用热板法测定大鼠热痛阈值,作为基础痛阈值。采用大脑中动脉阻塞线栓法(MCAO)建立局灶性脑缺血再灌注大鼠模型,沿右侧颈内动脉插入线栓并向前推进,直至大脑中动脉起始部被阻断,60 min后缓慢拔除线栓,恢复供血,造成脑卒中模型,假手术组仅分离颈总动脉。造模后两小时参照Zea Longa评分法评估模型[9],评分为1~3分的大鼠视为脑卒中造模成功,术后3 d再次测定热痛阈,以术前1 d测量值为参考值,筛选出热痛阈下降超过50%的大鼠[10],纳入模型组(CPSP)。
1.2.2 大鼠热痛阈测定 利用热板法测定各组大鼠术前1 d、术后3、7、14、21、28 d热痛阈值,将大鼠置于50℃的热板仪上,以30 s为上限值,以舔后足或连续缩足为观察指标,测试完毕,将大鼠放回笼中,间隔至少15 min后重复测试,测定3次,取后两次平均值为热痛阈值[11]。
1.2.3 脑组织TTC染色、HE染色和尼氏染色 术后3 d,从模型组和假手术组随机选取1只大鼠处死,取其脑组织,-40℃冰箱冰冻10 min,弃去脑干,每2 mm切一片,切成均匀的6~7片,室温避光用2%的TTC染液,室温避光处理30 min,后用4%多聚甲醛固定24 h,拍照采集图像[12]。术后28 d处死大鼠取其脑组织,4%多聚甲醛固定,经脱水后石蜡包埋切成5 μm薄片,固定于载玻片上,烘烤后,二甲苯脱蜡透明,梯度酒精水化,部分切片进行HE染色[13],苏木素染色5 min,盐酸酒精分化,氨水返蓝,伊红染色1 min,梯度酒精脱水,二甲苯透明,中性树胶封片,镜下观察;另一部分切片进行尼氏染色[14],60℃尼氏染液染色30 min,95%酒精脱色,梯度酒精脱水,二甲苯透明,中性树胶封片,镜下观察,对丘脑VPL区尼氏体进行计数。
1.2.4 Neun免疫组化检测和IBA1、BDNF免疫荧光检测 术后28 d处死大鼠取其脑组织,4%多聚甲醛固定,经脱水后石蜡包埋切成5 μm薄片,固定于载玻片上,烘烤后,二甲苯脱蜡透明,梯度酒精水化,部分切片进行Neun免疫组化检测,柠檬酸钠热修复,灭活内源过氧化酶,山羊血清封闭后,滴加兔源Neun(1∶200)4℃过夜孵育,洗去一抗后,37℃孵育HRP标记的山羊抗兔二抗(1∶50)30 min,DAB避光显色,苏木素复染后脱水封片。镜下观察并采集图片,使用Image J分析平均光密度值。另一部分切片进行IBA1、BDNF免疫荧光检测柠檬酸钠热修复,TritonX-100破膜,驴血清封闭,滴加山羊源 IBA1(1∶1 000)和兔源BDNF(1∶200)4℃过夜孵育,洗去一抗后,室温孵育驴抗山羊和驴抗兔荧光二抗(1∶1 000)2 h,DAPI染核,抗荧光淬灭封片剂封片,镜下观察并采集图片。
1.2.5 Western blot检测丘脑 BDNF,TRKB 和GABAAR蛋白的表达 术后28 d处死大鼠取丘脑组织,-80℃冷藏,加入裂解液后剪碎,提取总蛋白,BCA蛋白定量,100℃5 min使蛋白变性,取一定量的蛋白样品进行凝胶电泳,电转至0.45 nm PVDF膜上后,5%脱脂牛奶封闭2 h,一抗4℃孵育过夜,恢复室温,TBST洗膜5次,辣根过氧化物酶标记二抗室温孵育2 h,TBST洗膜5次,加入ECL荧光显色。采用Image J软件进行结果分析。
1.2.6 统计学分析 采用SPSS 23.0软件进行统计学分析,研究结果计量资料采用均数±标准差表示,实验数据图形用GraphPad Prism 5.0软件进行绘制,两组间比较采用t检验,P<0.05为差异有统计学意义。
2 结果
2.1 脑卒中模型评价 TTC染色结果如图1、表1所示,正常大鼠脑组织被染成红色,梗死脑组织被染成白色,与假手术组相比,模型组丘脑VPL区可见明显白色梗死区,涉及疼痛处理的脑区在tMCAO术后3 d受到损伤,证明tMCAO模型可以损伤大鼠丘脑。造模后,CPSP组与SHAM组相比神经功能评分升高,大鼠出现神经功能损伤,脑卒中模型造模成功。
表1 脑梗死面积与神经功能评分值Tab.1 Infarction area and Neurological deficit scores ±s

表1 脑梗死面积与神经功能评分值Tab.1 Infarction area and Neurological deficit scores ±s
注:与SHAM组比较,*P<0.05
组别SHAM组CPSP组脑梗死面积(cm2)0 5.52神经功能评分值(分)0 2.14±0.69*

图1 脑卒中造模结果Fig.1 Results of stroke modeling
2.2 MCAO术后大鼠热痛阈变化 50只大鼠进行MCAO造模后,术后死亡14只,共36只存活,大鼠热痛阈值的变化如图2、表2所示,术前各组大鼠热痛阈差异均无统计学意义(P>0.05)。MCAO造模后,11只大鼠出现热痛阈下降的情况,发病率为30.55%,与临床发病率一致[15],将其纳入CPSP组,测定其术后热痛阈值,结果表明术后因MCAO导致的大鼠热痛阈下降症状持续了至少28 d。
表2 MCAO术后大鼠热痛阈变化Tab.2 Development of heat pain hypersensitivity induced by MCAO ±s

表2 MCAO术后大鼠热痛阈变化Tab.2 Development of heat pain hypersensitivity induced by MCAO ±s
注:与SHAM组比较,*P<0.05;与SHAM组比较,**P<0.01;与SHAM组比较,***P<0.001
组别SHAM组CPSP组术前1 d 19.88±3.45 18.88±2.6术后3 d 20.62±2.89 8.73±3.27***术后7 d 21.41±3.53 9.84±2.45***术后14 d 17.89±1.44 10.5±2.33***术后21 d 15.93±3.94 10.2±2.79*术后28 d 17.39±4.33 9.97±2.59**

图2 MCAO术后大鼠热痛阈变化Fig.2 Development of heat pain hypersensitivity induced by MCAO
2.3 丘脑HE染色、尼氏染色、Neun免疫组化染色 大鼠丘脑VPL区的病理损伤如图3、表3所示,尼氏染色结果显示,SHAM组大鼠丘脑VPL区神经元排列规则,胞体较大,呈椎体形或椭圆形,CPSP组丘脑VPL区正常神经元排列紊乱,尼氏体数量减少,染色变浅,尼氏体数量显著降低(P<0.05)。HE染色结果显示,SHAM组脑组织均匀,神经元排列整齐、致密,胞核无固缩、变形,CPSP组脑组织损伤明显,可见组织结构排列紊乱,细胞核形态紊乱,大量神经元细胞固缩,胞核消失。Neun免疫组化染色结果显示,与SHAM组相比,CPSP组丘脑VPL区Neun阳性表达显著减少,平均光密度值显著降低(P<0.05)。
表3 尼氏体计数和Neun免疫组化平均光密度值Tab.3 The number of Nissl bodies and average optical density value of IHC ±s

表3 尼氏体计数和Neun免疫组化平均光密度值Tab.3 The number of Nissl bodies and average optical density value of IHC ±s
注:与SHAM组比较,*P<0.05,***P<0.001
组别SHAM组CPSP组尼氏体计数/mm2 233.57±10.65 142.29±8.38***Neun免疫组化平均光密度值146.24±5.44 135.65±3.41*
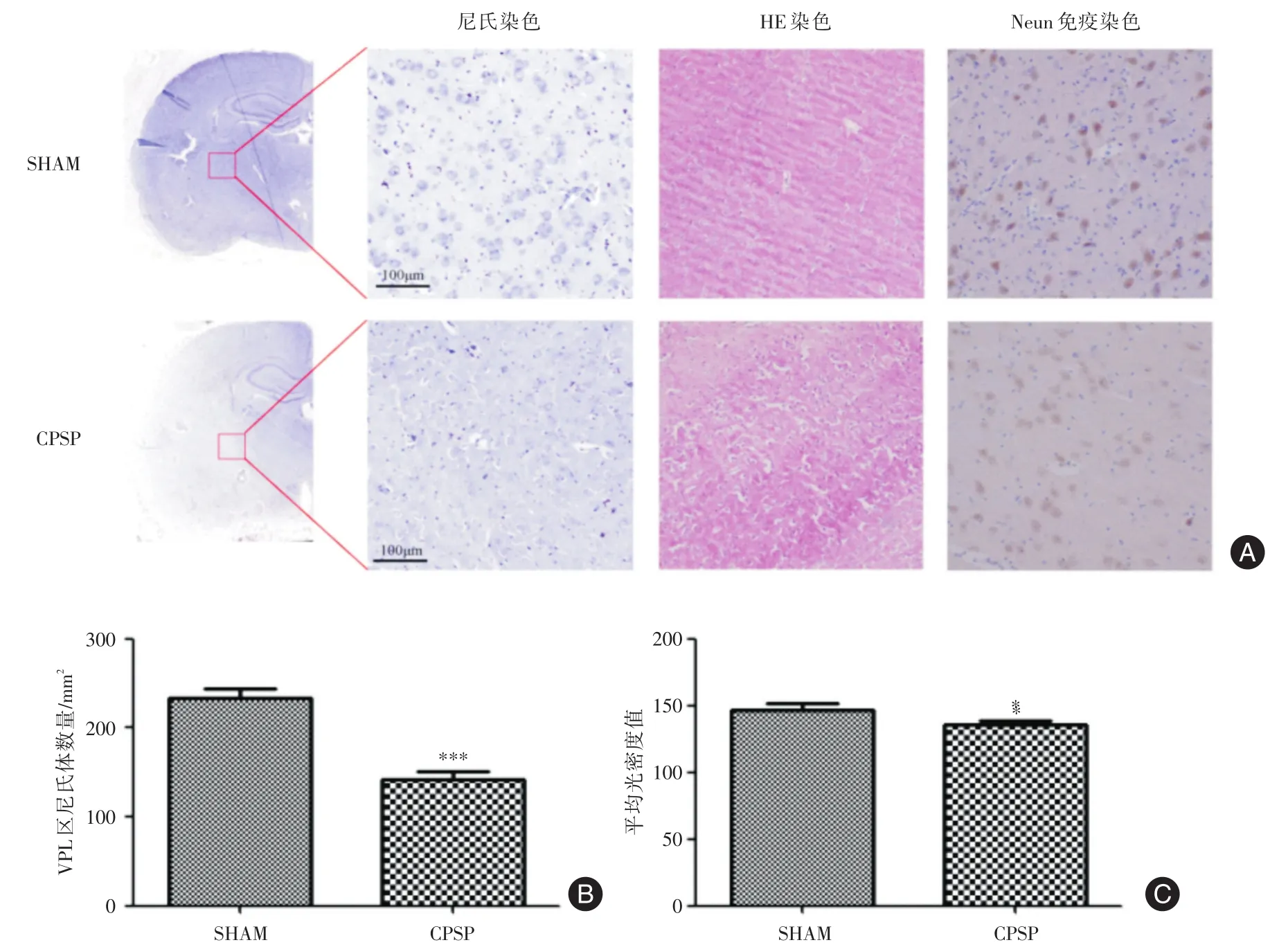
图3 丘脑VPL区尼氏染色、HE染色和Neun免疫组化染色Fig.3 The pathological changes of rat thalamus(VPL)
2.4 丘脑BDNF、iba1免疫荧光染色结果 免疫荧光结果如表4、图4所示,丘脑VPL区存在小胶质细胞与BDNF共表达,与SHAM组相比,CPSP组丘脑VPL区iba1与BDNF阳性表达增多。表明小胶质细胞激活后分泌的BDNF可能与MCAO术后的痛觉过敏有关。
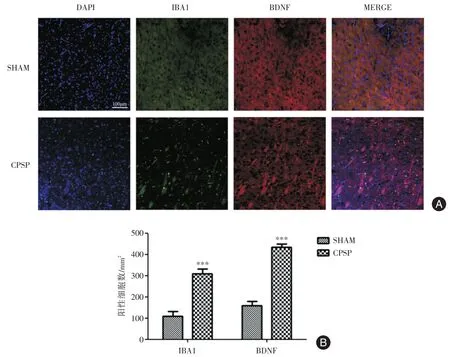
图4 丘脑BDNF、iba1免疫荧光染色结果Fig.4 Results of IBA1 and BDNF immunofluorescence measurement
表4 丘脑BDNF、iba1阳性细胞计数Tab.4 Numbers of iba1+and BDNF+cells ±s,个/mm2

表4 丘脑BDNF、iba1阳性细胞计数Tab.4 Numbers of iba1+and BDNF+cells ±s,个/mm2
注:与SHAM组比较,***P<0.001
组别SHAM组CPSP组iba1阳性细胞数109.72±21.38 158.4±20.67***BDNF阳性细胞数308.33±23.20 433.58±16.28***
2.5 丘脑BDNF、TRKB和GABAAR蛋白表达结果 大鼠丘脑BDNF、TRKB、GABAAR蛋白表达的结果如表5、图5所示,与SHAM组相比,CPSP组大鼠BDNF、TRKB蛋白含量显著升高(P<0.05),GABAAR蛋白含量显著降低(P<0.05)。
表5 丘脑BDNF、TRKB和GABAAR蛋白表达结果Tab.5 Expressions of BDNF、TrkB、GABAAR ±s

表5 丘脑BDNF、TRKB和GABAAR蛋白表达结果Tab.5 Expressions of BDNF、TrkB、GABAAR ±s
注:与SHAM组比较,**P<0.01,***P<0.001
组别SHAM组CPSP组BDNF 0.69±0.01 1.31±0.01***TrkB 0.77±0.07 1.24±0.07**GABAAR 1.13±0.09 0.71±0.07**
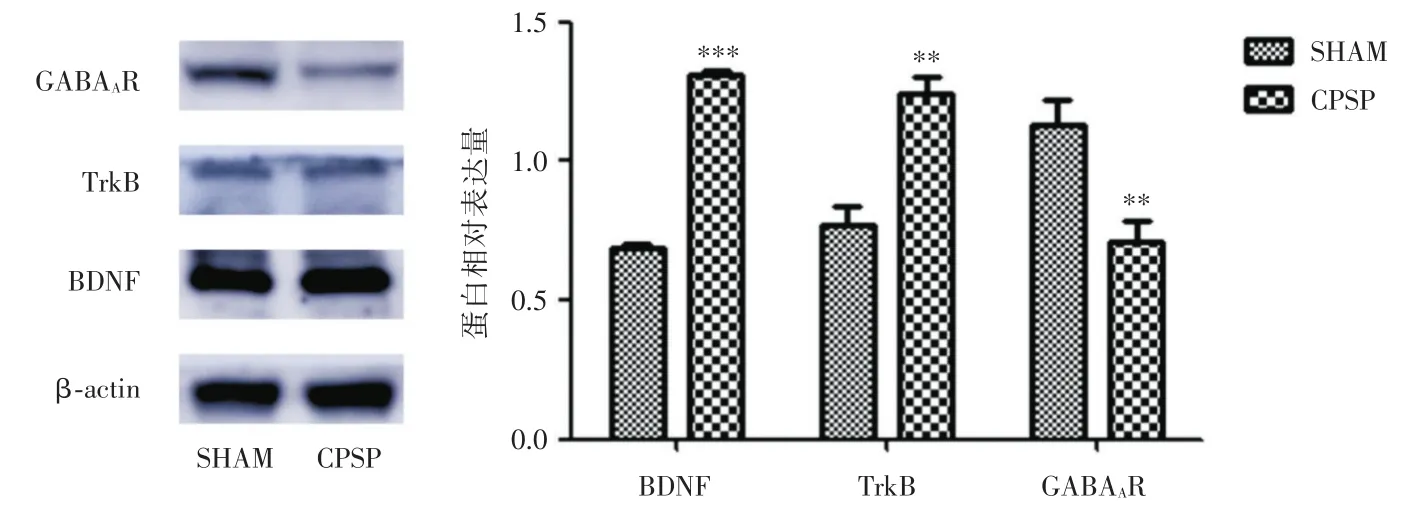
图5 丘脑BDNF、TRKB和GABAAR蛋白表达结果Fig.5 Expressions of BDNF、TrkB、GABAAR
3 讨论
脑卒中后中枢性疼痛是脑卒中后一种常见的并发症,发病机制尚不明确,是脑卒中并发症中研究较少的一种并发症,痛觉过敏是脑卒中后中枢性疼痛的主要症状之一[16]。HYAKKOKU 等[8]和TAKAMI等[17]证明tMCAO可以引起大鼠和小鼠的疼痛传导纤维Aδ和Aβ纤维发生变化,可能与CPSP的发病机制有关,但并未对其深入研究。本研究采用tMCAO复制大鼠脑卒中缺血再灌注模型,运用神经功能评分进行模型评价,同时使用热板法对脑卒中模型大鼠术前术后的热痛阈进行测定,观察大鼠术后热痛阈值的变化。结果表明,MCAO术后,大鼠神经功能评分升高,大鼠脑卒中模型复制成功;热板法结果显示,脑卒中模型大鼠术后有一部分出现了痛觉过敏的症状,且与临床脑卒中后中枢性疼痛的发病率相似[15],表明通过tMCAO可以成功建立起CPSP动物模型。
丘脑是疼痛传导通路中的重要组成部分,有研究表明约有50%左右CPSP患者存在丘脑损伤[18],尤其是丘脑腹外侧核的损伤[19],极有可能引起脑卒中后中枢性疼痛的发生。目前绝大多数关于CPSP的研究均定位于丘脑的功能障碍上,尤其是脑卒中后中枢神经系统疼痛传导通路中兴奋与抑制的失衡,具体表现为中枢敏化和去抑制[20]。本研究首先使用了TTC染色评估tMCAO造模后大鼠术后3 d的脑梗死面积,在明确丘脑腹外侧核存在损伤后,通过尼氏染色、HE染色和Neun免疫组化染色进一步考察丘脑的损伤,结果表明与SHAM组相比,CPSP组丘脑VPL区组织损伤明显,尼氏体数量减少,Neun阳性表达降低,表明脑卒中后中枢性疼痛模型大鼠丘脑VPL区出现损伤。
脑源性神经生长因子(brain-derived neurotrophic bactor,BDNF)是中枢神经系统中一种重要的神经生长因子,研究表明,BDNF的异常表达与痛觉过敏有着密切联系[21],在神经病理性疼痛中,脊髓和背根神经节中的BDNF表达升高,BDNF激活其受体TrkB,降低K+/Cl-突触后转运体(KCC2)的表达[22],导致Cl-外排减少,而 GABA 的中枢抑制性功能的发挥主要依赖于激活离子型GABAA受体引起的Cl-内流,KCC2的表达降低严重影响了GABA的中枢抑制性功能[23],最终导致细胞内氯离子含量的升高,中枢神经系统兴奋与抑制的失衡,脊髓背角神经元兴奋性升高,最终导致痛觉过敏。小胶质细胞作为中枢神经系统的固有免疫细胞,小胶质细胞的激活密切参与痛觉过敏的发展[24],神经损伤后,受损的初级传入神经释放趋化因子、信号分子和蛋白酶激活脊髓中的小胶质细胞,小胶质细胞中的BDNF表达升高,从而增强脊髓伤害感受回路的兴奋性[25]。本研究采用了免疫荧光染色检测了丘脑VPL区丘脑小胶质细胞的激活与BDNF的表达,同时运用Western blot检测了丘脑BDNF、TrkB的蛋白表达,结果表明与SHAM组相比,CPSP组丘脑VPL区小胶质细胞的数量与BDNF表达增加,且出现小胶质细胞与BDNF共表达现象,Western blot结果显示,与SHAM组相比,丘脑BDNF、TrkB表达显著增加,表明脑卒中后中枢性疼痛模型大鼠丘脑BDNF、TrkB表达增加,且增加表达的BDNF是与小胶质细胞的激活有关。此外本研究发现与SHAM组相比,CPSP组丘脑GABAAR表达显著降低,表明丘脑内除了受到BDNF/TrkB间接导致的GABA抑制功能减弱外,GABAAR的表达量降低将直接导致GABA抑制功能降低,中枢去抑制。目前尚未有文献报道此现象,GABAAR有可能是脑卒中后中枢性疼痛发病机制中的另一个关键环节。
综上所述,本研究利用免疫荧光技术和Western blot技术对脑卒后中枢性疼痛模型大鼠丘脑的小胶质细胞,BDNF,TRKB,GABAAR含量进行了研究,结果表明脑卒后中枢性疼痛模型大鼠丘脑小胶质细胞数量增加,BDNF,TRKB蛋白表达增加,GABAAR含量减少,丘脑内疼痛传导信号兴奋与抑制平衡被打破,提示丘脑内BDNF的升高可能是脑卒中后中枢性疼痛发病过程中的关键病理环节,可能为脑卒中后中枢性疼痛提供新的治疗靶点和治疗措施。

