Dhori病毒核蛋白抗原表位的筛选及鉴定
张 敏,古丽娜孜·沙都汉,刘利平,王 岚,孙素荣,张渝疆,丁军涛
蜱虫是一种可寄生于人和动物体表、以吸食其血液为生的节肢动物,是病原体(寄生虫、细菌和病毒等)最常见和最重要的载体之一[1],在传播疾病方面的危害仅次于蚊虫,严重威胁人类和牲畜的健康[2]。蜱虫可分为硬蜱科(Ixodidae)、软蜱科(Argasidae)和纳蜱科(Nuttalliellidae)3个科[3]。中国目前记录的蜱类有125种,其中硬蜱111种,软蜱14种[4]。
蜱传疾病(TBDs)是虫媒传播疾病的一个主要因素,在全球范围内,蜱媒疾病病例不断增加,其分布的地理范围逐渐扩大[5],蜱传病毒(tick-born virus,TBV)造成的危害越来越严重。人感染TBV最可能的方式是在户外活动时被感染的蜱虫叮咬[6],还有可能与食用生羊奶、酸奶、奶酪和黄油等各种奶制品有关[7]。目前全球范围内引起人类疾病的TBV,按病毒种类划分,主要有内罗病毒科(Nairoviridae)、白蛉病毒科(Phenuiviridae)、黄病毒科(Flaviviridae)、正粘病毒科(Orthomyxoviridae)和呼肠孤病毒科(Reoviridae)5科14种病毒[8]。正粘病毒科包括5个属,即流感病毒A、B、C三属、传染性鲑鱼贫血症病毒属和索戈托病毒属[9]。蜱传索戈托病毒属包括索戈托病毒(Thogoto virus,THOV)、多理病毒(Dhori virus, DHOV)和波旁病毒[10]。
2017年,我国首次从新疆古尔图地区采集的草原革蜱(Dermacctornuttalli)样本中分离并鉴定出Dhori virus的新病毒株,将其命名为Dhori virus 17-GRT169(DHOV-GRT169)[11]。该病毒不但可感染牛、羊和骆驼等大型家畜[12],也可以通过无媒介的气溶胶途径引起人类感染[13]。DHOV对小鼠是致命的,可引起与人类感染H5N1型流感病毒的报告相似的全身病理变化[14]。DHOV为负链RNA病毒,其基因组有7个RNA片段[15],其中1~6 片段的 ORFs 分别编码RNA依赖性RNA聚合酶亚基PB2、PB1、PA,以及糖蛋白(GP)、核蛋白(NP)和基质蛋白(M)[16]。有研究表明,NP蛋白氨基酸序列非常保守[17],为主要特异性抗原,NP分子至少包含3个独立的抗原位点,是淋巴细胞识别的主要抗原区域,并且可用于正粘病毒科不同属间的鉴别[18],但目前关于DHOV NP功能方面的研究未见报道[13]。
B细胞表位的准确鉴定为抗体治疗药物、多肽疫苗和免疫诊断工具的开发奠定了基础[19-20]。表位疫苗是在现代疫苗发展中出现的一种新型疫苗设计策略[21]。与聚合酶链式反应(PCR)、实时荧光定量PCR(qPCR)和原位杂交(ISH)等一些病毒性病原的检测方法相比,血清抗体检测更能快速、有效地反映感染者的感染状态。
本研究对DHOV NP蛋白抗原表位进行鉴定,为DHOV的流行病学调查和疫苗研制奠定基础。
1 材料与方法
1.1 材料 抗Dhori病毒NP兔多克隆抗体、pGEX-6P-1质粒、原核表达质粒pXXGST-3为本实验室保存;DHOV阳性羊血清由中国科学院武汉病毒研究所惠赠。限制性内切酶、DNA Marker DL5000、T4连接酶购自TaKaRa公司;E.coliBL21(DE3)、带GST标签鼠单克隆抗体、山羊抗小鼠IgG-HRP、山羊抗兔IgG-HRP购自北京索莱宝生物有限公司。
1.2 方 法
1.2.1 DHOV NP二级结构分析及分段表达策略 利用Signal 4.1和TMHHMM生物信息学分析软件对DHOV NP(GenBank登录号:MH688512.1- MH688517.1)进行了信号肽和跨膜区的预测。同时利用DNAStar-Protean软件对DHOV NP的二级结构进行分析,预测α螺旋、β转角、无规卷曲结构等二级结构及其亲水性、抗原性强的氨基酸序列;利用在线分析软件预测B细胞可能的线性表位。结合上述结果综合分析,初步确定NP的分段表达区域和潜在的抗原富集区。根据分析结果,将NP全长截短为A、B、C、D 4个片段(图1)。基因片段由上海捷瑞生物有限公司合成。

图1 DHOV NP蛋白分段表达策略Fig.1 Segmented expression strategy of DHOV NP protein
1.2.2 截短片段原核表达质粒的构建 利用EcoRⅠ、XhoⅠ限制性内切酶酶切pGEX-6P-1质粒,确认酶切成功后进行胶回收,将4个目的片段与pGEX-6P-1载体连接。分别构建pGEX-6P-1-A(1-112 aa),pGEX-6P-1-B(109-222 aa),pGEX-6P-1-C(219-336 aa)和pGEX-6P-1-D(333-460 aa)4个重组质粒。
1.2.3 截短片段的诱导表达及Western blotting抗原性分析 将重组质粒转化至E.coliBL21(DE3)中,利用IPTG 诱导表达,SDS-PAGE验证表达结果。将表达的蛋白湿转至PVDF膜后置于5 %脱脂奶粉中4 ℃过夜封闭,次日加入抗DHOV-NP的兔多克隆抗体(1∶1 000)或抗GST鼠单克隆抗体(1∶3 000)于37 ℃中孵育1 h,将PVDF膜于TBS-T中充分洗涤后,分别加入HRP标记羊抗兔(1∶3 000)或HRP标记羊抗鼠二抗(1∶3 000)于37 ℃孵育30 min,TBS-T洗涤PVDF膜,加适量ECL后于化学发光成像仪中显色。
1.2.4 截短16/8肽重组质粒的构建 采用改良生物合成肽法,将阳性的截短片段截短成相互重叠8个氨基酸的16肽,阳性的16肽继续截短为相互重叠7个氨基酸的8肽。利用BamHⅠ、SalⅠ限制性内切酶对pXXGST-3质粒进行酶切,确认酶切成功后进行胶回收,将16/8肽基因片段连接至pXXGST-3后测序验证。
1.2.5 DHOV NP截短16/8肽的诱导表达及Western blotting抗原性分析 将重组质粒转化至E.coliBL21(DE3)中,利用IPTG 诱导表达,SDS-PAGE验证表达结果。将表达的蛋白湿转至PVDF膜后置于5 %脱脂奶粉中4 ℃过夜封闭,次日加入抗DHOV-NP的兔多克隆抗体(1∶1 000)或抗GST鼠单克隆抗体(1∶3 000)于37 ℃中孵育1 h,将PVDF膜于TBS-T中充分洗涤后,分别加入HRP标记羊抗兔(1∶3 000)或HRP标记羊抗鼠二抗(1∶3 000)于37 ℃孵育30 min,TBS-T洗涤PVDF膜,加适量ECL后于化学发光成像仪中显色。
1.2.6 精细抗原表位的三维构象定位 Python 2.7软件分析BCEs在DHOV NP蛋白三级结构上的定位。
2 结 果
2.1 DHOV NP生物信息学分析 经Signal 4.1和TMHHMM等分析软件预测表明,NP氨基酸序列不含信号肽序列和跨膜区序列,蛋白位于膜外区。经DNAStar-Protean软件对DHOV NP蛋白二级结构进行了预测(图2),分析了氨基酸序列的亲水性,柔韧性,抗原性及表面可及性。

图2 DHOV NP蛋白二级结构的生物信息学分析结果Fig.2 Results of bioinformatics analysis of the secondary structure of DHOV NP
2.2 重组质粒酶切鉴定 4个重组质粒经EcoRⅠ和XhoⅠ双酶切,分别在336 bp、342 bp、354 bp、384 bp处有目的条带(图3),测序结果正确,重组质粒构建成功。
2.3 截短蛋白的诱导表达 SDS-PAGE电泳分析结果显示,DHOV NP蛋白的4个截短蛋白的条带大小与预期一致(图4),分别在38.3 kDa、38.5 kDa、38.9 kDa、40.0 kDa左右的位置有清晰的目的条带,表明融合蛋白表达成功。
2.4 截短蛋白的抗原性分析 Western blotting 结果显示,4个截短蛋白均能被兔抗DHOV NP多克隆抗体、鼠抗GST单克隆抗体识别,说明截短蛋白都具有良好的抗原性(图5)。

M:DNA Marker DL5000;1-2:pGEX-6P-1-A酶切前后;3-4:pGEX-6P-1-B酶切前后;5-6:pGEX-6P-1-C酶切前后;7-8:pGEX-6P-1-D酶切前后。图3 截短片段原核表达质粒的双酶切鉴定。Fig.3 Identification of truncated prokaryotic expression plasmids by double digestion

M:蛋白Marker;1-2:pGEX-6P-1-DHOV-A/BL21诱导前后; 3-4:pGEX-6P-1-DHOV-B/BL21诱导前后;5-6:pGEX-6P-1-DHOV-C/BL21诱导前后;7-8:pGEX-6P-1-DHOV-D/BL21诱导前后。图4 SDS-PAGE鉴定分段截短蛋白的诱导表达Fig.4 SDS-PAGE identification of induced expression of segmented truncated protein
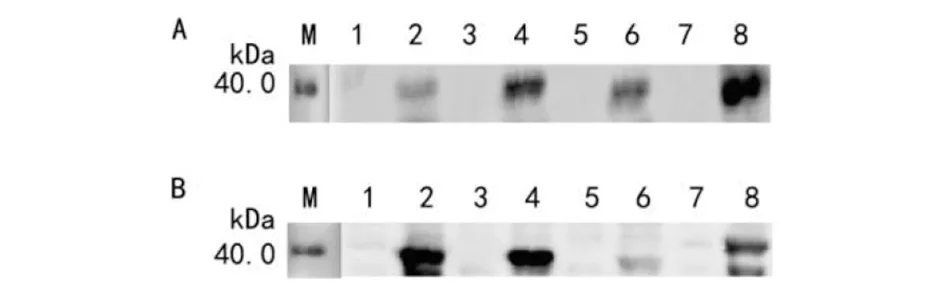
A:抗GST鼠单克隆抗体;B:兔抗DHOV NP多克隆抗血清M:蛋白蛋白Marker;1-2:pGEX-6P-1-DHOV-A/BL21诱导前后;3-4:pGEX-6P-1-DHOV-B/BL21诱导前后;5-6:pGEX-6P-1-DHOV-C/BL21诱导前后;7-8:pGEX-6P-1-DHOV-D/BL21诱导前后。图5 DHOV NP截短蛋白的Western blotting分析 Fig.5 Western blot analysis of segmented truncated DHOV NP
2.5 DHOV NP蛋白重叠16肽的诱导表达和Western blotting抗原性分析 SDS-PAGE电泳显示55个重叠16肽均正确表达(图6A和6C),Western blotting结果显示重叠16肽中的1(A1)、10(A10)、11(A11)、14(B1)、27(C1)、51(D11)、53(D13)能与兔多克隆抗体结合,具有抗原性(图6B和6D)。

M:蛋白Marker;1~13:A1~ A13;14~26:B1~B13; 27~40:C1~C14; 41~55:D1~D15;NC:阴性对照(pXXGST-3表达的GST188蛋白)。图6 NP蛋白55个重叠16肽SDS-PAGE(A、C)和Western blotting (B、D)分析Fig.6 The 55 overlapping 16mer peptides of NP protein were analyzed by SDS-PAGE (A, C) and Western blotting (B, D)
2.6 DHOV NP蛋白重叠8肽的诱导表达和Western blotting抗原性分析 SDS-PAGE电泳显示重叠8肽均正确表达(图7 A1-A7);其中8肽A1-1、A1-2、A1-3、A1-6、A1-7;A10-9;A11-1和A11-2;B1-2和B1-3;C1-6和C1-9;D11-6和D11-9;D13-4被抗DHOV NP兔多克隆抗体特异识别,具有良好的抗原性(图7 B1-B7)。通过最小表位序列作图发现共鉴定出9个最小BCEs(图7 C1-C7)。
2.7 DHOV NP蛋白抗原表位的三维构象分析 利用PymolTM软件展示9个BCEs在NP蛋白三维结构上的定位。如图8所有BCEs均位于NP蛋白三维结构表面,有利于与多克隆抗体结合。
3 讨 论
DHOV属于正粘病毒科索戈托病毒属,可引起与人类感染H5N1型流感病毒的报告相似的全身病理变化[14]。有研究发现,DHOV在哥伦比亚省的人和羊体中流行,显示DHOV已经威胁着人类和动物的健康,因此,有必要对该病毒做更深入的研究[22]。
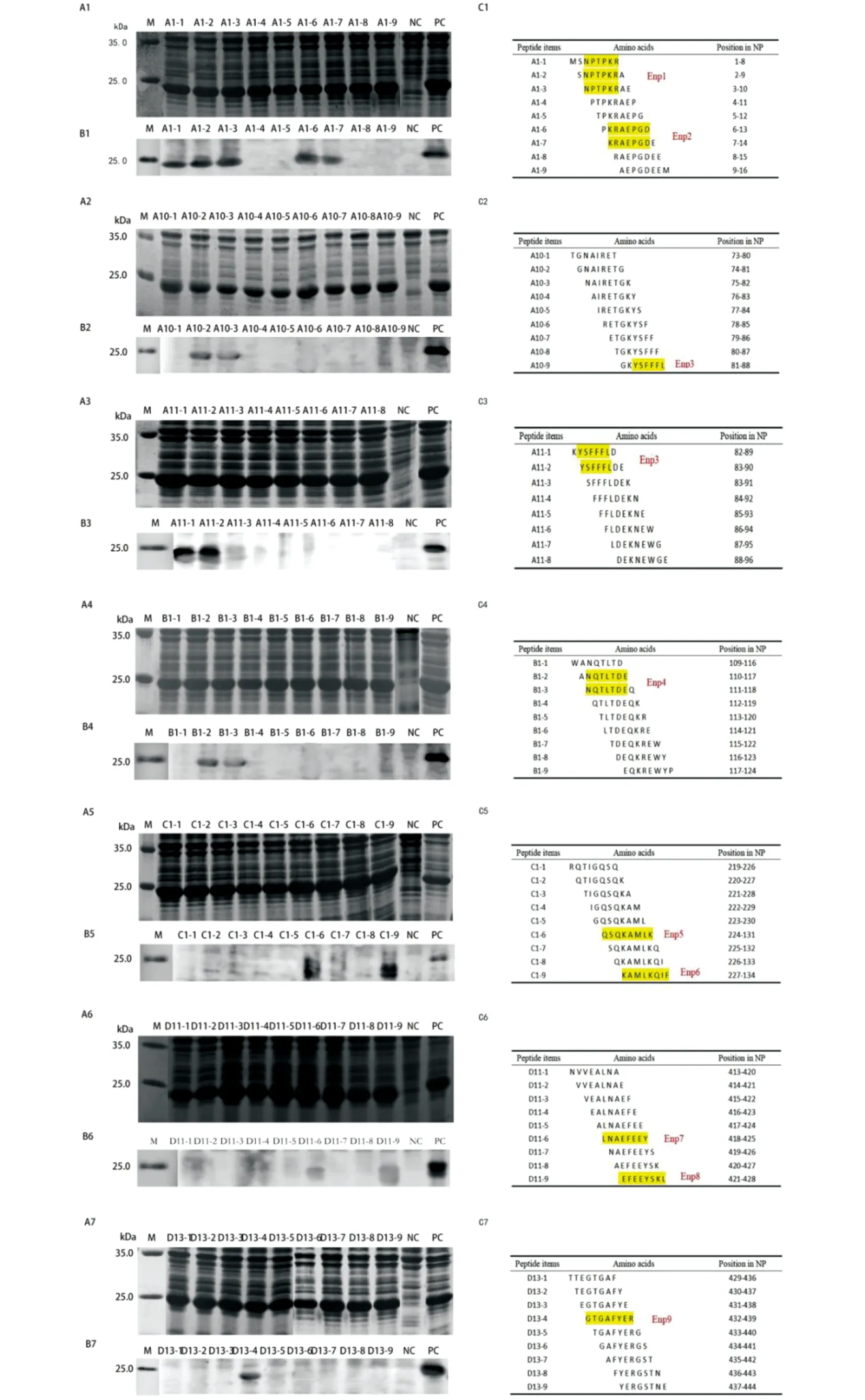
A1-A7:SDS-PAGE电泳图;B1-B7:Western blotting分析图;C1-C7:8肽最小表位序列作图M:蛋白Marker;NC:阴性对照(pXXGST-3表达的GST188蛋白);PC:对应阳性16肽。图7 NP截短8肽的表位鉴定分析Fig.7 Epitope identification and analysis of the truncated eight peptide of NP

图8 BCEs在DHOV NP蛋白三维结构上的位点示意图Fig.8 Epitope identification andanalysis of truncated 8mer peptides of NP protein
本课题组前期基于DHOV rNP为抗原的血清学检测发现,在塔城地区乌苏市古尔图牧场和阿勒泰地区布尔津县采集的羊血清中具有抗DHOV NP的抗体,说明该病毒在新疆地区有一定的流行,对该地区人兽具有潜在的风险。NP蛋白是多种病毒中含量最丰富、免疫原性最强的蛋白,是包裹病毒RNA基因组并形成螺旋状核衣壳的内部蛋白[23]。NP蛋白参与病毒生活周期的多个阶段,是一种高度保守的蛋白质,调节病毒的转录和复制,以及病毒特异性和毒性[24],当宿主感染病毒时,细胞毒性T淋巴细胞(CTLs)识别NP为病毒蛋白的主要抗原[25]。由于NP全长蛋白氨基酸序列中,包含一些没有抗原性的区域,因此去除这些可能具有干扰作用的表位区域,筛选具有较好抗原性的表位在准确诊断疾病方面有一定的重要性。目前国内外尚无有关 DHOV NP蛋白最小抗原表位鉴定或者多表位疫苗方面的研究报道。因此,深入研究 DHOV NP的免疫性质对于开发针对 DHOV 的检测试剂和新型疫苗具有重要意义。
目前抗原表位的鉴定方法有肽扫描技术、生物肽合成法、X-ray衍射或核磁共振技术、质谱技术、氨基酸定点突变技术、噬菌体展示肽技术以及多种技术结合等[26]。多种现代生物和物理技术方法也被用来精确定位抗原和抗体直接相互作用中的氨基酸残基或原子[27]。然而,这些方法也存在不足,即无法利用多克隆抗体(pAbs)来鉴定表位最小基序,因此对整个靶蛋白上的BCE进行鉴定有一定的难度[28]。本研究采用的“改良生物合成肽法”[29],用于鉴定线性B细胞最小表位基序。在本课题组先前的表位相关的研究中,使用该策略鉴定了克里米亚-刚果出血热病毒(CCHFV)NP、包膜糖蛋白Gn和Gc的线性B细胞表位,证明了改良生物合成肽法在表位鉴定相关研究中具有一定的可行性[30-31]。本实验将4个阳性截短片段分为55个相互重叠8个氨基酸的16肽,免疫印迹法筛选出了识别兔抗DHOV NP多克隆抗体的7个具有抗原性的16肽。进一步将阳性片段分成62个相互重叠7个氨基酸的8肽,构建至pXXGST-3载体上,同样利用兔多克隆抗血清鉴定了15个阳性8肽,因连续的8肽有重叠区域,最后鉴定出了9个最小抗原表位基序。已有的研究表明,最小抗原表位基序的长度通常为5至7个氨基酸或不超过20个氨基酸[32]。本研究鉴定出的9个表位的长度最短是由6个氨基酸残基组成,最长是由8个氨基酸残基组成(图7),这与已有的表位相关的研究结果一致[32],因此,可能为后期多表位肽设计,多表位疫苗研发及预后提供理论数据。由于多表位肽在病毒的检测方面受到越来越多的关注,对一些未知以及不易检测的病毒蛋白的筛选工作越来越多。
本研究实验结果有助于Dhori病毒的初期诊断、预防检测和疾病治疗,为Dhori病毒感染与免疫机制的阐明提供一定的理论基础。同时,本研究只对DHOV核蛋白的精细抗原表位进行了鉴定,后续可选择包膜糖蛋白进行抗原表位筛选,两者结合设计多表位肽,以期提高对病毒的检测率。
利益冲突:无
引用本文格式:张敏,古丽娜孜·沙都汉,刘利平,等. Dhori病毒核蛋白抗原表位的筛选及鉴定[J].中国人兽共患病学报,2022,38(11):956-962. DOI:10.3969/j.issn.1002-2694.2022.00.145
——一道江苏高考题的奥秘解读和拓展

