超电荷试剂在蛋白质紫外激光解离质谱表征中的应用研究
赵 恒,刘哲益,郭永杰,杨诗蕊,2,王方军,2
(1.中国科学院大连化学物理研究所,分离分析化学重点实验室,辽宁 大连 116023;2.中国科学院大学,北京 100049)
非变性质谱(native mass spectrometry, nMS)是一种基于非变性条件电喷雾离子化(ESI)的生物分子质谱表征方法[1]。nMS采用非变性缓冲溶液将生物分子在保持其高级结构和活性的条件下进行电喷雾离子化并引入质谱,可以获取除分子质量以外的结构和相互作用信息[2]。目前,nMS已广泛用于蛋白质动态结构变化、蛋白-蛋白相互作用、蛋白-配体相互作用等研究领域,成为蛋白质结构-功能表征的新兴质谱策略[3]。将非变性蛋白质离子在保持其高级结构的条件下进行二级质谱解离,通过检测产生的碎片离子可以获取蛋白质精细结构信息。然而,常规毫秒尺度气体碰撞诱导质谱解离(CID和HCD)通常在蛋白质解离前引发蛋白质结构解聚变性而丢失原始结构信息,且解离序列覆盖率低,只能表征部分易解离区域。
高能紫外光解离(UVPD)是近年来迅速发展的一种纳秒尺度快速解离方法,可以产生包括a、b、c、x、y、z等多种类型碎片离子,在肽段、整体蛋白质、蛋白质复合物的序列和结构表征中均表现出优异的性能[4]。193 nm紫外激光可以直接激发蛋白质骨架实现5~10 ns单脉冲激发解离,具有亮度高、稳定性好、可以在空气中传播的特点,在目前的UVPD分析中应用最广泛[5]。193 nm UVPD对29 ku Pin1蛋白的二级质谱解离序列覆盖率可达96%,且解离碎片离子仍然保留部分高级结构和相互作用信息,位点解离效率与其局部结构密切相关[6]。因此,UVPD与nMS的结合为蛋白质精细结构变化表征提供了一种全新研究范式,美国德克萨斯大学奥斯汀分校Brodbelt课题组和荷兰乌特勒支大学Heck课题组在该领域做出了开拓性工作[7-10]。在前期工作中,本课题组通过交叉学科联合攻关搭建了193 nm UVPD-MS装置,在多肽、蛋白质、金属团簇等分子组成和序列、结构表征中取得了新进展[11-15]。
在质谱气相中能保持高级结构及弱相互作用的类天然结构蛋白质离子通常电荷数较少、电荷分布较窄,具有较大的质荷比,对质谱的质量检测范围要求较高。此外,高分辨质谱(FTICR和Orbitrap)的分辨率会随着被测物m/z的提高而显著下降。因此,提高非变性蛋白质离子的电荷数目而不影响其高级结构,对质谱检测及后续二级质谱解离具有重要意义。电喷雾离子化过程中样品溶液会形成带电液滴,液滴表面的电荷密度随着溶剂的挥发而逐渐升高,当电荷密度达到Rayleigh极限后,液滴发生“库仑爆炸”产生更小尺寸的液滴,最终实现样品分子进入气相并带电荷。超电荷试剂可以在ESI电离过程中提高蛋白质离子的电荷数目,主要包括环丁砜(sulfolane)、间硝基苯甲酸(m-NBA)等[16]。它可以使蛋白质离子集中在较高电荷状态,提高质谱信号强度并降低谱图复杂度[17];提高电荷数目使检测离子转移到较低m/z区域,拓展质谱检测分析物的分子质量范围;且电荷数目增加有助于二级质谱解离,提升蛋白质序列结构表征覆盖度[18]。超电荷试剂增加蛋白质离子电荷数与其改变电喷雾液滴的表面张力、气液相酸碱度、偶极矩等因素有关;环丁砜等超电荷试剂可以在电喷雾过程中增加样品分子所带的电荷,也被称为增荷试剂[19],与超高电压增荷[20]和金属阳离子增荷[16]等提升样品分子电荷状态的方法相比,超电荷试剂具有操作简单、对质谱仪器污染小等优点。然而,目前超电荷试剂与蛋白质的相互作用、电荷增加对蛋白质构象的影响机理、增加电荷过程中蛋白质构象变化的详细信息仍然不清楚[21]。
碳酸酐酶(carbonic anhydrase Ⅱ, CA)在控制细胞pH值和CO2运输方面起着重要作用,其表达紊乱或位点突变会导致青光眼、骨硬化、脑钙化等疾病[22-24]。在天然状态下,CA与锌离子(Zn2+)非共价结合。本研究以CA为模型蛋白,利用193 nm UVPD-MS分析非变性电喷雾条件下不同电荷状态CA的UVPD解离规律,对比分析在加入超电荷试剂环丁砜前后CA的UVPD解离情况,包括解离位点序列覆盖区域和位点解离效率。
1 实验部分
1.1 主要仪器与装置
本工作所有nMS实验均在Orbitrap Fusion Lumos Tribrid质谱仪(美国Thermo Fisher公司产品)上完成。仪器配备了实验室自主搭建的ArF 193 nm EX50准分子激光(Gam Laser, Orlando, FL, USA) UVPD解离模块,在HCD解离阱中进行193 nm紫外激光单脉冲解离(5 ns),解离碎片离子转移进入Orbitrap高分辨检测器进行检测,具体仪器信息可参照本课题组前期工作[11-15]。
1.2 主要材料与试剂
牛碳酸酐酶:美国Sigma-Aldrich公司产品;环丁砜、醋酸铵:上海Aladdin公司产品;去离子水:美国Milli-Q公司产品;BF100-58-10硼硅酸毛细管:美国Phoenix公司产品;250 mL注射器:美国Thermo公司产品。
1.3 实验条件
1.3.1样品制备 在非变性样品制备中,以10 mmol/L醋酸铵为缓冲溶液(pH 7.4)配制10 μmol/L CA样品溶液,以14 725 r/min离心后进行质谱分析;取10 μmol/L CA溶液,加入0.25%环丁砜[25],振荡,以14 725 r/min离心10 min后进行质谱分析。在变性条件下,采用50%甲醇、0.1%甲酸水缓冲溶液进行配制,CA浓度同样为10 μmol/L。
1.3.2质谱条件 采用正离子模式采集质谱数据,毛细管喷针电喷雾直接进样,喷雾电压1.2~1.7 kV,样品流速0.3 μL/min,质谱加热毛细管温度275 ℃。一级质谱扫描范围m/z400~3 500。二级质谱HCD模式:碰撞气体为氮气,归一化碰撞能量20%,激发时间10 ms;UVPD模式:193 nm 激光单脉冲激发(脉宽5 ns),脉冲能量1.0~1.5 mJ。二级质谱扫描范围m/z400~4 000,自动增益控制(AGC)5×104;离子最大注入时间100 ms。所有二级质谱图均为500次扫描平均值。
1.4 数据处理
采用TopPIC软件对质谱数据进行去卷积处理[26],得到每个质谱峰的单同位素质量以及绝对强度;去卷积数据采用Rstudio软件进行处理,首先对碎片离子进行质量校正,随后以5×10-6的质量偏差进行匹配,并计算每个氨基酸位点的碎片产率。采用data.table和ggplot对数据进行可视化处理,pymol 2.5.0软件绘制蛋白质晶体结构(PDB:1v9i)。
2 结果与讨论
2.1 不同质谱解离模式表征蛋白质序列
在非变性电喷雾条件下,CA离子在质谱中的价态(Z)集中分布于Z9~Z11,其中以Z10为主,显著区别于变性条件电喷雾中的价态分布(Z15~Z39),示于图1a。这一结果表明,nMS分析中蛋白质仍然能保持较紧凑的高级结构及非共价相互作用,而在变性条件下结构去折叠展开,带电荷数目显著增加。本实验首先对比了HCD和UVPD对非变性CA强度最高的Z10离子的解离情况。从母离子解离效率上看,HCD可以实现对大部分母离子的解离,而UVPD仅对部分吸收紫外光子的母离子发生激发解离。虽然UVPD产生的碎片离子信号强度较低,但碎片离子类型和数量显著多于HCD,示于图1b。碎片离子匹配结果显示,HCD仅产生b、y类型碎片离子,且解离位点主要分布于CA的C端,中间区域解离较少,仅能在天冬氨酸(D)残基C端发生解离,示于图1c,这表明非变性蛋白质离子的内部缺乏可移动的质子,HCD只能依赖于Charge-remote途径进行位点特异性解离[27]。而UVPD产生a、b、c、x、y、z等不同类型碎片离子,离子总数是HCD的2.4倍,示于图1d。在解离位点分布上,UVPD可对大部分CA骨架区域进行高效解离,在CA的N端同样表现出高解离效率。CA的C端主要由结构较松散的Loop组成,而N端存在Helix和Sheet紧凑结构。HCD可以解离较松散的C端,但对于结构紧凑的N端解离较困难,总体解离序列覆盖率仅为36.8%。UVPD是对蛋白质骨架直接产生激发,5 ns内高能光子的快速激发可避免蛋白结构去折叠而导致能量耗散,直接引发骨架肽键解离而产生丰富的碎片离子,解离位点序列覆盖率达到77.9%,是HCD的2.1倍。以上结果表明,193 nm UVPD在表征保持高级结构特征的蛋白质方面相比于常规HCD具有明显优势。
2.2 UVPD-MS表征蛋白质结构
采用193 nm UVPD-MS分析非变性电喷雾中产生的带有不同电荷的CA离子,Z9、Z10、Z11价态CA离子的UVPD解离序列覆盖率分别为49.2%、77.9%、79.8%,示于图2a。通过对不同电荷CA的位点光解离效率进行归一化对比分析发现,3个价态下高效解离位点分布区域类似,表明非变性条件下不同电荷CA离子的高级结构和UVPD解离总体上具有相似性,示于图2b。解离效率发生显著变化的位点主要位于CA序列中间区域(Phe65-Leu155),随着电荷数目增加,中间区域位点逐渐发生解离。
193 nm UVPD对蛋白质不同二级结构区域具有较高的解离选择性,解离位点更偏向于结构相对松散的柔性区域,而局部吸光截面积较小、受更多氢键和盐桥束缚的刚性紧凑区域较难解离[4]。从晶体结构上看,CA分子中包含大量的Loop、部分Helix及Sheet区域,活性结构中还结合1个Zn2+。通过分析CA Z11离子解离位点分布,可以看出UVPD能够高效解离CA大部分序列结构中的氨基酸位点,覆盖包括Turn、Loop以及Helix区域的几乎所有位点;但在绿圈标注的结构区域解离较困难,特别是Ile116-Asn125,该区域位于CA结构中心,靠近Zn2+结合口袋,示于图2c。虽然193 nm UVPD比常规HCD具有更高的解离位点覆盖率,但对结构中心具有较多非共价相互作用的刚性紧凑区域的解离效率较低。相对而言,位于蛋白质外周的Loop等区域的氢键和盐桥等非共价相互作用束缚较少,更容易激发解离并释放碎片离子。从以上结果可以看出,电荷数目的增加有利于提高蛋白质解离位点覆盖率,但是存在电荷引起局部结构变化的风险。在保持蛋白质主要高级结构特征的前提下,增加蛋白质的电荷数目可能是提高UVPD解离覆盖率的有效策略。

图1 非变性和变性电喷雾条件下CA 一级质谱图(a),CA Z10 离子的HCD、UVPD二级质谱图(b),解离序列匹配结果(c)及碎片离子种类分布(d)Fig.1 MS spectra of CA under native and denatured electrospray conditions (a), MS2 spectra by using HCD and UVPD (b), sequence matching results (c), and distribution of fragments in different ion types (d) of CA Z10

图2 CA Z9-Z11价态UVPD解离序列匹配结果(a),CA位点UVPD归一化解离效率(b), 以及CA Z11离子UVPD覆盖结构区域(晶体结构:PDB 1v9i)(c)Fig.2 Sequence matching results of CA Z9-Z11 (a), the normalized UVPD fragmentation yields (FYs) of different residues of CA (b), and the UVPD characterized CA Z11 sequence in crystal structure (PDB 1v9i) (c)
2.3 超电荷试剂对CA价态和UVPD的影响
向CA样品中加入0.25%环丁砜后,在相同非变性电喷雾条件下,CA离子电荷数目显著增加,但仍相对集中分布于Z9~Z15范围,其中以Z11和Z12为主;去卷积所得平均电荷数目由10.1增加至11.6。从去卷积分子质量可以看出,加入环丁砜后,Zn2+非共价结合仍稳定存在,显著区别于变性电喷雾条件下CA的质谱结果,示于图3。表明环丁砜的加入并没有导致CA结合Zn2+离子的丢失,推测Zn2+离子结合区域高级结构及非共价相互作用未受明显影响。本实验对加入环丁砜后CA Z10-Z15价态离子进行UVPD和碎片序列匹配,发现CA Z11和Z12价态解离位点覆盖率可分别提升至87.2%和83.3%,其余价态CA覆盖率均大于70%,示于图4a。与未添加环丁砜前的CA Z11离子解离相比,解离位点覆盖率提升了7.4%。增加的位点主要在绿色圈中的2个Helix及靠近Zn2+结合口袋的Sheet区域,示于图4c。随着CA离子价态持续上升至Z13~Z15,解离位点覆盖率保持在约78%,并未随电荷数增加而继续上升,这可能是由于在较高价态时产生的碎片离子在谱图中较集中,数据去卷积存在偏差[28]。
进一步对Z10~Z15价态CA位点的UVPD效率进行归一化和对比分析,与未添加环丁砜时所得结果类似(图2b),不同价态CA的UVPD解离具有较高的序列和结构选择性,示于图4b。随着环丁砜的加入引起CA价态的上升,蛋白N端的UVPD解离效率逐渐提高,而C端解离效率逐渐降低,难以解离区域也有向C端偏移的趋势。这可能是由于价态升高后,质子数量、位置以及局部结构发生一定程度的变化,从而导致解离位点效率的改变。CA Z11价态UVPD解离位点在晶体结构上的分布情况示于图4c,发现加入环丁砜后,CA中有更多结构区域可以发生UVPD解离。与未加入环丁砜时相比,图4c中绿圈内的难解离Sheet区域的多个位点(包括Lys170、Ser166、Leu121)均可发生解离,其中Leu121靠近Zn2+

图3 不同电喷雾条件和添加环丁砜后,CA质谱图及去卷积后分子质量Fig.3 MS spectra and deconvolution results of CA under different electrospray conditions with the addition of sulfolane

图4 加入环丁砜后CA Z10~Z15价态的UVPD序列匹配结果(a), 位点归一化解离效率(b), CA Z11的UVPD解离位点覆盖结构区域(晶体结构:PDB 1v9i)(c)Fig.4 UVPD sequence matching results of CA Z10-Z15 charge states after the addition of sulfolane (a), normalized UVPD FYs of different residues of CA Z10~Z15 (b), UVPD characterized CA Z11 sequences in crystal structure (PDB 1v9i) (c)
结合口袋刚性区域。以上结果表明,超电荷试剂的加入可以提高蛋白质UVPD解离位点覆盖率,增加对难解离紧凑区域的解离效率,但是电荷的持续增加会对解离的序列和结构选择性产生一定的影响。
2.4 超电荷试剂对CA结构的影响
超电荷试剂的加入可以提高非变性质谱分析中蛋白质的电荷数,提高UVPD解离位点覆盖率,特别是对相对紧凑区域的解离效率,同时,更多的电荷有利于检测更大分子质量的蛋白质和蛋白质复合物。但是,超电荷试剂对蛋白质结构的影响风险还需深入分析与评估。
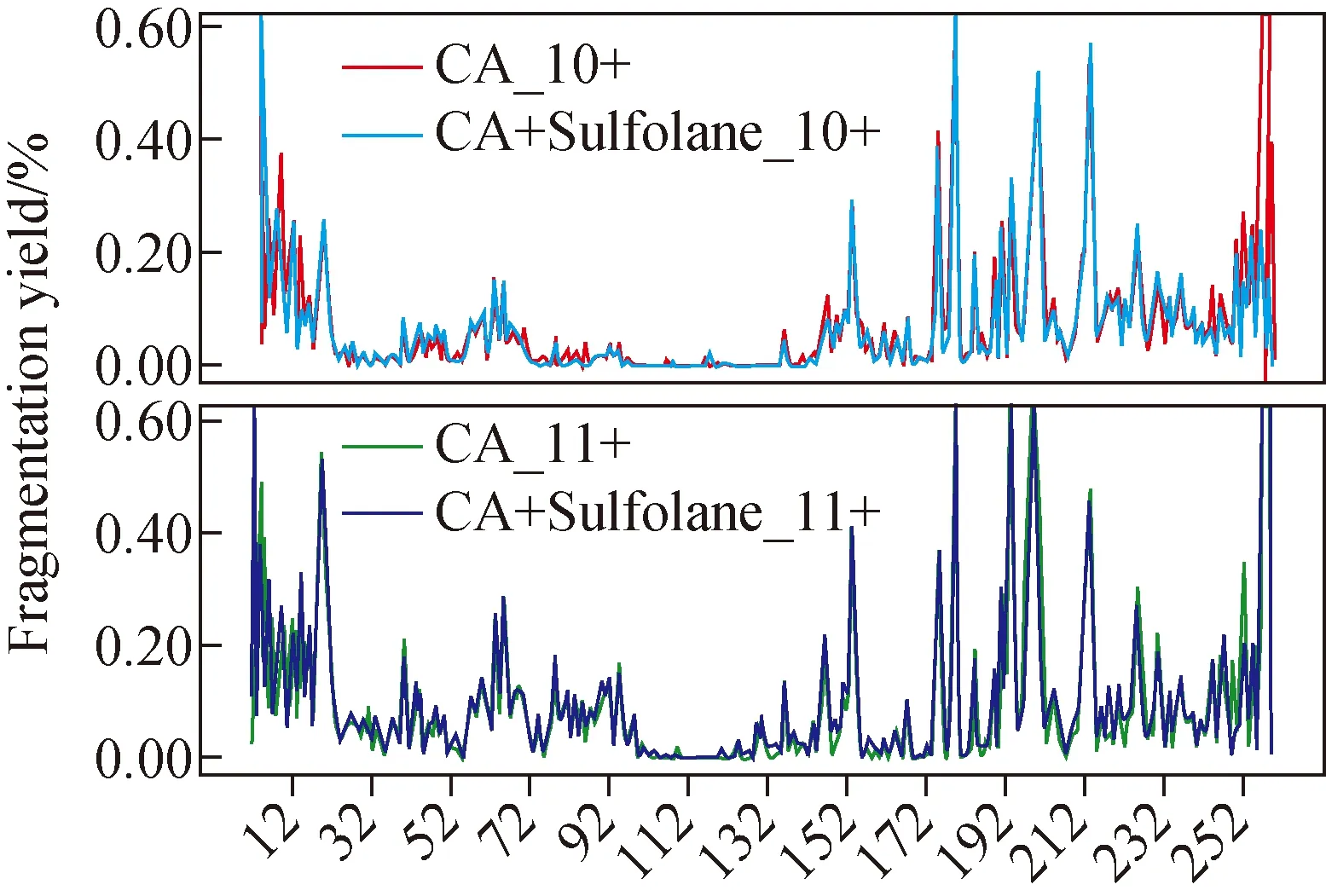
图5 加入环丁砜前后Z10和Z11价态CA位点的归一化UVPD解离效率Fig.5 Normalized UVPD dissociation efficiency of Z10 and Z11 charge states of CA site before and after sulfolane addition
加入环丁砜后,CA的nMS谱图与完全变性状态的CA谱图显著不同,示于图3。CA仍表现出Z9~Z15相对集中的价态分布,电荷数目也显著区别于变性状态,且非共价结合的Zn2+仍稳定存在,表明CA仍具有有序的高级结构。为进一步探究超电荷试剂对蛋白质结构的影响,对比分析环丁砜加入前后Z10和Z11价态CA的位点UVPD解离效率,结果示于图5。在相同电荷下,环丁砜的加入对绝大多数分布位点的解离效率影响不大,表明0.25%的超电荷试剂并不会对大部分位点的局部结构产生明显影响。虽然加入环丁砜后Z11 CA的UVPD解离位点覆盖率提升了7.4%,但并未干扰其他位点局部结构。对于Z12~Z15等更高价态的CA离子,存在电荷增加引起蛋白质结构局部变动的风险。
3 结论
本文采用UVPD-MS系统研究了0.25%的超电荷试剂对蛋白质序列和结构表征的影响。结果表明,超电荷试剂环丁砜的加入可以有效提升非变性电喷雾条件下产生的蛋白质离子价态,拓展了质谱检测的质量范围,有利于分析大分子质量蛋白质及其复合物。加入环丁砜后,蛋白质仍然保持有序的高级结构,在nMS分析中仍保持相对集中的电荷分布,金属离子等非共价结合也能稳定存在。进一步的UVPD位点解离分析表明,超电荷试剂有助于对难解离结构紧凑区域的解离和表征,但是引入的更高价态存在蛋白质局部结构变化的风险,在nMS分析中应谨慎使用。综上所述,本研究认为超电荷试剂是一种在nMS结构分析中调控蛋白质价态和进行序列结构表征的有效策略,具有广泛的应用前景。
致谢:感谢大连相干光源技术团队在仪器搭建和运行中的技术支持。