基于纳米毛细管的非变性质谱分析
胡 军,陈 芸,陈洪渊,徐静娟
(1.南京大学化学化工学院,生命分析化学国家重点实验室,江苏 南京 210023;2.南京医科大学药学院,江苏 南京 211166)
以蛋白质为代表的生物大分子是生命体内各种生理功能的主要执行者,其功能的实现和动态调控通常取决于其三维结构及与多种分子间的弱相互作用过程[1]。因此,对蛋白质及其复合物结构的精准解析和复杂作用网络的揭示,既是理解构效关系的基础,也是认知各种生命活动过程,乃至是攻克一系列重大疾病的关键。传统的结构生物学研究通常利用X射线晶体学(X-raycrystallography)、核磁共振(NMR)和冷冻电镜(cryo-EM)技术实现蛋白质等生物大分子的三维结构测定[2]。与之相比,质谱(MS)虽不能提供原子级分辨的精细三维结构,但能方便、快捷地解析复杂基质条件下蛋白质与其他分子(如代谢物、脂质、辅因子、药物分子等)间的弱相互作用,是上述几种表征方法的极佳互补,已成为当前结构生物学研究不可或缺的重要技术手段[3]。近年来,该领域的迅速发展也催生出一门新兴学科—气相结构生物学(gas-phase structural biology)[4]。
电喷雾电离质谱(ESI-MS)是气相结构生物学的技术基础,其应用于蛋白复合物的研究始于20世纪90年代。作为一种软电离方式,电喷雾电离(ESI)能将蛋白质等生物大分子从溶液中完整地转移至气相环境,但经由非共价弱相互作用结合在一起的蛋白复合物在离子化过程中能否维持结构不变在当时仍颇有争议[5]。Chait等[6]最早展示了完整血红蛋白(hemoglobin)的ESI-MS分析结果,表明血红素(heme)和珠蛋白(globin)之间的非共价弱相互作用确实能在ESI过程中得以保持。之后,研究人员对ESI技术和质谱仪硬件进行了持续的优化和改进,研发出多种既能与质谱兼容,又能在离子化过程中较好地维持蛋白质及其复合物的立体结构和相互作用信息的溶液体系,并逐渐形成了非变性质谱(native MS)的概念[7]。Native MS一词最早于2004年见诸文献[8]报道,其中native的内涵可以从与非变性凝胶电泳(native PAGE)的类比中得到部分阐释。简而言之,native MS致力于使用ESI-MS技术解析非变性缓冲溶液中非共价复合物(如大型蛋白质组装体、蛋白质-药物复合物、核酸-配体复合物等)的组成、结构、结合计量比、结合常数及动力学等信息[7-9]。经过20余年的发展,基于native MS的结构生物学已被学界广为接受,并成为2015年美国质谱年会的主题[10]。之后,国内逐渐开始将native MS正式译为“非变性质谱”。
长期以来,基于微米毛细管的纳喷雾电离(nano-ESI)一直是native MS的核心。2013年,Baker等[11]首次将开口直径<100 nm的纳米毛细管引入ESI-MS。虽然在ESI-MS中的应用不足10年,但得益于纳米毛细管极高的离子化效率、抗基质干扰能力以及对非特异性加合物形成的抑制等诸多特性,使其在native MS领域获得了广泛关注。本文重点介绍纳米毛细管的制备与表征技术、电离行为特性及其机理,并回顾近10年来纳米毛细管电喷雾电离在蛋白质、核酸及其非共价复合物的非变性质谱分析中的应用。
1 纳米毛细管的制备与表征
1.1 纳米毛细管制备
通常使用微电极拉制仪对纳米毛细管进行次序加热和拉制,基本原理示于图1。以Sutter Instrument公司的Model P-2000激光拉制仪为例,其包含HEAT、FILAMENT、VELOCITY、DELAY和PULL等5项参数,分别对CO2激光加热功率、加热宽度、预拉制速度、硬拉延迟时间以及拉力大小进行程序控制,且可使用多项参数实现对毛细管锥度、孔径的精细调控。各项拉制参数对毛细管最终的锥度、孔径等具体影响可参阅该公司的用户手册[12]。通常,在仪器状态良好,且保持环境温度、湿度恒定以及毛细管洁净的情况下,毛细管孔径的平均标准偏差(SD)可控制在5%以内。常见的玻璃毛坯管材质有硼硅酸盐玻璃和石英玻璃2种,前者易于熔化加工、价格低廉,使用广泛;后者质地坚硬、性质稳定,更易于制备尺寸极小的针尖,如孔径小于20 nm的毛细管。

图1 锥形纳米毛细管的拉制示意图[13]Fig.1 Fabrication of nanopipettes[13]
典型的纳米毛细管结构示于图2,包含源自玻璃毛坯管的主干(stem)和逐渐缩小的肩部(shoulder)和胫部(shank),以及微纳尺度的针尖(tip)部分[14]。其中,主干部分的长度通常在数厘米范围,使这类微纳毛细管的操纵和使用十分便捷;而锥形部分的尺寸则涵盖了从毫米到微米、纳米尺度的演变;除了改变拉制参数[12],毛细管针尖的孔径还可利用后期修饰或刻蚀进行精细调控[15-16]。如Jin等[15]利用硅酸钠水解法在针尖内壁生长SiO2(与石英玻璃同质)以进一步减小其内直径,得到了开口直径仅为6.4 nm的纳米毛细管。
1.2 纳米毛细管表征
纳米毛细管尖端的尺寸极小,已超出光学显微表征的分辨极限,目前常用的表征方法主要包括扫描电子显微镜(SEM)、透射电子显微镜(TEM)和电化学。其中,SEM表征最常用,能直接获得针尖的锥度、孔径等形貌信息,但对样品导电性有一定要求。常见的做法是在针尖溅射一层仅数纳米厚度的金属层(常用铂、金等)以增强导电性。而TEM的空间分辨率更高,透射式的观测模式甚至能获得针尖内壁镀层的组成与形貌信息[17-19]。虽然TEM不严格要求导电性,但在高能电子束的轰击下,玻璃针尖会迅速解构变形,示于图3,从而无法准确获得其几何形貌信息。Watanabe等[20]发现使用导电碳膜包覆的铜网进行制样,同时使用TEM的低电子剂量(minimum dose)模式,可以有效避免针尖解构畸变,实现超小针尖(<10 nm)的形貌表征,示于图3。

注:a.锥形尖端的微观结构示意图;b.锥形尖端的光学显微照片;c.SEM显微照片图2 纳米毛细管的形貌示意图及其表征[14]Fig.2 Micrographs of nanopipettes[14]

图3 纳米毛细管针尖的TEM表征[20]Fig.3 Characterization of a nanopipettes via transmission electron microscope (TEM)[20]
基于电化学的电阻或电导测量也常用于毛细管孔径的间接测算,且通常与电镜表征结果有较好的一致性。纳米毛细管内的溶液电阻(R)与溶液电阻率(ρ)、针尖孔径(rt)等关系示于式(1)[21-22]:
(1)
其中,rs、rt、θ等定义示于图2a,通过简单的溶液电阻测量即可推算出针尖孔径(rt)的大小。Moss等[23-24]的公式则更简洁,电阻(R)与溶液导电率(κ)、针尖孔径(rt)及半锥角(θ)等的关系示于式(2):
(2)
Unwin等[25]后续研究表明,基于该方程的有限元模拟结果与实验结果吻合度较好。因此,通过测量纳米毛细管的电阻和锥角信息即可利用该方程推算出纳米毛细管的孔径。需要指出的是,上述2个方程在原理上无本质区别,只是所选取的参数略有差异。
此外,针尖孔径也可以根据液/液界面上的极限扩散电流(id)进行间接测算[26-27],示于式(3):
id=4f(θ)zFDCrt
(3)
其中,F、z、D、C分别是法拉第常数、发生界面转移的离子电荷数、扩散系数、浓度,f(θ)是半锥角θ的列表函数,具体可参考文献[26-27]。与电镜(SEM或TEM)表征相比,电化学表征无需复杂且耗时的制样过程,且理论上对针尖孔径大小没有限制。例如,孔径仅约1 nm的毛细管已远超电镜方法的极限,只能通过电化学方法进行间接测算[28],但电化学方法使用的高浓度电解质溶液难以完全清洗去除,通常表征后不再适合用于质谱实验。所幸的是,经1次拉制即可得到2根几何尺寸几乎完全相同的毛细管,因此可将其中的1根用于表征,另1根用于具体实验。
2 纳米毛细管电喷雾电离的基本特性
与传统的微米毛细管相比,亚微米或者纳米尺度的毛细管用作ESI喷针时,其电离行为表现出独特的尺寸效应,体现在喷雾起始电压、喷雾流量、初始液滴尺寸、离子电荷分布、基质耐受性、分子构象、电迁移等方面,对这些尺寸效应的认知及其机理阐释有助于评估纳米毛细管电喷雾对特定研究体系的适用性。
2.1 起始电压
纳米毛细管的电喷雾起始电压通常显著低于开口尺寸更大的微米毛细管,这可以从Smith等[29]推导的公式得到解释,其指出了电喷雾起始电压(Von)和喷针半径(rt)、溶液表面张力(γ)、喷针尖端与质谱入口距离(d)之间的关系,示于式(4):
(4)
其中,ε0为真空介电常数,β为泰勒锥(Taylor cone)的半锥角(通常为49.3°)[30]。非变性质谱分析中的溶剂通常为水,其在负离子模式下容易发生电晕放电(corona discharge),进而降低目标分子的离子化效率;此外,电晕放电产生的活性氧还会造成生物分子的氧化损伤[31]。喷雾电压的降低可有效避免电晕放电对离子化过程的不利影响,这也是纳米毛细管喷雾的优点之一。玻璃毛细管的结构脆弱性要求不宜使用过高的电压进行喷雾,特别是纳米毛细管尖端的玻璃壁仅几十甚至几纳米厚,喷雾电压的大小对其结构的维持至关重要[32]。如,Baker等[11]发现使用相对较低的电压(0.9 kV)时,喷雾前后的石英纳米毛细管孔径无明显变化;而当电压提高至1.8 kV时,仅2 min后,孔径即可从37 nm扩大至65 nm。
2.2 喷雾流量
纳米毛细管的喷雾流量通常显著低于微米毛细管的喷雾流量。直径1~2 μm毛细管的喷雾流量通常小于100 nL/min,即纳喷雾(nanospray)[33];而直径 <100 nm毛细管的喷雾流量可低至皮升流量(< 1 nL/min),即皮喷雾(picospray)[34]。Williams等[33]使用称重法测量了喷雾一定时间后毛细管内溶液的质量变化,测得直径约1 465 nm毛细管的喷雾流量约为54.78 nL/min,而直径约244 nm毛细管的喷雾流量则仅约2.88 nL/min。然而,利用称重法实现皮升级流量的准确测定十分困难,这是因为在皮喷雾中,1 μL样品的质量仅1 mg,但其喷雾时间却长达数十小时。因此,常用体积法测定皮喷雾流量,即通过显微镜拍摄、测算喷雾前后毛细管内溶液的体积变化。如,Li等[34]利用该方法实现了纳米毛细管中超低喷雾流量(< 10 pL/min)的测定。对于极微量样品而言,纳米毛细管的超低流量是有益的,其延长的喷雾时间有利于串联质谱数据的采集,以实现复合物组成的解析。
2.3 离子电荷分布
利用纳米毛细管分析蛋白质、核酸等生物大分子时,其产生的离子平均电荷数通常显著高于尺寸更大的微米毛细管[11,35]。事实上,这种伴随喷针直径减小而离子平均电荷数增加的现象在微米尺度亦同样适用。如Cole等[36]研究发现,当使用直径5 μm喷针时,血管紧张素Ⅰ的离子以1+和2+的低电荷分布为主;当喷针直径减小至1 μm时,则以3+的高电荷分布为主。而尺寸更小的纳米毛细管用于蛋白质ESI-MS分析时,其产生的蛋白离子电荷态更高,甚至可与以对硝基苯甲醇(m-NBA)为代表的超级充电试剂(supercharging reagent)的效果相媲美[37-38]。离子电荷态越高,通常其碎裂所需的能量越低,且更易于产生丰富的碎片离子,因此有利于蛋白质结构解析。
一般认为,电喷雾产生的初始液滴尺寸与喷针开口直径相关,当使用微米毛细管时,前者通常不到后者的1/10[39-42]。虽然目前尚无精准测定的报道,但纳米毛细管电喷雾产生的初始喷雾液滴尺寸通常被认为应远小于传统微米毛细管产生的初始喷雾液滴尺寸[34-35,40]。初始带电液滴的尺寸越小,其荷电量与体积的比值越大,这也是纳米毛细管电喷雾中离子具有较高电荷态的原因之一。
2.4 非特异性加合
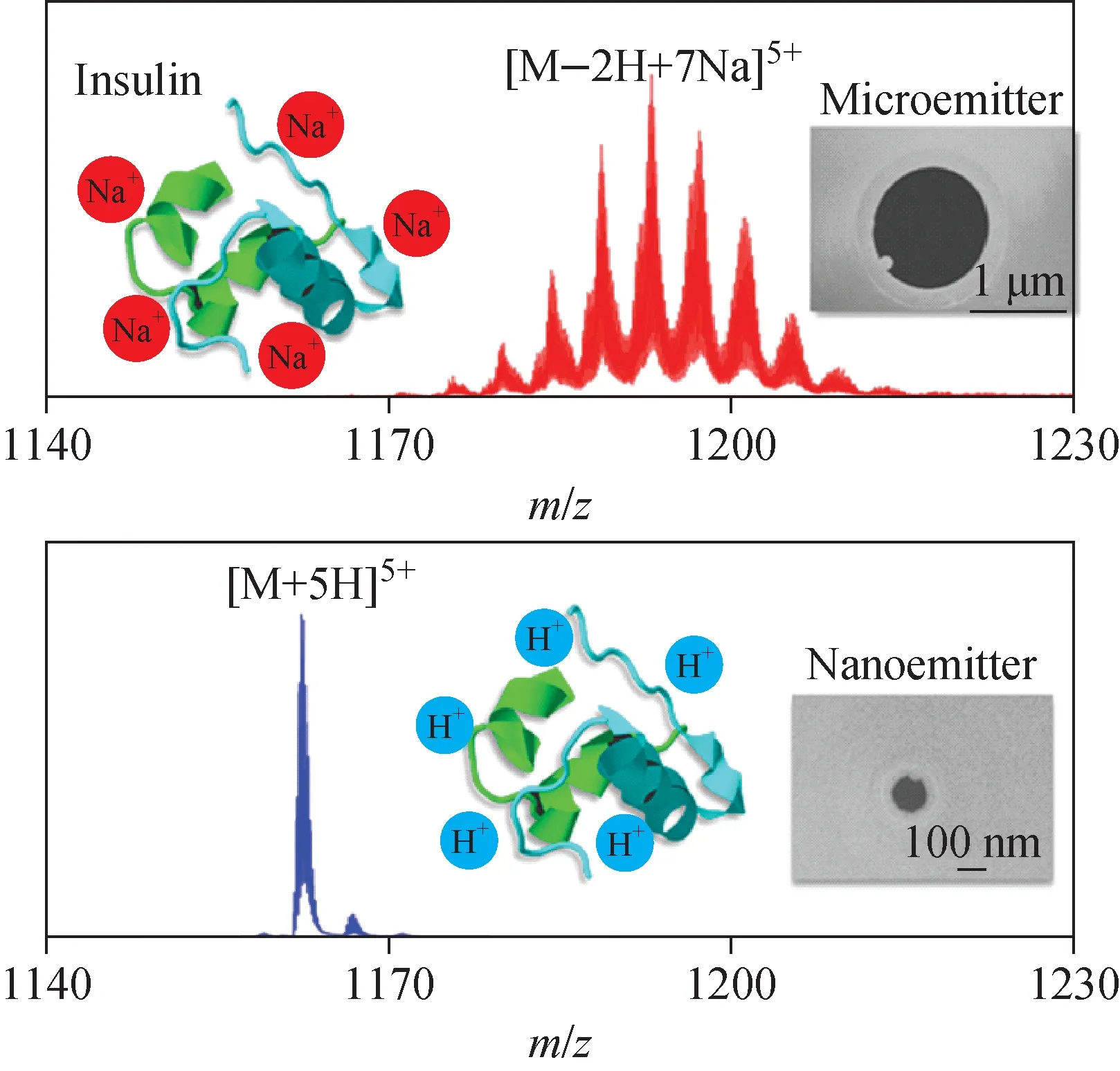
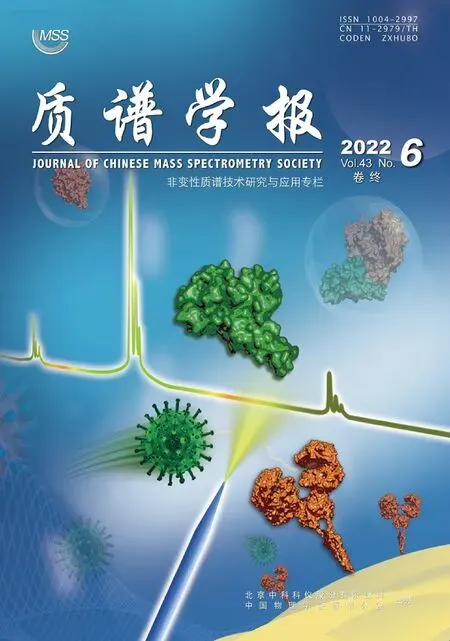
图4 纳米毛细管对蛋白质和钠离子非特异性加合物形成的抑制效应[35]Fig.4 Effect of nanoemitters on suppressing the non-specific metal adduction to protein[35]
得益于极小的初始液滴尺寸,纳米毛细管能显著减少甚至完全避免电喷雾电离过程中蛋白质与金属离子、配体等分子间的非特异性结合,示于图4[35]。以常见于各种缓冲溶液中的钠离子为例,其对蛋白质ESI-MS分析的不利影响来自多个方面[43]:1) 作为非挥发性盐,Na+具有离子抑制效应,能显著抑制蛋白质等目标分子的离子化,降低其总信号强度[43];2) 在去溶剂过程中,Na+能与蛋白质中的负电性基团(如天冬门氨酸、谷氨酸以及肽链羧基端的R—COO-)通过静电相互作用形成加合物[43-44],使得蛋白质的质谱峰分散,进一步降低信号强度与信噪比;3) 高浓度的非挥发性盐还易形成盐簇峰,严重干扰甚至完全掩盖蛋白质的质谱峰[45]。纳米毛细管能从多方面改善非挥发性盐溶液中目标蛋白质分子的ESI-MS分析性能。首先,得益于更小的初始液滴尺寸,蛋白质与Na+等金属阳离子的非特异性加合能被显著抑制。以150 mmol/L NaCl、5 μmol/L蛋白质的水溶液为例,平均直径85 nm的液滴在概率上刚好包含1个蛋白质分子,此时Na+数量约为30 000;而当液滴尺寸减少至30 nm时,虽然大部分液滴中都不含有蛋白质分子(即平均每22个液滴才含有1个蛋白质分子),但恰好含有1个蛋白质分子液滴的Na+数量仅约为1 400[40],这是纳米毛细管能显著减少电喷雾中蛋白质与金属阳离子间的非特异性加合的原因之一。此外,尺寸较大的带电液滴需经历多个“溶剂蒸发”和“液滴碎裂”过程才能最终形成气相离子,伴随着的是非挥发性盐的显著浓缩,这也是电喷雾中蛋白质易与金属离子形成非特异性加合物的重要原因[35,44,46]。而在纳米毛细管电喷雾中,由于初始带电液滴尺寸极小,Williams等[47]甚至推测蛋白质分子能从纳米毛细管直接喷射出来,因此由于多步“溶剂蒸发”和“液滴碎裂”过程导致的溶质浓缩效应在纳米毛细管电喷雾中不显著,这也是其能抑制非特异性加合物形成的重要原因[35,40]。
2.5 基质耐受性
除了对非特异性加合物形成的抑制效应,纳米毛细管电喷雾还具备极佳的抗基质干扰能力。通常,溶液中除目标分子以外的其他成分都可称为基质,其对目标分子电离的不利影响可统称为基质干扰。纳米毛细管实现高灵敏分析的原因:一方面源自其产生的初始液滴尺寸极小,具有较高的电荷/体积比,有利于目标蛋白分子的离子化,因而能改善非挥发性盐等的离子抑制效应[11];另一方面,小尺寸初始液滴中非挥发性盐等基质的绝对含量更低,盐簇峰的形成显著减少,其对目标分子的谱峰干扰和掩盖更少,有利于实现复杂基质环境下蛋白质等生物分子的高灵敏检测[40]。通常,大型蛋白质组装体、蛋白质-药物复合物结合状态的维系往往需要生理或者近生理的离子强度和pH值环境[48],所使用的高浓度非挥发性缓冲盐对ESI-MS的分析性能影响极大[40,49]。对基质尤其是非挥发性盐的耐受能力是纳米毛细管电喷雾最重要的特性,为这些极具挑战的样品分析提供有效的技术基础,是其在native MS领域广受关注的根本原因。
2.6 蛋白质与玻璃内壁的相互作用
纳米毛细管的诸多特性对native MS亦非总是有利,如前文提及的蛋白离子高电荷态现象。ESI-MS中,蛋白离子的电荷态通常被认为是反映蛋白质构象状态的指针[33,50-51]。以细胞色素c(cyt c)为例,其在中性pH值下呈紧凑折叠的球状构象,非变性质谱分析所得的质谱峰通常应为介于6+~10+的低电荷分布。然而,纳米毛细管电喷雾所得的cyt c离子常为大于10+的高电荷分布,意味着其通过毛细管时构象发生了改变,从紧凑折叠部分转变为去折叠构象[11,35,52]。Mortensen等[52]对该现象进行了细致的研究,指出cyt c等正电性蛋白质分子通过纳米毛细管时与带负电玻璃内壁的静电相互作用导致了去折叠过程,示于图5。类似的静电相互作用还体现在正电性蛋白质在玻璃内壁上的吸附,结果是cyt c等正电性蛋白质在界面吸附饱和之前完全无法测得任何质谱信号[53]。通过对玻璃内壁的界面修饰、改性,可有效避免上述静电相互作用的不利影响[54]。
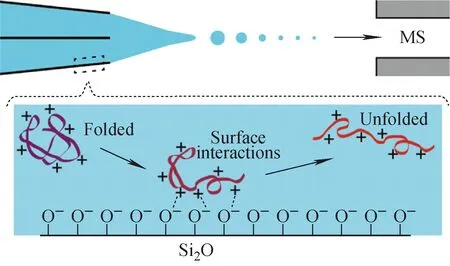
图5 蛋白与玻璃内壁的相互作用导致蛋白发生去折叠[52]Fig.5 Surface-induced protein unfolding in submicron electrospray emitters[52]
2.7 浓差极化
在静电场下,玻璃毛细管中的物质输运方向取决于电泳和电渗流(EOF)的矢量和。但与常规EOF有所不同,伴随着喷雾的进行,毛细管内体相溶液的运动总是朝向针尖(质谱入口)方向。而由于荷电离子的电迁移方向和速率(离子淌度)不同,在微纳毛细管电喷雾中,常能在针尖观察到显著的浓差极化现象,体现为不同荷电性分子的质谱信号随时间增强或减弱的变化[55]。依据不同溶质分子电迁移速率的不同,可在电喷雾过程中实现在线分离。如Wei等[45,56]利用梯度电场实现了基质尤其是非挥发性盐与蛋白质、多肽等分子的有效分离,能在高浓度的缓冲盐溶液中实现蛋白质、多肽等高灵敏质谱检测。纳米毛细管电喷雾的流量较微米毛细管要低很多,因此由荷电离子的电泳运动引起的浓差极化现象通常更显著,示于图6,进而有可能造成相对定量、蛋白质-药物复合物的结合状态等分析结果的误差,应在相关的定量研究中予以考虑与评估。
图6 高压电场下纳米毛细管内离子的浓差极化现象[55]Fig.6 Ion concentration (depletion or enrichment) in a nanoscale electrospray emitter under high-voltage field[55]
3 纳米毛细管电喷雾在非变性质谱中的应用
非变性质谱要求在电喷雾电离中尽可能地保持蛋白质及其复合物的三维构象和结合状态,这是纳米毛细管用于非变性质谱分析的前提。Wysocki等[57]利用离子迁移谱和表面诱导解离等技术,详细对比了直径分别为80 nm和9 μm毛细管产生的蛋白质离子的电荷态分布、碰撞截面积和碎裂模式,发现纳米毛细管和常规微米毛细管产生的蛋白质离子在结构上具有高度的相似性,表明使用合适的缓冲溶液体系时,纳米毛细管电喷雾能在离子化过程中较好地保持蛋白质及其复合物的三维构象和结合状态。近年来,基于纳米毛细管的ESI-MS已广泛用于生理或近生理缓冲溶液中蛋白质的直接检测、蛋白质-配体亲和力的直接测量、大规模潜在成药分子的快速筛选、寡核苷酸的直接质谱分析等领域。
3.1 生理或近生理缓冲溶液中蛋白质的直接检测
目前,native MS中常用的醋酸铵缓冲溶液虽能提供足够的离子强度,但有研究[58]指出,醋酸铵并不具备中性pH值范围内的缓冲能力。而传统生化缓冲体系中的非挥发性盐对蛋白质的离子化存在极大的抑制效应,因此不经除盐处理的直接质谱分析难度极大。此前,本课题组首次报道了~120 nm毛细管喷针能有效减少ESI-MS中多肽、蛋白质与金属阳离子间的非特异性加合,显著改善ESI-MS的基质耐受性[35]。Williams等[40]利用~0.5 μm毛细管实现了离子强度100~200 mmol/L生理缓冲溶液中蛋白质的直接检测,无需任何除盐操作。与之相比,~1.6 μm微米喷针所得的质谱图中几乎全是盐簇峰,少有可辨别的蛋白质信号。随后,该课题组[49]将可分析的溶液体系进一步拓展至磷酸盐(PBS)、哌嗪-1,4-二乙磺酸(PIPES)、3-(N-吗啉基)丙磺酸(MOPS)、4-(2-羟乙基)-1-哌嗪乙磺酸(HEPES)、三羟甲基氨基甲烷(TRIS)、2-(N-吗啡啉)乙磺酸(MES)等生化实验常用的缓冲体系(示于图7),除水溶性蛋白外,还利用~0.5 μm喷针实现了膜蛋白的直接分析[47]。通常,膜蛋白的水溶性较差,常使用表面活性剂辅助溶解。然而,离子型和非离子型表面活性剂对膜蛋白的离子化存在显著的抑制效应,同时表面活性剂与膜蛋白的加合还会使蛋白质的谱峰展宽,进一步降低其信噪比。因此,使用传统微米毛细管喷针通常无法实现复杂基质中膜蛋白的直接质谱分析。与之相比,~0.5 μm亚微米喷针则成功实现了从含有150 mmol/L NaCl、25 mmol/L Tris-HCl以及1.1%辛烷基葡糖苷溶液中直接检出膜蛋白,无需任何除盐或分离等前处理步骤[47]。
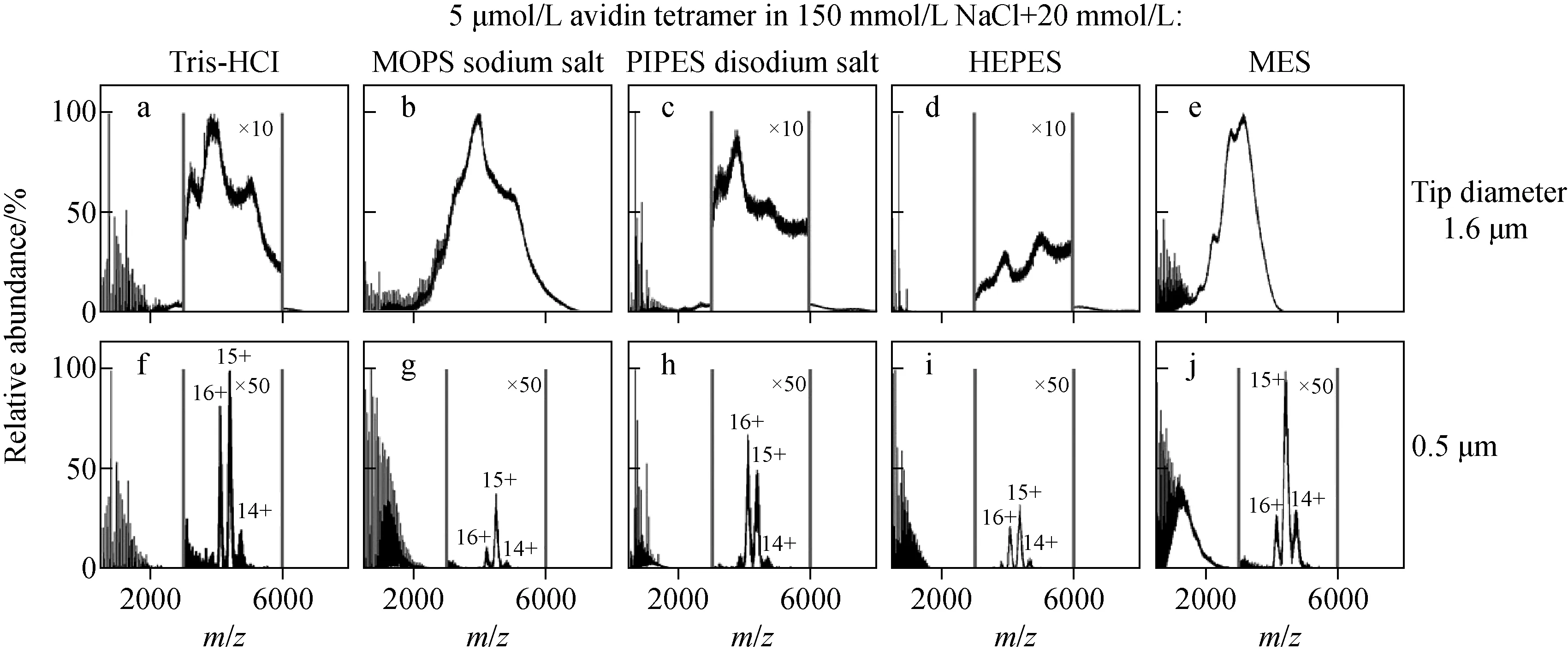
图7 生理或近生理缓冲溶液中蛋白质的直接质谱检测[49]Fig.7 Mass spectra of proteins from solutions at or near physiological ionic strength[49]
需要指出的是,上述研究虽然实现了生理或近生理缓冲溶液中蛋白质分子的直接检测,但仅是实现了蛋白谱峰的电荷分辨,金属离子、表面活性剂等对蛋白的非特异性加合仍十分严重,表现为所测得的蛋白分子质量通常远大于其理论值。
3.2 蛋白质-配体亲和力的直接测量
非挥发性盐常用于稳定蛋白质-配体复合物的结构与结合状态。得益于基质耐受性以及对非特异性加合的抑制,基于亚微米和纳米毛细管的ESI-MS可用于蛋白质与配体分子间亲和力(解离常数Kd)的直接测量。Donald等[59]发现毛细管直径从~2 μm逐步减小至~250 nm时,蛋白质及其与配体复合物的谱峰质量得到显著改善,可满足定量分析要求。而得益于质谱的多组分同时检测能力,实现了从1张质谱图中直接测算碳酸酐酶与多达6种配体分子的亲和力数据。Klassen等[60]利用直径~50 nm毛细管进一步将蛋白质与配体间亲和力的直接精准测量从此前的μmol/L级拓展至更弱的mmol/L级,此项定量研究表明纳米毛细管电喷雾能在离子化过程中很好地保持蛋白质-配体间仅mmol/L级的非共价弱相互作用。但值得指出的是,这些工作仍使用了醋酸铵部分或全部替换常规生化缓冲体系中的非挥发性盐,以改善质谱峰的质量,对于生理或近生理溶液中蛋白质-配体间亲和力的直接测算仍存在困难。
3.3 潜在成药分子的快速筛选
天然产物是指从自然界的动物、植物及微生物中分离、提纯得到的代谢物,其种类繁多、结构多样,是药物研发中获得先导化合物的重要来源[61]。水杨苷、奎宁、青蒿素、紫杉醇等一系列结构新颖、生物活性强的天然产物的发现和利用是现代药学发展过程中重要的里程碑,对人类健康产生了深远影响。然而,天然产物浩如烟海,其中活性组分的快速、高通量筛选充满挑战[62]。最近,Donald课题组[63]利用非变性质谱技术开发了从天然产物中快速筛选活性分子的方法,其流程示于图8a。该方法直接利用天然植物的提取物作为分子库,将其与靶蛋白(如碳酸酐酶)混合,随后利用凝胶过滤法除去提取物中未与靶蛋白结合的组分,再利用基于纳米毛细管的非变性质谱对新形成的复合物进行检测。同时,利用串联质谱还可方便地鉴定复合物中的活性小分子。该方法无需对提取物进行复杂且耗时的分离提纯,1次实验即可从包含上千种分子的天然产物提取物中快速鉴定出可能的活性分子,极大地提升了潜在药物分子的筛选效率。
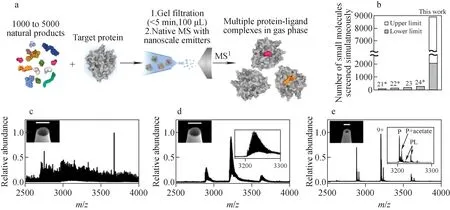
图8 天然产物中活性分子的快速native MS筛选[63]Fig.8 Multiplexed screening of thousands of natural products for protein-ligand binding via native MS[63]
3.4 高浓度非挥发性盐溶液中核苷酸的直接质谱分析
与蛋白质分子类似,核苷酸的三维结构及其与配体(药物分子、辅因子等)间的弱相互作用同样广泛受到溶液中金属离子的调控[64]。一方面,正电性的金属阳离子(如Na+、K+等)能通过与核苷酸骨架上负电性的磷酸基团间的静电相互作用,削弱核苷酸分子内及分子间的静电排斥,促进分子折叠以形成发卡(hairpin)、双螺旋(duplex)、三螺旋(triplex)、G-四链体(G-quadruplex)、i-Motif等高级结构;另一方面,金属阳离子也能通过与核酸分子的配位相互作用促进高级结构(特别是G-四链体)的形成并使其稳定化[65]。此外,Mg2+等还能在磷酸基团间形成盐桥(salt bridge),实现对核酸拓扑结构的长程调控[66]。由于核酸分子含有大量的磷酸基团,其在中性pH值下整体带负电,因此常使用负离子模式进行质谱分析,这与蛋白质分析时常使用正离子模式有所不同。然而,即便是在负离子模式下,溶液中的金属阳离子对核酸分子的检测仍存在极大的干扰和抑制。Fabris等[67]对比研究了1.4 μm和0.6 μm喷针分析高浓度非挥发性盐(1~20 mmol/L NaCl)溶液中寡核苷酸时的性能表现,发现亚微米喷针所得的质谱图中不仅盐簇峰极大地减少,寡核苷酸的信号强度以及谱峰信噪比也较微米喷针有数倍的提升。此外,寡核苷酸与金属阳离子(Mg2+和Na+等)间的非特异性加合在亚微米喷针下也得以显著减少,这对Mg2+与核酸之间特异性结合的识别十分有益。这些现象与正离子模式下分析蛋白质时十分类似,表明了小尺寸喷针在改善基质抑制效应、减少非特异性加合等方面的普适性。
Donald等[68]使用~250 nm喷针进一步研究了纺锤菌素(netropsin)和发卡DNA间的结合机理。纺锤菌素是第一个被鉴定的能特异性结合在DNA小沟区(minor groove)的小分子[69],但其与DNA分子的结合模式存有一定争议,文献报道的结合模式主要包括与发卡结构结合的2M机理(two modes (2M) mechanism)[70]以及结合诱导发卡结构向双螺旋转变的HD机理(hairpin-to-duplex (HD) transition mechanism)[71]。得益于亚微米喷针的使用,他们从高质量的质谱数据中定量分析纺锤菌素与发卡DNA的结合情况,并发现了纺锤菌素的结合并不会显著改变发卡与双螺旋结构的比例等不符合2M和HD机理的现象。据此提出了纺锤菌素与发卡结构、双螺旋结构同时结合的SB机理(“simultaneously” bind (SB) mechanism),表明了非变性质谱在核酸与配体相互作用机理研究中的重要价值。
虽然亚微米毛细管能显著提升高浓度非挥发性盐溶液中核酸的质谱检出性能,但仍不足以完全抑制金属阳离子与核酸分子间的非特异性加合现象,因而限制了对诸如G-四链体等复合物中金属阳离子(如K+等)配位情况的准确解析。针对这一挑战,本课题组提出了一种联合策略,即同时利用~70 nm纳米毛细管、低流量干燥气流以及使用乙酸三甲基铵部分替代非挥发性盐,最终实现了对非特异性加合的完全抑制,能直接从生理或近生理离子强度溶液中准确识别G-四联体内K+、Na+配位数及其配位模式[72]。
4 总结与展望
基于纳米毛细管的非变性质谱技术可以直接从生理或近生理的缓冲溶液中,在不破坏完整蛋白质复合物结构和结合状态的情况下,从分子层面获取其组成、结合动力学等信息,已广泛应用于蛋白质-配体间的弱相互作用、潜在药物分子的快速筛选等领域。纳米毛细管的引入为电喷雾电离质谱带来了前所未有的基质耐受性,极大地拓宽了非变性质谱的应用范围,是该领域近年来最重要的技术进步。然而,浓差极化、蛋白与玻璃内壁的界面相互作用(蛋白质的去折叠、吸附等)造成的不利影响仍需要在具体研究中予以考虑并设法避免。此外,当前基于纳米毛细管的非变性质谱在通用性上仍存在较大的局限。首先,纳米毛细管的小尺寸特性使其极易发生堵塞;其次,纳米毛细管的喷雾流量极低,难以与液相色谱、毛细管电泳等分离技术结合;此外,纳米毛细管电喷雾的电离行为对所使用的电离参数(电压、温度、距离、干燥气流量等)极为敏感,实际操作中往往需要进行细致调优才能获得较好的分析性能。纳米毛细管的尺寸效应和界面性质是其电离行为特性的根源,通过精准的尺寸控制、界面修饰与功能化,有望进一步优化纳米毛细管电喷雾电离质谱的分析性能,促进其在大型蛋白质组装体、蛋白质-药物复合物等样品分析中的应用研究。