槲皮素对草莓生长发育、光合和生理生化特性影响的综合评价
柳苗苗, 蔡伟建, 张斌斌, 赵密珍, 王 静, 刘怀锋
(1.石河子大学农学院,新疆石河子 832000; 2.江苏省农业科学院果树研究所/江苏省高效园艺作物遗传改良重点实验室,江苏南京 210014)
草莓生长周期短、产出快、收益高,是江苏等地冬春季第1果。草莓以设施生产为主,冬春季低温弱光会严重制约草莓生产,提高设施条件下草莓的光合速率和抗性,是冬春季草莓生产的重要研究方向。
槲皮素(quercetin)即3,3′,4′,5,7-五羟基黄酮,是一种植物性黄酮醇,属于多酚中的黄酮类化合物,广泛存在于果蔬、中草药植物的花、叶和果实中[1],位于叶绿体外被,有强抗氧化作用[2-3],有望成为一种新的植物生物刺激素[2-4]。槲皮素在植物中的应用较少,主要集中在保护植物免受非生物胁迫的影响[5-7],或通过激素信号[脱落酸(ABA)、吲哚-3-乙酸(IAA)]级联调控影响植物生长发育[8-9]。
本试验以宁玉草莓品种为材料,研究不同浓度(0、20、40、80 mg/L)槲皮素溶液对草莓生长发育、光合及抗性的影响,以期确定槲皮素对于草莓耐低温弱光的作用,为未来草莓的生产提供指导。
1 材料与方法
1.1 试验设计与试剂
供试材料为宁玉草莓(由江苏省农业科学院选育并经江苏省农作物品种审定委员会鉴定),将草莓种苗定植于江苏省农业科学院溧水植物科学基地中长度55 m、跨度7 m的塑料大棚内,垄高 30 cm,垄面宽60 cm,垄间距40 cm,采用高垄双行的栽培方式。处理分为6个小区,种苗植株长势均一,分别喷施20、40、80 mg/L槲皮素(分别记作T1、T2、T3处理),以喷清水为对照(CK),每个小区设5株重复,取草莓顶端生长点以下完全展开的第2~3张叶片测定相关指标。
槲皮素、丙二醛(MDA)试剂盒、脯氨酸测定试剂盒、总抗氧化能力试剂盒(T-AOC)均购于南京建成生物工程研究所,测定可溶性糖含量所用试剂盒购于索莱宝生物科技有限公司,蛋白含量测定所用考马斯亮蓝法蛋白含量测试盒、测定植物总酚(TP)含量所用测试盒购于苏州科铭生物技术有限公司。
1.2 测定指标与方法
1.2.1 植株农艺性状测定 2021年2月测定草莓的农艺性状和光合特性。株高、叶柄长、果长和果宽用卡尺测定,根茎粗用游标卡尺测定,花序数、叶片数用目测法测定,果质量用电子计数天平称量,叶面积使用CI-203手持式激光叶面积仪(美国CID公司)测定,相对叶绿素含量使用SPAD-502 Plus便携式叶绿素测定仪(日本柯尼卡美能达公司)测定。选择连续无云的晴天,在09:00—11:00用Li-6800便捷式光合系统测定仪(美国LI-COR公司)测定光合参数[光合速率(Pn)、蒸腾速率(Tr)、气孔导度(Gs)和胞间CO2浓度(Ci)]。
1.2.2 叶片生理生化指标测定 丙二醛(MDA)、脯氨酸(Pro)、可溶性糖、可溶性蛋白、总酚(TP)含量和总抗氧化能力(T-AOC)均用试剂盒检测。
1.3 数据处理
用Excel 2016进行试验数据整理,用SPSS 25.0进行单因素方差分析(ANOVA)、邓肯差异显著性(α=0.05)分析和双变量相关性分析,用DPS 7.05统计处理软件进行主成分分析。
通过如下公式得出不同处理后综合指标的隶属函数:
U(Xj)=(Xj-Xmin)/(Xmax-Xmin),j=1,2,3,…,n。
式中:Xj表示第j个综合指标;Xmax、Xmin分别表示第j个综合指标的最大值、最小值。根据公式计算出每个处理所有指标的隶属函数值。
权重计算公式:

式中:Wj表示在所有综合指标中第j个综合指标的重要程度(权重);Pj表示第j个综合指标的贡献率。
综合评价指标(D值)的计算公式:
D=n∑j=1[u(Xj)×Wj],j=1,2,3,…,n。
式中:D值即草莓在不同浓度槲皮素处理下用综合指标评价得到的最优处理浓度的综合评价值。
用Origin 2019软件分析作图,数据均用“平均值±标准误”表示。
2 结果与分析
2.1 对草莓花序数、结果数和果实质量的影响
由图1可以看出,不同浓度槲皮素对草莓花序数量和结果数量的影响不大,喷施清水的对照与20、40、80 mg/L 3个浓度槲皮素处理的花序数量间差异不显著,但结果数量有显著差异。清水对照与20、40、80 mg/L槲皮素处理的花序数分别为2.86、3.36、2.73、3.07个,结果数分别为3.52、6.24、5.74、6.47个。由表1可以看出,与清水对照相比,3种浓度槲皮素处理的单果质量和果实总质量均增加,清水对照与20、40、80 mg/L槲皮素处理的果实总质量、单果质量分别为301.14、338.18、366.60、382.08 g和19.30、22.91、25.13、25.21 g,3种浓度槲皮素处理间的果实可溶性固形物含量差异不显著。
2.2 对草莓植株农艺性状的影响
由表2可以看出,在不同浓度槲皮素处理下,草莓农艺性状中的株高、叶片数与清水对照处理相比均无显著差异,清水对照与3个浓度槲皮素处理的株高分别为12.85、12.73、12.95、12.75 cm,相互之间无显著差异;各处理的植株叶片数为11.85~15.67 张,没有显著差异。与清水对照相比,槲皮素处理的植株叶柄更长、叶面积更大、根茎越粗且差异显著,20mg/L槲皮素处理的叶面积最大,为18.75 cm2,其次为40 mg/L槲皮素处理(18.19 cm2)和80 mg/L槲皮素处理(18.17 cm2),叶面积最小的为清水对照(15.23 cm2);40 mg/L槲皮素处理的叶柄最长,根茎最粗,在叶柄长度上,表现为40 mg/L槲皮素处理(11.33 cm)>20 mg/L槲皮素处理(11.10 cm)>80 mg/L 槲皮素处理(11.08 cm)>清水对照(8.99 cm);在根茎粗上,表现为40 mg/L槲皮素处理(15.70 mm)>20 mg/L槲皮素处理(15.57 mm)>80 mg/L槲皮素处理(15.25 mm)>清水对照(12.32 mm)。

表1 不同浓度槲皮素对草莓果实质量的影响

表2 不同浓度槲皮素对草莓植株农艺性状的影响
2.3 对草莓叶片叶绿素含量和光合作用的影响
由图2可以看出,槲皮素处理显著提高了草莓植株叶片的叶绿素含量,20、40、80 mg/L槲皮素处理的叶片叶绿素含量分别比对照高7.00%、6.86%、8.13%,在不同浓度槲皮素处理下,叶绿素含量无显著差异。
由图3可以看出,槲皮素处理提高了草莓叶片的净光合速率、蒸腾速率、胞间CO2浓度、气孔导度。在40 mg/L槲皮素处理下,Pn最大,为 22.77 μmol/(m2·s),显著高于对照的 20.73 μmol/(m2·s);在20、80 mg/L槲皮素处理下,Pn分别为21.52、22.33 μmol/(m2·s),20 mg/L 处理、对照和40 mg/L槲皮素处理间有显著差异。在80 mg/L槲皮素处理下,Tr最大,达 4.4 mmol/(m2·s),显著高于对照[3.3 mmol/(m2·s)]。在20、40 mg/L 槲皮素处理下,Tr分别为3.9、4.2 mmol/(m2·s),20 mg/L处理、对照和80 mg/L槲皮素处理间差异显著。80 mg/L 槲皮素处理的Ci、Gs分别为 283.17 μmol/mol、0.348 4 mol/(m2·s),40 mg/L 槲皮素处理的Ci、Gs分别为 275.88 μmol/mol、0.34 mol/(m2·s),对照Ci、Cs分别为 265.33 μmol/mol、0.28 mol/(m2·s)。
2.4 对草莓叶片丙二醛含量和脯氨酸含量的影响
由图4-A可以看出,不同浓度槲皮素处理降低了草莓叶片中的丙二醛含量,并且随着施用槲皮素浓度的递增,丙二醛含量逐渐降低,其中清水处理的丙二醛含量最高,达0.0267 μmol/g,80 mg/L槲皮素处理的丙二醛含量仅为0.018 3 μmol/g,表明施用槲皮素可有效缓解逆境中植株细胞的受损。由图 4-B 可以看出,施用槲皮素处理可有效提高植株叶片细胞中的脯氨酸含量,其中40、80 mg/L槲皮素处理下草莓植株叶片的脯氨酸含量分别为38.5、37.1 μg/g,与清水对照(20.5 μg/g)间差异显著。
2.5 对草莓叶片可溶性糖和可溶性蛋白含量的影响
由图5可以看出,槲皮素处理的草莓植株叶片中的可溶性糖、可溶性蛋白含量与清水对照相比差异显著,施用槲皮素有效提高了草莓植株叶片中可溶性糖、可溶性蛋白含量。在3个不同浓度槲皮素处理下,可溶性糖含量逐渐增加,分别为16.83、21.16、22.33 mg/g(图5-A);但3个浓度槲皮素处理之间的草莓叶片可溶性蛋白含量差异不显著(图5-B)。
2.6 对草莓叶片总酚和总抗氧化能力的影响
施用不同浓度槲皮素对草莓叶片总酚含量(图6-A)和总抗氧化能力(图6-B)没有显著影响。清水对照(CK)与T1、T2、T3处理的总酚含量分别为16.18、16.74、16.78、16.76 mg/g,总抗氧化能力分别为8.392、8.785、9.558、8.864 U/mg。
2.7 各项指标相关性主成分分析及隶属函数法综合评价
由表3可以看出,总酚含量与叶柄长、叶片数,可溶性糖含量与果实总质量,根茎粗与叶柄长、可溶性蛋白含量间的相关系数最大,均为1.00。叶片数与叶柄长、叶面积、叶绿素含量、根茎粗、总酚含量及可溶性蛋白含量间呈极显著正相关,相关系数均为0.96以上。呈极显著正相关的还包括结果数与叶片数、叶面积、可溶性蛋白含量、总酚含量,以及根茎粗与叶面积、叶片数、叶绿素含量、总酚含量;单果质量与叶柄长、叶片数、结果数、果实纵径、果实横径、果实硬度呈显著正相关,相关系数分别为0.93、0.94、0.88、0.92、0.94、0.88,同时单果质量与果实总质量、可溶性糖含量、蒸腾速率、净光合作用、气孔导度均呈极显著正相关。
在对不同浓度槲皮素处理结果的比较评价中,直接用以上各项指标不具有代表性,结果也缺乏准确性,可利用主成分分析法进行分析,进而确定综合评价指标。对不同浓度槲皮素处理的草莓的24项指标进行主成分分析,提取出3个主成分,累计贡献率达100%,可代表原来的24个指标,其中第1主成分(Z1)占77.22%,第2主成分(Z2)占15.19%,第3主成分(Z3)占7.58%,它们对应的特征向量表达式为:
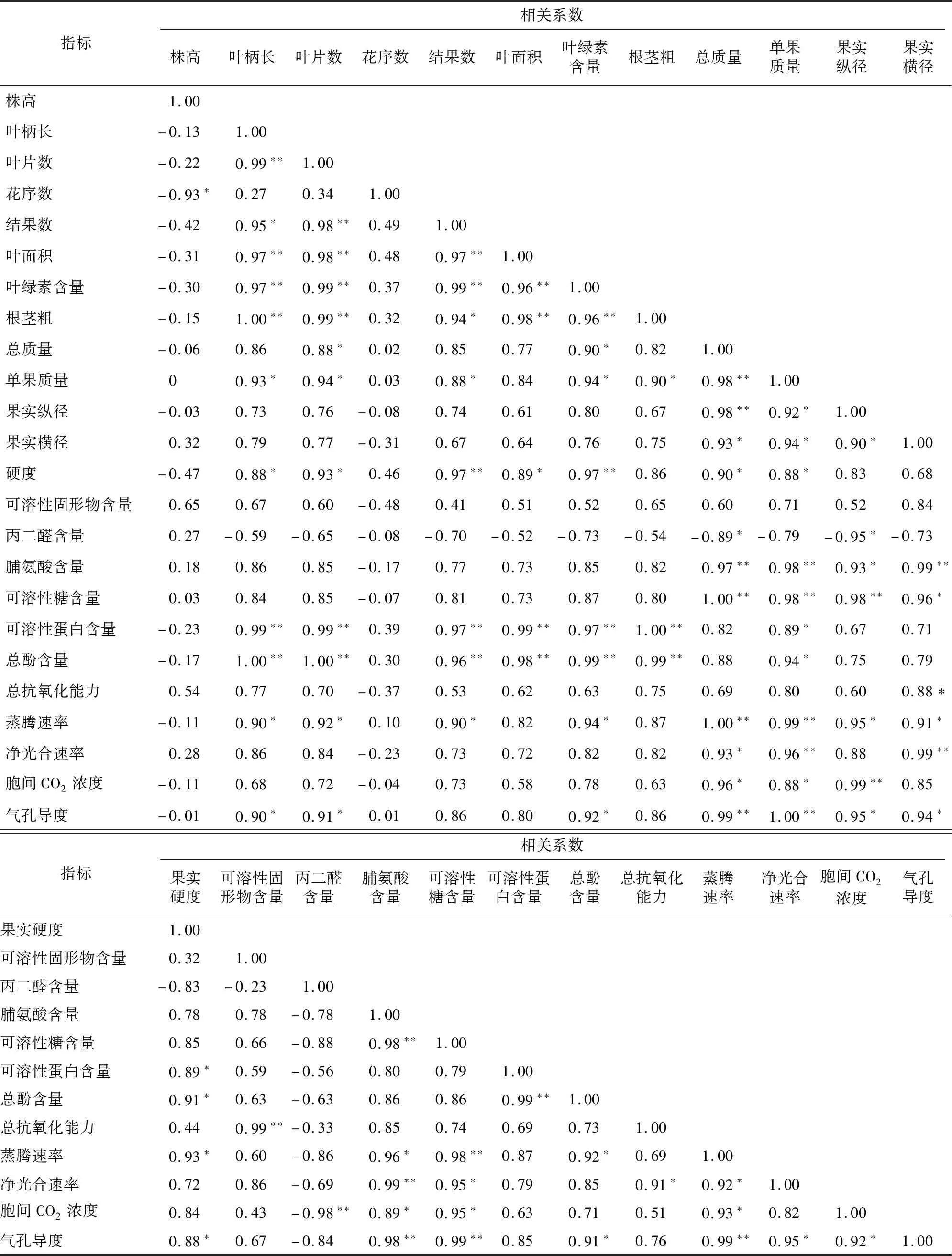
表3 不同浓度槲皮素对草莓各项指标的相关系数矩阵
Z1=-0.016 4X1+0.221 6X2+0.223 0X3+0.026 8X4+0.213 7X5+0.204 8X6+0.223 8X7+0.215 6X8+0.226 1X9+0.231 5X10+0.208 9X11+0.210 9X12+0.212 0X13+0.155 9X14-0.182 4X15+0.222 8X16+0.224 1X17+0.214 3X18+0.223 5X19+0.177 6X20-0.229 5X21+0.217 7X22+0.201 4X23+0.229 7X24;
Z2=-0.510 5X1-0.062 5X2-0.103 1X3-0.512 6X4-0.199 7X5-0.173 2X6-0.132 5X7-0.082 6X8+0.029 9X9+0.042 0X10+0.063 3X11+0.214 6X12-0.202 0X13+0.331 3X14+0.047 4X15+0.141 4X16+0.079 6X17-0.123 4X18-0.081 0X19+0.278 9X20-0.005 7X21+0.182 4X22+0.030 4X23+0.046 3X24;
Z3=0.156 5X1+0.204 4X2+0.147 5X3+0.124 5X4+0.067 3X5+0.249 1X6+0.064 1X7+0.249 5X8-0.164 2X9-0.017 8X10-0.311 3X11-0.064 2X12-0.099 2X13+0.286 7X14+0.454 0X15-0.062 6X16-0.159 6X17+0.226 9X18+0.166 2X19+0.269 2X20-0.114 1X21+0.015 5X22-0.367 0X23-0.089 9X24。
式中:X1~X24分别为株高、叶柄长、叶片数、花序数、结果数、叶面积、叶绿素含量、根茎粗、总质量、单果质量、果实纵径、果实横径、果实硬度、可溶性固形物含量、丙二醛含量、脯氨酸含量、可溶性糖含量、可溶性蛋白含量、总酚含量、总抗氧化能力、蒸腾速率、净光合速率、胞间CO2浓度、气孔导度。
由以上表达式可以看出,第1主成分中叶柄长、叶片数、叶绿素、总质量、单果质量、果实硬度、脯氨酸含量、可溶性糖含量、总酚含量、气孔导度的系数较大;第2主成分中果实横径、可溶性固形物含量、总抗氧化能力、净光合速率的系数较大;第3主成分中叶面积、根茎粗、可溶性固形物含量、丙二醛含量、可溶性蛋白含量的系数较大。
以所有综合指标的数值为原始数据进行隶属函数分析,换算成隶属函数值(表4)。对于同一综合指标如Z1,其中T3处理的U(X1)最大,表现最佳,而清水对照最小,表现最差。根据综合评价值(D值),对不同浓度槲皮素处理进行排序。结果显示,不同处理按D值排序为40 mg/L处理>80 mg/L处理>20 mg/L处理>清水对照,其D值分别为0.948、0.822、0.592、0.125,说明40 mg/L槲皮素是最优处理剂量。

表4 不同浓度槲皮素处理的综合指标值、隶属函数值、D值及综合评价
3 结论与讨论
长江中下游地区在冬季(尤其是12月至次年2月)常有低温弱光,严重影响草莓生产。从遗传学角度分析可知,适合选用耐低温弱光的草莓品种,但选育品种的费用、品种的适应性、生物学潜力的局限性及农民偏好有时会制约其使用;从栽培学角度分析可知,利用化学调控手段喷施主栽草莓品种,提高其耐低温弱光能力是一种简便可行的方式。近年来,植物生物刺激素的使用改善了植物耐逆境的水平[10]。
槲皮素是一种应用最广泛的植物生物类黄酮,常存在于果树、蔬菜中,有较强的抗氧化、抗逆能力,有望成为植物生物刺激素[14]。外源应用槲皮素能减轻猕猴桃叶片在夏季所受的高温强光的灼伤[15]、延缓苹果果实衰老[16]、延迟猕猴桃果实软化、抑制扩展青霉的发生[17]、吸收UV-B光以保护豌豆幼苗[5]、提高渗透胁迫下罗布麻种子的发芽率和活力[4]、缓解番茄盐胁迫[3]和百草枯毒性作用[18]。
槲皮素处理能有效增加草莓的结果数和单果质量,同时不同浓度的槲皮素显著增加了草莓叶面积、叶柄长和根茎粗,这与槲皮素处理增加番茄幼苗茎高、茎围和根长[6]并提高罗布麻种子的发芽率、茎长、根长、干质量和鲜质量的结果[7]相同。
槲皮素能够提高植株的光合特性。逆境胁迫会破坏叶绿体和类囊体膜结构,降低叶绿素合成和气孔导度,减少水分蒸腾,使光合作用降低。在本研究中,施用外源槲皮素增加了草莓叶片叶绿素含量,这与对番茄、罗布麻和小麦幼苗的研究结果相同[4,6-7];槲皮素显著促进了草莓植株的光合作用,其中40 mg/L槲皮素显著提高了净光合速率。各浓度槲皮素处理均提高了胞间CO2浓度、气孔导度和蒸腾速率。槲皮素可以通过诱导类囊体膜的结构变化,影响电子传递,调控气孔开放的信号通路,消除光抑制和对光合机构膜的损伤,导致光合效率提高[5]。
相关生理生化指标包括丙二醛含量、脯氨酸含量、可溶性糖含量、可溶性蛋白含量、抗氧化能力和总酚含量等植物应对逆境的指标。本研究发现,随着槲皮素浓度升高,草莓体内的脯氨酸、可溶性糖和可溶性蛋白含量呈递增趋势,而丙二醛含量显著降低,都有效减少了逆境中植株细胞受损;总抗氧化能力和酚类化合物总量与对照有显著差异(P<0.05),这与小麦幼苗中应用槲皮素增加了总抗氧化能力、酚类化合物总量的结果[17]相同。植物抗性的增加与多种因素有关,例如不良环境下植物体内活性氧的动态平衡被打破,植物就会启动保护系统,清除过剩的自由基;脯氨酸含量提高会降低活性氧的水平,抑制丙二醛含量增加,从而减轻细胞膜脂过氧化,这与酚类捕获活性氧的活力的作用相似;可溶性糖、可溶性蛋白含量的增加提高了草莓的代谢反应,以产生更多的渗透调节物质来缓解不良环境尤其是低温弱光的伤害。
槲皮素以剂量依赖性的方式起作用,而最佳剂量证明对植物是有益的[18]。由本试验结果可知,40 mg/L 槲皮素能够有效提高净光合速率、减少细胞膜损伤、提高草莓植株生长和抗性能力,可用于冬春季草莓生产。

