一例牛丘疹性口炎的诊断及病原序列分析
任云鑫,汤承,岳华
(西南民族大学畜牧兽医学院,四川成都 610041)
牛丘疹性口炎(bovine papular stomatitis,BPS)是牛的一种高度传染性疾病,由牛丘疹性口炎病毒(bovine papular stomatitis virus,BPSV)感染引起[1]。BPSV 会导致患病牛唇部、牙龈、口腔、舌头、前胃和乳房出现丘疹、结节和糜烂,其中鼻唇镜和鼻孔周围会形成明显突起的火山样病灶,患病奶牛由于乳房局部疼痛,无法完成挤奶,导致泌乳中断;偶尔还会继发乳腺炎,导致患畜哺乳期中断和产奶量下降,给奶牛养殖业带来严重经济损失[2]。此外,如果人与被感染动物有密切接触也可感染BPSV,被感染者病变通常出现在手上,一般由丘疹或直径3~8 mm 的结节组成,有些病例还会出现发热、红斑性疹、液下腺病和肌痛等症状[3]。BPSV 最早于1884 年被发现,日本、阿根廷、巴西、韩国、美国和中国等多国都报道了BPS暴发[1,4-8]。国外报道:自美国弗吉尼亚州采集的45 份牛口腔拭子中有31 份检出BPSV 阳性,阳性率高达68.89%[9];日本某牛场14 头小牛中9 头被检测为BPSV 阳性,阳性率为64.29%[10]。我国关于BPS 的流行病学资料未见报道,而国外的流行病学调查资料也较为匮乏,因此开展BPS 流行病学调查具有重要意义。除了BPSV,口蹄疫病毒(foot and mouth disease virus,FMDV)、牛病毒性腹泻病毒(bovine viral diarrhea virus,BVDV)和牛结节性皮肤病病毒(lumpy skin disease viruses,LSDV)等也可以导致患畜出现流涎或口腔黏膜溃疡和糜烂的临床症状[11-12]。这几种病原引起的症状相似,因此往往需要实验室诊断技术进行病原鉴定。
BPSV 是一种DNA 病毒,基因组为单一的线性双链DNA,大小约134 kb,含有131 个推定的基因编码区[13]。BPSV 属于痘病毒科(Poxviridae)副痘病毒属(Parapoxvirus,PPV)。该属成员还包括羊传染性脓疱病毒(Orf virus,ORFV)、伪牛痘病毒(pseudocowpox virus,PCPV)和新西兰红鹿副痘病毒(parapoxvirus of red deer in New Zealand,PVNZ)等。PPV 成员的B2L基因具有高度保守性[14],其包含1 个1 137 bp 的开放阅读框,编码378 个氨基酸,是PPV 成员分子检测最常用的靶基因[15]。目前,实验室检测BPSV 的方法中有普通PCR、半巢式PCR 和qPCR 检测方法,其中半巢式PCR 方法最常用并能扩增所有PPV 成员的B2L基因序列[8,15-16]。B2L基因引物片段超过500 bp,因此可以进一步用于PPV 成员的进化分析[17-19]。本研究对一奶牛场犊牛发生的口腔黏膜糜烂疾病病原进行实验室鉴定并分析病原的B2L基因分子特征,以期为国内BPS 防控提供参考。
1 材料与方法
1.1 临床样品和病毒核酸
2021 年12 月四川省某奶牛养殖场发生了以口腔黏膜糜烂等为主要特征的疾病。该场96 头2~3月龄犊牛中,有46 头患病,发病率达47.92%;患畜临床主要表现为精神沉郁、食欲不振、牙龈红肿以及鼻唇镜部有红色丘疹或溃疡病灶等(图1)。无菌采集10 份患病犊牛口腔黏膜糜烂样本置于-20 ℃备用。BPSV、FMDV、BVDV 和LSDV 的阳性核酸样品,由西南民族大学动物医学实验室保存。
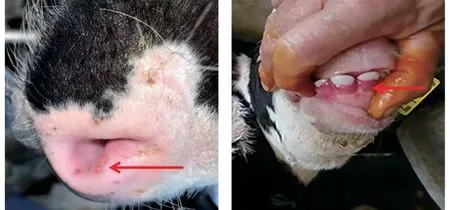
图1 犊牛鼻唇镜部溃疡和牙龈红肿
1.2 主要试剂与仪器
TrizolTMReagent、Prime ScriptTM、2×TaqPCR Master Mix、DNA Marker,购自日本TaKaRa 公司;凝胶成像系统(VersaDoc2000)、PCR 仪(ThermoFisher),购自赛默飞世尔科技;核酸蛋白电泳仪(powerpacuniversalTM),购自美国Bio-Rad 公司;高速冷冻离心机(5804),购自德国Eppendorf 公司。
1.3 样本处理与核酸提取
所有患病犊牛的口腔黏膜糜烂样本经-80 ℃反复冻融3 次后按照1:3 体积比加入PBS,充分研磨后5 000 r/min 离心10 min,收集上清并分成两份。一份采用酚-氯仿法进行DNA 提取;另一份按照TrizolTMReagent 说明书进行总RNA 提取,并按照Prime ScriptTM反转录试剂盒说明书合成cDNA。DNA 和cDNA 均放置于-20 ℃保存备用。
1.4 病原检测
用文献报道的特异性PCR 检测方法,分别对FMDV[20]、BVDV[21]和LSDV[22]进行检测。BPSV检测采用半巢式PCR 方法。病原检测引物信息见表1,其中PP1 和PP2 分别为第一次扩增反应的上游和下游引物,PP3 和PP4 分别为第二次扩增反应的上游和下游引物。PCR 产物经1.50%琼脂糖凝胶电泳鉴定,阳性产物送上海生工生物有限公司双向测序后进行BLAST 比对。

表1 病原检测引物信息
1.5 BPSV 序列分析
将病原检测中扩增的594 bp BPSV PCR 产物纯化回收后克隆到pClone007 载体中,并将其转化到EHA105 感受态细胞中构建重组质粒,测序后利用MEGA 4.0 软件与GenBank 中BPSV(GenBank登录号:JN171861、KF478805、JN171854、JN171860、KF830858)和PCPV 的B2L基因(GenBank 登录号:KF830856、KT992225、KF830855)进行多重序列比对,并利用邻近法(Neighbor-Joining)建立系统进化树。
2 结果
2.1 病原检测
琼脂糖凝胶电泳检测结果(图2)显示:在BPSV 的半巢式PCR 检测中,10 份犊牛口腔黏膜糜烂样本中有 6 份样本扩增出大小约230 bp 的片段,阳性率为60.00%;PCR 产物双向测序后证实为BPSV,其余3 种病原均未检出。
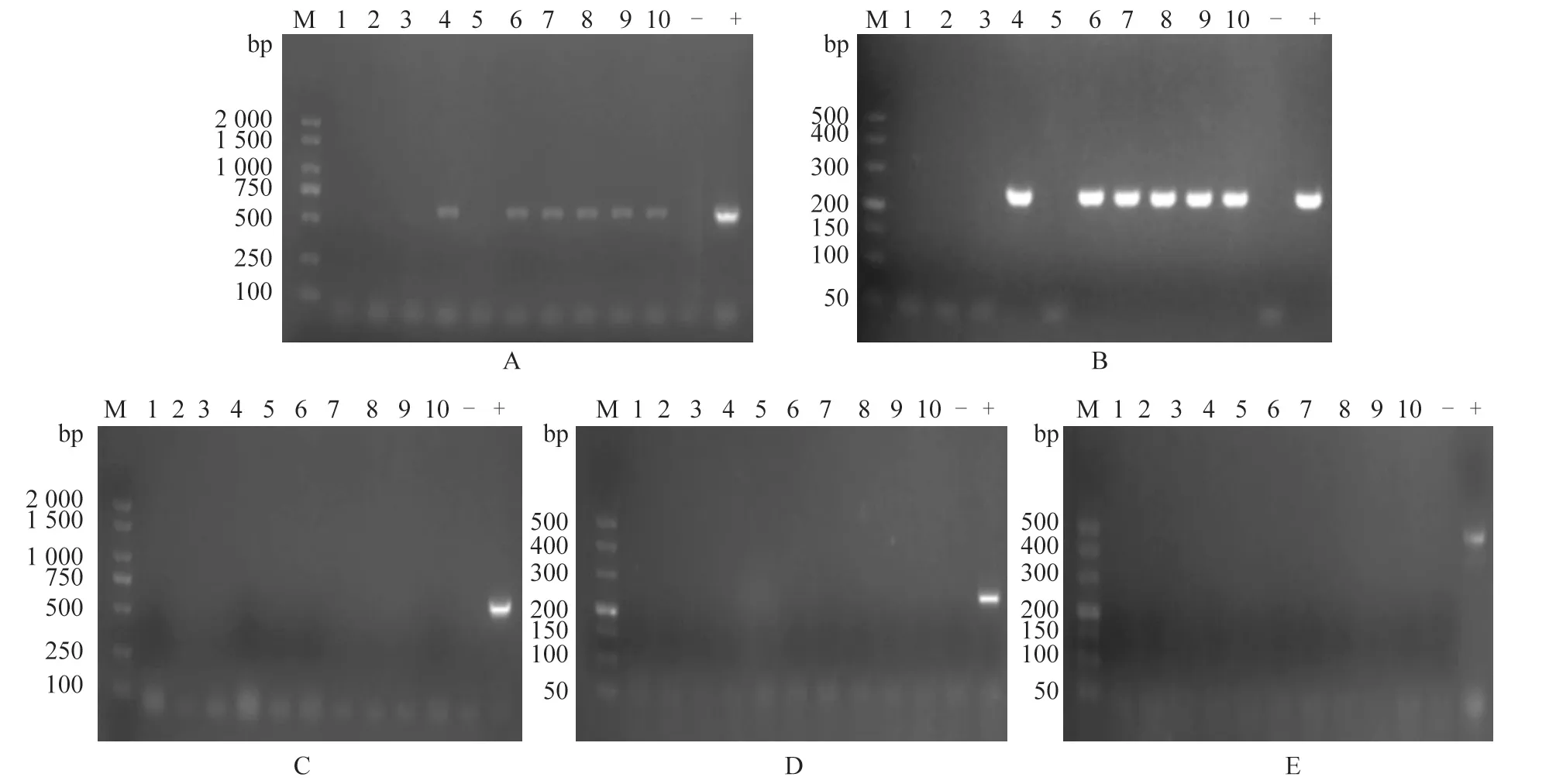
图2 PCR 检测结果
2.2 BPSV B2L 基因序列分析
成功从6 个BPSV 阳性样本中克隆出6 条BPSV 的B2L基因片段,分别命名为BPSV/SWUN01、BPSV/SWUN02、BPSV/SWUN03、BPSV/SWUN04、BPSV/SWUN05 和BPSV/SWUN06(GenBank登录号:ON469818—ON4698123),长度均为594 bp,编码198 个氨基酸;6 条核苷酸序列之间的同源性为99.30%~100%,氨基酸序列同源性为100%;与GenBank 数据库中所有BPSVB2L基因的核苷酸同源性为97.39%~99.33%,氨基酸同源性为100%。基于核苷酸建立的系统遗传进化树(图3)显示:本研究中扩增得到的6 条B2L基因序列位于两个不同的分支内,其中BPSV/SWUN01、BPSV/SWUN02和BPSV/SWUN03 单独聚为一个大支,而BPSV/SWUN04、BPSV/SWUN05 和BPSV/SWUN06 和孟加拉国的BSH07005 毒株遗传距离最近,但3条序列又聚集为独立的一个小分支。对扩增获得的B2L基因序列进行进一步分析发现,与BPSV/SWUN04、BPSV/SWUN05 和BPSV/SWUN06 相比,单独聚为一个大支的BPSV/SWUN01、BPSV/SWUN02 和BPSV/SWUN03 发生了4 个共有的无义突变(C292G、A304G、C415T 和G538C)。
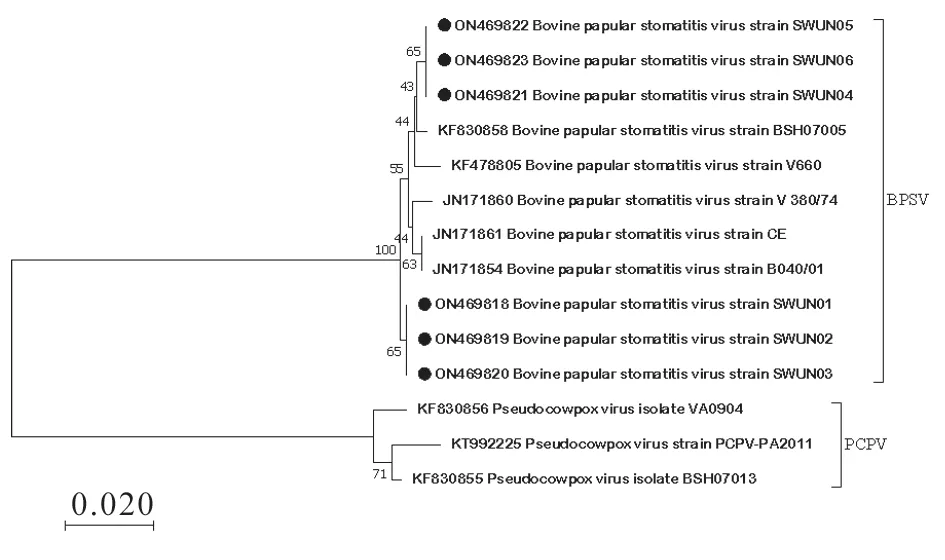
图3 BPSV 部分B2L 基因片段核苷酸进化树
3 讨论
BPSV 是导致犊牛口炎的重要病原,在世界有广泛的地域分布[2,5,16]。本研究从四川省某奶牛场患病犊牛采集的10 份犊牛口腔黏膜糜烂样本中检出6 例BPSV 阳性,其他病原未检出,结合发病犊牛临床症状,可以确诊该奶牛场发生的犊牛口腔黏膜糜烂病症是由BPSV 感染所致。国内关于BPS病例的报道涉及四川省、青海省、广西壮族自治区等多个地区,表明BPSV 在我国分布范围可能较广。牦牛和水牛均对BPSV 易感,但本研究发现奶牛也可感染BPSV。这可能意味着奶牛、牦牛和水牛等各种牛可能都对BPSV 易感。国内关于BPS 的流行病学资料和分子特征研究匮乏,并且在GenBank数据库中未见我国BPSV 毒株的基因序列资料。本研究将扩增的6 条BPSV 部分B2L基因序列上传于GenBank 数据库内,丰富了国内BPSV 毒株的资料。基于核苷酸建立的进化树显示,扩增的6条B2L序列分为两个分支,表明感染该场犊牛的BPSV 可能有两种不同的毒株。已有研究[6]表明,不同BPSV 毒株共感染将引起患畜表现出更严重的临床症状。另一项研究[9]从临床健康小牛身上采集了45 份口腔拭子进行BPSV 检测,结果有31 份样本检出阳性,阳性率为68.89%,表明亚临床感染的牛是BPS 的重要传染源,因此需要加强临床健康畜群的BPS 监测。
对成功获得的6 条长594 bp 的BPSVB2L基因序列进一步分析发现,与扩增获得的另外3 条序列相比,在进化树中单独聚为一个大支的BPSV/SWUN01、BPSV/SWUN02 和BPSV/SWUN03 毒株序列发生了4 个共有的无义突变(C292G、A304G、C415T 和G538C)。尽管目前关于BPSVB2L基因无义突变的生物学意义尚不清楚,但B2L基因是PPV 成员的检测靶基因,因此进一步开展BPSV 流行毒株B2L基因核苷酸遗传多样性研究,对国内建立BPSV 的特异性PCR 检测方法具有重要意义。

