河南省濮阳市犊牛腹泻大肠杆菌分离鉴定及生物学特性分析
赵朋宽
(南乐县农业农村局,河南南乐 457400)
犊牛腹泻是危害养牛业的主要疾病之一,临床中尤以细菌性腹泻最为常见,如大肠杆菌、沙门氏菌、巴氏杆菌、奇异变形杆菌等引起的腹泻,其中沙门氏菌和大肠杆菌危害最严重[1-3]。犊牛大肠杆菌病由不同血清型的致病性大肠杆菌引起,临床以腹泻、脱水、消瘦为主,呈地方性或散发性流行,10 日龄以内犊牛最易感,发病率和死亡率均较高,严重影响牛养殖业健康发展[4-6]。相关研究[7-8]表明,大肠杆菌抗原结构复杂,具有多种致病性血清型且无交叉保护性,无有效疫苗预防其感染,导致大肠杆菌病广泛发生与流行。细菌生物被膜(bacterial biofilm,BBF)是组成结构性细菌群落的主要物质,其形成能力与细菌毒力及耐药性具有一定相关性[9]。当前,犊牛大肠杆菌病主要用抗生素进行治疗,而抗生素的滥用,致使大肠杆菌耐药性增强,且出现了多重耐药菌株,因而加大了该病的治疗难度,同时大肠杆菌的耐药性和药物残留问题也威胁着人类健康[10-11]。
本试验采集243 份腹泻犊牛的肛拭子、粪便、肝脏等病料样品进行大肠杆菌分离鉴定,然后对致病性大肠杆菌进行致病性、血清型、生物被膜形成能力及耐药性等相关生物学特性检测,以期为该地区犊牛大肠杆菌性腹泻防治提供参考。
1 材料与方法
1.1 菌株来源
从2018—2020 年采集的243 份腹泻犊牛肛拭子、粪便、肝脏等病料样品中进行大肠杆菌分离鉴定,其中肛拭子样品96 份、粪便样品86 份、肝脏样品61 份。
1.2 主要材料
麦康凯培养基、96 孔细菌培养板、大肠杆菌显色培养基、营养肉汤,购自北京双旋微生物培养基制备科技公司;药物纸片,购自杭州天和微生物制剂有限公司;细菌生化试纸条,购自上海研晶生物科技有限公司;大肠杆菌O 抗原鉴定因子,购自中国兽医药品监察所;460 只体质量(25±2)g的昆明系小白鼠,购自北京维通利华实验动物有限公司。
1.3 细菌分离与培养
对腹泻犊牛样品处理后,无菌接种于麦康凯培养基进行鉴别培养;37 ℃恒温培养18~24 h 后,挑取单个菌落接种于大肠杆菌显色培养基;37 ℃培养12~18 h,再挑取单个菌落接种于营养肉汤纯化培养,然后进行镜检和生化试验。
1.4 致病性试验
参考文献[12]的方法,将分离菌株接种于营养肉汤中,200 r/min 37 ℃震荡培养2~4 h 至对数期,用平板计数法进行菌落计数;调整菌液浓度为107cfu/mL,每株分离菌株灌服4 只昆明系小鼠,剂量为0.25 mL,对照组给予等量的无菌生理盐水。试验期为7 d,试验期间观察小鼠发病情况,对死亡小鼠进行细菌分离鉴定。
1.5 细菌血清型检测
参考文献[7]方法,将分离菌株接种于普通营养琼脂培养斜面上,37 ℃培养12 h 后取出,在无菌条件下用无菌生理盐水洗脱灭菌管,121 ℃灭菌3 h,破坏分离菌株K 抗原、O 抗原鉴定因子后进行玻板凝集试验,用5%石碳酸作对照,对分离菌株进行血清型检测。
1.6 细菌生物被膜形成能力检测
参考文献[13]方法,在96 孔细菌培养板,加入190 μL 普通营养肉汤,然后接种10 μL 菌液,对照孔加200 μL 营养肉汤,37 ℃培养18 h;用PBS 洗涤3 次,用甲醛固定20 min;加入结晶紫染色5 min,PBS 洗涤烘干;每孔加入200 μL 95%乙醇洗脱30 min,用酶标仪测OD600,对分离菌株进行被膜形成能力测定。判定标准以阴性对照孔OD 的2 倍作为判断能否形成被膜的临界点ODc。当OD=ODc 时,表示被膜形成能力为0;当OD <ODc 时,表示被膜形成能力较弱;当ODc <OD ≤2ODc 时,表示被膜形成能力中等;当OD ≥2ODc 时,表示被膜形成能力较强。
1.7 药敏试验
参照美国临床实验室标准化协会(CLSI)2013 年推荐的标准药敏试验法[14]进行操作和试验结果判断。将分离菌株培养至对数期,调整菌液浓度为107cfu/mL,无菌条件下取100 μL 菌液均匀涂布在90 mm普通营养琼脂培养基中,贴上药敏纸片,每种药做3 个重复;37 ℃培养18 h 后,测定抑菌圈直径,取平均值。药物敏感性标准见表1。

表1 常用药物的药敏试验判定标准
2 结果
2.1 细菌分离培养
经麦康凯培养基、大肠杆菌显色培养基培养及镜检,从采集的243 份样品中分离到113 株符合大肠杆菌培养特性和形态学的细菌。
2.2 细菌生化试验
参照细菌生化试纸条说明书,对分离的疑似大肠杆菌菌株进行生化试验,结果分离的113 株细菌全部被鉴定为大肠杆菌,大肠杆菌平均分离率为46.5%(113/243),其中肛拭子样品的分离率为43.8%,粪便样品为45.3%,肝脏样品为52.5%(表2)。

表2 不同病料样品中的大肠杆菌分离情况
2.3 致病性试验
攻毒组小鼠在攻毒后2~4 d 出现发病情况,个别小鼠出现急性死亡。剖检死亡小鼠发现,肠道出血,肠黏膜脱落,肝、脾出现不同程度出血,且均分离到大肠杆菌,而对照组小鼠健康存活。经统计,引起小鼠发病的有9 株大肠杆菌,引起死亡的有78 株(表3),表明引起小鼠发病和死亡的87株大肠杆菌为致病性大肠杆菌。
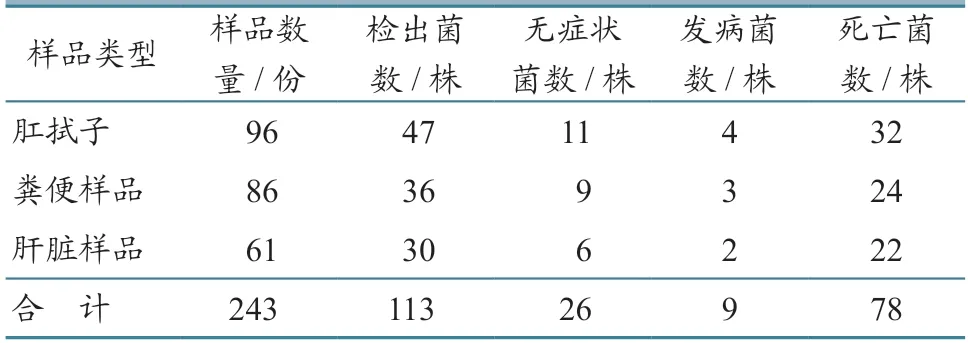
表3 大肠杆菌致病性试验结果
2.4 血清型检测
用玻板凝集试验对分离的87 株致病性大肠杆菌进行血清鉴定。结果(表4)显示:分离的致病性大肠杆菌分属于14 种血清型,分布在不同样品中,其中O101(18.4%)、O38(17.2%)和O142(14.9%)型占比较高,为该地区致犊牛腹泻的优势血清型。

表4 分离的致病性大肠杆菌血清型分布
2.5 生物被膜形成能力检测
分离的87 株犊牛源致泻性大肠杆菌中,膜形成能力较强的24株(26.6%),中等的34株(43.6%),较弱的17株(19.5%),不形成被膜的12株(15.4%),不同生物被膜形成能力的菌株分布在不同血清型中(表5)。

表5 分离的致病性大肠杆菌血清型和生物被膜形成能力相关性分析结果
2.6 药敏试验
药敏试验结果(表6)显示:分离的87 株致病性大肠杆菌对阿莫西林、氨苄西林、链霉素等6种药物的耐药率较高,为77.0%~98.9%,其次是对新霉素、庆大霉素、大观霉素等4 种药物,耐药率为49.4%~52.9%;对头孢噻呋、头孢噻肟、氟苯尼考等7 种药物的耐药率较低,为9.2%~26.4%。
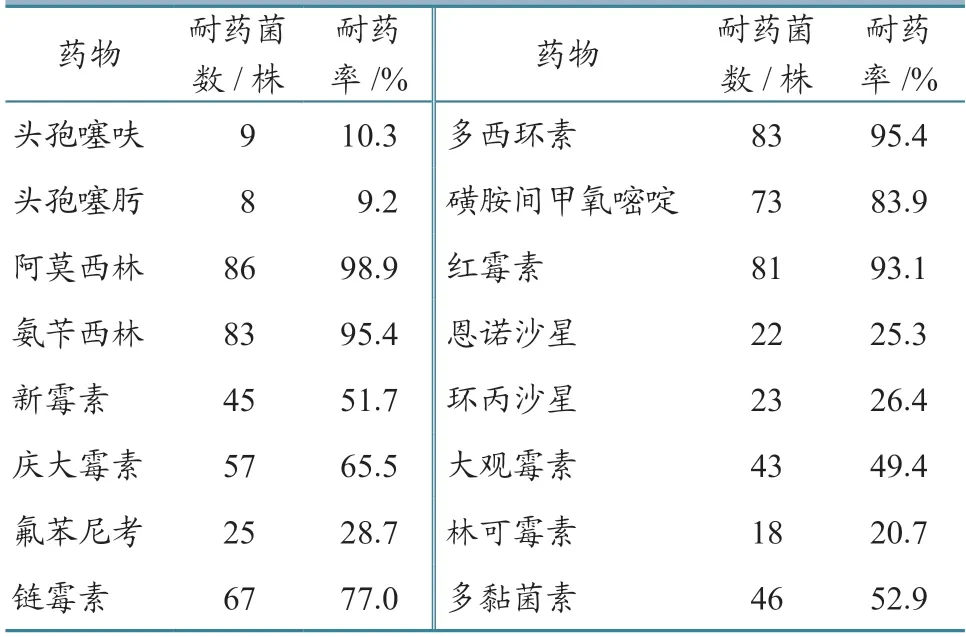
表6 药敏试验结果
3 讨论
国内外研究[15-16]表明,大肠杆菌是引起犊牛腹泻的主要的病原菌之一,引起的发病率和死亡率较高,对犊牛危害较大,严重影响养牛业发展。大肠杆菌为条件性致病菌,广泛存在于环境中,尤其是卫生较差的牛舍,当发生冷热等外在因素应激时,机体抵抗力下降,继而引起大肠杆菌病,因此,注意环境卫生及环境消毒也是有效防控大肠杆菌病的重要措施。致病性大肠杆菌在我国广泛分布,因此应做好控制,降低该疾病发病率[17-18]。本研究从濮阳市243 份腹泻犊牛病料中分离到87 株致病性大肠杆菌,分离率为35.8%,说明致病性大肠杆菌可能在该地呈地方性流行。大肠杆菌血清型多样化,同一宿主不同地区,其优势血清型分布也存在一定差异。吴孟等[19]报道,巴州地区犊牛腹泻大肠杆菌血清型以O78、O111 为主;史量全等[20]报道,内蒙古地区犊牛腹泻大肠杆菌血清型主要为O132 型;高海慧等[11]报道,宁夏地区犊牛腹泻大肠杆菌的优势血清型是O20 和O26。而本研究发现,濮阳市犊牛致病性大肠杆菌优势血清型为O38(17.2%)、O101(18.4%)和O142(14.9%)。因此,各地应根据当地的优势血清型研制相应血清型的疫苗,如濮阳市可以研制O38、O101 和O142血清型多价疫苗。本研究为研制该地区犊牛腹泻性大肠杆菌疫苗提供了参考。
研究[8-9]表明,细菌生物被膜可以抵抗外界不利环境因素,其形成是细菌的一种自我保护机制。本研究发现,分离的87 株致病性大肠杆菌中,膜形成能力强的 24 株,中等的34 株,占66.7%。张召兴等[13]报道,河北省蛋鸡源大肠杆菌具有生物被膜形成能力;麻海澜等[18]报道,内蒙古地区犊牛源大肠杆菌具有生物被膜形成能力。综合上述报道与本研究结果,说明各地的致病性大肠杆菌外界生存能力均较强。因此,在养殖过程中,对于环境消毒,可考虑不同种类消毒药交替使用,以减少环境中大肠杆菌对消毒药的耐药性。
在临床防治大肠杆菌病过程中,不合理使用抗菌药物现象较多,导致大肠杆菌出现较强的耐药性,且耐药性在不同菌株之间传播,导致大肠杆菌耐药性加重[4-5]。麻海澜等[18]报道,内蒙古地区分离的51 株犊牛源大肠杆菌对甲氧苄啶、磺胺嘧啶、氨苄西林等20 种药物产生耐药性;高海慧等[11]报道,宁夏地区犊牛腹泻大肠杆菌的耐药率高,多重耐药普遍,耐药现象严重;石凯元等[21]报道,湘西北地区某肉牛养殖场犊牛腹泻性大肠杆菌对22种药物产生了耐药性。本研究发现,分离的87 株致病性大肠杆菌对阿莫西林、氨苄西林、链霉素等10 种药物的耐药率较高,均在49.4%以上。上述研究结果说明,犊牛腹泻性大肠杆菌耐药性普遍,应该引起重视。不同地区的大肠杆菌耐药谱并不相同,这可能与不同地区使用的抗生素种类不同有关。因此,在临床治疗犊牛腹泻大肠杆菌病过程中应注意抗生素的合理使用,结合药敏试验科学用药。

