高纤维蛋白原血症与急性缺血性脑卒中患者静脉溶栓预后的相关性研究
金天宇,曹方正,张哲宇,黄 薇,徐良额,江秉泽,徐 彬
脑卒中具有高致残性、高复发率和高死亡率的特点,其中急性缺血性脑卒中(acute ischemic stroke,AIS)占比达75%[1,2]。目前,对于AIS最有效的治疗手段为早期再灌注治疗,起病4.5 h内的AIS患者接受重组组织型纤溶酶原激活剂(recombinant tissue plasminogen activator,rt-PA)静脉溶栓治疗已经成为国内外指南均推荐的一线治疗手段[3]。
纤维蛋白原(fibrinogen,FIB)又称凝血因子I,是参与体内凝血与止血过程中重要的糖蛋白。目前大多数研究将高纤维蛋白原血症(hyperfibrinogenemia)定义为血浆纤维蛋白原水平≥4 g/L[4]。既往大型荟萃研究表明血浆FIB水平的升高是心脑血管事件的独立危险因素[5]。此外,有研究表明接受静脉溶栓治疗的患者因rt-PA激活纤溶酶原转化为纤溶酶,导致血浆FIB水平急剧波动,加重患者症状性颅内出血(symptomatic hemorrhagic transformation,sICH)的风险[6]。然而,目前关于高纤维蛋白原血症对静脉溶栓患者预后的影响的研究仍较少。因此,本研究旨在分析接受rt-PA静脉溶栓治疗的AIS患者相关数据,明确高纤维蛋白原血症与预后的相关性,为今后AIS患者静脉溶栓决策以及早期预后判断提供理论依据。
1 资料和方法
1.1 研究对象 本研究为回顾性分析,连续收集2018年8月-2021年12月期间在浙江省人民医院神经内科发病4.5 h内接受rt-PA静脉溶栓的AIS患者327例的临床和影像学资料。纳入标准参照《中国急性缺血性脑卒中诊治指南2018》[7]:(1)存在有神经功能缺损症状,并诊断为AIS;(2)年龄≥18岁;(3)头部CT排除颅内出血;(4)静脉溶栓后24 h完成头部CT平扫复查或72 h内完成头部MRI检查;(5)患者及其家属签署rt-PA静脉溶栓知情同意书。排除标准:(1)存在《中国急性缺血性脑卒中诊治指南2018》中静脉溶栓禁忌者;(2)静脉溶栓前改良Rankin量表(modified rankin scale,mRS)评分≥2分者;(3)合并有严重的心、肝、肾功能不全者;(4)合并有感染性疾病、恶性肿瘤、血液系统疾病、结缔组织疾病者;(5)不能完成电话随访者。本研究符合2013年修订的《赫尔辛基宣言》(www.wma.net/en/30publications/10policies/b3/index.html)要求。
1.2 方 法
1.2.1 资料收集 (1)基线资料:收集患者一般临床资料:包括人口学资料(年龄、性别、身高、体重)、既往史(高血压病、糖尿病、高脂血症、心房颤动、既往卒中或短暂性大脑缺血发作(transient ischemic attack,TIA)病史、抗血小板药物使用史、抗凝药物使用史等)、基线临床特征[血压、血糖、血小板、FIB、活化部分凝血活酶时间(activated partial thromboplastin time,APTT)、凝血酶原时间(prothrombin time,PT)、就诊至接受溶栓时间(door-to-needle time,DNT)、发病至接受溶栓时间(onset-to-needle time,ONT)、美国国立卫生院神经功能缺损评分(national institute of health stroke scale,NIHSS)]、影像学检查评估(梗死部位、出血转化、脑水肿)及90 d随访资料。(2)预后评估:采用 NIHSS 评分评估患者溶栓后 24 h、7 d、出院时的早期神经功能改善情况,采用90 d mRS评估患者远期神经功能转归情况。(3)病因学根据 TOAST(trial of ORG 10172 in acute stroke treatment)标准对AIS亚型进行分类。
1.2.2 治疗方法 应用德国勃林格殷格翰公司生产的rt-PA进行静脉溶栓治疗。静脉溶栓治疗时剂量为0.9 mg/kg,最大剂量为90 mg。使用时先静脉推注10%剂量,剩余剂量在60 min内持续微泵静脉泵入。
1.3 观察指标 (1)90 d mRS:mRS≤2分定义为预后良好;mRS>2定义为预后不良;6分定义为死亡;(2)NHISS评分:包括基线 NHISS评分、24 h NHISS评分和7 d NIHSS评分;(3)早期神经功能改善:溶栓后24 h内NIHSS评分改善≥4分或24 h NIHSS评分为0分;(4)出血转化定义:AIS患者静脉溶栓后出血转化通过24 h内复查头部CT或72 h内头部MRI影像结果进行评估是否发生出血转化,根据ECASS Ⅱ(european cooperative acute stroke study)标准分为两种类型:①出血性梗死(hemorrhagic transformation,HT):沿着梗死区边缘的点状出血,或梗死区内片状且无占位效应的出血;②脑实质出血(parenchymal hemorrhage,PH):伴有占位效应的血肿形成,或梗死区远隔部位的出血。sICH定义为患者静脉溶栓治疗后24 h内引起患者神经系统功能恶化(NIHSS评分增高≥4分)的脑实质出血;(5)脑水肿评分:根据CT或MRI将脑水肿程度评分为0~6分,0分:无脑肿胀;1分:皮质沟消失;2分:同侧皮质沟消失及侧脑室轻度消失;3分:同侧皮质沟消失及侧脑室完全消失;4分:同侧皮质沟消失以及侧脑室、第三脑室消失;5分:中线移位;6分:中线移位及基底池消失。轻度水肿:0~2分;重度水肿:3~6分。

2 结 果
急性缺血性卒中患者的临床资料327例患者中男性227例(69.42%),女性100例(30.58%);年龄(67.82±13.99)岁,范围23~97岁;BMI指数(23.84±3.54),范围13.52~33.39;既往高血压病史213例(65.14%)、糖尿病病史73例(22.32%)、血脂异常病史117例(35.78%)、房颤病史64例(19.57%)、卒中或TIA病史57例(17.43%);静脉溶栓前NIHSS评分3(2~7);TOAST病因学分型:大动脉粥样硬化型115例(35.17%)、心源性栓塞型60例(18.35%)、小动脉闭塞型109例(33.33%)、其他病因型4例(1.22%)、不明原因型39例(11.93%);梗死位置:前循环218例(66.67%)、后循环68例(20.79%)、两者均有41例(12.54%),DWI阴性32例(9.79%)。静脉溶栓后早期功能改善138例(42.20%),PH型出血转化14例(4.28%),sICH 25例(7.64%)。出院90 d预后良好264例(80.73%)。
高纤维蛋白原血症组与非高纤维蛋白原血症组基线临床资料比较 与非高纤维蛋白原血症组比较,高纤维蛋白原血症组基线FIB水平以及既往饮酒史均较高,差异有统计学意义(P<0.05)。余基线临床资料的差异均无统计学意义(P>0.05)(见表1)。
高纤维蛋白原血症组与非高纤维蛋白血症组结局指标比较 与非高纤维蛋白原血症组比较,高纤维蛋白原血症组预后不良比例均较高,差异有统计学意义(P<0.05),早期神经功能改善、PH型出血转化、sICH、重度脑水肿及死亡比例的差异均无统计学意义(P>0.05)(见表2)。
预后良好组与预后不良组患者间临床资料比较 与预后良好组相比,预后不良组年龄较大,DNT较长,FIB较高,小动脉闭塞型及早期神经功能改善比例均较低,抗凝药物使用、大动脉粥样硬化型、心源性栓塞型、PH型出血转化、sICH及重度脑水肿比例均较高,差异均有统计学意义(P<0.05),其余的临床资料差异均无统计学意义(P>0.05)(见表3)。
急性缺血性卒中患者静脉溶栓治疗后预后不良的独立影响因素,将单因素分析中P<0.05的变量纳入多因素Logistic回归,结果显示:基线FIB(OR=0.566,95%CI0.368~0.872,P<0.05)、7 d NIHSS评分(OR=0.638,95%CI0.490~0.831,P<0.05)是AIS静脉溶栓患者预后不良的独立影响因素(见表4)。

表1 高纤维蛋白原血症组患者与非高纤维蛋白原血症组临床资料的单因素分析

表2 高纤维蛋白原血症组与非高纤维蛋白原血症组临床结局指标的单因素分析

表3 预后良好组与预后不良组患者间临床资料的比较
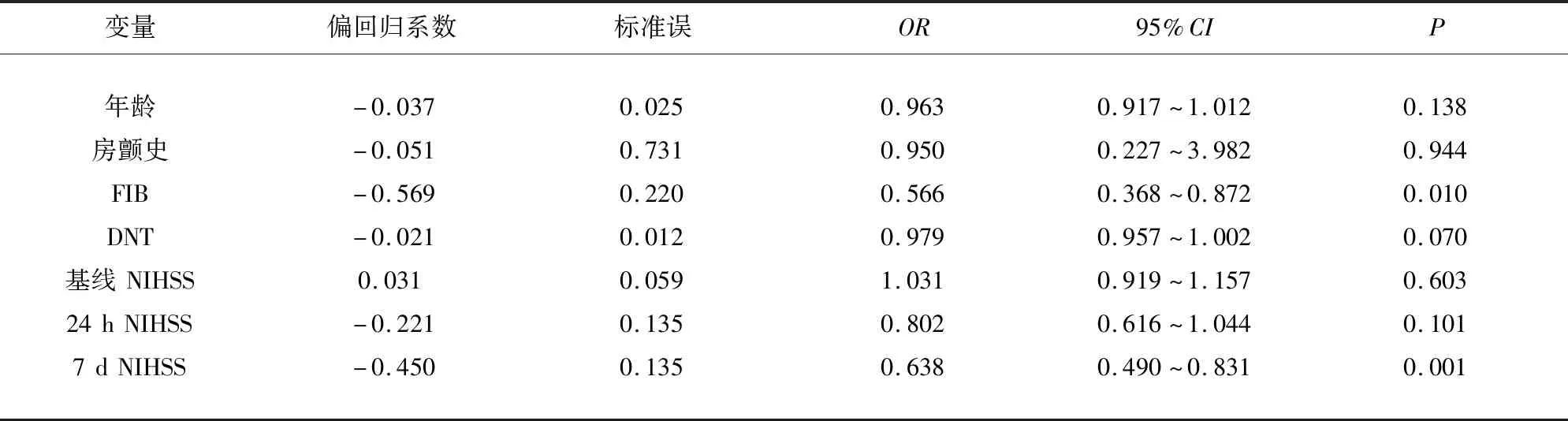
表4 急性缺血性脑卒中静脉溶栓患者预后的二元Logistic回归分析
3 讨 论
对于在时间窗内的AIS患者而言,早期进行rt-PA静脉溶栓治疗可以显著改善患者预后,为国内外AIS指南均推荐的一线治疗方案[3,7]。然而,个体对rt-PA治疗的反应各不相同,可能与年龄、基线NIHSS评分、基线血压、糖尿病和梗死面积等相关[8],但大多数研究均没有考虑到凝血因子的作用。
FIB作为血浆中含量最高的凝血蛋白,在机体的凝血系统、血小板聚集和红细胞黏着中起到关键作用。You等人纳入了3 212名AIS的患者,发现高纤维蛋白原血症的患者住院死亡风险增加1.76倍,在亚组分析中同样也提示了高纤维蛋白原血症与住院死亡率有着显著的相关性[9]。Swarowska等人随访时间达10余年的前瞻性研究发现入院时高水平FIB与AIS患者远期不良预后以及死亡率有关。此外,该类人群在卒中后数月,FIB仍处于较高的水平,这可能与患者的FIB基因β链G455A多态性相关[10]。目前在亚洲人群中高纤维蛋白原血症的AIS患者进行rt-PA静脉溶栓研究尚缺乏。
本研究结果显示,溶栓前FIB是静脉溶栓患者不良预后的独立影响因素,FIB水平越高,静脉溶栓患者的预后越差。其引起预后不良的具体机制现不明确,可能原因如下:首先,因纤维蛋白原特异性不完全,rt-PA也可以攻击循环中的FIB,高纤维蛋白原血症循环中FIB过高,可能会降低rt-PA的有效性。其次,在部分高纤维蛋白原血症患者中存在结构异常的FIB,这使得纤溶酶原无法有效切割FIB,进一步降低rt-PA的疗效。另外,高水平的FIB会增加机体的血液黏度,促进炎症反应,加速红细胞与血小板的黏附聚集,同时也可使血栓中的纤维蛋白含量提高,增加血栓的密度,不利于血栓的溶解。此外,高纤维蛋白原血症提示着机体高凝状态,增加卒中复发可能,对患者远期预后产生不良影响[11]。目前关于高纤维蛋白原血症与静脉溶栓患者远期预后的研究较少。Li等人纳入了176例AIS经过静脉溶栓治疗后的患者,发现入院时FIB升高与14 d时预后不良显著相关。在校正混杂因素后,仍然发现两者具有显著相关性[12]。此外,早年Tanne等人发现经过rt-PA静脉溶栓治疗后高FIB水平与患者90 d死亡率有着显著的相关性,但未发现其他因素与死亡率相关[13]。综上所述,高纤维蛋白原血症可作为预测rt-PA静脉溶栓效果不佳的依据。
虽然高纤维蛋白原血症是AIS患者静脉溶栓不良预后的独立影响因素,但是本研究结果表明其对出血转化无明显影响。基线FIB水平与静脉溶栓治疗后sICH与PH型出血转化没有显著的关联,这与之前的研究结果一致[14]。然而,Matosevic等人纳入了547例接受静脉溶栓治疗的AIS患者进行研究,结果发现“早期纤维蛋白原耗竭性凝血病”(溶栓后2 h纤维蛋白原消耗≥200 mg/dl)的患者发生颅内出血或严重全身出血事件的概率为8.6%,相较对照组风险升高4.53倍。同时,该研究也证实“早期纤维蛋白原耗竭性凝血病”为严重出血风险的独立危险因素[15]。此外,Yan等人前瞻性研究发现“早期纤维蛋白原耗竭性凝血病”的患者与sICH相关,但并非是出血风险的独立危险因素[6]。其出血转化的机制可能与FIB被切割成具有减弱纤维蛋白聚合以及破坏血小板功能相关的X、Y、D和E片段[16]。
本研究还发现7 d NIHSS评分是患者的独立影响因素,7 d NIHSS评分越高,患者的预后越差。NIHSS评分作为评估神经功能缺损的常用评估量表之一,可以一定程度上反应AIS患者病情的严重程度。目前,NIHSS评分已经广泛应用于预测患者静脉溶栓早期神经功能恢复以及远期预后的评估,指导住院期间护理工作以及后期患者的康复治疗[17,18]。
综上所述,高纤维蛋白原血症与AIS静脉溶栓不良预后相关。同时本研究证实了高水平血浆FIB、7 d NIHSS评分为患者远期不良预后的独立影响因素。需要指出的是,本研究为回顾性分析,并非每一位患者均有溶栓前可用的FIB数据,因此可能存在患者选择偏倚。其次,溶栓前后FIB变化水平是否也能提示预后,可能需要在溶栓后多个准确时间点测定血浆FIB水平进行研究。FIB数据简单易得,且测量的重复性、稳定性好,对临床医师早期进行预后的判断以及治疗的决策会提供一定的帮助。另外,高水平FIB可能为AIS的潜在治疗方向。患者可通过饮食调整、戒烟戒酒、体育锻炼和一些药物来降低FIB的水平,进而达到改善患者预后的作用。

