载脂蛋白B与载脂蛋白A-Ⅰ比值联合颈动脉内膜-中层厚度预测急性脑梗死价值研究
匡俊鑫,刘志强,韩登峰
急性脑梗死(acute cerebral infarction,ACI),即急性缺血性脑卒中,是各种原因导致脑组织不同程度的缺血、缺氧,进而发生局部脑组织的坏死,并导致相应的神经功能损伤表现的一种疾病。由于脑损伤已无法完全逆转,多数患者会留下不同程度的后遗症,对个人、家庭、社会经济发展造成了沉重的负担。目前针对缺血性脑卒中,最常用的分型标准是比较类肝素药物治疗急性缺血性卒中实验分型(trial of org 10172 in acute stroke treatment,TOAST)[1]。而不同的卒中类型的危险因素、发病机制、治疗和预后存在差异,充分评估每种类型的危险因素和发病风险,并实施相应的预防措施至关重要。其中大动脉粥样硬化型(large-artery atherosclerosis,LAA)是ACI主要的临床类型,它占据到所有类型的40.0%~60.9%,临床症状及影像学主要表现为脑的大动脉或其皮质分支>50%的狭窄或堵塞,颈部动脉粥样硬化病变和斑块破裂是它的重要病因[2,3]。
动脉粥样硬化涉及脂蛋白内膜下的滞留与聚集、内皮细胞的损伤、巨噬细胞的趋化与泡沫细胞的形成、平滑肌细胞的迁移与改变等多个过程。血脂异常是动脉粥样硬化重要的危险因素,甘油三酯、低密度脂蛋白胆固醇的增高和(或)高密度脂蛋白胆固醇的降低与动脉粥样硬化心脑血管疾病的发病风险的升高存在关联[4]。循环中的血脂大部分须与载脂蛋白(apolipoprotein,apo)结合方可被运输和参与代谢。其中载脂蛋白B(apolipoprotein B,apoB)参与构成乳糜微粒、低密度脂蛋白胆固醇、脂蛋白a等多种具有致动脉粥样硬化作用的胆固醇酯[5]。而载脂蛋白A-Ⅰ (apolipoproteinA-Ⅰ,apoA-Ⅰ)则主要参与构成具有抗动脉粥样硬化作用的高密度脂蛋白胆固醇[6]。apoB与apoA-Ⅰ比值被认为在预测心肌梗死、卒中等心血管风险上比传统血脂指标更具有优势,并与颈动脉的内膜-中层厚度(carotid intima-media thickness,CIMT)密切相关[7,8]。目前关于apoB与apoA-Ⅰ比值在预测脑梗死发病风险的研究仍较少,而构成比值的两个指标属于实验室常规检测项目,且通过颈动脉超声测量CIMT具有无创、简便、经济等特点,适用于大规模社区筛查。本研究旨在探讨apoB与apoA-Ⅰ比值、CIMT与前循环的大动脉粥样硬化型脑梗死的相关性,并评估其在预测发病风险上价值,为脑梗死高危人群的早期预防提供科学证据。
1 资料与方法
1.1 研究对象 选取2020年7月-2021年6月在新疆医科大学第一附属医院神经内科住院的急性脑梗死患者作为病例组。随机选取同期住院的非心脑血管疾病患者作为对照组,主要包括前庭周围性眩晕、紧张型头痛、特发性震颤、躯体形式障碍、抑郁状态等患者。卒中组纳入标准:(1)年龄>18周岁;(2)符合《中国急性缺血性脑卒中诊治指南2018》[9]诊断标准,并经头部影像学证实具有责任缺血灶;(3)符合TOAST[1]分型中大动脉粥样硬化型的诊断要点,且责任缺血灶位于颈内动脉系统(前循环);(4)首次发病,发病24 h内入院,既往无脑血管疾病史;(5)病史及临床资料完整。病例组排除标准:(1)既往有自身免疫性疾病,或长期服用激素、免疫抑制药物;(2)发病前2 w内有明确的呼吸道、消化道或其它部位的感染史;(3)存在血液系统、内分泌系统疾病,恶性肿瘤,严重的肝、肾等器质性疾病;(4)具有严重缺血性心肌病、心脏瓣膜疾病、心房颤动、先天性心脏疾病等心脏疾病史。对照组纳入标准:既往无心脑血管疾病史,年龄>18周岁,头部影像学证实颅内未见明显异常。对照组排除标准参照观察组。研究符合2013年修订的《赫尔辛基宣言》,所有研究对象均被提前告知参与研究,并签署知情同意书。
1.2 研究方法
1.2.1 资料的收集 收集所有研究对象的人口统计学特征及病史资料,包括性别、年龄、身高、体重、吸烟史、饮酒史、高血压、2型糖尿病、心脏疾病等。收集的实验室资料中,血常规类包括红细胞计数(red blood cell,RBC)、红细胞分布宽度(red blood cell distribution width,RDW)、白细胞计数(white blood cell,WBC)、血小板计数(platelet count,PLT);血脂类指标包括甘油三酯(triglyceride,TG)、总胆固醇(total cholesterol,TC)、游离脂肪酸(free fatty acid,FFA)、低密度脂蛋白胆固醇(low density lipoprotein cholesterol,LDL-C)、高密度脂蛋白胆固醇(high density lipoprotein cholesterol,HDL-C)、apoA-Ⅰ、apoB、脂蛋白a[Lipoprotein-a,Lp(a)];肝功类指标包括总胆红素(total bilirubin,Tbil)、直接胆红素(direct bilirubin,Dbil)、间接胆红素(indirect bilirubin,I-Bil)、总胆汁酸(total bile acid,TBA)、血清胱抑素C(Cystatin C,CysC)、白蛋白/球蛋白比例(albumin /globulin ration,A/G);肾功类指标包括血尿素氮(blood urea nitrogen,BUN)、肌酐(creatinine,Cre)、肾小球滤过率(glomerular filtration rate,GFR)、尿酸(Uric Acid,UA);凝血功能类指标包括血浆纤维蛋白原(fibrinogen,FIB)、D-二聚体(D-Dimer)、纤维蛋白原降解产物(fibrinogen degradation products,FDP);其余还包括糖化血红蛋白(glycosylated hemoglobin,HbAlc)、同型半胱氨酸(homocysteine,Hcy)等。研究对象于入院的次日清晨抽取外周静脉血进行实验室检查,并于采血前8 h禁食、禁水。收集的辅助检查包括心脏超声、颈部血管超声、头部CT和(或)MRI等,均在研究对象入院48 h内完成。其中CIMT采用的是脑梗死责任病灶同侧颈动脉最大测量值。
1.2.2 仪器与设备 血常规采用日本SYSMEX公司生产的XE-2100型血细胞分析仪检测;血液生化指标采用日立7600型全自动生化分析仪;糖化血红蛋白检测使用伯乐D10糖化血红蛋白分析仪,试剂为伯乐配套试剂;同型半胱氨酸检测方法为酶循环法,检测仪器和配套试剂为美国公司生产的贝克曼DXC800全自动生化分析仪和配套试剂;均严格按照标准流程进行测定和分析。颈部血管超声使用Philips iE33彩色超声诊断仪,参数设置探头频率为5~10 MHz,受检者取仰卧位头偏向检测血管对侧,常规对颈总动脉起始段至颈内动脉颅外段进行横向、纵向检测,详细记录斑块情况,计算内膜-中层厚度及狭窄程度。

2 结 果
2.1 病例组与对照组一般资料比较 本研究最终纳入143例卒中患者和122例非卒中患者。病例组男82例,女61例,平均年龄为(64.99±13.67)岁;对照组男61例,女61例,平均年龄为(60.65±11.61)岁,两组的性别、体重指数差异无统计学意义(P>0.05)。病例组的年龄、吸烟、过度饮酒、高血压、糖尿病比例及CIMT高于对照组,差异有统计学意义(P<0.05)。实验室指标中,RBC、WBC、FFA、LDL-C、apoB、apoB/apoA-Ⅰ、Tbil、Dbil、I-Bil、Cre、D-二聚体、FDP、HbAlc、Hcy的水平比较,显示为病例组高于对照组,差异有统计学意义(P<0.05);apoA-Ⅰ、A/G、GFR的水平比较,显示为病例组低于对照组,差异有统计学意义(P<0.05)。病例组与对照组其余实验室指标水平比较,差异无统计学意义(P>0.05)(见表1)。
2.2 急性脑梗死的相关影响因素分析 采用单因素和多因素Logistic回归分析各变量与急性脑梗死的关系。分析结果显示吸烟、糖尿病、CIMT、WBC、FFA、apoB/apoA-Ⅰ、D-二聚体、Hcy是急性脑梗死的独立危险因素(见表2)。
2.3 apoB/apoA-Ⅰ与急性脑梗死发病风险的关系 按照apoB/apoA-Ⅰ的4分位数将研究对象分为4等份,依次为第1分位数水平至第4分位数水平。未调整其它因素时,与第1分位数水平相比,第4分位数水平的(OR=5.007,95%CI2.352~10.659,P<0.05)。在调整吸烟史、高血压、糖尿病等因素后,与第1分位数水平相比,第4分位数水平的(OR=3.605,95%CI1.008~12.889,P<0.05)。整体来看,随着apoB/apoA-Ⅰ升高,OR呈增加趋势,提示apoB/apoA-Ⅰ升高增加了急性脑梗死的发病风险(见表3)。
2.4 CIMT与急性脑梗死发病风险的关系 按照颈动脉内膜-中层厚度的4分位数将研究对象分为四等份,依次为第1分位数水平至第4分位数水平。未调整其它因素时,与第1分位数水平相比,第3分位数水平、第4分位数水平的(OR=4.300,95%CI2.074~8.917,P<0.05)、OR=6.765,95%CI3.162~14.472,P<0.05)。在调整吸烟史、高血压、糖尿病等因素后,与第1分位数水平相比,第4分位数水平的(OR=3.568,95%CI1.057~12.038,P<0.05)。整体来看,随着CIMT升高,OR也呈增加趋势,提示CIMT升高增加了急性脑梗死的发病风险(见表4)。
2.5 apoB与apoA-Ⅰ比值、CIMT对急性脑梗死发病的预测价值 利用ROC曲线分析不同指标对急性脑梗死的预测价值。apoB预测ACI发病风险的最佳截断值为0.925,灵敏度为46.9%,特异性为71.3%,AUC=0.601(95%CI0.534~0.669)。apoB与apoA-Ⅰ比值预测ACI发病风险的最佳截断值为0.867,灵敏度为37.8%,特异性为87.7%,AUC=0.645(95%CI0.579~0.710)。LDL-C与HDL-C比值预测ACI发病风险的最佳截断值为2.357,灵敏度为62.9%,特异性为48.4%,AUC=0.566(95%CI0.497~0.635)。利用配对法(Delong)比较AUC的差异,结果显示apoB与apoA-Ⅰ比值的AUC要分别高于apoB以及LDL-C与HDL-C比值,差异有统计学意义(P<0.05)。提示相较于apoB、LDL-C/HDL-C,apoB与apoA-Ⅰ比值对急性脑梗死具有更好的预测价值(见图1)。
IMT预测ACI发病风险的最佳截断值为1.750,灵敏度为74.1%,特异性为62.3%,AUC=0.711(95%CI0.649~0.774)。其与apoB/apoA-Ⅰ组成的联合预测因子的最佳截断值为0.466,灵敏度为81.8%,特异性为58.2%(AUC=0.757,95%CI0.699~0.816)。比较联合预测指标、apoB/apoA-Ⅰ、CIMT三者AUC的差异,结果显示联合预测因子的AUC分别高于其余两者,差异有统计学意义(P<0.05);而apoB/apoA-Ⅰ、CIMT两者的AUC比较,差异无统计学意义(P>0.05)。提示相较于apoB与apoA-Ⅰ比值、颈动脉内膜-中层厚度,其组成的联合预测因子对急性脑梗死具有更好的预测价值(见图2)。
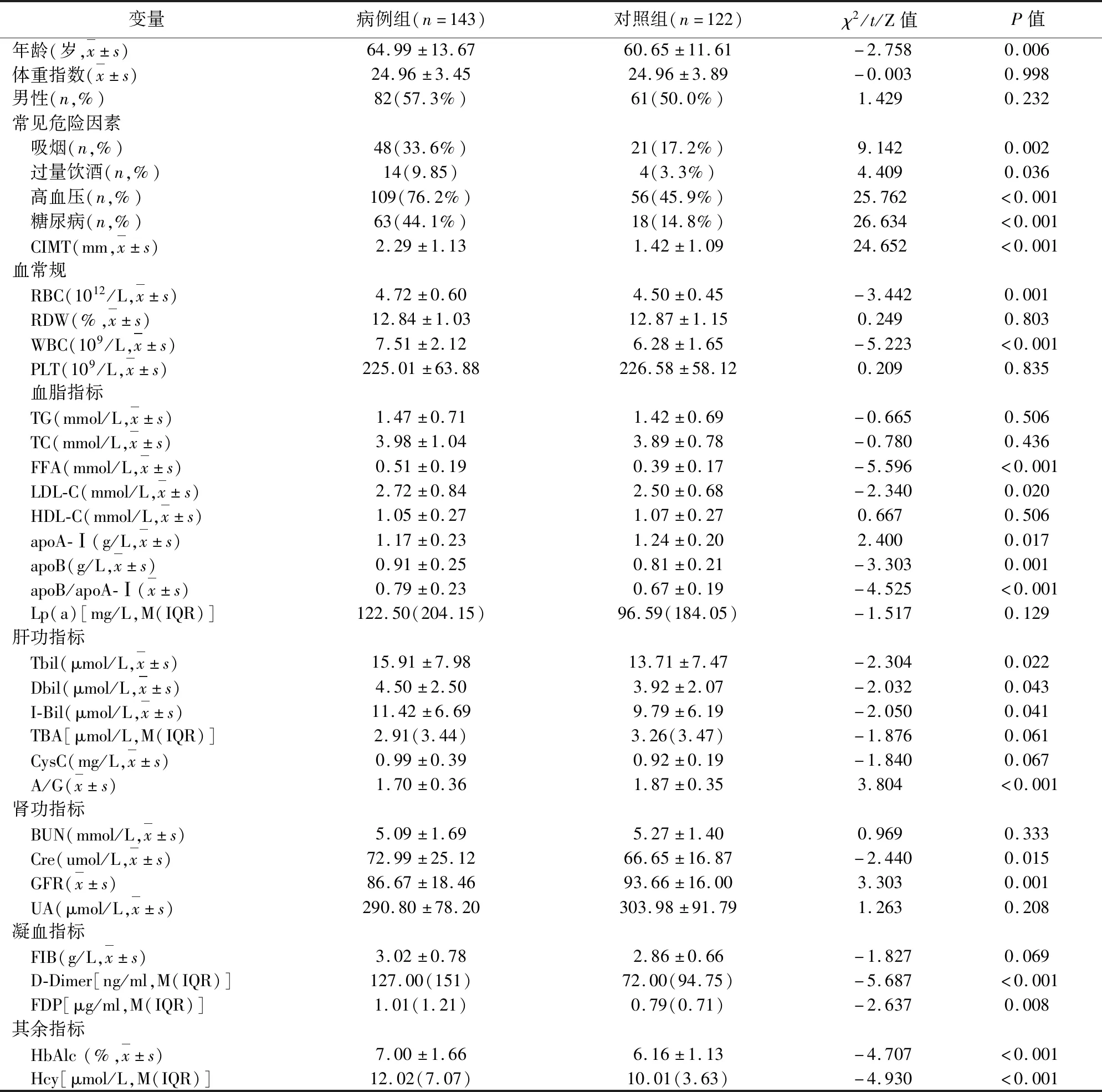
表1 病例组与对照组一般资料比较

表2 急性脑梗死的影响因素二元Logistics回归分析
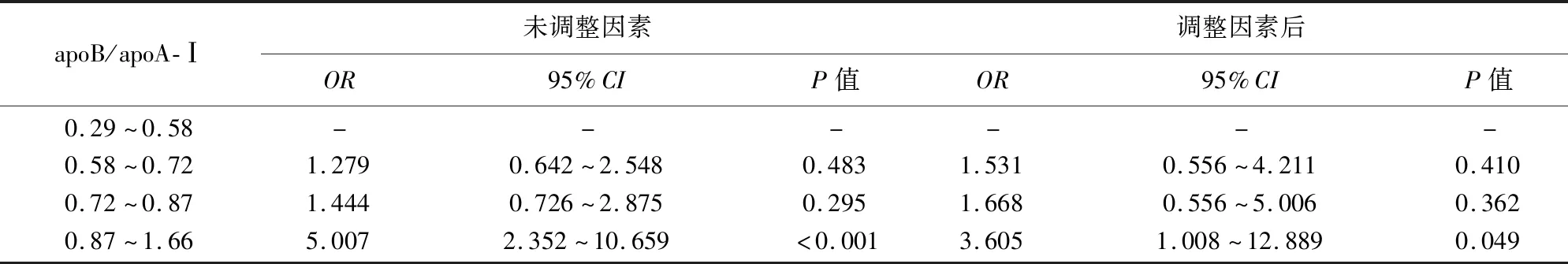
表3 apoB与apoA-Ⅰ比值与急性脑梗死之间的关系
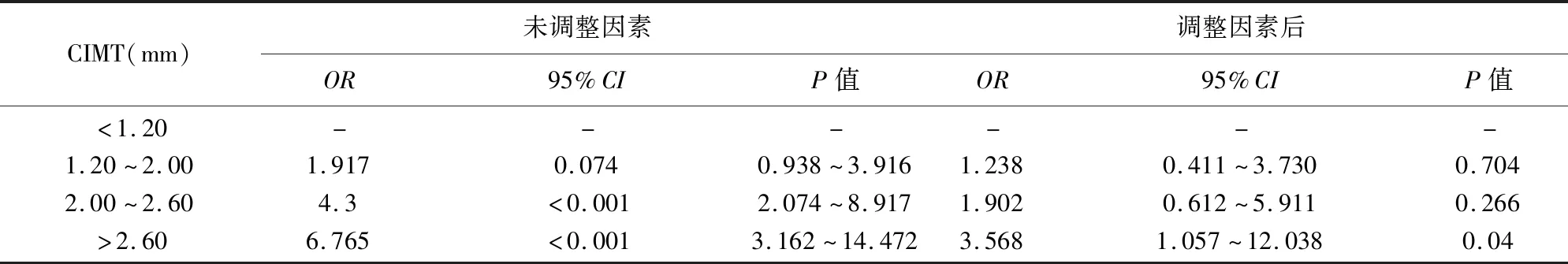
表4 颈动脉内膜-中层厚度与急性脑梗死之间的关系

图1 apoB与apoA-Ⅰ比值预测急性脑梗死的ROC曲线

图2 联合预测因子预测急性脑梗死的ROC曲线
3 讨 论
脑梗死是动脉粥样硬化这一全身疾病在脑部的表现,颅内动脉及颈内动脉颅外段的动脉粥样硬化是发病的基础,它们的狭窄程度和斑块脆弱性与脑梗死的发生密切相关[10]。粥样斑块的病理表现为在病变的动脉内膜下聚集大量胆固醇等脂质成分和细胞坏死物,同时伴有泡沫细胞、淋巴细胞的浸润。相较于颅内的小动脉,颈动脉等脑部大动脉的血管壁结构更利于脂质内膜下沉积,导致血管狭窄和不稳定斑块的形成,它们的粥样硬化病变增加了缺血性卒中的发生风险[11]。本研究中,吸烟、糖尿病、Hcy、WBC、FFA等均显示出与ACI较强的相关性。它们不仅是动脉粥样硬化的危险因素,还被发现可增加粥样硬化斑块的脆弱性,从而促使急性心血管事件的发生[12~16]。
脂质是粥样硬化斑块的重要成分,在众多危险因素中,高脂血症也被认为是动脉粥样硬化的重要因素。血液循环中脂质需与载脂蛋白结合方能转运,且apo在内皮下的滞留和进一步修饰是动脉粥样硬化的关键。脂蛋白根据密度大小依次分为乳糜微粒、极低密度脂蛋白、中密度脂蛋白、低密度脂蛋白以及高密度脂蛋白。HDL-C与脂质从外周向肝脏的逆转运有关,有抗动脉粥样硬化作用,而以LDL-C为代表的脂蛋白则是动脉粥样硬化的强烈危险因素[17]。apoB存在于前四者,其中乳糜微粒为apoB-48亚型,由肠道合成;其余为apoB-100亚型,由肝脏合成。此外,脂蛋白家族中主要与遗传相关的Lp(a)同样具有一分子apoB-100。动脉粥样硬化是由含apoB的脂蛋白从内皮下滞留下起始的,它们通过脂蛋白酯酶介导与细胞外基质中的硫酸乙酰脂结合形成大分子聚集体,进而增加了内皮下基质的滞留和细胞摄取[18]。即使没有其它危险因素的存在,此类脂蛋白也会推动粥样硬化的发展。apoA-Ⅰ则主要存在于HDL-C,其临床测定的血清浓度大致反映的也是后者的水平。因此,apoB/apoA-Ⅰ在某种程度上代表着人体内促动脉粥样硬化与抗动脉粥样硬化之间的平衡关系。同样LDL-C/HDL-C也在一定程度上反映着这种关系,该比值与缺血性脑卒中的关联性在其它研究中得到了证实[19,20]。目前评估颈动脉的粥样病变情况有许多手段,其中数字剪影血管造影和CT血管成像在评估血管狭窄情况上有着较高的准确性,核磁共振血管壁成像甚至可测量斑块的负荷和成分从而评估其性质,但由于它们的有创、辐射、耗时、价格昂贵等缺点,并未在门诊患者的卒中筛查以及流行病学调查中广泛应用[11,21]。基于B型多普勒超声测量的CIMT在一定程度上代表着粥样病变的程度,是急性脑血管事件发生的独立危险因素[22]。钟维章等[23]的研究表明在评估急性脑梗死患者的颅外段颈动脉狭窄方面,彩色多普勒超声与数字剪影血管造影拥有较高的诊断一致性。
本研究结果显示,apoB与apoA-Ⅰ比值是前循环大动脉粥样硬化型脑梗死的独立危险因素,其水平的升高分别会增加脑梗死的发病风险,这与近期的两项研究结果一致[24,25]。Dong等[26]的荟萃分析纳入了8项队列研究和4项病例对照研究,来自于22个国家的医疗中心,分析后发现apoA-Ⅰ水平降低以及 apoB/apoA-Ⅰ升高是首次缺血性卒中的危险因素,但与出血性卒中无关。该研究同时针对中国南方人群进行了相关的研究,显示出与荟萃分析相同的结果,并且发现apoB/apoA-Ⅰ升高与缺血性卒中的关联性较apoB更为密切。高的apoB与apoA-Ⅰ比值意味着“促”与“抗”平衡被打破,特别是在多种危险因素的共同作用下,外周血管表现为更快和更易出现的动脉粥样硬化。Zivanovic等[27]与Jun等[28]的研究均表明apoB/apoA-Ⅰ是颈动脉粥样硬化良好的预测因子。同样,它也是颅内动脉粥样硬化的独立危险因素,在该机制下增加LAA型及小动脉闭塞型梗死发生风险[29]。此外,apoB/apoA-Ⅰ还与经颈动脉超声测量的卒中患者IMT增加有着密切的关联,该值的升高意味内膜下会有更多的低回声不稳定斑块[27]。颈动脉内膜的增厚及狭窄不仅是动脉粥样硬化的早期标志物,而且是脑梗死明确的危险因素[10]。Chen等[30]的研究显示了CIMT与ACI发病风险之间的这种正相关关系,并且颈动脉内膜斑块的脆弱性会进一步增加风险,这与本研究的结果基本相似。高apoB/apoA-Ⅰ值可能通过CIMT的增加以及颈动脉斑块脆弱性的加大两条途径从而达到更高的卒中风险。最近发表的一项涉及119项临床试验,含100 667例患者的Meta分析显示CIMT的进展与心血管风险增加是密切相关的,其可作为干预措施对降低心血管风险的替代标志物[31]。
在预测急性脑梗死的发病风险上,本研究结果显示apoB/apoA-Ⅰ优于LDL-C/HDL-C,也优于apoB,这与Johnson等[32]在比较apoB、apoB/apoA-Ⅰ与传统血脂指标预测冠心病相关结局差异的研究结论相类似。相较于LDL-C,apoB不仅大致反映了循环中所有致动脉粥样硬化的脂质水平,而且与apoA-Ⅰ的比值更是显示出两者之间的平衡关系。此外,LDL-C等其它血脂指标易受饮食、应激等因素的影响,而apoB水平则较为稳定[17]。一项来自台湾的前瞻性研究也表明apoB/apoA-Ⅰ在预测缺血性卒中方面是一个优于传统脂质临床指标[24]。本研究还发现,CIMT在单独预测前循环ACI时的效能要高于apoB/apoA-Ⅰ,它们两者在联合预测ACI时则表现出更优的预测效能。这说明可通过这两项简单的检查指标大致预测个体急性脑梗死的发病风险,适用于门诊检查及大规模筛查,以指导脑血管病的预防。目前,绝大部分指南仍以LDL-C、TC作为降脂治疗的关键靶点,其水平下降可降低心血管的发病风险也十分明确。但以apoB为靶向治疗靶点的药物在不断开发与研究,apoB以及它与apoA-Ⅰ的比值也有望成为除LDL-C之外的降脂治疗新的监测指标,这可能有利于血脂异常患者的个体化精准治疗[33,34]。
本研究仍存在一些局限性。首先本研究为横断面研究,不能明确apoB/apoA-Ⅰ、CIMT与ACI之间的因果关系。其次,样本量较少,且来源于单一中心,不排除存在地理因素的影响。另外,研究对象仅针对前循环的大动脉粥样硬化型脑梗死,结论可能不适用于所有卒中类型。后续需要样本量较大的前瞻性研究证实。
综上所述,apoB与apoA-Ⅰ比值、CIMT分别是前循环大动脉粥样硬化型脑梗死的独立危险因素,它们的水平上升均会增加脑梗死的发病风险,这两项指标在联合预测急性脑梗死发病上比它们单独以及其它血脂指标更有优势。apoB与apoA-Ⅰ比值有望成为缺血性脑卒中预防与治疗的标记物。

