宫颈脱落细胞中PAX1和SOX1基因甲基化对宫颈癌实验诊断的临床研究
谌媛媛,李 静
(1.阜阳市临泉县人民医院妇产科,安徽阜阳 230022;2.西安高新医院产科;西安 710075)
宫颈癌是女性常见的一种恶性肿瘤,其发病率仅次于乳腺癌,位女性多发肿瘤第二位,严重威胁着女性的生命健康[1-2]。目前宫颈癌筛查项目中液基薄层细胞检测(thin-layer cytological test,TCT)和人乳头瘤病毒(human papilloma virus,HPV)检查是早期宫颈癌筛查的最有效手段。其中TCT检查虽然有较高的特异度,但敏感度却只有40%~70%,容易造成较高的假阴性,联合HPV检测后对其灵敏度有一定的提高,但对宫颈上皮内瘤变2级(cervical intraepithelial neoplasia grade 2,CIN2)以下的患者特异度仍较低[3]。因此,筛选可以评估宫颈病变的潜在分子标志物,建立一个安全有效的宫颈癌筛查体系对于宫颈癌的早期诊断和预防具有重要意义。随着分子检测技术的快速发展,表观遗传学在肿瘤的发病机制中被发现,其中DNA甲基化作为最早发现的表观遗传标记,对多种生物过程至关重要[4]。配对盒家族1(paired box1, PAX1)基因作为配对盒家族中的一员,是一种重要的转录调控因子,在胸腺、脊椎、甲状腺及配套骨骼组织的发育中发挥重要的调控作用[5]。此前有研究表明,PAX1的高甲基化水平与女性宫颈肿瘤的严重程度相关,已被提议作为宫颈癌检测的潜在生物标志物[6]。性别决定区域Y盒蛋白1(Sex determining region Y box1, SOX1)基因是最早在外胚层细胞中表达的转录因子之一,已有研究证实SOX1甲基化可以高灵敏度和特异度区分高度鳞状上皮内病变(high-grade squamous intraepithelial lesions, H-HIL)和正常宫颈[7]。以前期报道为基础,本研究进一步探讨了PAX1和SOX1基因甲基化与宫颈癌临床病理参数之间的关系,并比较两种基因甲基化水平在鳞状上皮内病变与早期宫颈癌中的诊断价值,以期为宫颈癌的临床诊断提供一定的参考依据。
1 材料与方法
1.1 研究对象 前瞻性纳入2019年1月~2021年12月在阜阳市临泉县人民医院经病理检查确诊的58例宫颈癌患者为宫颈癌(CC)组,平均年龄59.3±4.7岁,平均身高160.7±7.2cm,平均体重60.2±4.3kg,初次性生活年龄20.4±2.1岁,性伴人数1人,平均生育次数2次,家族遗传5例(8.6 %)。35例高级别鳞状上皮内病变患者为H-SIL组,平均年龄57.8±5.6岁,平均身高158.8±8.5cm,平均体重59.4±6.5kg,初次性生活年龄21.2±2.3岁,性伴人数1人,平均生育次数2次,家族遗传3例(8.6 %)。33例低级别鳞状上皮内病变(lowgrade squamous in traepithelial lesions, L-SIL) 患者为L-SIL组,平均年龄60.2±3.8岁,平均身高159.5±7.8cm,平均体重60.7±4.8kg,初次性生活年龄20.8±1.5岁,性伴人数1人,平均生育次数2次,家族遗传2例(6.1 %)。另选取同期在我院进行健康体检的50例正常人群作为Control组,平均年龄58.8±5.2岁,平均身高160.5±8.2cm,平均体重59.6±5.6kg,初次性生活年龄21.5±1.7岁,性伴人数1人,平均生育次数2次,家族遗传4例(8.0%)。四组患者在年龄、身高、体重、初次性生活年龄、性伴人数、平均生育次数、家族遗传等一般资料比较中,差异无统计学意义(P>0.05),具有可比性。
纳入标准:①所有患者符合《宫颈癌及癌前病变规范化诊疗指南》中的诊断标准[8];②经活检或阴道镜检分别确诊为宫颈癌、高级别鳞状上皮内病变患者、低级别鳞状上皮内病变患者以及正常或炎症者;③患者确诊前未接受放化疗或使用激素类药物进行抗肿瘤治疗等;④临床资料完整者;⑤本研究经本院伦理委员会审核批准后进行,所有研究对象均知情并签署同意书。排除标准:①患有自身免疫性疾病或服用免疫抑制剂;②妊娠状态或产后8周内;③已接种宫颈癌疫苗者;④并发其他恶性肿瘤者。
1.2 仪器与试剂 DNA提取试剂盒(德国Qiagen),重亚硫酸盐转化试剂盒(北京百奥莱博科技有限公司),PAX1和SOX1基因甲基化特异性PCR扩增试剂盒(上海哈林生物科技有限公司),荧光定量PCR仪(瑞士Roche公司),引物序列由上海生工生物工程股份有限公司设计合成。
1.3 方法
1.3.1 标本采集:取材时间避开经期,取材前24 h不上药、不清洗、不过性生活,取病人的膀胱截石位,用棉签拭去多余阴道分泌物,将宫颈细胞取样刷插入子宫颈通道内,向前抵住采样器,并绕同一方向转动5~8周,将取样刷立即放入配套的保存液中,拧紧盖子并标记好患者信息。
1.3.2 PAX1和SOX1基因甲基化检测:将上述保存液中的样本转移至1.5 ml离心管中,10 000 r/min离心5 min,收集宫颈脱落细胞,然后根据核酸提取试剂盒说明书提取宫颈脱落细胞中的DNA,为防止DNA降解,应将其保存至-15℃以下。采用重亚硫酸盐对DNA进行转化处理,使DNA暴露在碱性条件下,并与其试剂发生萃取反应,将DNA与载体分离洗脱;将转化后的DNA样本经甲基化PCR扩增试剂盒进行扩增,扩增体系为20 μl (DNA样本 1 μl,上下游引物各0.5 μl,内参基因上下游引物各0.5 μl,检测基因和内参基因探针各0.8 μl,2×Premix Type 10 μl,50×Rox ReferenceB Dye II 0.2 μl,ddH2O 5.2 μl)。反应条件为 95 ℃预变性5 min,95 ℃变性30 s,60℃退火 30 s,72℃延伸 45 s,共进行35个循环。反应结束后通过Light Cycler 480仪器检测PAX1和SOX1基因和内参基因ACTB的Cp值,并计算ΔCp=(Cp样本-Cp内参)。甲基化的判断标准:若ΔCp≤9为阳性,若ΔCp>9或FAM Cp无法测定为阴性。将PCR扩增反应体系在120 V恒压下进行琼脂糖凝胶电泳,待电泳条带跑至胶板2/3时即可停止(约30 min),取出胶片,用凝胶成像仪拍照保存,用Image J软件计算其灰度值,以ACTB为内参计算PAX1和SOX1基因甲基化相对水平,甲基化特异性PCR引物设计见表1。

表1 PAX1和SOX1基因甲基化特异性PCR引物
1.4 统计学分析 采用SPSS 22.0软件进行统计学分析,计数资料以例(%)表示,采用χ2检验;符合正态分布的计量资料以均数±标准差(±s)表示,两组间比较采用独立样本t检验,多组间比较采用方差分析;根据甲基化水平分别绘制 ROC曲线,计算AUC值,以P<0.05为差异有统计学意义。
2 结果
2.1 四组患者PAX1和SOX1基因甲基化情况比较 见表2。PCR结果显示,L-SIL组、H-SIL组及CC组患者的PAX1和SOX1基因甲基化发生率较Control组呈上升趋势,差异有统计学意义(F=53.805, 46.228, 均P<0.05),而L-SIL组,H-SIL组及CC组患者宫颈细胞中PAX1和SOX1基因甲基化水平逐渐下降,差异有统计学意义(F=5.230,4.764,P=0.025,0.031)。

表2 宫颈病变患者PAX1和SOX1基因甲基化情况比较
2.2 PAX1和SOX1基因甲基化与宫颈癌患者临床病理参数的关系 见表3。58例宫颈癌患者PAX1和SOX1基因甲基化状态均与淋巴结转移有明显相关性,差异有统计学意义(P<0.05),与年龄、肿瘤大小、临床分期、组织学类型、分化程度及WHO病理分级等无相关性,差异均无统计学意义(P>0.05)。

表3 58例宫颈癌患者PAX1和SOX1甲基化与临床病理参数的关系
2.3 PAX1和SOX1基因甲基化对宫颈癌诊断价值比较 见图1。ROC曲线结果显示,PAX1基因甲基化水平诊断L-SIL,H-SIL和CC时对应AUC分别为0.645,0.703和0.917,SOX1基因甲基化水平诊断L-SIL,H-SIL和CC时对应AUC分别为0.604,0.689和 0.850。
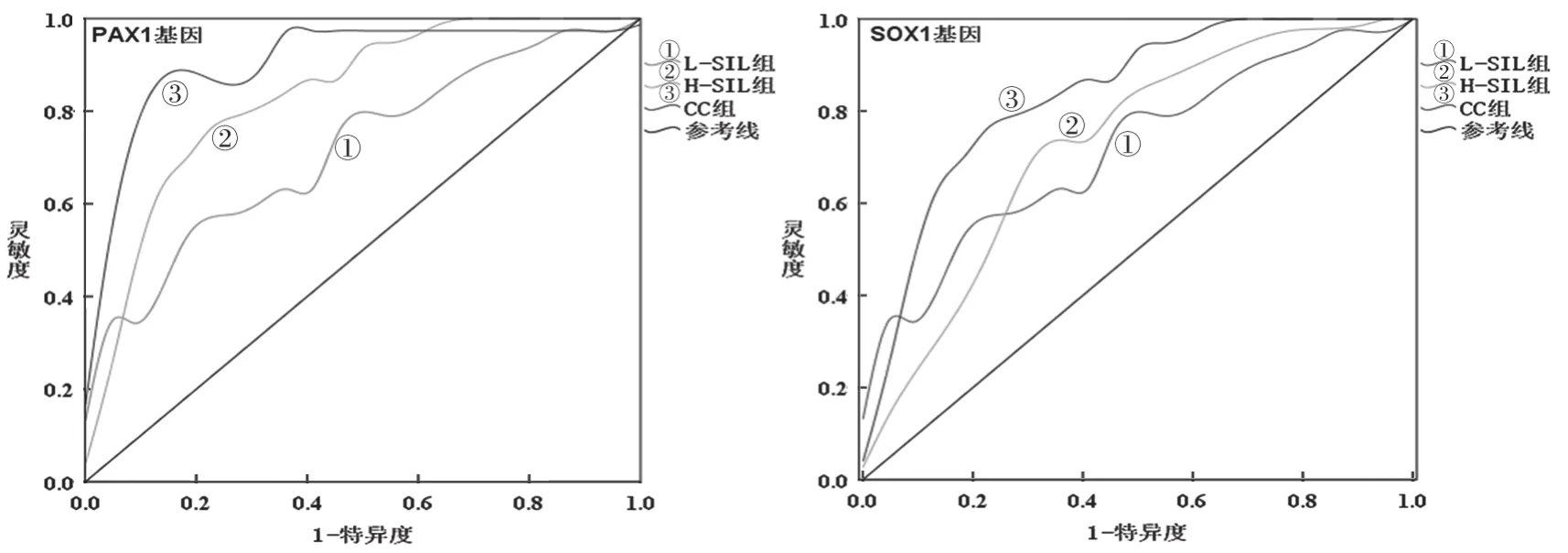
图1 PAX1和SOX1甲基化检测宫颈病变及宫颈癌的ROC曲线
3 讨论
据统计全世界每年有50万宫颈癌新发病例,约25万死亡病例,其早期治愈率可达80%~90%,但发展到后期时其治愈率仅有10%左右,因此,探究宫颈癌的诱因、找寻特异性分子标志物用于宫颈癌的早期诊断,对于女性健康是非常必要的[9]。前期已有学者通过对宫颈癌病理组织检测发现,某些基因特异性位点出现甲基化可作为宫颈癌早期筛查的重要技术手段[10]。PAX1基因编码序列特异性DNA结合转录因子,在胚胎发育和人类疾病中起关键作用,参与多种肿瘤的发生进程,调节肿瘤细胞增殖和迁移[11]。LIANG等[12]研究发现,在宫颈癌筛查中,HPV和PAX1检测的敏感度分别为89.23%和86.67%,均保持较高水平,而PAX1检测的特异度和AUC分别为97.18%和0.919,相比之下,HPV检测的特异度和AUC仅为19.10%和0.541,提示在宫颈癌筛查中PAX1基因诊断效果优于HPV。黄勉等[13]研究显示,筛查宫颈鳞状上皮内病变时,PAX1基因甲基化灵敏度和特异度分别为81.3%和96.6%,明显优于TCT检查,提示在细胞学检查时结合PAX1基因甲基化检测,可作为一种有效的宫颈筛查方法。LI等[14]探讨发现,对于宫颈高级别病变和宫颈癌患者,在进行的各种测试中PAX基因检测方法的特异度最高(97.30%),其甲基化水平可作为宫颈癌诊断和分类的重要生物标志物。
SOX1是SOXB1转录因子亚组的成员,参与早期胚胎发生、胚胎发育和神经干细胞的维持[15]。有研究分析显示,SOX1在结直肠癌组织中高甲基化,并且在I期和II期结直肠癌患者中观察到SOX1甲基化状态对总生存期和无病生存期存在显著影响,可以被认为是结直肠癌患者预后的分子标志物[16]。张良等[17]发现,肝癌患者血清中SOX1基因启动子甲基化阳性率显著高于健康对照组,其甲基化状态与肝癌患者的包膜侵犯程度、分化程度,TNM分期及远处转移情况有明显相关性,可作为肝细胞癌分子诊断和病情进展的生物标志物。此外,SOX1基因甲基化在宫颈癌中也有研究,Rogeri等[18]研究了宫颈癌前体病变中基因的甲基化特征,以改进高级别上皮内瘤变的筛查技术,结果在验证中发现,7个基因呈现出显著不同的甲基化谱,其中SOX1基因的甲基化频率显著增加,可能是宫颈癌前体病变的一个有希望的生物标志物。ZHAO等[19]研究表明,SOX1基因甲基化检测宫颈腺癌的特异度和敏感度分别为91%和71%,其和细胞学联合检测时的敏感度和特异度分别为84%和96%,表明SOX1基因甲基化检测在宫颈腺癌的诊断中具有较高的应用价值。
本研究结果表明,患者从低级别鳞状上皮内病变向宫颈癌发展过程中,PAX1和SOX1甲基化发生率呈逐渐上升趋势,但其甲基化水平却呈逐渐下降趋势,这一结论可推断PAX1和SOX1基因启动子甲基化异常,则可导致基因转录发生障碍,从而引起其表达水平下降,这与JEZIORSKA等[20]发现的基因启动子区发生甲基化后,mRNA表达水平则降低的结果相一致。此外,本研究发现PAX1和SOX1基因甲基化与淋巴结转移呈明显相关性,该结果在前期研究中还未见报道,提示PAX1和SOX1基因甲基化状态可作为宫颈癌病情评估的有效分子标志物。根据PAX1和SOX1甲基化水平绘制ROC曲线,结果显示,PAX1和SOX1基因甲基化水平对L-SIL,H-SIL和CC患者的诊断价值逐渐升高,这说明PAX1和SOX1甲基化水平可作为鉴别宫颈癌病情进展可能性的重要分子标志物,这一结论与Li等[14]和ROGERI等[18]的研究结果相吻合。但本研究还存在一定的不足,首先纳入的样本数较少,后期可通过扩大样本量进一步证实本结论,其次由于时间限制,未进行随访,后期可通过随访探究PAX1和SOX1基因与上皮内病变消退及宫颈癌预后的相关性。
综上所述,PAX1和SOX1基因甲基化与宫颈癌的发生发展密切相关,宫颈癌的甲基化状态与淋巴结转移呈一定相关性,随着患者从鳞状上皮内病变向宫颈癌的演变,PAX1和SOX1基因甲基化水平对其诊断价值也逐渐升高,值得在临床应用中推广。

