心腔内超声心动图中国专家共识*
钟敬泉 龙德勇(此后作者按姓氏笔划排序) 马长生 王建安 王祖禄 孔祥清 付 华朱文青 刘 旭 刘兴鹏 刘丽文 刘启明 刘 艳 汤宝鹏 李 妍 李述峰 李学斌李树岩 何建桂 张 运 张劲林 张晓春 张 薇 陈 茂 陈明龙 范 洁 周达新郑良荣 袁祖贻 夏云龙 徐亚伟 徐 健 唐 闽 桑才华 董建增 蒋廷波 蒋晨阳韩学斌 储慧民 舒茂琴 谢瑞芹 薛玉梅 Luigi Di Biase Paul C.Zei
心腔内超声心动图(intracardiac echocardiography,ICE)指在导管的顶端安置超声探头,经由外周血管输送至心腔内部,对心脏及其邻近组织进行实时高质量成像和(或)血流动力学测定的超声成像技术[1-3]。ICE 能够直接显示心脏结构,有助于理解心脏内各部位之间的解剖关系,现已逐渐推广应用于指导各种心脏介入手术、监测术中相关并发症,是各种心脏介入手术中重要的辅助工具。
早在1960年就已有将带有超声换能器的导管通过颈静脉送入狗的心腔并获得左、右室心内膜回声的报道[4]。此后陆续有科学家利用早期的超声探头对心腔内结构进行成像[5-6]。随着相控阵换能器等的相继发明[7-8],ICE 也被逐步应用于指导房间隔穿刺等临床工作[9-11]。近年来,经皮导管介入技术不断发展,其优势日益凸显,已成为许多结构性心脏病和心律失常介入诊疗的重要方式。与日益复杂的心脏介入手术方式伴随而生的是术中对成像技术的愈发严苛的要求,恰恰ICE实时成像、实时监测术中并发症及患者易耐受等特点极大地契合了这些要求,被越来越广泛地用于各类心脏介入手术[3,12-13]。鉴于当前国内外尚缺乏相关指南,为推动及规范ICE的临床应用,本专家工作组广泛研读国内外相关研究成果,并结合自身一线工作实践经验,经过反复论证与研讨,最终达成此共识,希望能为临床医生提供指导,进一步提高心血管介入诊疗水平。
1 ICE的器械类型及临床应用概述
基于不同的技术原理,目前使用的ICE 导管主要有两类:一类是机械旋转式超声导管,另一类是相控阵超声导管[14]。前者的导管头端是可以360°旋转的机械超声换能器,能提供垂直于导管长轴的环形切面图像,超声频率单一且只适用于探头周围6~8 cm 以内的近距离成像,无法进行多普勒成像,可操纵性差,需要在长导管鞘的引导下才能置入右房,现在主要用于电生理研究[12,15]。相控阵超声导管是临床最常用的ICE导管类型,由手柄和导管两部分组成。手柄上有三排旋钮,可操纵导管向前(A)、后(P)、左(L)、右(R)4个方向弯曲并固定[1,3,12-16]。导管的头端配备64晶体相控阵换能器,纵向扫描能提供90°的扇形视野,配合手柄多方向的操纵,可对心腔结构进行360°无死角扇扫,超声频率可变(5~10 MHz),最大探测深度可达15~16 cm,具备多普勒成像能力。目前的ICE 相控阵导管通过在头端嵌入位置传感器,可将心腔内获得的二维图像与三维电解剖标测系统进行整合,使超声扇面呈现在三维模型上,更直观地显示解剖关系及实时导管位置[13],有助于临床医生更加准确快速且安全地进行标测。
ICE最初主要用于指导房间隔缺损(atrial septal defect,ASD)和卵圆孔未闭(patent foramen ovale,PFO)的介入封堵,其成像效果与经食管超声心动图(transesophageal echocardiography,TEE)相当,ICE 无需全身麻醉和超声科医生辅助,使用更加普遍[2,13]。另外,ICE 可对房间隔进行成像,明确卵圆窝的位置和解剖结构,辅助术者选择理想穿刺位置,提高房间隔穿刺的成功率和安全性[12],现已应用于多种需要房间隔穿刺的介入手术,如心房颤动(简称房颤)射频导管消融术、二尖瓣介入治疗手术、左心耳封堵术(left atrial appendage closure,LAAC)等[12]。三维导航的低分辨率和X 射线透视/造影的二维重叠影像,有时会导致术者无法精准确定消融靶点与特定解剖部位的关系,如前所述,ICE 能实时、全程、清晰和准确的显示各心腔感兴趣的精细解剖关系,评估导管和组织的接触情况,有助于提高消融的精准度和有效性,可在房颤、心房扑动(简称房扑)、室性心律失常等复杂心律失常的介入手术中发挥重要作用[3,12],并且,ICE能够显示食管、动脉和心耳等结构,从而有望避免相关并发症的发生,增加术者信心,减少学习曲线,减少并发症,增加成功率[17]。此外,ICE 还被用于指导多种介入手术及相关并发症的监测,如经导管主动脉瓣膜置换术(transcatheter aortic valve replacement,TAVR)、动脉导管未闭(patent ductus arteriosus,PDA)封堵术、瓣膜周围漏(para-valvular leak,PVL)封堵术、室间隔缺损(ventricular septal defect,VSD)封堵术、肺动脉瓣球囊成形术、梗阻性肥厚型心肌病室间隔射频消融、左室起搏、房间隔起搏、室间隔起搏、心包穿刺、心肌组织活检、排查心腔内血栓以及心脏电子设备的植入和移除等[2,3,12,15]。
早期应用ICE相关的并发症发生率约4%,主要是导管在右房操作过程中诱发的房性心动过速(简称房速)[18]。虽然ICE临床应用价值显著,但费用问题仍是限制其临床广泛推广的主要原因之一。然而,美国的一项研究数据表明术中使用ICE与TEE相比,患者总体费用相当[19]。
总之,ICE具有对心腔内结构及毗邻解剖关系实时成像的能力,被逐渐用于指导多种结构性心脏病和心律失常等的介入治疗及术中并发症的监测。与X 射线和TEE 相比,ICE能减少辐射暴露剂量、无需全身麻醉、患者耐受性更好且无需额外的超声科医生辅助。未来,随着ICE的成像质量不断提高、三维(3D)甚至四维(4D)ICE(实时三维)成像能力,尤其是分辨率和图像清晰度不断增强、导管直径不断缩小、价格逐渐下降,将会更加广泛地应用于临床实践当中,并可能对包括心肌纤维化等临床医学堡垒的最终攻克提供影像学支持。
2 ICE应用推荐
推荐的手术操作、说明、推荐类别见表1。推荐类别适合:临床获益明确,应予优先应用;倾向应用:临床大多可获益,效果较好,多数情况下可应用;不确定:治疗获益证据不充分,可根据临床实际情况权衡应用;不适合:临床应用可能无益或受损,不推荐应用

表1 ICE应用推荐
3 ICE在心律失常介入诊疗中的应用
ICE有助于理解心律失常相关的重要解剖,确定标测和消融导管与之相应的心脏结构之间的空间关系,直接观察并指导调整消融导管顶端与组织贴靠的程度。ICE 可以用来监测消融损伤的形成、部位、范围和程度,以帮助判断消融的有效性。ICE可以实时监测并发症,判断其发生部位及严重程度。由于ICE的实时监测功能,往往可以在血流动力学改变之前发现并发症从而及时处理。ICE 在右心系统内操作即可显示全部的心脏结构,并可准确定位主动脉根部、肺动脉窦,对流出道的消融指导性更强,对突出于心腔内的结构,如乳头肌、假腱索及调节束等相关心律失常的标测消融指导意义更大,同时可以观察心肌的透声变化、搏动状态,精准展现瘢痕等室性心律失常基质,并有助于减少X 线的辐射和对比剂的应用。
3.1 ICE 在房性心律失常中的应用
在房性心律失常介入治疗过程中,ICE 可发挥多种作用,包括评估肺静脉解剖特征(数量、直径、解剖变异),指导房间隔穿刺,排查心房/心耳血栓,消融位点损伤监测等[3,20],ICE 还可在术中对可能发生的并发症进行实时监测,如避开食管,避免穿及主动脉,尽早发现心包压塞、血栓形成等,提高手术安全性[3];此外,ICE 在局麻下经血管入路进行操作,可避免全身麻醉的风险及食管插管的不适体验[21];ICE由术者独立操作,从而降低了人力成本[2];目前,在ICE指导下的低射线或零射线导管消融术已日趋成熟[23-25]。
3.1.1 ICE 在房间隔穿刺中的应用 房间隔穿刺术最早于1959年由Ross等[26]用于左房测压,20世纪80年代随着经皮球囊二尖瓣成形术(percutaneous balloon mitral valvuloplasty,PBMV)等技术的开展而得到了迅速普及[27]。发展至今,房间隔穿刺已成为左心系统导管消融、先天性心脏病介入、LAAC、左心辅助装置植入等心腔介入治疗过程中必不可少的操作。该操作多在传统二维射线指导下完成,虽已取得了较高的成功率[28],但仍具有一定局限性。首先,不同患者的手术类型不尽相同,根据各类介入技术的操作需求,房间隔穿刺部位有所不同,即需要部位特异性穿刺,以穿刺至最佳位点,提高手术效率;其次,对于心脏结构正常的患者,传统射线指导下的房间隔穿刺安全有效,但在解剖变异患者中进行穿刺时,穿刺失败及并发症风险不容忽视,有导致心包压塞、刺破主动脉根部、动脉栓塞、肺静脉穿孔的风险。
ICE是房间隔穿刺术的重要辅助工具,可易化穿刺过程。相比于TEE,ICE无需全身麻醉,可由术者单人操作,并且可配合标测系统进行三维重建,视野活动度更佳。房间隔穿刺前,术者可通过ICE,重建(熟练者可不重建)左房、卵圆窝、主动脉等重点结构,根据后续操作需要,通过调整扇面选择恰当的穿刺位点并进行标记。当穿刺针鞘落入卵圆窝后,通过ICE观察到卵圆窝“帐篷征”,出针后推注对比剂或盐水,通过左房内的微泡影,确定针尖进入左房,避免出针过深[3,25,29-30]。
ICE在解剖结构异常患者的房间隔穿刺中更具价值,如房间隔增厚、房间隔膨出瘤、心脏外科手术后房间隔穿刺、房间隔封堵器术后等,ICE 可准确判断针鞘与卵圆窝的位置,选择恰当的穿刺位点,提高穿刺成功率,避免严重并发症[31-32]。因此对于此类病人可常规考虑使用ICE引导。此外,在ICE扇面的实时跟踪下,可实现全程零射线房间隔穿刺,这对妊娠及儿童心律失常患者具有重要意义(图1)。但应注意,零射线方法仅适用于经验丰富的术者,对于常规房间隔穿刺,应同时结合传统射线及ICE技术完成。

图1 ICE指导下的零射线房间隔穿刺影像及三维重建
ICE在房间隔穿刺中的应用流程见图2。

图2 ICE在房间隔穿刺中的应用流程
3.1.2 ICE 排 查 左 心 耳 血 栓 如 前 文 所 述,ICE 和TEE 各有其优点和局限性。TEE 一直是传统的房颤导管消融或LAAC术前排除左房及左心耳血栓的金标准,且价格实惠,但TEE会给患者带来更多不适,检查前需要禁食禁水,检查时需要患者配合,检查中还可能会引起食管损伤。左房CTA 也用于左心耳血栓的诊断,但由于需要丰富的诊断经验、假阳性率较高,以及需要静脉注射对比剂等因素未能广泛应用。与TEE 相比,ICE 价格虽较为昂贵,但患者不适感较少,配合度高,且可指导后续手术过程,降低并发症发生率并减少射线量。针对左房及左心耳血栓,已有诸多临床研究表明,ICE临床应用价值不亚于TEE[33-36]。ICE 检查时,可将ICE导管经股静脉入路置于右房、冠状静脉窦口、右室流出道、肺动脉内对左房及左心耳进行扫描[33]。当ICE探头置于右室流出道和肺动脉中时,其对于左心耳成像质量更佳,可有效识别左心耳血栓。而ICE探头处于右房时,其对于左心耳成像质量欠佳[36]。由于冠状静脉窦口距离左心耳较近,ICE在冠状静脉窦内可清晰的显示与其平行的左心耳横截面视图,缺点是在冠状静脉窦内导管头端操作受限,且ICE导管质地较硬,若操作不当则会有导致夹层或静脉穿孔的风险[3]。
患者术前因食管病变、体质虚弱或情绪紧张等因素不能或不愿行TEE 检查,或左房CTA 检查不能确诊抑或排除左心耳血栓,可选择ICE 排查左房及左心耳血栓。此外,对于已行TEE的患者,ICE 也有其应用价值,尤其在TEE 检查时提示“明显云雾影”、“疑似血栓”等不能明确情况下,可利用ICE进一步核实[37-38]。
3.1.3 ICE指导房颤导管消融术 房颤导管消融的各个环节中ICE都可以发挥重要作用,提高了手术的舒适度、安全性和效率。进行肺静脉前庭隔离时,ICE 实时图像监测功能也有助于提高手术的安全性和准确性。
单纯根据快速解剖建模(fast anatomy mapping,FAM)中左房和肺静脉轮廓进行逐点消融,计划消融点与真实消融点往往存在一定空间上的偏差。ICE 二维图像配合Carto-Sound模块在三维电解剖标测系统中构建左房和肺静脉的三维模型,可提高FAM 的准确性。多数临床研究中,都是将超声导管置于右房中,但为进一步提高模型准确性,也有研究将ICE导管送入左房内建模不仅可行,而且精准度更高(与右房内建模相比)[39]。在这些工作基础之上,有的中心将ICE与三维电解剖标测技术结合完成零射线房颤射频消融术,其中21例房颤患者中19例实现手术全程零射线操作[25],另外极低射线剂量下房颤消融安全有效[40],且未出现手术相关并发症。在房颤的冷冻消融中,使用ICE指导球囊定位,评估封堵的情况等,可以减少X 线曝光时间、对比剂的使用,提高手术效率。
实时三维又名四维ICE,是近年来出现的一项新技术,以此指导房颤导管消融的研究还少有报告,随着相关研究的开展,此项技术是否能在房颤导管消融全流程的各个环节中发挥作用,进一步提高手术的效率及安全性,我们拭目以待。
ICE在房颤消融中的应用流程见图3。

图3 ICE在房颤射频消融中的应用流程
3.1.4 ICE 在其他房性心律失常中的应用 除房颤消融外,ICE也可用于其他房性心律失常的消融,其作用与房颤消融中发挥的作用类似,主要包括排查血栓、观察解剖结构、直接观察导管与心内膜的贴靠及移动情况、射频消融过程中消融灶形态的演变、监测消融过程中是否形成血栓及预防气爆(steam pop)等。其中,ICE 对于左房相关的房性心律失常检查过程与房颤消融时类似。右房相关房性心律失常中,ICE可置于右房中,通过在“home-view”顺时针或逆时针转动及打弯等操作,可清晰显示三尖瓣峡部、三尖瓣瓣环、右心耳、冠状窦口、上腔静脉等重要解剖结构。已有多篇文献提示ICE在典型房扑消融中可清晰显示三尖瓣峡部消融线上小梁、凹陷、欧氏瓣等解剖结构,减少手术时间和透视时间,提高手术成功率和安全性[41-45]。对于无冠窦起源房速,ICE可置于右房或右室流出道中对消融过程进行监测。
3.1.5 ICE在房颤冷冻消融中的应用 肺静脉隔离(pulmonary vein isolation,PVI)被认为是治疗房颤,恢复窦性心律的经典方法[46]。房颤冷冻球囊消融(cryoballoon ablation,CBA)已成为实现PVI的标准方法之一[46-47]。CBA 与射频消融相比,其在维持窦性心律方面的有效性相当,但CBA 往往伴随着更高的辐射暴露和对比剂使用率[46]。在房颤的CBA 中,使用ICE指导球囊定位,评估封堵的情况等,可以减少X 线曝光时间和对比剂的使用,且不影响手术的成功率和安全性[48]。但尚缺少ICE 指导CBA 实现PVI与X 线二维影像指导相比较,可提高手术效率、安全性的研究报告。此外,ICE基础上,彩色多普勒血流成像的使用进一步降低对比剂的暴露。在PVI中,彩色多普勒成像下观察到的球囊周围存在流动的现象表明阻塞不彻底,指导操作者立即调整球囊位置,且不需要静脉造影[49]。因此,对于那些肾功能不全或对比剂过敏而无法行透视造影的患者,ICE 的应用为治疗带来了新的选择。
对于持续性房颤患者,单纯PVI治疗的成功率较低。近年来应用CBA 进行持续性房颤PVI外的基质改良有部分报告,包括:①左房顶部线消融[50];②左房后壁隔离[51];③分段式PVI或扩大肺静脉前庭消融[52];④左心耳隔离;⑤非肺静脉触发灶消融[53]。上述研究提示应用CBA 进行PVI外的基质消融可能提高持续性房颤的消融成功率,但尚缺乏多中心随机对照研究结果。PVI外的基质消融多需应用球囊非阻塞性消融技术,此时应用ICE的影像学或血流监测,可能有助于指导冷冻球囊贴靠,提高消融的效率和有效性[54](图4)。但需要指出的是,应用ICE引导CBA 消融需要经过技术培训和经验积累。ICE在冷冻消融中的应用流程见图5。

图4 ICE指导冷冻消融术影像

图5 ICE在冷冻消融中的应用流程
3.1.6 ICE减少导管消融相关的并发症 ICE 最重要的功能之一是快速诊断和预防消融过程中的潜在并发症[55]。近期的一项研究表明,房颤导管消融患者的早期死亡率为0.46%;及时处理术后并发症和充血性心力衰竭可能对降低死亡率至关重要;尽管术者的经验和适应证的把握至关重要,但即时预防、诊断和管理手术并发症对于降低房颤消融死亡率尤为关键[56]。与死亡病因相关的主要并发症包括消融过程中心脏穿孔、左房血栓形成、食管损伤和肺静脉狭窄[56]。
在导管消融术中应用ICE 可减少围术期并发症的发生,尤其是显著降低血栓栓塞、心包压塞等严重并发症的发生率[3,56-65],缩短患者平均住院时间[61]。有研究证实,与传统X 线射线透视相比,Carto-Sound系统下通过ICE 引导对房颤患者进行环肺静脉消融安全可行[66],两组在穿刺处血肿、心包压塞等并发症发生率上无明显差异[66-68]。通过ICE与电解剖标测相结合,可实现零射线房间隔穿刺,并可安全有效地进行左心系统心动过速(包括房颤、非典型房扑、左侧旁道、室速及局灶房速)消融[69]。另外,其术后30天内的手术并发症(脑卒中/短暂性脑缺血发作、心包积液、心包压塞、需要外科手术或干预的假性动脉瘤、食管损伤、一过性膈神经麻痹、植入式心脏设备移位)发生率为1.9%,与房间隔穿刺相关心包压塞的发生率为0.2%。
急性心包压塞是消融过程中与导管操作相关的最常见的严重并发症之一。ICE 可以沿心室下缘和左房后部检测早期心包积液,早期发现心包积液可以通过逆转抗凝治疗,防止心包压塞的发生[55,58,60,63-64]。同时,可尽早行心包穿刺,必要时放置引流管,引流过程中ICE 还可连续监测心包液体的动态变化[55,58]。ICE导管从右房推进,头端指向前方偏转穿过三尖瓣并进入右室可以看到心脏的下后壁边界[55]。在室间隔处顺时针旋转可看到左室腔、二尖瓣和心包后下方空间的成像[55]。
血栓栓塞是与左心系统消融手术相关的另一种严重并发症。ICE引导的导管消融可使术者实时观察增加卒中风险的相关因素,如导管、鞘管和心内膜病变部位的血栓形成以及消融电极上的凝块形成[55]。一旦ICE 检测到软血栓,就可以将凝块抽吸到鞘管中,并且可以给予更高剂量的抗凝剂以防止严重的血栓栓塞并发症[55];如血栓牢固地附着在导管上,ICE可以引导将血栓撤出到右房[56]。
食管损伤和心房食管瘘是房颤消融中需要重视的问题。尽管心房食管瘘的发生率为0.05%~2%,但食管损伤仍较为常见[55]。ICE明确食管和左房相应位置关系的能力可与磁共振成像相媲美。此外,ICE的实时成像功能可帮助术者实现导管消融过程中实时监测消融导管与食管的位置,在导管消融靠近左房后壁区域时,减少射频能量,以降低食管损伤的风险[55]。然而,ICE 在房颤导管消融过程中监测食管位置的有效性仍缺乏大样本的临床研究数据[70]。
肺静脉狭窄与肺静脉前庭的消融部位有关,可以通过使用ICE准确定位消融部位减轻或避免这种并发症[55,62]。ICE可以监测消融位点的损伤程度,一旦发现消融部位组织发白或微气泡产生等局部过热的表现,可立即停止放电,以防止进一步的损伤[62,71]。并且,ICE 可测量肺静脉流速,重复消融手术的患者出现肺静脉狭窄风险较高,应用ICE 测量肺静脉血流速度也尤为重要[55]。
ICE应用相关的并发症很少见,但ICE 导管相对较硬,推进过程可能导致血管损伤和/或穿孔,因此需要强调谨慎推进[58]。
3.1.7 ICE缩短导管消融学习曲线,降低学习难度 心腔解剖结构的成像质量可直接影响手术效率,传统接触式三维重建方法不可避免的产生假腔,影响术者对消融靶点或特殊结构的判断。ICE为非接触式三维重建,不受导管到位限制,通过简单的扇面调整,即可客观、准确的将房体、肺静脉、心耳等结构完整重建,配合接触式的重点结构重建,经过影像融合,可获得更加真实准确的解剖模型,为后续消 融奠定基础(图6)。

图6 ICE结合快速解剖重建法进行左房模型重建
在消融过程中ICE 不仅可实时追踪消融导管,明确左心耳-肺静脉嵴部等复杂结构的导管到位情况,还可避免在食管走行及心肌变薄部位过度消融。
使用以ICE为基础的标准化流程可提高各操作的成功率。初学者在导管消融中使用以ICE 为体系的房颤低射线导管消融术式,可获得满意效果,平均透视时间为(2.3±3.0)min,且学习曲线较短,透视时间从研究初期的3.8 min迅速降至9 s[45]。
专家建议:①在房间隔穿刺过程中,有条件的中心推荐应用ICE指导;对于房间隔解剖异常患者,推荐应用ICE 指导。②在房颤患者行导管消融术前常规行TEE或左房和肺静脉CT 检查,以排除左心耳血栓及初步评估左心耳的形态和大小;对于术前难以辨别的疑似血栓或不能耐受及无法行左房和肺静脉CT 或TEE 的患者,术中可应用ICE 进一步排除左心耳血栓及再次评估左心耳形态和大小;同时,ICE还可作为TEE无法耐受患者的替代监测和评估技术。③对于有条件的中心推荐应用ICE,辅助指导房颤导管消融术,以实现低射线或零射线导管消融术,以减少患者及术者的射线暴露。④应用ICE的影像学和血流检测,可能有助于指导冷冻球囊贴靠,提高消融的效率和有效性。⑤对妊娠等不宜接受射线患者需在ICE下行消融治疗。⑥对于训练新的电生理医生,推荐使用ICE指导。
3.2 ICE在室性心律失常介入诊疗中的应用
恰似在房性心律失常介入中的应用一样,ICE 在室性心律失常导管消融手术过程中亦发挥着重要作用,主要包括实时监测心脏结构,减少手术用时,减少射线暴露[72],详细构建运动障碍区域[73],以及快速辨别术中并发症[74]。
3.2.1 ICE在分支型室速中的应用 左后分支型室速是特发性室速中最常见的类型,其电生理机制至今仍存在争议,传统观点认为是起源于左后分支内的一种大折返性心律失
常,临床上最需要和乳头肌起源的室速相鉴别。而两者在心电图和电生理上的绝对区分有时是比较困难的。事实上,已有研究证明部分分支型室速其机制是和分布在乳头肌周围的蒲肯野纤维、假腱索等结构密切相关[75]。这一部分左后分支性室速的成功消融靶点可能并不在传统的左中后间隔区域,而是在左后乳头肌和/或与之相连的假腱索等解剖结构周围。这些结构和间隔在位置上十分邻近,尤其在室速发作时(心腔缩小)更明显,难以在普通三维标测系统下区别开来。ICE可以在手术中直观地显示消融导管和左室间隔,乳头肌及假腱索的位置关系,明确最佳靶点的真实解剖位置,导管与靶点的贴靠程度等,对深化左后分支室速的机制研究和提高手术的成功率都有较大意义,因此近年来ICE 在左后分支室速标测和消融中的优势已逐渐被认可。
3.2.2 ICE在流出道起源室性心律失常中的应用 特发性流出道室性心律失常主要包括单形性室性早搏(简称室早)、非持续性室速或持续性单形性室速。右室流出道室性心律失常为临床最常见的室性心律失常,多为特发性,约占整个流出道室性心律失常的80%[76]。近年来,随着对右室流出道消融的进一步认识,肺动脉瓣上倒U 形消融被广泛关注和推广[77],但若无ICE对消融靶点的精准解剖定位,判断消融位置是否确切仍然是一大难题:导管头端是否在肺动脉瓣上? 贴靠是否确切? 解剖位置仅凭借造影不易清楚确定,而心腔内超声则可以清晰显示消融导管、肺动脉瓣结构、肺动脉、右室流出道之间的毗邻关系,实时观察消融导管与靶点相应解剖位置的贴靠,且ICE 及其所构建的三维模型,能够帮助术者更直观地理解标测及消融的解剖部位,为提高成功率奠定了坚实的基础。可运用ICE 电解剖证明左冠状动脉与右室流出道前中隔部位的密切结构,并通过旋转右室中的成像导管获得连续的ICE图像来标记左冠状动脉的解剖图像。利用ICE导管描绘心室流出道结构时,通常将其置于右房,从最初的三尖瓣开始顺时针旋转,此时长轴上显示为主动脉瓣,短轴显示为肺动脉瓣。
右室流出道心肌组织解剖性地向肺动脉瓣及肺动脉延伸,使得消融靶点的定位也更为复杂。部分病例在瓣下消融失败时,转为瓣上消融可获得消融成功。对于瓣上消融方式,跨瓣膜径路容易导致瓣膜损伤等并发症的出现,ICE 的应用有助于避免此类并发症,不仅如此,术中对肺动脉、主动脉瓣、左前降支及右室流出道的良好重建及实时监测,避免了X 线透视及对比剂的使用,未发生瓣膜关闭不全等并发症。ICE放置于右心耳中,实现肺动脉瓣横截面实时成像[78],更易识别肺动脉各瓣膜位置,确定消融靶点,从而实现手术成功。
由于流出道毗邻的复杂解剖结构(冠状动脉等),靠近冠状动脉传递的射频能量可导致主要的心外膜血管(如左前冠状动脉降支)阻塞并可能发生心肌梗死。因此识别冠状动脉的功能状态至关重要,以往通常需要冠状动脉造影来明确血管状态。ICE可实现术中对于动脉解剖的精准重建及实时动态观察,避免了对比剂的应用,对患者的损伤进一步降低。右室流出道起源的室性心律失常往往起源于肺动脉根部,由于此部位纵横交错的肌小梁和纤维组织,应用三维导航的低分辨率和X 线透视/造影的二维重叠影像,使得术者无法确定消融靶点与特定解剖部位之间的关系,而ICE 则可以实时成像心脏精细解剖标志,从而指导导管操作[17],全程直视,增加术者信心,减少学习曲线,有望提高成功率,减少并发症。
左室流出道室性心律失常,尤其是主动脉窦及其邻近区域起源的室早/室速,随着认识的深入和诊断水平的提高,发病率逐年增加。由于主动脉窦位于心脏的中心部位,其邻近组织解剖结构复杂,部分患者起源部位可能接近重要解剖结构(如冠状动脉等,图7),一旦损伤毗邻重要结构,产生瓣膜损伤、心脏穿孔,甚至急性心肌梗死、完全房室传导阻滞等严重致命并发症,手术风险急剧增大;主动脉根部为左室流出道,血流速度快、压力大,消融导管不易稳定贴靠,有时难以有效地释放消融能量。因此对于消融靶点邻近区域的解剖重建尤为重要,ICE 可以构建出左室流出道的三维模型,评估动脉与导管之间的距离,消除在该区域消融的潜在风险,明确消融可行性。将ICE探头放置在右房并向前偏时显像,可以实时监测标测位置和消融导管及其与主动脉、主动脉瓣、冠状动脉口等结构的相应关系,指导消融,减少可能对主动脉瓣或冠状动脉的损害,增加手术的安全性,提高消融的成功率。在儿童流出道室性心律失常患者的消融中,ICE 也发挥着越来越重要的作用[79]。
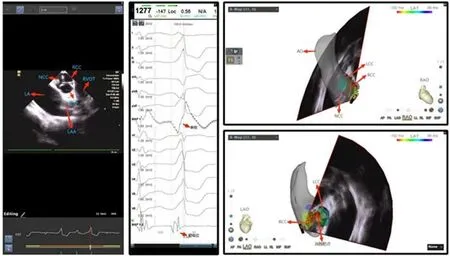
图7 左右冠窦之间室早消融周围的结构影像
3.2.3 ICE在乳头肌起源室性心律失常中的应用 左、右室乳头肌和调节束起源的室性心律失常临床上比较常见,由于这些是位于心腔内表面的解剖结构,传统的X 线影像和三维系统均无法直观显示其位置,且这些结构因表面光滑,在心动周期中独立地运动,易受导管推移而位置不固定等因素,使得这类心律失常在常规方法下行标测和消融时会面临既无法准确到位,也难以稳定贴靠的巨大挑战(图8),尤其是左室前乳头肌导管的贴靠对电生理医生仅在X 线作为影像引导有挑战性,而ICE则显示出很大优势(图9)。与起源于其他部位的室性心律失常相比,此类心律失常的消融成功

图8 左室后乳头肌室早消融周围结构影像及电解剖图

图9 左室前乳头肌室早消融周围结构影像及电解剖图
率较低,且复发率较高[80]。ICE 近年来已经成为解决这类心律失常的一项不可或缺的辅助手段,其作用包括:①直观显示乳头肌解剖位置,引导标测导管迅速地初步到位;②术者通过实时超声扇面和三维图像的互相追踪,明确导管位于乳头肌的具体节段(头端、中段和根部)和侧面,从而判断最佳靶点的精确位置;③在ICE 实时监测下通过细微调整导管,保证其和乳头肌始终保持良好的贴靠,这是完成一切准确标测(起搏和激动标测)和有效消融的前提;④手术中观测消融效果和损伤程度(组织水肿发白),监测pop和并发症的发生,减少射线暴露,提高安全性。
3.2.4 ICE在左室顶部和其他特殊心腔部位起源的室性心律失常中的应用 左室顶部是室性心律失常的主要起源之一,而且往往起源于心外膜,其主要结构是主动脉与左室流入道交界的位置,该位置内膜面有一层坚韧的纤维组织连接主动脉与二尖瓣,其心外膜面靠近冠状动脉且覆盖丰富的心外膜脂肪垫[81]。此区域导管消融成功率较低,因为近端冠状动脉上覆盖着厚厚的心外膜脂肪层,而且该区域导管消融可能对这些血管造成潜在的损伤风险[82]。通常临床会采用冠状静脉窦或心脏大静脉造影指导定位,有时采用心内心外膜联合消融的方式治疗。而应用ICE协助导管消融证明:尽管ICE的分辨率不足以勾画出远端细小的静脉,但当导管置于右室流出道时仍可构建出左冠状动脉前降支血管,以及左室、主动脉等解剖结构,呈现三维毗邻关系,指导消融导管到位,术者可在不需要静脉造影的情况下在该区域成功进行消融治疗[83]。此外,在X 线作为影像学导引难以显示的心腔结构和体表心电图难以定位的特殊类型的室早,ICE 也有一定的独到作用(图10)。

图10 三尖瓣环室早消融周围结构影像及电解剖图
3.2.5 ICE在室速伴缺血性心肌病中的应用 缺血性心肌病中心室壁瘢痕可介导大折返性室速,是心律失常的重要基质,部分患者在晚期还会出现室壁瘤,进一步增加了手术的复杂性。这类患者的消融策略是通过在瘢痕区域行激动标测或基质标测后,有针对性地进行消融。在术前可通过经胸超声(transthoracic echocardiography,TTE)、心脏CT/MRI对瘢痕区域进行大致定位。室速伴缺血性心肌病的消融难点在于这类病人通常合并心脏扩大、室壁变薄,导管操作具有一定难度和风险。通过ICE 可经右室将左室及室内结构的轮廓重建,指导导管到位,避免因压力过高导致心脏穿孔。尤其在合并室壁瘤的缺血性心肌病患者中,这类患者的左室失去正常的解剖毗邻关系,而ICE 可将室壁瘤及其瘤颈重建,初步判断消融靶点[84](图11)。
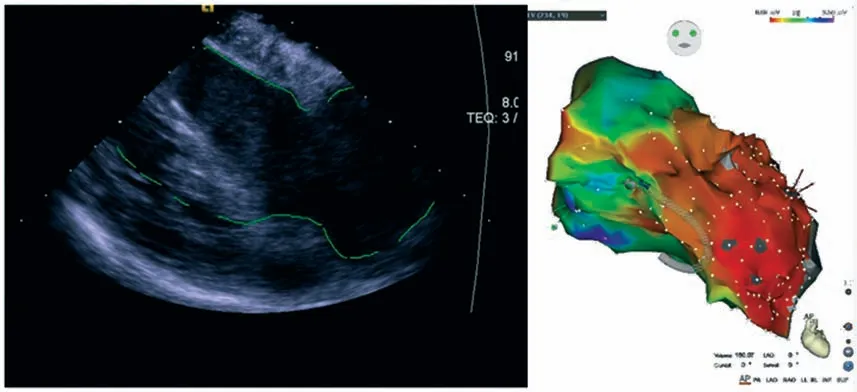
图11 ICE在缺血性心肌病合并室壁瘤室速中的应用
针对此类病人,ICE的另一重要优势在于对瘢痕区的识别,瘢痕区在超声扇面上表现为高回声区,而边缘区为中高回声混合,明显区别于正常心室肌[85]。一项纳入18例器质性室速的研究(83%为缺血性心肌病)显示,ICE定义的瘢痕区与经基质标测定义的瘢痕区一致性达到86%[86]。上述优势并不仅限于缺血性心肌病[87],一项最终纳入1 324例器质性室速患者的倾向性评分研究显示,与非ICE 组相比,使用ICE的患者的室速再住院率及再次手术率较低[88]。
ICE在室性心律失常消融中的流程见图12。

图12 ICE在室性心律失常消融中的流程(以乳头肌心律失常消融为例)
专家建议:①由于ICE安全有效,方便全面,在识别和定位消融部位、绘制心脏解剖图上有独特的优点,而且在显示小的异常局灶方面优于其他技术,推荐在成人左、右室流出道室性心律失常、TAVR 术后并发室速以及VSD 引起的室速的射频消融之中应用ICE,普通的室速射频消融中也可通过运用ICE降低再入院率、重复消融的可能性和并发症发生的概率。②ICE可积极应用于室性心律失常伴室壁功能障碍且需消融患者。
4 ICE在先天性心脏病中的应用
4.1 ICE在ASD、PFO 中的应用
目前在各种先天性心脏病的介入封堵治疗中,ICE 在ASD 和PFO 封堵术中使用得最为广泛。美国国家的统计结果表明,经皮ASD 封堵术中ICE 的应用率已经从最初的9.7%增加到目前的50%以上[89]。既往,TEE被认为是指导ASD 和PFO 介入封堵手术的金标准[90-91],但目前多项研究证实,与传统TEE相比,ICE具有更好的安全性和临床效果,更适合作为继发性ASD 和PFO 封堵术的超声学引导[92-93]。
与TEE相比,ICE 具有更高的图像分辨率,虽然其不具备多平面成像功能,但依靠其探头的灵活性,可从多个切面对房间隔成像,获得的图像与TEE获得的图像相似或更好[94]。ICE可以精确测量卵圆窝的直径、房间隔的直径、隧道宽或长、隧道入口及出口直径;同时可以观察PFO 患者心房水平的分流表现,明确有无过长的下腔静脉瓣或希阿里氏网、房间隔膨出瘤、双层隔等现象及特殊的复杂结构[95]。在ASD 封堵术中,ICE能够在封堵器释放前后在不同切面上准确测量ASD 直径,评估ASD 边缘的长度和厚度,例如上下腔静脉缘、房间隔前上缘和上缘、隔膜后部,显示缺损与周围结构间的关系(如右肺静脉、冠状静脉窦、二尖瓣、三尖瓣等),这些均有助于选择合适尺寸的封堵器,以及排除其他缺损或静脉窦型ASD等少见情况的存在[96];另外,术中可通过ICE进行实时彩色多普勒血流监测,以进一步排除潜在的其他缺损。与TEE 相比,ICE 能够更好地显示房间隔的后缘和下缘[97],以及封堵器与上腔静脉的关系(特别是在幼儿中)[98],可以用于ASD 直径超过38 mm 和(或)除前上缘外伴有边缘缺损的ASD、多孔性ASD 以及左室收缩功能受损的ASD 等复杂ASD 封堵术中[99-101]。此外,ICE 在进行解剖测量和引导植入方面已被证明比TEE 更准确(特别是对于左房较小的患者)[98]。术程中,ICE 能有效、绿色地实时监测并指导手术过程,帮助术者精确定位PFO 裂隙的位置、指导导丝快速通过裂隙,缩短手术时间;指导术者全程直视下释放封堵器、确定封堵器是否倾斜或处于异常位置,观察封堵器稳定性,避免了TEE 食管探头所造成的X 射线伪影。同时,术者可在ICE指导下通过注射生理盐水和(或)彩色多普勒检查来确认有无残余分流。在PFO 封堵术中,若发现特别长的隧道,可能需要采用房间隔穿刺的策略进行封堵手术,否则,可能会存在较大量的残余分流[102],因而ICE在房间隔穿刺方面是重要的指导工具(图13)[103]。

图13 ICE指导下的PFO 封堵术过程中的影像
ICE的另一显著优势是其可以显著减少术中X 线暴露时间[104],有效降低对患者(特别是儿童、孕妇、肥胖患者)和术者的辐射危害。同时也避免了TEE 相关的主要缺点,如食管穿孔、需要全麻和可能的气管插管带来的相关并发症。费用问题是制约ICE 在临床中广泛应用的重要原因之一,虽然应用ICE本身的费用比TEE 要高,但是应用ICE 可以避免全身麻醉、缩短平均住院日[89,105],从而降低了住院过程中的其他费用。ICE在PFO 中有应用流程见图14。

图14 ICE在PFO 中的应用流程
4.2 ICE在其他常见先天性心脏病中的应用
目前,ICE用于PDA 和VSD 的经验相对较少。经皮介入PDA 封堵术是目前PDA 的标准治疗,常规术式是主动脉造影引导下介入封堵。然而,对于大部分PDA 患者,主动脉造影需要大量的对比剂,而且部分情况下不能提供足够清晰的图像来评估PDA 解剖结构[106-107],有可能低估PDA 的大小,影响术者对器械的选择,并可能导致栓塞[108],此外,对比剂过敏或肾功能不全的患者进行主动脉造影有一定风险[108-110]。现有研究结果表明,在测量肺动脉侧PDA直径的准确性方面,ICE与主动脉造影或心脏CTA 相当,但是在ICE引导下进行的PDA 评估所需造影量明显低于主动脉造影。因此,ICE 目前被认为可替代主动脉造影,成为评估PDA 的相关结构的常规检查,尤其适用于大PDA、肾功能不全或对比剂过敏的患者[111]。
在膜部VSD 的经皮封堵治疗中,TEE 对于缺损的解剖结构评估和术者术中抉择起着很重要的作用。但由于VSD封堵手术时间较长,需在全麻下进行TEE 相关检查。而ICE 可提供清晰的VSD 膜部的图像,并且其测量结果与TEE所得结果相近;同时ICE和TEE对判断缺损与主动脉瓣和三尖瓣的关系、测量缺损大小以及不同阶段的引导均具有可比性。
专家建议:①ICE 在进行相关结构解剖测量、实时引导封堵器植入、评估封堵后残余分流等方面具有良好性能,推荐有条件的中心应用ICE 指导继发性ASD 及PFO 的介入治疗;②推荐ICE用于指导复杂或特殊ASD、PFO 患者的介入封堵术,尤其是复杂ASD 的封堵、不能耐受TEE、左室收缩功能受损及无法使用透视的患者,特别是儿童、孕妇、肥胖患者;③推荐使用ICE 指导大PDA、肾功能不全、对比剂过敏患者的PDA 介入封堵术;④对于解剖结构复杂的VSD 患者,可考虑使用ICE指导其封堵治疗。
5 ICE在瓣膜性心脏病介入治疗中的应用
5.1 经导管主动脉瓣置换介入治疗
严重的症状性主动脉瓣狭窄是一种致命的疾病,2年死亡率高达50%[112],TAVR 已成为一种对其有效的治疗方法[113-114]。然而,TAVR 的风险较多,包括瓣环破裂、心室穿孔、主动脉夹层、冠状动脉闭塞以及瓣膜假体移位等,其次还包括因为瓣膜放置不当引起的人工瓣膜PVL。没有超声心动图的指导,大多数并发症不能在早期发现[115]。术前和围手术期的影像对于准确判断瓣膜大小、评估术后主动脉瓣和瓣膜旁返流以及其他并发症至关重要[116]。目前,国内TAVR 术中使用较多的是TEE 进行术中指导。TEE 的一个替代方案是ICE,它的优势是患者无需进行全身麻醉和气管插管即可进行TAVR,尤其对于有食管疾病的患者。
Kadakia等[117]报道过一个TAVR 病例,该病例成功使用三维ICE成像引导。本病例显示,ICE 引导TAVR 可能是TEE成像引导的一种重要替代方法,并且可能允许较低强度的镇静或麻醉,具有安全性和可行性。研究发现,在TAVR 中,ICE对瓣膜位置和主动脉瓣关闭不全的评估与常规TEE成像提供的结果相当,显示了与多排计算机断层扫描(MDCT)相当的诊断成像质量[118]。ICE 测量主动脉瓣环和主动脉窦直径与使用MDCT 获得的测量值相当[116]。Bartel等[118]评估了ICE 和TEE 在TAVR 的术中指导,他们将50例计划进行TAVR 的严重主动脉瓣狭窄患者随机分为两组,分别进行ICE 监测和TEE 监测。结果显示,ICE允许连续监测,在手术过程中,ICE 组对探针重新定位的需求要低得多。ICE视图提供了更高的与升主动脉的同轴度,由所描绘的升主动脉长度表示。在ICE组中,两个冠状动脉口更频繁地显现。ICE导出的环空测量值与常规TEE 读数紧密相关,与常规测量相比,TEE 低估了术中压力梯度,但ICE没有。ICE和TEE均检测到了新发心内血栓。根据本研究,他们提出了,ICE与镇静和局部麻醉兼容,可作为TEE的替代指导工具。它似乎也比TEE 更好地匹配TAVR 期间的操作流程。一项研究[119],招募了21 例准备进行TAVR 的患者,使用三维ICE作为主要的术中成像方式,这些患者是由多学科TAVR 团队一致决定的。这一研究首次前瞻性评估了无气管插管情况下ICE引导下TAVR 的安全性和可行性。并且得出以下结论,ICE 在选定的患者中是安全可行的,并且可以在没有重大并发症的情况下进行;术中ICE可以发现瓣膜周围渗漏,有助于指导必要的治疗。随着对在TAVR 手术中使用清醒镇静的持续重视,考虑将ICE作为主要的术中成像工具变得非常重要。目前三维ICE 探头可用于体积成像;然而,在目前的结构中,环形瓣膜的横截面尺寸测量是困难的。对于TAVR 来说,ICE 与TEE 相比是一种有吸引力的替代方案[105,120]。另外,ICE 更容易测量三尖瓣返流(tricuspid regurgitation,TR)和主动脉瓣流速,评估围手术期肺动脉压等血流动力学[121]。ICE 可以测量主动脉瓣复合体,可以得到更精确的主动脉瓣压差[118,121]。除了提供影像学指导,ICE 还消除了气管插管的必要性,缩短了手术时间,避免了全身麻醉和TEE 的并发症[122]。因此,在多学科团队认为合适的患者中,ICE 引导的无气管插管TAVR 是一种可行的选择。
PVL是TAVR 最常见的并发症之一。有人描述了一例在术后超声心动图和心血管成像中出现PVL的患者[114]。TEE监测TAVR 术后偏心性主动脉瓣返流容易误诊为PVL,ICE 可以准确评估手术过程中的主要并发症,得到更精确的图像,并且进一步评估返流的原因和严重程度[114,121]。该例患者,通过ICE 明确了诊断,该偏心性主动脉瓣返流是由冻结的TAVR 生物瓣尖端导致的。因此,该研究认为ICE为TAVR 植入后的评估提供了一种合理的替代标准成像方式,或者至少是一种互补的成像方式。
关于ICE的操作方法,TAVR 手术过程中,ICE 使用8-Fr Acu NavTM导管从右侧颈内静脉进入上腔静脉,逆时针旋转将导管推进5 cm,获得升主动脉图像,术前评估升主动脉。再将导管推进几厘米时获得房间隔图像,可判断有无ASD或PFO。继续顺时针旋转,获得右房、三尖瓣和右室的长轴视图,测量术前TR 和估计的右室收缩压。在右室前曲逆时针旋转前推,左室长轴切面术前可显示左室收缩和心包积液,术中显示导丝位置。当导管以顺时针方向返回并拉至右房时,获得了主动脉瓣的长轴视图,可测量术前主动脉瓣流速及主动脉瓣复合体的直径。TAVR 术后,从无冠瓣边缘可以观察有无并发症,如PVL[121]。
ICE的局限性包括需要建立额外的静脉通路、与新设备相关的学习曲线以及可能增加的成本[115]。在操作ICE 探头时需要特别注意以避免心律失常和右侧心脏和腔静脉穿孔[123]。当然在释放瓣膜的同时操作ICE 比较适合有经验的术者。
ICE在TAVR 中的应用流程见图15。
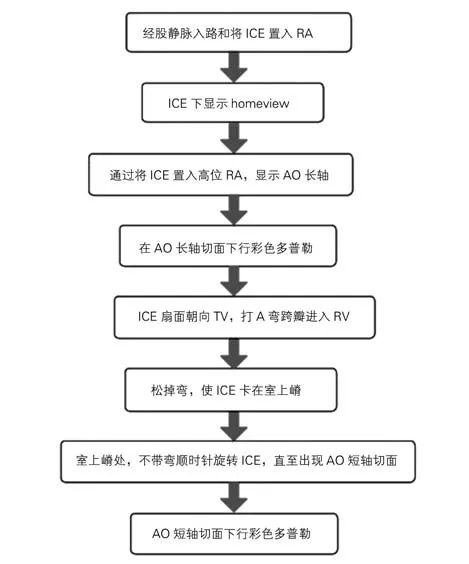
图15 ICE在TAVR 中的应用流程
专家建议:①ICE对于有食管病变或者不适合全麻的老年主动脉瓣狭窄患者接受TAVR 手术是一个值得推荐的TEE的替代方案;②ICE 在术前、术中和术后对于主动脉瓣及瓣上、瓣下结构的测量及可能的并发症与CT 三维重建的测量值相当,甚至部分病例优于TEE;③适合用于对TAVR手术及ICE的应用均经验丰富的术者。
5.2 经导管二尖瓣介入治疗
ICE引导下二尖瓣介入治疗包括了二尖瓣球囊扩张术,二尖瓣缘对缘修复(TEER),二尖瓣置换术(TMVR)。ICE引导的房间隔穿刺、ICE导管进入左房以及二尖瓣成像和功能评估是这些治疗方法的基础操作,因此我们将统一进行详细描述。不同治疗方法的后续操作则在对应部分进行描述。
5.2.1 房间隔穿刺 房间隔穿刺是二尖瓣介入治疗中关键步骤,直接影响了二尖瓣介入治疗的成功率。在透视指导下,将ICE探头经股静脉送至右房下位,即三尖瓣环水平,适当旋转导管,当可见右房、三尖瓣、右室和右室流出道时。此时,三尖瓣后叶通常在9点方向,而前叶(或隔叶)在3点方向,这是ICE的最基本切面。在透视下将ICE 探头送至右房中位,适当顺时针旋转导管并加少许P弯即可获取房间隔长轴切面,可显示房间隔及其与上下腔静脉的交界。进一步顺时针转导管并加P弯,可获取房间隔短轴切面,此时可显示房间隔的前界(主动脉)和后界。在房间隔长轴切面确定穿刺针“Tenting征”后,逆时针转ICE 导管直至可以同时显示穿刺针tent和二尖瓣环,从而确定穿刺位置的高度。
5.2.2 ICE导管进入左房 穿刺成功后,固定穿刺针,推送扩张鞘至左房内,撤出鞘芯后在超声图像中可见“双轨征”。将加硬导丝送至左上肺静脉或放置于左房内。此时,需要确定活化凝血时间(ACT)在治疗范围后方可进行后续操作。外周动脉球囊扩张房间隔以便后续鞘管能顺利通过房间隔。在透视下调整ICE导管的A/P 旋钮,使得导管与加硬导丝轨迹一致,轻柔推送导管至左房。若在过程中遇到阻力,稍许调整R/L旋钮或顺时针/逆时针转动导管后再次尝试推送导管,也可以通过左前斜或右前斜透视下调整ICE导管。
5.2.3 左心系统成像 ICE 超声探头进入左房后可显示左心耳、肺静脉和二尖瓣的图像。尽管二尖瓣介入治疗术前TEE能够识别大部分心耳内血栓,但当TEE 难以鉴别左心耳内血栓与正常梳状肌组织时,可考虑术中应用ICE 再次明确是否有心耳内血栓[38,124]。释放张力旋钮,回复A/P及L/R 弯至中位,旋转ICE导管直至面向右肩,调节A/P弯显示肺静脉,获取肺静脉血流频谱。在中位状态,旋转ICE 导管直至显示二尖瓣结构,稍许调节R/L 弯获取最佳的双交界区切面,在彩色多普勒及多平面成像下对二尖瓣进行结构功能评估。
5.2.4 二尖瓣关闭不全的介入治疗 Henning等[125]首次报道了ICE在TEER 中的应用。然而,由于当时ICE 缺乏多平面三维成像技术且应用经验匮乏,ICE在TEER 中仅仅作为TEE的辅助成像技术。随后该团队又报道了一例单纯ICE指导下的TEER,他们在患者的左、右房分别置入一个ICE探头,从而模拟正交二维图像[126]。4D ICE 可以提供实时容积成像及多平面重建技术,对于不能耐受TEE 或有禁忌的患者,可替代TEE 用于TEER 术中成像[127-128]。操纵指引导管(SGC)经加硬导丝跨房间隔至左房。建议行单个房间隔穿刺,SGC和ICE导管经同一个穿刺点进入左房,结合ICE正交二维、三维成像以及彩色多普勒可明确二尖瓣返流位置及程度。由于4D ICE可获取4D 图像并进行多平面成像,因此当ICE探头在左房获取二尖瓣图像后可对ICE导管进行固定,只需进行适度调整即可。应当在ICE持续监测下对导管传输系统(CDS)进行操纵,避免CDS头端穿通心房侧壁。当操纵CDS进行M 向运动后,逆时针旋转ICE导管,而当操纵CDS进行P 向运动时,顺时针旋转ICE 导管。缓慢反复调整,直至操纵CDS在完成M 向运动后从左房顶部至指向二尖瓣中心位置,夹子的头端在二尖瓣中心上方的瓣环平面。在多平面重建及彩色多普勒的指导下,夹子放置于返流最严重的区域。正交二维及实时三维心房图像指导夹臂垂直于二尖瓣的结合平面,夹臂打开置于二尖瓣叶下方的左室内。在持续监测下进行夹合、释放。术后再次对二尖瓣返流位置、程度,二尖瓣跨瓣压差以及肺静脉血流频谱进行测量,并与术前进行对比分析,必要时可进行补充夹合。
5.2.5 二尖瓣狭窄的介入治疗 Salem 等[129]首先报道了ICE指导下行PBMV,后续也有更多关于ICE指导下PBMV的系列病例报道[130-131]。ICE在术中指导房间隔穿刺,球囊定位,治疗效果评价以及监测并发症。ICE 测得血流动力学数据与TTE和心导管测得结果相当。然而,大多数患者可以在局麻联合TTE监测下进行PBMV,故ICE在PBMV 中的应用并没有显示出明显优势。
5.2.6 经导管二尖瓣置换术 冠状静脉窦电极导管联合ICE指导下的TMVR 可用于治疗生物瓣衰败或人工瓣环功能异常以及重度二尖瓣瓣环钙化(MAC)导致的重度二尖瓣关闭不全[132-133]。ICE 可指导术中房间隔穿刺、二尖瓣跨瓣、瓣膜定位释放、以及瓣膜释放后功能评估。
由于ICE成像的距离限制,因此在二尖瓣介入治疗后应注意保留左房的导丝,以便ICE 探头进入左房进行治疗效果的评价。尽管ICE在二尖瓣介入治疗中表现出很多优势,但由于相关应用经验较少、缺乏统一的操作规范以及3D ICE尚未普及等原因,目前不建议完全取代TEE。
专家建议:①ICE 在二尖瓣的介入治疗中对房间隔穿刺、评估二尖瓣的返流情况有较好的指导作用;②但是二尖瓣的介入治疗需要有较大的鞘管跨过房间隔进行操作,会影响ICE导管进入左房,且二尖瓣的治疗多数需要3D 影像的指导,故目前不作为主要推荐方法。
5.3 肺动脉瓣介入治疗
ICE可以清楚地显示右室流出道、肺动脉瓣以及近端肺动脉。因此,ICE在肺动脉瓣经导管介入治疗中有着良好的应用前景。目前关于ICE 在肺动脉瓣介入治疗中的应用经验还较少,仅限于指导经导管肺动脉瓣置换(transcatheter pulmonary valve replacement,TPVR)[134-135]。在右房中切面,ICE可评价三尖瓣功能,估算右室压力(若存在TR)。在右室流出道切面,除了显示流出道的解剖结构,还可以应用彩色多普勒和连续多普勒评价手术前后瓣膜返流及跨瓣压差情况。ICE 在术中还可以监测并发症的发生(如心包积液或血栓形成)。
ICE在肺动脉瓣中的应用流程见图16。
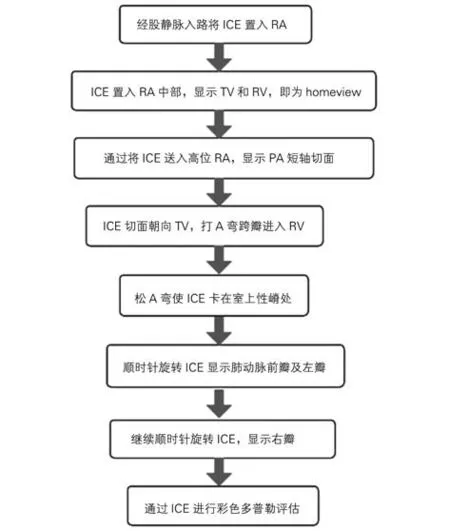
图16 ICE在肺动脉瓣介入中的应用流程
TPVR 术后感染性心内膜炎(infective endocarditis,IE)是一种潜在致命性并发症。既往研究提示,TPVR 术后IE和经导管肺动脉瓣相关IE 的发生率分别为5.1%和1.9%[136]。TEE是检测瓣膜赘生物,诊断IE 最常用的影像学方法。然而,由于肺动脉瓣距离食管超声探头较远,仍有部分病变无法通过TEE 探及。对于怀疑TPVR 术后IE 而TEE检测阴性的病例,ICE可以协助明确诊断[136-137]。
专家建议:①ICE在肺动脉瓣介入治疗中及并发症的评估有良好的作用,不逊于TEE;②肺动脉瓣介入治疗与ICE的入路一致,可能有互相干扰;③可推荐作为TTE 及TEE的一种有效的替代方案。
5.4 三尖瓣介入治疗
在老年人群中,TR 具有很高的发生率[138]。重度TR 患者的一年生存率仅有64%[139]。TR 药物治疗效果有限,而外科手术的死亡率较高[140]。因此,近些年出现各种经导管治疗技术,主要包括经导管缘对缘修复术,瓣环成形术及瓣膜置换术。TEE是三尖瓣介入操作的标准成像技术,但也存在着一些技术问题,如三尖瓣环位置与食管超声探头的距离较远;左心腔瓣膜假体和组织钙化会对成像造成干扰;输送系统等器械在超声下会形成声影。研究发现,在三尖瓣介入治疗中仅使用TEE 成像会有50%的病例三尖瓣结构未得到充分显示,其中2/3的病例可在ICE 的指导下植入夹子[141]。因此,在三尖瓣介入治疗的术中成像方面,ICE 可作为TEE的重要补充技术。
由于三尖瓣解剖结构复杂多变,三尖瓣介入治疗ICE成像平面并没有统一的标准。Hagemeyer等[142]对三尖瓣介入治疗中ICE的基本成像平面进行了归纳:在home view切面,将超声探头向前弯曲并朝向右房游离壁(左/右旋钮),轻微顺时针或逆时针旋转导管进行调整,这个视角通常垂直右室长轴,可根据与瓣叶的关系判断夹臂的位置,是抓捕瓣膜的理想视角。若需要清晰显示前-隔交界,可将导管推进至右房较高的位置,若需要清晰显示后-隔交界,则可以回撤导管。在介入操作中保持稳定的心腔内操作视野至关重要,需要有第二个操作者在术中协助固定或微调以获取最佳的成像平面。4D 容积成像ICE可能会为三尖瓣介入治疗带来巨大改变。4D 容积成像ICE对于三尖瓣瓣环尤其是外侧瓣环的显示优于TEE,可用于三尖瓣关闭不全的经导管瓣环成形,瓣膜修复和瓣膜置换术[140,143]。值得注意的是,静脉麻醉药物降低体循环压力而机械通气则可增加胸腔内压力,这些都会影响术中TR 的准确评估。在局麻清醒TR 患者中应用ICE系统,可避免这些影响,使得TR 的评估更加准确可靠。ICE在三尖瓣手术中的应用流程见图17。

图17 ICE在三尖瓣手术中的应用流程
专家建议:①ICE在经导管三尖瓣成形术中的影像不逊于TEE,甚至部分优于TEE;②推荐有咽喉或食管病变及麻醉禁忌者可接受ICE的指导;③3D/4D ICE的引导将对三尖瓣的介入治疗产生巨大推动作用。
5.5 瓣周漏介入治疗
外科心脏瓣膜置换术后长期随访发现,有5%~17%的患者发生PVL[144-145],TMVR 的PVL发生率是TAVR 的3倍[146]。PVL同样也是TAVR 重要的并发症之一,多见于早期的自膨胀瓣膜[147-148]。中重度PVL患者出现充血性心力衰竭和/或溶血时,需要进行干预治疗。外科手术修复或再次瓣膜置换是主要的干预手段,但手术死亡率较高。随着介入技术及封堵器械不断发展,越来越多的中心采用经皮瓣周漏封堵术治疗PVL,2020ACC/AHA 指南指出,对于外科手术高危或禁忌,NYHA Ⅲ/Ⅳ级或具有难治性溶血,解剖结构合适的PVL患者,推荐行经皮封堵治疗(Ⅱa级,证据等级B-NR)[149]。经皮PVL封堵术常规需要全麻且在TEE指导下进行,这无疑增加了很多风险。因此,ICE 在经皮PVL封堵中的应用具有很重要的意义。Ruparelia等[150]对ICE引导下经皮PVL封堵的有效性及安全性进行了一项回顾性研究。该研究的结果显示,ICE 指导下PVL 封堵成功率达到了77.8%,与TEE 相近,且未出现ICE 相关并发症。在术后随访中,78.6%的患者心衰症状得到改善,没有出现持续性溶血。术后30天未出现死亡,术后1年的生存率为71.4%。该研究结果提示ICE指导下的PVL 封堵具有较好的安全性及有效性。
ICE成像可在术中确定PVL 位置,指导房间隔穿刺,帮助器械选择,判断残余漏以及发现围术期并发症。对于主动脉瓣PVL,应用经股动脉逆行路径进行封堵。对于二尖瓣PVL,若瓣周漏位置靠近外侧(心房正对二尖瓣视野的6~10点方向),则采用房间隔穿刺顺向路径封堵,若PVL 位置靠近隔侧(心房正对二尖瓣视野的2~4点方向),则采用逆行路径封堵。对于大多数患者,ICE导管置于右房即可以得到满足手术的成像要求,极个别患者需要将ICE 导管放置在右室甚至左房。ICE指导下PVL封堵失败的患者仍可再次尝试封堵或其他治疗。尽管一次性导管增加了手术费用,但ICE指导下PVL 封堵避免了麻醉医生的需求,减少了手术操作时间。目前还没有关于ICE 指导下TAVR 术后PVL封堵的报道。由于目前市面上多数ICE 仅能通过二维和彩色多普勒评估返流束,且由于导管放置相关的安全性问题,其临床应用还受到很大限制。近期实时三维/容积成像的出现,可有助于ICE对于解剖结构的进一步显示,从而提高操作的成功率,具有良好的应用前景。
专家建议:①ICE 在主动脉瓣、二尖瓣PVL 中的应用值得推荐,尤其在不耐受TEE检查的患者;②3D/4D ICE 更有利于PVL介入治疗。
6 其他
6.1 ICE在左心耳封堵中的应用
在LAAC手术中,ICE以相较于TEE 更为灵活便捷的操作、更为丰富全面的观察角度、更为良好的耐受性及安全性、更低的X 线暴露及对比剂用量,正逐步受到越来越多术者及患者的青睐。几乎所有患者都可以很好地耐受局部麻醉下的ICE指导LAAC。多角度扫描及评估左心耳是其重点所在,将ICE 导管操作的灵活性与左心耳评估的系统性有机地结合,联合三维电解剖标测系统甚至可以实现零射线、零对比剂LAAC[151]。
由于ICE可避免TEE探头进入食管的不良反应及食管损伤,患者耐受性良好,因此LAAC 手术可在局部麻醉下完成。ICE导管到达右房后,通常推荐3个常规部位,即右房体部、右室流出道及冠状窦近段,对左房/左心耳进行逐层扫描,以排除可能存在的心房和心耳血栓,其中右室流出道为最佳排除血栓的扫描位置。在LAAC 术中,ICE 指导房间隔穿刺时,穿刺点高低的判断方法:选择房间隔下端膜部靠近肌部部位;穿刺点前后的判断方法:ICE 扇面与穿刺针头端和左上肺静脉嵴部位于同一个平面。成功穿刺房间隔后在X 线指引下,调整ICE导管头端朝向,沿导丝所在方向将ICE导管送入左房;也可在三维电解剖系统中,沿穿间隔标记点位置送入。
左心耳是心腔内的一个三维立体结构,因此对其尺寸的评估理应立体。ICE 导管送入左房内可以近距离和多角度扫描左心耳,避免了TEE 在心脏转位和心耳变异患者应用的局限性。多角度评估是ICE 指导LAAC 的重点,常规可通过正交垂直的三个解剖位置,即X 轴(左侧肺静脉)、Y 轴(右侧肺静脉口)和Z轴(二尖瓣环),进行长轴逐层扫描(如图18所示),测量左心耳口部、着陆区直径及有效工作深度,可更好地适应不同心耳迥异的解剖结构和轴向,并可在封堵器展开后同样立体地评估封堵器的位置、封堵效果、压缩及稳定性[152]。
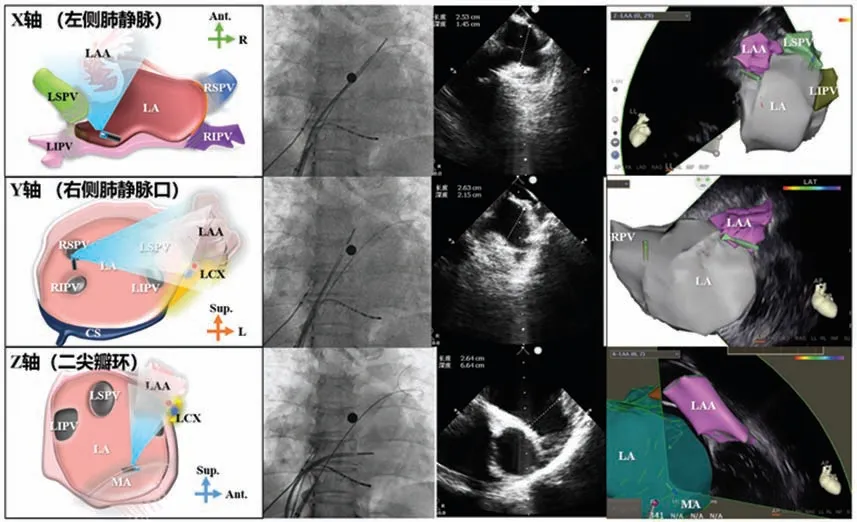
图18 多角度左心耳测量
ICE导管置于左上肺静脉内打P 弯,扇面指向左心耳。送猪尾导管至左心耳内,超声切面可见明显导管标记,据此定位着陆区及左冠状动脉回旋支位置。在猪尾导管指引下送输送鞘进左心耳口部(如图19A 所示)。明确显示进入左心耳的鞘管头端达到封堵所需深度,撤出猪尾导管,送封堵器(或固定盘)至左心耳着陆区。展开封堵器(Watchman封堵器)或固定盘(ACP或LAmbre封堵器),注意最大受力部位应位于左冠状动脉回旋支内侧(如图19B 所示)。随后继续展开封堵盘(ACP 或LAmbre封堵器,如图19C 所示)。必要时可行微回收或半回收操作以调整封堵器位置(如图19D 所示)。封堵器位置满意后,在ICE 指导下行牵拉测试(如图19E所示)。最后行彩色多普勒检查封堵器边缘是否存在残余分流(如图19F所示)。

图19 ICE指导下的LAAC过程
当封堵器(盘)展开后,应用ICE从多角度逐层扫描对封堵效果进行评估,包括封堵器位置、封堵严密性及稳定性。符合各封堵器的释放标准后(例:Watchman封堵器为PASS原则),完全释放封堵器,然后再次多角度ICE 检查,评估封堵器释放效果,排除封堵器移位情况和封堵器对邻近结构(如肺静脉、二尖瓣)的影响,观察有无心包积液等情况。如不符合释放原则,建议行回收操作(全回收/半回收/微回收),调整位置后重新展开,并再次评估展开效果。
尤应注意的是:①对于符合LAAC 适应证的房颤患者,在ICE引导下成功穿刺房间隔后,建议将ICE 导管经房间隔穿刺点送入左房或左上肺静脉内,从三个解剖学标志位置以正交垂直的“三轴六向”逐层扫描,评估左心耳的形态、大小、解剖结构。②根据造影和ICE测量的左心耳开口宽度和可用深度选择合适大小的封堵器,植入封堵器后,可通过造影和ICE确认没有大量的封堵器周围残余分流后,进行最后的牵拉试验以检查封堵器的锚定情况。
ICE指导LAAC封堵的应用流程见图20。
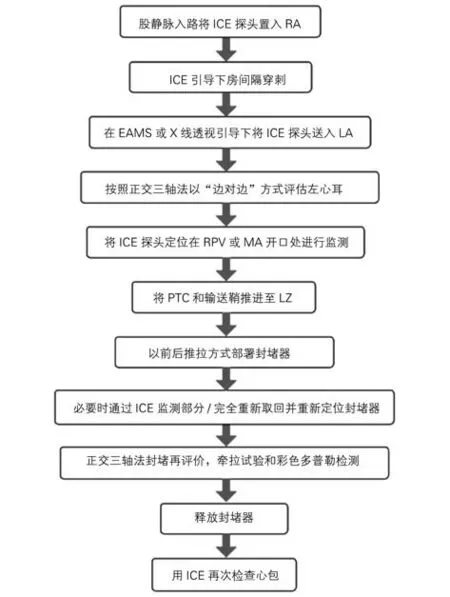
图20 ICE指导LAAC术的应用流程
6.2 ICE在妊娠患者的使用
妊娠期心律失常管理是一项重要挑战,妊娠期心律失常对母体和胎儿会造成许多不良影响。在治疗时,抗心律失常药物存在诸多弊端,如药物选择有限、不良反应显著、治疗无效等问题。传统导管消融尽管放射性暴露较小,但仍会给孕产妇及胎儿带来风险,故在特殊人群中应用受限[153]。
近年来,随着三维电解剖标测系统和ICE 技术的成熟,全程零射线导管消融手术得以实现,使导管消融治疗妊娠期心律失常成为可能,且并不局限于常规室上性心动过速和室早,更涵盖了房颤、室速等复杂心律失常类型。ICE 技术配合三维电解剖标测系统可使多电极导管可视化,有助于完成电极放置,在ICE指导下完成房间隔穿刺后,可进行后续的左心系统消融[154-156]。并且,ICE在妊娠期的应用并不局限于导管消融,也可实现起搏器植入、部分先天性心脏病介入的零射线治疗。但应注意的是,妊娠期零射线介入操作应严格把控适应证,充分权衡手术成功率、并发症、放射性暴露等风险,出于安全性的考虑,不可一味追求手术的完全零射线,需加强与妇产科团队以及麻醉科团队的合作。
6.3 ICE在植入左室辅助装置中的应用
ICE是指导左室辅助装置植入的可行选择,尤其是在其他成像模式不合适的情况下应予仔细考虑。但是,为了避免严重的医源性并发症,临床医生必须意识到经验的有限性、成像的局限性和与该技术相关的风险。在某些特殊情况下,X线、TTE和TEE由于临床因素不适用于植入左室辅助装置,这时ICE可以引导植入左室辅助装置的手术。而且与TTE和TEE相比,ICE 可用于需要正压通气和插管的患者。但是,ICE在心腔内可能导致在经主动脉瓣植入左室辅助装置后软导丝缠绕,这种情况下导线张力过大可能会导致血管穿孔这一潜在的并发症,并且ICE 在空间分辨率上的限制不能对降主动脉成像,这可能增加额外风险[157]。
ICE可作为TEE的替代或补充用于左室辅助装置围术期及术后管理。目前有个案报道ICE 用于左室辅助装置植入术后装置结构、血流动力学及相关并发症的评估[158-160,2-4]。
与TTE、TEE或三维计算机断层扫描相比,其优势在于成像质量高、无需全身麻醉、无需辐射暴露及恢复时间缩短[160,5]。ICE在左室辅助装置中的应用流程见图21。
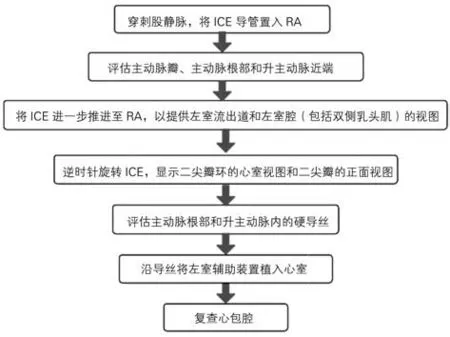
图21 ICE在左室辅助装置中的应用流程
6.4 ICE应用于心肌活检
ICE引导下的心内膜心肌活检(endomyocardial biopsy,EMB)是ICE的一个有趣的应用。ICE 能够实现精确活检定位,降低了与手术相关的风险,并减少了诊断性开胸手术的需要,对选定病例更具可操作性[161]。这种新的方法显著提高了活检诊断率,并减少了并发症[162]。
有报告报道了一系列右室占位患者在ICE 指导下安全有效地施行EMB,并为制定治疗策略提供必要的信息[161]。心脏转移性肿瘤和原发性心脏肿瘤的诊断均依赖于组织病理学分析。这一系列病例表明,EMB 是疑似肿瘤的心内肿块的术前诊断和手术计划有价值的工具,而ICE 对于心脏结构的精确定位和引导靶区活检取材的能力使得其应用得到进一步关注。ICE 可用于引导心脏占位EMB,其可准确定位活检靶区,降低手术相关风险,减少诊断性开胸手术,从而避免了对选定病例使用更具侵入性的诊断方法[161]。
疑似心律失常性心肌病及不明原因室性心律失常患者可行电解剖标测联合ICE 指导EMB,此方法可显著提高活检阳性率,并减少并发症[162]。
ICE在心肌活检中的应用流程见图22。

图22 ICE在心肌活检中的应用流程
6.5 ICE在梗阻性肥厚型心肌病的应用
室间隔射频消融术是目前治疗梗阻性肥厚型心肌病的一种新型的手术方式,其可行性已经被多项研究证明[163-164]。二尖瓣前叶与室间隔拍击区的准确定位是室间隔射频消融的关键。既往肥厚型心肌病室间隔消融过程中目标靶区的定位主要通过TEE与CARTO 系统的结合来实现[165]。术中持续的TEE监测因患者耐受有限而受限,同时全身麻醉、以及食管插管等也增加了胃食管损伤、误吸在内的其他手术风险[166]。另外,ICE 对于二尖瓣解剖结构的成像效果显著优于TEE,并且对于心脏整体结构的成像质量不劣于TEE[167]。既往研究证明ICE 可以提供室间隔的详细解剖结构信息[167]。CARTO-Sound实现了ICE 图像与三维定位系统图像的有机结合,可显示二尖瓣与室间隔拍击区的清晰图像,可指导消融大头选择性精准消融。应用ICE构建左室、左室流出道、二尖瓣前叶和主动脉根部三维模型,可精确描记室间隔梗阻部位(前叶与室间隔拍击区),同时术中可以实时监测消融导管贴靠和消融损伤情况。患者可在ICE指导下室间隔消融中获益,一项小样本研究显示,20例症状明显的梗阻性肥厚型心肌病患者,术前静息TTE 检查主动脉跨瓣压力阶差大于50 mm Hg,室间隔消融术后随访6个月,在局限于室间隔肥厚梗阻者、二尖瓣前叶较短者、乳头肌位置正常者中,NYHA 心功能分级明显改善,左室流出道压力和压力梯度明显下降[100]。另外,在一些小规模的研究中,也证实了ICE 指导肥厚性心肌病室间隔消融的可行性[163,168],期待未来进一步的研究结果。
6.6 ICE在肺动脉高压中的应用
在主动脉瓣狭窄合并肺动脉高压的高危患者中行TAVR,术中使用ICE取代右心导管进行肺动脉压力监测安全可行[169]。肺动脉高压的治疗以药物为主,而球囊房间隔造口术(balloon atrial septostomy,BAS)可作为药物治疗不佳等待肺移植的桥接治疗或姑息性治疗方法[170-171]。在ICE指导下,术者能够准确识别卵圆窝的位置及周围解剖结构,减少射线需求。已有研究证实ICE指导球囊或者植入性器械行房间隔造口术的可行性[172-175]。
在动物试验中证实ICE指导下行BAS联合射频消融术能有效减少房间隔造口后自发闭合的问题[176]。ICE 指导BAS展现出良好的应用前景。对药物治疗无效的严重肺动脉高压患者Potts分流术比BAS有一定的优越性:①它具有更可靠的通畅性;②该分流不会导致身体上部的持续性低氧血症,因此冠状动脉和脑循环不会受到影响。但该手术操作风险高,主要的风险来自于降主动脉和主肺动脉通道建立。未来可以通过4D ICE实时容积成像及多平面重建技术等手段对穿刺进行指导,可能会提高手术安全性,使该操作得到进一步推广应用,造福更多患者。此外,ICE 可以清楚地显示右室流出道,肺动脉瓣以及近端肺动脉。因此,ICE 在经皮穿刺肺动脉去交感神经消融治疗肺动脉高压中也有着潜在的应用前景。然而,ICE在肺动脉高压中的应用需要继续探索,需要相关临床研究进一步验证。
6.7 ICE在电极导线拔除术中的应用
随着起搏器等心脏电子植入装置的应用量逐渐增加,装置相关的并发症亦时常发生,如感染、血栓形成和装置故障等。经静脉电极导线拔除术(transvenous lead extraction,TLE)是治疗心脏电子植入装置相关感染的重要方法[177]。在TLE中,传统X 线透视、经TEE引导,以及术前CT 成像评估均存在各自的局限:透视下无法识别电极导线绝缘层等不显影组件的磨损和残留,无法评估电极导线与组织的粘连;CT 成像无法实时引导和评估;TEE 靠近心脏后方,对其他区域图像质量较差且重现困难等。
ICE作为一种独特的成像技术,术中能够指导TLE 或联合新技术应用,且安全可行[178-181]。ICE 可以在直视下评估电极导线情况、血栓、赘生物、电极导线“鬼影”以及导线与组织间的粘连,还可以及时发现电极导线周围强回声[182](LAEs,目前通常将其归类为血栓或赘生物,普遍存在于四分之三的电极导线植入病人,右房、三尖瓣、右室以及上腔静脉部位均有发现),预防栓塞等并发症;目前正在探索在ICE引导下去除LAEs。ICE术前对电极导线与血管、瓣膜、右房游离壁以及右心耳等组织粘连的评估具有重大意义,有助于高风险瓣膜的识别、电极拔除手术的风险评估、工具选择,有助于早期判断是否需转外科手术拔除或延迟拔除的手术决策;ICE在术中能够实现动态风险评估,实时监测并发症,准确识别电极导线拔除时由于牵拉在TEE下出现的假性心包压塞,以及动态评估三尖瓣瓣膜功能,对减少术后并发症和增加手术安全性具有重要意义。
ICE已广泛应用于射频消融等心脏介入手术中,基于上述优点,ICE同样适用于TLE。随着技术的进步以及三维超声成像的应用,未来ICE 的成像质量会进一步提高,因此,ICE指导TLE的应用前景较为明朗。
ICE引导电极拔除应用流程见图23。

图23 ICE引导电极拔除应用流程
除上述应用外,ICE 还可用于引导无导线起搏器、左束支起搏器等的植入。同时,对于已植入起搏器的患者,也可在ICE的帮助下完成零透视消融。然而,需要更多的临床证据来证明这些手术的可行性。
7 展望
无创影像学技术引导介入操作已经越来越成为现代介入性心脏病手术的标准做法,尤其近20年来,经胸超声、经食管超声和ICE 在介入手术的综合运用,能够改进图像质量同时减少甚或避免放射线透视和造影。并且,ICE 不需要全麻,在减少费用的同时减轻病人的痛苦,能够实时全程显示心脏的血流状态和血流速度,而且ICE 能够实时显示心肌的运动、心室肌纤维化和心室肌的厚度甚或室壁瘤,直视看到导管与局部组织接触的程度,甚至能够观察到消融过程中组织爆裂(steam pop)所产生的围绕消融导管尖端即刻的微泡状的回声[71,183],介入医师本人就可以完成操作ICE,有望增加介入手术的成功率,避免或者减少并发症。一旦发生类似于急性心包压塞、血栓前状态或者形成等情况,ICE 也能及时发现甚或早于临床症状出现前发现,使得临床医生能够尽早处理,挽救病人的生命。所以,ICE 渐已成为介入手术的标准流程[184]。随着ICE技术的不断进展,临床上已经有直径仅为8F的超声导管,这将进一步扩大ICE 的临床应用范围,如儿童心血管介入手术等。随着4D-ICE 的应用[143,185-186],图像质量进一步的提高和成本的降低等,相信ICE会得到更为广泛的应用,更好的服务于临床术者和广大病患。
作者名单及单位
钟敬泉 教育部和国家卫健委心血管重构与功能研究重点实验室,山东大学齐鲁医院心内科;山东大学齐鲁医院(青岛)心内科
龙德勇 首都医科大学附属北京安贞医院
马长生 首都医科大学附属北京安贞医院
王建安 浙江大学医学院附属第二医院
王祖禄 北部战区总医院
孔祥清 南京医科大学第一附属医院
付 华 四川大学华西医院
朱文青 复旦大学附属中山医院
刘 旭 上海交通大学附属胸科医院
刘兴鹏 首都医科大学附属北京朝阳医院
刘丽文 中国人民解放军空军军医大学第一附属医院
刘启明 中南大学湘雅二医院
刘 艳 教育部和国家卫健委心血管重构与功能研究重点实验室,山东大学齐鲁医院心内科
汤宝鹏 新疆医科大学第一附属医院
李 妍 第四军医大学第二附属医院唐都医院
李述峰 哈尔滨医科大学附属第二医院
李学斌 北京大学人民医院
李树岩 吉林大学第一医院
何建桂 中山大学附属第一医院
张 运 教育部和国家卫健委心血管重构与功能研究重点实验室,山东大学齐鲁医院心内科
张劲林 武汉亚洲心脏病医院
张晓春 复旦大学附属中山医院
张 薇 第四军医大学第二附属医院唐都医院
陈 茂 四川大学华西医院
陈明龙 南京医科大学第一附属医院
范 洁 云南省第一人民医院
周达新 复旦大学附属中山医院
郑良荣 浙江大学医学院附属第一医院
袁祖贻 西安交通大学医学院第一附属医院
夏云龙 大连医科大学附属第一医院
徐亚伟 上海市第十人民医院
徐 健 中国科学技术大学附属第一医院
唐 闽 中国医学科学院阜外医院
桑才华 首都医科大学附属北京安贞医院
董建增 郑州大学第一附属医院;首都医科大学附属北京安贞医院
蒋廷波 苏州大学附属第一医院
蒋晨阳 浙江大学医学院附属邵逸夫医院
韩学斌 山西省心血管病医院
储慧民 宁波市第一医院
舒茂琴 陆军军医大学第一附属医院
谢瑞芹 河北医科大学第二医院
薛玉梅 广东省人民医院
Luigi Di Biase Albert Einstein Collegeof Mwdicine at Montefiore Medical Center,美国,纽约
Paul C.Zei Brigham and Women′s Hospital,美国,波士顿

附录 执笔专家及撰写的有关内容

