生物钟基因Bmal1对结肠癌细胞增殖的影响
张博汝,魏 柏,石晓雅,谢梦丽
(华中科技大学同济医学院附属梨园医院肿瘤科,湖北 武汉 430077)
结肠癌是全球癌症高发病率和高病死率的主要原因之一,是男性人群的第三大最常见癌症,女性人群的第二大常见癌症,2018年全球癌症负担数据显示,结肠癌新发病例超过180万例[1]。目前,结肠癌常规治疗包括手术治疗和化学治疗,然而,手术治疗不适合晚期已经发生全身转移的患者,而化学治疗在杀伤肿瘤细胞的同时可能对患者产生多种毒副作用,因此,探索新的治疗靶点对提高患者的生存率至关重要。生物钟基因Bmal1 在不同肿瘤的发生、转移及预后中的作用不同,其具有促癌作用或者抑癌作用。研究表明,生物钟紊乱可增加结直肠癌患病的风险[2],但Bmal1基因对结肠癌MC38细胞的增殖能力的影响及机制目前研究报道较少。基于此,本研究通过体外细胞生物学和分子生物学实验,观察生物钟基因Bmal1对结肠癌细胞增殖能力的影响及其相关的分子作用机制,以期为临床结肠癌的诊治提供可能的生物标志物和靶点,从而改善患者预后。
1 材料与方法
1.1 细胞、主要试剂与仪器结肠癌MC38细胞由华中科技大学同济医学院附属协和医院肿瘤中心馈赠。RPMI 1640培养基购自美国Gibco公司,胎牛血清购自以色列BI公司,胰酶和青霉素-链霉素溶液购自陕西白鲨生物科技有限公司,Bmal1小干扰RNA(small interfering RNA,siRNA)和阴性对照(negative control,NC)siRNA由武汉奇景生物科技有限公司合成,HiPerFect转染试剂购自美国QIAGEN公司,细胞计数试剂盒-8(cell counting kit-8,CCK-8)购自赛文创新生物科技有限公司,RNA 提取试剂TRIzol购自天根生化科技有限公司,甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)、Bmal1、缺氧诱导因子-1α(hypoxia inducible factor-1α,HIF-1α)、血管内皮生长因子(vascular endothelial growth factor,VEGF)引物由武汉天一辉远生物科技有限公司合成,反转录试剂盒和实时荧光定量聚合酶链式反应(real-time quantitative polymerase chain reaction,RT-qPCR)试剂盒购自南京诺唯赞公司,放射免疫沉淀(radioimmunoprecipitation,RIPA)蛋白裂解液购自上海碧云天生物技术有限公司,二喹啉甲酸(bicinchoninic acid,BCA)蛋白检测试剂盒购自上海碧云天生物技术公司,兔GAPDH多克隆抗体、兔HIF-1α多克隆抗体、辣根过氧化物酶标记山羊抗兔二抗购自武汉塞维尔生物科技有限公司,兔Bmal1多克隆抗体购自武汉三鹰生物技术有限公司,兔VEGF 多克隆抗体购自武汉爱博泰克生物科技有限公司,CO2细胞培养和生物安全柜购自上海力申科学仪器有限公司。
1.2 实验方法
1.2.1 细胞培养和转染将小鼠结肠癌MC38细胞接种于含体积分数10%胎牛血清的RPMI 1640培养基;置于37 ℃、含体积分数5% CO2的恒温培养箱中培养,每1~2 d更换1次培养基;选择处于对数生长期的MC38细胞随机分为对照组和Bmal1基因沉默组,并接种于6孔板内,置于37 ℃培养箱中继续培养,按照HiPerFect转染试剂说明书进行转染,Bmal1基因沉默组细胞转染Bmal1 siRNA,对照组细胞转染NC siRNA。
1.2.2 CCK-8实验检测MC38细胞增殖能力取2组转染后的MC38细胞,吸去6孔板中培养基,收集细胞悬液转至离心管中,1 000 r·min-1离心5 min,弃上清,使用1 mL完全培养液重悬,反复轻轻吹打细胞,取 10 μL 细胞悬液进行细胞计数,按每孔2×103个细胞接种于96孔板,每组设4个复孔,一共铺3块板,标记为板1、2、3,以细胞贴壁为0 h,取出板1,每孔加10 μL CCK-8试剂,置于培养箱继续培养2 h后,用酶标仪在450 nm处测定每孔细胞吸光度值;并依次在培养24、48 h测板2、3每孔吸光度值,用吸光度值表示细胞增殖能力。实验重复3次,取均值。
1.2.3 RT-qPCR法检测MC38细胞中Bmal1、HIF-1α、VEGF mRNA相对表达量取2组转染后48 h 生长状态良好的MC38细胞,采用TRIzol法提取细胞中总RNA,并使用反转录试剂盒反转录为cDNA,以cDNA为模板,使用RT-qPCR试剂盒检测2组细胞中Bmal1、HIF-1α、VEGF mRNA相对表达量,按照说明书进行PCR。GAPDH上游引物序列为5′-TGCACCACCAACTGCTTAGC-3′,下游引物序列为5′-GGCATGGACTGTGGTCATGAG-3′;Bmal1上游引物序列为5′-TGCCACCAATCCATACACAG-3′,下游引物序列为5′-TTCCCTCGGTCACATCCTAC-3′;HIF-1α上游引物序列为5′-AATGAAGTGTACCCTAACTAGCCG-3′,下游引物序列为5′-GTTCACAAATCAGCACCAAGC-3′;VEGF上游引物序列为5′-ACAACAAATGTGAATGCAGACCA-3′,下游引物序列为5′-GAGGCTCCAGGGCATTAGAC-3′。反应体系:2×ChamQ SYBR qPCR Master Mix 5 μL;引物1.0 μL;50×ROX Reference DyeⅡ0.2 μL;cDNA 1.0 μL;dd H2O 2.8 μL。反应条件:预变性95 ℃ 30 s;循环反应 95 ℃ 10 s,60 ℃ 30 s,循环40次;融解曲线95 ℃ 15 s,60 ℃ 60 s,95 ℃ 15 s,循环10次。扩增结束后得到2组细胞Ct值,以GAPDH为内参基因,采用2-ΔΔCt法计算细胞中Bmal1、HIF-1α、VEGF mRNA的相对表达量。实验重复3次,取均值。
1.2.4 Western blot法检测MC38细胞中Bmal1、HIF-1α、VEGF蛋白的相对表达量取2组转染后48 h生长状态良好的MC38细胞,加入细胞裂解液,提取细胞中总蛋白;采用 BCA 法测定蛋白浓度,分别取10 μg蛋白样品进行十二烷基硫酸钠聚丙烯酰胺凝胶电泳,切胶后转膜至聚偏氟乙烯树脂膜上,于质量分数5% 脱脂奶粉中封闭 1 h。用Tris-HC1缓冲盐溶液洗膜3次,每次10 min,分别加入兔抗小鼠Bmal1、HIF-1α、VEGF一抗(滴度均为11 000),4 ℃过夜孵育;加入山羊抗兔二抗(滴度13 000),室温孵育1 h。使用电化学发光试剂显影,应用紫外凝胶成像系统拍照,Image J软件分析各个蛋白条带灰度值,目的蛋白的相对表达量以目的蛋白的灰度值与内参GAPDH的灰度值比值表示。实验重复3次,取均值。
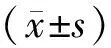
2 结果
2.1 2组细胞增殖能力比较结果见表1。细胞转染后0 h,Bmal1基因沉默组与对照组细胞增殖能力比较差异无统计学意义(P>0.05);细胞转染后24、48 h,Bmal1基因沉默组细胞增殖能力显著低于对照组,差异有统计学意义(P<0.05)。
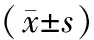
表1 2组细胞增殖能力比较
2.2 2组细胞中Bmal1 mRNA和蛋白相对表达量比较结果见表2和图1。细胞转染后48 h,Bmal1基因沉默组细胞中Bmal1 mRNA和蛋白相对表达量显著低于对照组,差异有统计学意义(P<0.05)。
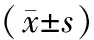
表2 2组细胞中Bmal1 mRNA和蛋白相对表达量比较

图1 2组细胞中Bmal1蛋白表达
2.3 2组细胞中HIF-1α、VEGF mRNA相对表达量比较结果见表3。细胞转染后48 h,Bmal1基因沉默组细胞中HIF-1α和VEGF的mRNA相对表达量显著低于对照组,差异有统计学意义(P<0.05)。
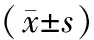
表3 2组细胞中HIF-1α和VEGF mRNA相对表达量比较
2.4 2组细胞中HIF-1α、VEGF蛋白相对表达量比较结果见图2和表4。细胞转染后48 h,Bmal1基因沉默组细胞中HIF-1α和VEGF蛋白相对表达量显著低于对照组,差异有统计学意义(P<0.05)。

图2 2组细胞中HIF-1α和VEGF蛋白的表达
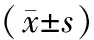
表4 2组细胞中HIF-1α和VEGF蛋白相对表达量比较
3 讨论
在哺乳动物中,位于下丘脑视交叉上核的主时钟和周围组织的外周时钟同步调控昼夜节律[3]。Bmal1基因作为碱性螺旋-环-螺旋蛋白-PAS结构域转录因子成员之一,控制其他核心昼夜节律基因,维持机体正常的昼夜节律性,除调节生物节律性的作用外,还与细胞周期进展、增殖和凋亡有关[4]。然而,具体的调节作用机制尚未完全明确,有研究提出,Bmal1 基因在病理状态下可以调控肿瘤坏死因子,进而调节p21表达并激活氨基末端激酶反应途径,从而促进肠上皮细胞再生来取代受损的上皮细胞[5]。MOMMA等[6]研究报道,结肠癌肿瘤组织中Bmal1表达水平显著低于癌旁组织,推测其低表达导致肠上皮细胞再生减少,从而促进结肠癌进展。程玉等[7]研究发现,敲除Bmal1基因表达可抑制SHH信号通路进而促进胃癌细胞的增殖,提示Bmal1基因在胃癌中是抑癌因素。本研究结果显示,Bmal1基因沉默组细胞中Bmal1 mRNA和蛋白相对表达量显著低于对照组,说明细胞Bmal1基因沉默成功;CCK-8实验结果显示,培养0、24、48 h Bmal1基因沉默组细胞增殖能力显著低于对照组,这提示Bmal1基因在结肠癌MC38细胞系中具有促癌作用,沉默 Bmal1 基因后可以抑制结肠癌细胞的增殖能力。
研究表明,肿瘤细胞内低氧状态可以增强血管生成、促进糖酵解、增加细胞侵袭及细胞存活、有利于免疫逃避,最终导致肿瘤的发生、发展和侵袭转移[8-10]。细胞通过缺氧诱导因子来感知和适应组织低氧环境,恶性肿瘤由于其快速增殖的特点,使肿瘤细胞长期处于低氧状态,进而导致缺氧诱导因子表达水平增加。研究报道,缺氧区域的存在是影响肿瘤预后的独立因素之一,如肺癌、胰腺癌、结肠癌等恶性肿瘤中 HIF-1α表达量增加,HIF-1α表达的变化和随后的代谢组学变化对肿瘤细胞和生理功能产生影响,最终影响患者的预后[11-12]。血管生成使肿瘤在氧气和营养供应不足的情况下继续生长,HIF-α表达水平决定了血管生成的强弱程度,不同于正常组织中新形成的血管,新生血管在肿瘤微环境中是杂乱无序,这使肿瘤内的缺氧程度更加明显,使肿瘤易于转移及扩散,同时也阻碍了免疫系统对肿瘤的杀伤作用[13-14]。VEGF是血管生成的关键作用因子,HIF-lα可通过缺氧激活的磷脂酰肌醇-3-激酶/苏氨酸蛋白激酶/雷帕霉素靶蛋白信号通路来调节VEGF蛋白的合成[15]。研究显示,体内的缺氧反应是由生物钟控制的[16],缺氧微环境和昼夜节律基因表达紊乱密切相关,而HIF-1α是连接缺氧信号和生物钟通路的关键调控点[17]。随着研究的深入,越来越多的证据显示,缺氧信号与昼夜节律之间相互干扰,这意味着HIF-lα可以调节生物钟基因的表达,而昼夜节律基因也可以影响 HIF-lα。有研究显示,在小鼠髓核细胞中发现Bmal1基因控制着HIF-lα的转录活性,一旦Bmal1被敲除,就会导致髓核细胞生长受限[18]。SOLECKI等[19]研究发现,VEGF表达水平与Bmal1的表达水平呈正相关,且Bmal1通过E-boxes调节VEGF的转录。孙宪春等[20]研究发现,激活HIF-1α/VEGF信号通路可促进胰腺癌细胞的增殖和迁移能力;WANG等[21]研究发现,Bmal1可能通过 HIF-1α通路调节VEGE的表达从而参与人胶质瘤细胞的血管生成,但是在结肠癌细胞中Bmal1和HIF-1α/VEGF通路之间的关系尚未见报道。本研究结果显示,Bmal1基因沉默组细胞中HIF-1α和VEGF的mRNA和蛋白表达水平显著低于对照组,这提示结肠癌细胞Bmal1基因沉默将降低HIF-1α和VEGF的表达,并通过抑制HIF-1α/VEGF,信号通路来抑制结肠癌细胞的增殖能力,在结肠癌细胞中可能存在Bmal1基因与HIF-1α/VEGF信号通路调控的相关性。
综上所述,结肠癌细胞中生物钟基因 Bmal1可通过调节HIF-1α/VEGF信号通路影响结肠癌细胞的增殖能力,这为结肠癌的治疗奠定一定的理论基础;但是,有关调控结肠癌细胞增殖能力的其他分子机制尚有待进一步研究。

