益气清热活血方不同制剂对创伤性肌肉损伤兔肌肉组织中水通道蛋白-1及血清白细胞介素-8表达水平的影响
佘锐豪,蒋顺琬,钟 静,何富平
(广州中医药大学第四临床医学院/深圳市中医院骨伤科,广东 深圳 518033)
创伤性肌肉损伤是最常见的损伤之一,也是临床上最常见的运动性疾病之一[1]。肌肉损伤分为挫伤、拉伤、撕裂伤[2]。美国的调查研究显示,挫伤、拉伤约占所有运动损伤的90%[3],其中由钝器、非穿透性物体撞击所造成的肌肉挫伤最为常见[4]。臀部肌肉是骨骼肌挫伤的最常见部位之一,人类身体下肢出现挫伤的概率更大[5],在临床上屡见不鲜,尤其多见于运动员、下肢不稳的老年人、搬运工等。创伤性肌肉损伤可引起局部发热、疼痛、肿胀、皮下淤血[6],甚至影响肢体功能,临床处理不当或不及时,会对肌肉容量产生持续性的影响以及难以逆转的损害。康复缓慢、治疗方式不当而出现运动功能不全的患者,有发生二次损伤和瘢痕组织形成的风险[2]。
我国传统医学在治疗创伤性肌肉损伤方面有着丰富的经验和得天独厚的优势,自汉代起,中医外科学就起着举足轻重的作用,其流传至今仍有许多中药外用制剂,如酊剂、油剂、软膏剂、膏药、散剂等[7]。到了近代又发展出了橡胶贴膏剂、靶向制剂、巴布膏剂等[8-9],其中巴布膏剂自20世纪传入我国后,以其载药量大、不污染衣物、对皮肤刺激性小、保湿性良好等优点被广泛使用[10];近年来其工艺日渐成熟而逐步走向工业化,大量投入临床应用。但在与中医药结合时,因复方药大多组成复杂,成分繁多,提取困难,中药巴布膏的疗效容易受到影响[11]。因此,在临床使用中药外用制剂治疗创伤性肌肉损伤时,同一复方制备的传统工艺和现代制剂的治疗效果对比一直存在争议,其中传统浸渍剂和现代巴布膏贴剂均是当前被广泛运用于临床的制剂,但关于二者疗效对比的动物实验尚未见相关报道。基于此,本研究比较了清热益气活血方的传统浸渍剂与现代巴布膏贴剂治疗兔创伤性肌肉损伤的效果,旨在为清热益气活血巴布膏在临床中的应用提供依据。
1 材料与方法
1.1 实验动物40只3月龄普通新西兰雄兔由广东省医学实验动物中心提供,体质量200~350 g。将兔置于(24±1)℃的环境中,进行12 h/12 h的光暗循环,每日定时清理并更换新鲜垫料,保证充足且适量的食物和水。实验前实验主要人员与雄兔共处1周。本实验遵循赫尔辛基宣言和中国相关法律法规,获得深圳市中医院实验动物管理及伦理委员会批准。
1.2 主要药物、试剂与仪器清热益气活血浸渍液(院内制剂,由黄芪、黄连、黄芩、栀子、地榆、大黄、红花、冰片等中药组成,除冰片外其余药材用清水漂洗1遍,加入蒸馏水并进行煎煮得到煎煮液,将冰片溶于体积分数95%乙醇后加入煎煮液,装瓶加铝盖高温灭菌后备用)、清热益气活血巴布膏贴(院内制剂,由黄芪、黄连、黄芩、栀子、地榆、大黄、红花、冰片等中药组成,以上药物用乙醇回流提取,过滤,回收乙醇,制成浸膏。并将上述浸膏加入由聚丙烯酸钠、聚乙二醇、羧甲基酸钠、明胶为主要材料制成的半固体基质中,充分搅拌均匀并再次过滤,涂布盖衬制成后备用)、不含药物的巴布膏贴(除不含药物,余制法同清热益气活血巴布膏贴),80 g·L-1硫化钠脱毛剂、磷酸盐缓冲液(phosphate buffered saline,PBS)购自德国ASPEN公司,RNA Loading Buffer购自日本TaKaRa公司,TRIzol试剂、无水乙醇购自上海国药集团化学试剂有限公司,SuperReal PreMix Plus(SYBR Green)购自天根生化科技(北京)有限公司,兔白细胞介素-8(interleukin-8,IL-8)酶联免疫吸附试验(enzyme linked immunosorbent assay,ELISA)试剂盒购自江苏苏联科生物科技有限公司,水通道蛋白-(aquaporin-1,AQP-1)抗体购自美国Genetex公司,蛋白Marker购自美国Thermo公司;实时荧光定量聚合酶链反应(polymerase chain reaction,PCR)仪购自瑞士Roche公司,酶标仪购自中国无锡华卫德朗仪器有限公司,台式离心机购自上海安亭科学仪器厂,水浴锅购自金坛市江南仪器厂,DNA电泳系统及电泳槽、凝胶成像系统购自美国Bio-Rad公司,超低温(-80 ℃)冰箱购自美国Thermo公司。
1.3 实验方法
1.3.1 实验动物分组、干预及损伤症状评分将40只兔随机分为空白组、模型组、浸渍组和巴布膏组,每组10只。空白组兔不给予任何干预措施;模型组、浸渍组和巴布膏组兔参照文献[5,12-13]制备创伤性肌肉损伤模型。造模前对兔右侧大腿外侧根部直径2.5 cm区域进行脱毛,脱毛后由3名人员分别对兔进行损伤症状评分[14],剔除评分>1分的兔。其中空白组剔除1只兔,其余兔均符合要求进行造模(平均症状损伤评分>2.5分视为造模成功)。造模成功后40 min,模型组兔用不含药物的巴布膏贴剂贴于患处,并用医用胶布加强固定,每日1次,每次10 h;浸渍组兔用棉签蘸取适量清热益气活血浸渍液涂擦于患处,每日3次;巴布膏组兔用清热益气活血巴布膏贴剂贴于患处,并用胶布加强固定,每日1次,每次10 h。治疗24、72 h后由3名实验外人员分别对兔独立进行损伤症状评分(皮下淤血、肌肉肿胀、肌肉颜色),并计算平均分。
1.3.2 ELISA法检测血清中IL-8水平治疗24 h后分别于各组随机选取5只兔(治疗72 h后选取剩余兔),将兔仰卧位固定于兔台,扪及心脏搏动最强点,以此为圆心将周围直径约2 cm的区域脱毛、标记、消毒,采集10 mL血液[15],装入一次性真空负压含乙二胺四乙酸二钾抗凝管。当天全部样本采集结束后,离心取血清,采用ELASA法检测血清中IL-8水平。从室温平衡20 min后的铝箔袋中取出所需板条,剩余板条用自封袋密封放回4 ℃。设置标准品孔和样本孔,标准品孔各加入不同浓度的标准品50 μL。样本孔中加入待测样品50 μL;空白孔不加。除空白孔外,标准品孔和样本孔中每孔加入辣根过氧化酶标记的检测抗体100 μL,用封板膜封住反应孔,37 ℃恒温箱温育60 min。弃去液体,吸水纸上拍干,每孔加满洗涤液(350 μL),静置1 min,甩去洗涤液,吸水纸上拍干,反复洗板5次。每孔加入底物A、B各50 μL,37 ℃避光孵育15 min。每孔加入终止液50 μL,15 min后在450 nm波长处测定各孔的吸光度(absorbance,A)值。以标准品的A值为横坐标,标准品的浓度为纵坐标,绘制标准曲线,得出回归方程,将样品的A值代入方程,计算样品的浓度。
1.3.3 荧光定量PCR法检测肌肉组织中AQP-1 mRNA的表达测完血清中IL-8水平后麻醉处死各组兔,将兔固定于兔台,充分暴露右侧大腿外侧,取打击区域中心一块约1 cm×1 cm×1 cm新鲜组织,PBS清洗后剪碎(任一方向<0.5 cm),置于-80 ℃冰箱保存。当天全部样本采集结束后,采用TRIzol法提取RNA样品,并使用酶标仪进行定量,采用A260/A280判断RNA纯度。将RNA样品进行电泳,同时加入少量RNA酶抑制剂,预防电泳过程中RNA降解影响结果。取RNA样本1 μg加入引物1 μL,无酶水加至12 μL,65 ℃水浴5 min。冰上操作,依次加入反应缓冲液4 μL、RNA酶抑制剂 1 μL、脱氧核糖核苷三磷酸 2 μL及反转录酶1 μL;依次25 ℃水浴5 min、42 ℃水浴60 min、72 ℃水浴5 min得到cDNA样品。AQP-1上游引物序列为5′-CTTCAACAACCACTGGATCTTCTG-3′,下游引物序列为5′-GTTGATGTCATCGCCGTCCA-3′;以β-actin为内参,其上游引物序列为5′-CTTCAACAACCACTGGATCTTCTG-3′,下游引物序列为5′-GTTGATGTCATCGCCGTCCA-3′。取cDNA样品及引物进行荧光定量PCR反应,反应条件:95 ℃预变性15 min、95 ℃变性10 s、60 ℃退火30 s、72 ℃延伸30 s,循环45次,计算Ct值。采用2-△△Ct法计算AQP-1 mRNA相对表达量,实验重复3次,取均值。
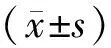
2 结果
2.1 4组兔损伤症状评分比较结果见表1。脱毛后,4组兔损伤症状评分比较差异均无统计学意义(P>0.05)。造模后和治疗24、72 h时,模型组、浸渍组和巴布膏组兔损伤症状评分显著高于空白组,差异有统计学意义(P<0.05)。造模后、治疗24 h时,模型组、浸渍组和巴布膏组兔损伤症状评分比较差异均无统计学意义(P>0.05)。治疗72 h时,浸渍组和巴布膏组兔损伤症状评分显著低于模型组,差异有统计学意义(P<0.05);浸渍组与巴布膏组兔损伤症状评分比较差异无统计学意义(P>0.05)。
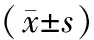
表1 4组兔损伤症状评分比较
空白组兔不同时间点损伤症状评分比较差异无统计学意义(P>0.05)。模型组、浸渍组、巴布膏组兔造模后及治疗24、72 h时的损伤症状评分均显著高于脱毛后,差异有统计学意义(P<0.05)。模型组兔治疗24、72 h时的损伤症状评分与造模后比较差异无统计学意义(P>0.05);模型组兔治疗 72 h时的损伤症状评分显著低于治疗 24 h 时,差异有统计学意义(P<0.05)。浸渍组兔治疗 24 h时的损伤症状评分与造模后比较差异无统计学意义(P>0.05);浸渍组兔治疗72 h时的损伤症状评分显著低于造模后,差异有统计学意义(P<0.05);浸渍组兔治疗72 h时的损伤症状评分显著低于治疗24 h时,差异有统计学意义(P<0.05)。巴布膏组兔治疗24、72 h时的损伤症状评分显著低于造模后,差异有统计学意义(P<0.05);巴布膏组兔治疗72 h时的损伤症状评分显著低于治疗24 h时,差异有统计学意义(P<0.05)。
2.2 4组兔血清中IL-8水平比较结果见表2。治疗24 h时,模型组、浸渍组、巴布膏组兔血清中IL-8水平均显著高于空白组,差异有统计学意义(P<0.05);浸渍组与模型组兔血清中IL-8水平比较差异无统计学意义(P>0.05);巴布膏组兔血清中IL-8水平显著低于模型组,差异有统计学意义(P<0.05);巴布膏组与浸渍组兔血清中IL-8水平比较差异无统计学意义(P>0.05)。治疗72 h时,模型组、浸渍组、巴布膏组兔血清中IL-8水平均显著高于空白组,差异有统计学意义(P<0.05);浸渍组、巴布膏组兔血清中IL-8水平显著低于模型组,差异有统计学意义(P<0.05);巴布膏组与浸渍兔血清中IL-8水平比较差异无统计学意义(P>0.05)。
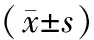
表2 4组兔血清中IL-8水平比较
空白组、模型组兔治疗24 h时与治疗72 h时血清中IL-8水平比较差异无统计学意义(P>0.05)。浸渍组、巴布膏组兔治疗72 h时血清中IL-8水平显著低于治疗24 h时,差异有统计学意义(P<0.05)。
2.3 4组兔肌肉组织中AQP-1 mRNA相对表达量比较结果见表3。治疗24 h时,模型组、浸渍组、巴布膏组兔肌肉组织中AQP-1 mRNA相对表达量显著高于空白组,差异有统计学意义(P<0.05);模型组、浸渍组、巴布膏组兔肌肉组织中AQP-1 mRNA相对表达量比较差异均无统计学意义(P>0.05)。治疗72 h时,模型组、浸渍组、巴布膏组兔肌肉组织中AQP-1 mRNA相对表达量显著高于空白组,差异有统计学意义(P<0.05);浸渍组和巴布膏组兔肌肉组织中AQP-1 mRNA相对表达量显著低于模型组,差异有统计学意义(P<0.05);巴布膏组与浸渍组兔肌肉组织中AQP-1 mRNA相对表达量比较差异无统计学意义(P>0.05)。
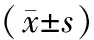
表3 4组兔肌肉组织中AQP-1 mRNA相对表达量比较
空白组、模型组兔治疗24 h时与治疗72 h时肌肉组织中AQP-1 mRNA相对表达量比较差异无统计学意义(P>0.05);浸渍组、巴布膏组兔治疗72 h时肌肉组织中AQP-1 mRNA相对表达量显著低于治疗24 h时,差异有统计学意义(P<0.05)。
3 讨论
骨骼肌组织暴露于人体最外层,作为保护人体免于外伤的第1道屏障,在各类损伤中首当其冲。随着对骨骼肌研究的深入,越来越多的学者开始关注结缔组织的作用[16-17]。创伤性肌肉损伤是常见的运动损伤之一,当肌肉受到突然而沉重的钝器打击时会发生肌肉挫伤,肌纤维撕裂、组织出血和水肿是肌肉急性损伤的典型特征[18-19]。肌纤维遭受破坏后,随即出现出血、肿胀及炎症反应,细胞内IL-8、AQP-1等炎症因子浸润[20-24]。之后IL-8、AQPs等炎症因子作为中性粒细胞的主要化学引诱剂,对中性粒细胞进行诱导趋化,进而诱发中性粒细胞的“呼吸爆发”,进一步加重炎症反应。因此,IL-8、AQP-1也被视为炎症反应的重要相关指标[25-28]。基于此,本研究通过比较益气清热活血方的浸渍剂与巴布膏剂对创伤性肌肉损伤雄兔肌肉组织中AQP-1和血清中IL-8表达水平的影响,探讨益气清热活血方不同制剂治疗创伤性肌肉损伤的效果。
崔晓娟等[29]认为,清热活血中药具有一定的抗炎作用。临床和动物实验证明,清热益气活血外治法治疗肌肉损伤疗效显著[12,30]。传统中药外用制剂有酊剂、油剂、膏剂、浸渍剂等[31],其中浸渍剂以其制取方便、使用快捷、疗效显著而被广泛使用。但浸渍剂存在需要多次涂擦、晾干,患者等待的时间较长及涂擦范围大、涂擦后易留下药液痕迹和气味等缺点。本研究团队多年来运用清热益气活血外治法治疗创伤性肌肉损伤积累了一定经验,并以“黄连解毒汤”化裁(黄芪、黄连、黄芩、栀子、地榆、大黄、红花、冰片)为主要药物,利用现代巴布膏制剂工艺制成了“清热益气活血巴布膏”,欲在运用清热益气活血方快速解决病痛的同时,与具有透气性强、黏合性高、防水性好、过敏反应低等有优点的巴布膏剂相结合,给患者带来更好的治疗效果。本研究中用到的2种中药外用剂型——清热益气活血浸渍剂、清热益气活血巴布膏剂,均为本院院内制剂,中药成分相同。
在本研究中,因脱毛剂使用不当,致空白组1只兔右侧大腿外侧出现明显灼伤及皮损,为排除影响,将该样本剔除。本研究结果显示,脱毛后各组兔损伤症状评分比较差异无统计学意义;造模后,模型组、浸渍组、巴布膏组症状损伤评分均显著高于空白组,说明造模成功。模型组兔治疗24 h时损伤症状评分与造模后比较差异无统计学意义,IL-8、AQP-1显著高于空白组,治疗72 h时各指标较于 24 h 均出现轻微的下降趋势,这说明在自然状态下,兔受到创伤性肌肉损伤后在炎症刺激下IL-8、AQP-1水平均明显升高,并持续一段时间,在72 h后开始缓慢下降。实验中观察到,雄兔大腿具有较强的自愈能力,造模后2~3 d往往可以观察到较为明显的症状缓解及恢复。治疗24 h后,浸渍组兔损伤症状评分、IL-8水平较模型组有轻微下降,而AQP-1较模型组有轻微上升,但差异均无统计学意义;同时,巴布膏组与模型组损伤症状评分、AQP-1 mRNA相对表达量比较差异无统计意义,仅2组的IL-8比较差异有统计学意义。这说明治疗24 h后,清热益气活血方的不同制剂并未明显起效。治疗72 h后,浸渍组与巴布膏组兔症状损伤评分、血清中IL-8水平和肌肉组织中AQP-1表达量均较治疗24 h 显著下降,且显著低于模型组;浸渍组与巴布膏组兔上述各指标比较差异无统计学意义。这说明治疗72 h后,清热益气活血方的2种制剂均可有效改善创伤性肌肉损伤兔的上述各项指标。
综上所述,清热益气活血方治疗创伤性肌肉损伤效果显著,这种效果可能与抑制AQP-1及IL-8的表达有关,且浸渍剂与巴布膏剂的治疗效果接近。在临床上使用时,清热益气活血浸渍剂具有制取方便、使用快捷、价格更低廉的优点,是治疗创伤性肌肉损伤不错的选择,而对于一些对外观、治疗时间有要求的患者来说,可以选择清热益气活血巴布膏进行治疗。另外,本实验在制备创伤性肌肉损伤模型时发现,用成年雄兔制备模型存在2个问题:一是成年雄兔毛生长迅速,容易遮挡视野,干扰损伤症状评分;二是成年雄兔大腿肌肉发达,自愈能力强,在造模后72 h往往可以观察到雄兔状态好转和症状缓解,因此,在制备创伤性肌肉损伤模型时可以考虑使用大鼠。未来可对2种制剂进行临床研究,以进一步验证2种制剂的临床治疗效果。

