LIMK1高表达通过LIMK1/cofilin1通路促进人结肠癌SW480细胞增殖、迁移与侵袭
潘志兵, 李娟, 苏坚, 夏红, 刘芳, 苏琦
(1.南华大学衡阳医学院肿瘤研究所 湖南省肿瘤细胞与分子病理学重点实验室,湖南省衡阳市 421001;2.娄底市中心医院消化内科,湖南省娄底市 417000;3.南华大学衡阳医学院附属第二医院,湖南省衡阳市 421001)
结肠癌是最常见的恶性肿瘤之一,其发病率与死亡率分别居于全球第三位与第二位[1]。由于结肠癌患者就诊时大多已发生侵袭转移,从而手术、化疗、放疗等疗效差,死亡率高于50%[2]。因此,研究结肠癌侵袭转移的分子机制,寻找其关键标记,为靶向干预治疗及对结肠癌的防治具有重要意义。
LIM激酶1(LIM domain kinase 1,LIMK1)为丝氨酸/苏氨酸蛋白激酶家族成员,可通过磷酸化和失活肌动蛋白解聚因子cofilin调节肌动蛋白聚合,调控肿瘤细胞增殖、细胞周期与侵袭转移等[3]。大量文献表明,LIMK1在人类各种类型癌症中异常调控,促进癌症进展[3-8]。课题组前期工作证明,LIMK1在胃癌与结肠癌中高表达与肿瘤大小、淋巴结转移及TNM分期有关[9-10]。本研究探讨LIMK1高表达对人结肠癌SW480细胞增殖、迁移、侵袭的影响。
1 材料和方法
1.1 主要试剂
LIMK1与β-actin抗体(Abcam公司),p-LIMK1、cofilin1、p-cofilin1(Abzoom公司),Rac1(Millipore公司),Pak1(Epitomics公司),Total RNA Kit(Omega公司),RT reagent Kit、pMD18-T vector(TaKaRa公司),PCR试剂盒(Promega公司),DNA凝胶回收试剂盒(Axygen公司),真核表达质粒pIRES2-EGFP、LipofectamineTM2000、杀稻瘟菌素、oligo DNA、platinum Pfx DNA Polymerase(Invitrogen公司),BglII、SalI、T4 DNA ligase(NEB公司),BCA蛋白定量试剂盒(Pierce公司),ECL发光检测试剂盒(北京中杉金桥生物技术有限公司),质粒抽提试剂盒与壮观霉素(Sigma公司),Transwell小室(Corning公司),Matrigel(BD公司),小牛血清(杭州四季青生物工程公司),RPMI-1640培养基(Gibco公司)。
1.2 细胞培养及分组
人结肠癌SW480细胞系南华大学肿瘤研究所保存。培养于10%新生牛血清的RPMI-1640培养液中,37 ℃、5%CO2恒湿培养箱中传代培养。实验分为空载体组、SW480组、LIMK1高表达组(LIMK1/SW480组)。
1.3 构建真核表达载体
设计与合成引物序列LIMK1:F 5′-GGGGCATCATCAAGAGCA-3′,R 5′-CCAGGCAGTTGTGGGAGT-3′。将合成好的LIMK1序列装入pMD18-T载体,再转化至感受态细胞DH5α。BglII/SalI将TA克隆质粒酶切,37 ℃酶切2 h,酶切体系:10×buffer 5 μL,TA克隆质粒5 μL,BglII 1 μL,SalI 1 μL,ddH2O 38 μL。BglII/SalI将pIRES2-EGFP酶切,37 ℃酶切2 h,酶切体系:10×buffer 5 μL,pIRES2-EGFP 2 μL,BglII 1 μL,SalI 1 μL,ddH2O 41 μL。电泳并回收酶切的LIMK1片段。用T4 DNA ligase连接回收的片段与载体,室温连接2 h。从每个转化平板上分别挑取4个克隆,摇菌并抽提质粒进行测序验证。
1.4 建立稳定高表达LIMK1基因SW480细胞
1×105/mL SW480细胞接种于6孔培养板,培养24 h后,取出6孔板,无血清RPMI-1640培养基洗涤3次,再换1.5 mL无血清Opti-MEM培养基洗涤3次,放回培养箱中。将4.0 μg的质粒DNA(pIRES2-EGFP-LIMK1真核表达载体和pIRES2-EGFP空载体)用无血清的Opti-MEM稀释,最终体积为250 μL,并标记为A液。10 μL LipofectamineTM2000加到240 μL无血清Opti-MEM培养基中混匀,标记为B液。孵育5 min后,将A与B液混合得到C液,混匀后室温中孵育20 min。将500 μL C液加到6孔培养板,轻轻摇匀,培养6 h,吸弃原培养液,更换为含10%胎牛血清的Opti-MEM培养液。48 h后将孔内细胞以1∶10比例传代。培养24 h后,用含G418终质量浓度为500 mg/L的RPMI-1640完全细胞培养基继续培养并筛选阳性克隆SW480细胞,隔天换液1次,连续培养14天后,挑取发绿色荧光的阳性克隆细胞至96孔板,待形成阳性单克隆细胞后再挑取至24孔板扩大培养,以250 mg/L G418作为维持质量浓度,反复3~4次,最后移入培养瓶培养并冻存。
1.5 RT-PCR检测
RNA试剂盒提取细胞总RNA,AMV酶作用下反转录合成cDNA。PCR引物序列:LIMK1:F 5′-GGGGCATCATCAAGAGCA-3′,R 5′-CCAGGCAGTTGTGGGAGT-3′,138 bp;β-actin:F 5′-ACACTGTGCCCATCTACGAGGGG-3′,R 5′-TGATGGAGTTGAAGGTAGTTTCGTGGAT-3′,367 bp。PCR反应条件:94 ℃,5 min;94 ℃,40 s;52.3 ℃,45 s;72 ℃ 80 s,28个循环;72 ℃ 10 min。5 μL的PCR产物经1%的琼脂糖电泳,嗅化乙啶染色,IS1000图像分析软件读取条带灰度值。
1.6 Western blotting
收集细胞,提取细胞总蛋白,BCA法测定。每组取等量样本进行凝胶电泳,电泳后转膜,封闭1 h,加一抗,4 ℃过夜,TBST洗膜,加二抗孵育1 h,洗膜,采用ECL发光法,最后X片曝光、显影、定影。
1.7 MTT检测
取对数生长期SW480细胞,接种到96孔板,每组设置6个复孔;细胞贴壁4~6 h后,更换细胞培养基为150 μL RPMI-1640完全细胞培养基,再加入20 μL 5 g/L MTT溶液,培养4 h;吸弃上清液,加入150 μL DMSO溶液;摇床上平摇10~15 min,酶联免疫检测仪测量各孔在570 nm处光密度值(OD)。细胞增殖抑制率(%)=(1-实验组OD570/对照组OD570 nm)×100%。
1.8 流式细胞术检测
取对数生长期SW480细胞,4 ℃预冷PBS液重悬细胞,800 r/min离心5 min,加入4 ℃预冷70%乙醇固定。检测前,将固定的细胞800 r/min离心5 min,预冷PBS液洗涤1次,加入RNA酶50 μL,37 ℃水浴30 min,然后加1 g/L碘化丙啶50 μL,避光振荡混匀,4 ℃放置30 min,300目尼龙网滤过,上机检测,进行细胞周期分析。
1.9 划痕实验
调整细胞为1×106/mL,吸1 mL细胞悬液接种于6孔板,每组3个平行样本。RPMI 1640培养液37 ℃、5%CO2培养,直至形成细胞单层。用Eppendorf Tip在细胞板上划痕,无血清培养液洗细胞3次,加新鲜无血清培养基。显微镜下测量划痕区相对距离,实验重复3次。
1.10 侵袭实验
将基质胶稀释液铺置在Transwell小室中,放置成膜。100 μL细胞稀释液接种至小室上腔,取500 μL含10%胎牛血清培养液添加至下腔,小室放置在37 ℃、5%CO2的培养箱中培养36 h后取出,擦弃小室上层细胞并用4%多聚甲醛固定10 min,0.1%结晶祡染色。显微镜下随机选取4个高倍视野进行细胞计数,取平均值。每组细胞设3个复孔,实验重复3次。
1.11 统计学分析
2 结 果
2.1 LIMK1高表达SW480稳定细胞系构建
LIMK1基因cDNA序列与真核表达载体pIRES2-EGFP连接,获得pIRES2-EGFP-LIMK1重组真核表达载体,取部分质粒进行BglII和SalI双酶切鉴定(图1A)。抽提质粒后进行测序,插入序列与LIMK1全长cDNA的GenBank序列完全一致,表明LIMK1全长cDNA已经成功连接到pIRES2-EGFP载体上。将重组质粒转染SW480细胞24 h后,倒置荧光显微镜可见绿色荧光。加入G418(500 mg/L)筛选14天后,可见阳性克隆细胞(图1B),挑选克隆细胞加G418继续培养(图1C)。
转染空载体的SW480细胞LIMK1 mRNA和蛋白表达与SW480细胞均无明显差异(P>0.05)。LIMK1真核表达载体转染SW480细胞后,LIMK1 mRNA和蛋白表达均明显增加(P<0.05),表明成功构建稳定高表达LIMK1基因的SW480细胞(图1D和E)。

图1 LIMK1高表达SW480细胞的构建
2.2 LIMK1高表达对SW480细胞增殖、细胞周期的影响
LIMK1/SW480组细胞增殖能力高于SW480组和空载体组(P<0.05;图2A),提示LIMK1高表达对SW480细胞增殖具有促进作用。
LIMK1/SW480组G2/M期细胞百分率较SW480组和空载体组明显降低(P<0.05)。表明LIMK1高表达可抑制SW480细胞G2/M期阻滞作用(图2B、C、D)。
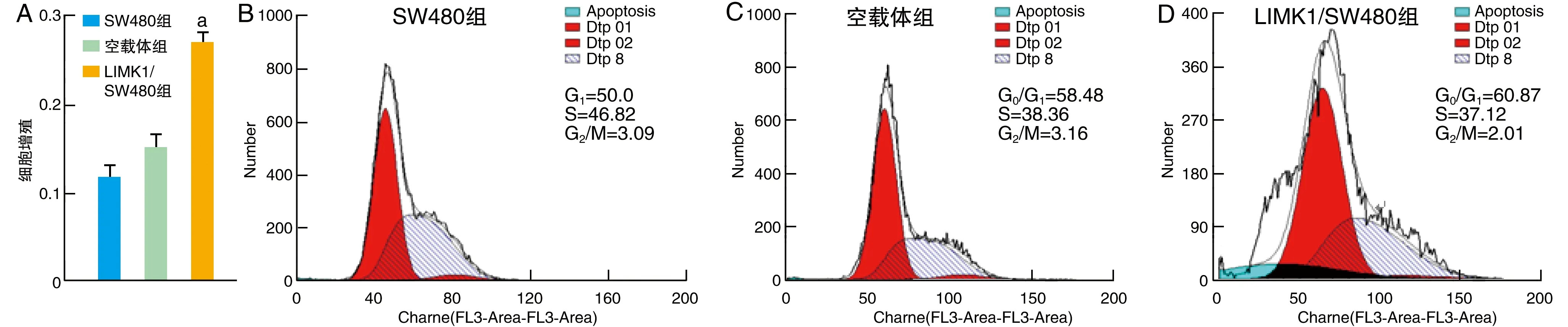
图2 LIMK1高表达对SW480细胞增殖和细胞周期的影响
2.3 LIMK1高表达对SW480细胞迁移能力影响
0 h时,各组迁移距离基本相同。划痕24 h后,LIMK1/SW480组瘢痕距离[(12.6±0.73)μm]明显低于SW480组[(36.0±0.50)μm]和空载体组[(37.8±0.63)μm](P<0.05)。表明LIMK1高表达可促进SW480细胞迁移(图3)。

图3 LIMK1高表达对SW480细胞迁移的影响
2.4 LIMK1高表达对SW480细胞侵袭能力的影响
LIMK1/SW480组穿膜细胞数(174±6.95)明显多于SW480组(102±9.94)和空载体组(99±8.28),差异有显著性(P<0.05)。表明LIMK1高表达可促进SW480细胞侵袭(图4)。
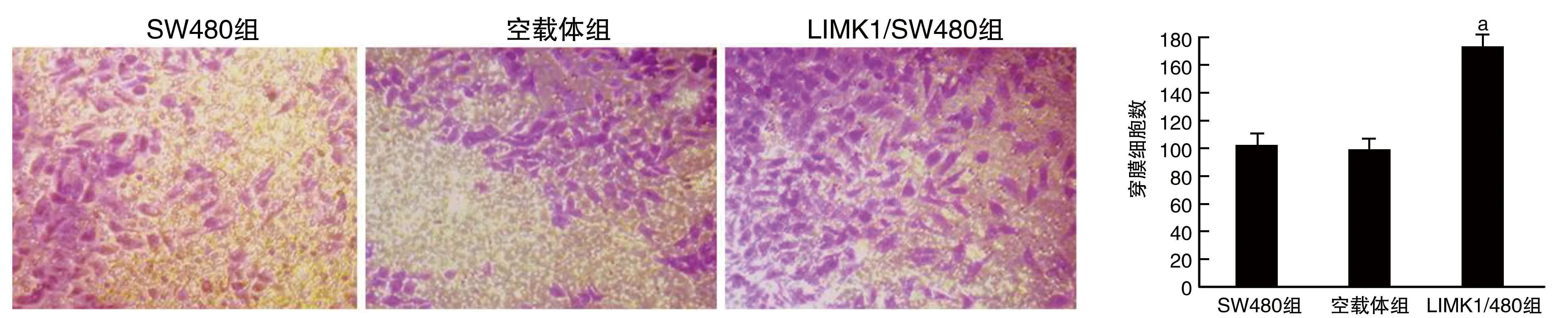
图4 LIMK1高表达对SW480细胞侵袭的影响(结晶紫染色,40×)
2.5 LIMK1高表达对SW480细胞LIMK1/cofilin1通路的影响
LIMK1/SW480组LIMK1、p-LIMK1、cofilin1较空载体组与SW480细胞组表达上调(P<0.05;图5)。表明LIMK1高表达可上调LIMK1,促进LIMK1与cofilin1的磷酸化。
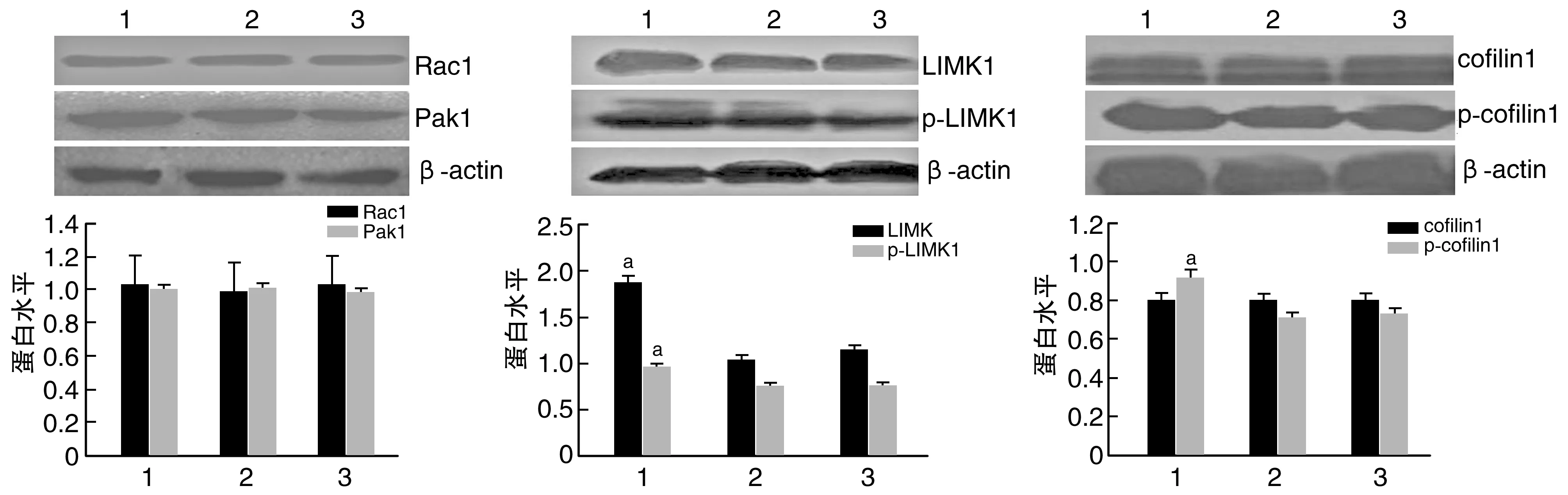
图5 LIMK1高表达对SW480细胞通路影响
3 讨 论
LIMK1在多种肿瘤中高表达与迁移侵袭有关。在一项临床队列研究中,高水平的LIMK1患者显示出明显较低的总生存率和较大的淋巴结转移潜力[3]。在结直肠癌组织中,LIMK1高表达与肿瘤转移和患者预后不良密切相关。上调LIMK1可促进上皮-间质转化(epithelial-mesenchymal transformation,EMT)与激活PI3K/Akt通路,增加增殖和迁移与移植瘤的生长和转移,而沉默LIMK1效果相反[4]。肺腺癌组织中LIMK1高表达与淋巴结转移、TNM分期和不良预后相关,表明LIMK1可以作为肺腺癌不良预后的生物标志物和潜在的治疗靶点[5]。前列腺癌LIMK1表达明显高于良性前列腺增生。LIMK1上调与前列腺体积、PSA及其抗原密度、Gleason评分、T分期、淋巴结转移、囊外扩展和精囊侵袭、手术边缘阳性密切相关。分析显示,LIMK1是前列腺癌转移、复发与生存缩短的独立危险因素[6]。LIMK1在胃癌中高表达,并且胃癌腹膜转移较原发性胃癌中LIMK1表达增加,敲除LIMK1可下调p-cofilin显著抑制胃癌细胞的迁移和侵袭以及消除裸鼠体内胃癌细胞的腹膜和肝转移[7]。
LIMK1/cofilin1通路在调控肿瘤细胞增殖和侵袭转移中起着重要作用。在骨肉瘤组织和细胞中PAK4、LIMK1和cofilin-1均高表达,并与临床分期、远处转移和肿瘤分级相关。沉默PAK4可通过降低LIMK1/cofilin-1通路的活性抑制骨肉瘤细胞的增殖、侵袭和迁移与裸鼠移植瘤生长[8]。SphK2与S1P可通过激活PAK1/LIMK1/cofilin1信号通路促进三阴性乳腺癌转移[11]。LncRNA DANCR在肝癌中高表达,与增殖和转移相关,并且DANCR可通过诱导miR-27a-3p调控ROCK1/LIMK1/cofilin1通路,促进肝癌的发展,诱导EMT[12]。在胰腺癌中发现LINC00941和ROCK1高表达,而miR-335-5p低表达。沉默LINC00941可抑制胰腺癌细胞生长、转移和EMT。LINC00941作为miR-335-5p的分子海绵和ROCK1的ceRNA,可促进ROCK1上调和激活LIMK1/cofilin-1通路[13]。
本研究结果显示,采用真核表达载体转染技术成功构建高表达LIMK1基因的SW480细胞,LIMK1高表达可通过LIMK1/cofilin1通路上调LIMK1和激活LIMK1与cofilin1促进SW480细胞增殖与迁移侵袭。因此,LIMK1可能是诊治结肠癌的靶点。
目前,靶向LIMK1的有效抑制剂和小分子化合物的研发成为抗肿瘤治疗的新途径。研究发现,土木香内酯(ATL)通过靶向抑制LIMK酶活性激活cofilin,从而上调Gactin/Factin比值,抑制恶性胶质瘤细胞迁移和侵袭[14]。Dasatinib可直接靶向LIMK1下调p-LIMK1和p-cofilin,抑制cyclin D1、D3和CDK2表达,阻滞细胞在G1期,增加Caspase-3和Caspase-7表达诱导细胞凋亡,抑制高表达LIMK1的SCID小鼠移植瘤生长,表明Dasatinib是一种治疗肺癌的新型LIMK1抑制剂[15]。Luteolin靶向LIMK1下调LIMK1通路相关靶点p-LIMK和p-cofilin,增加Caspase-3水平,降低cyclin D1表达,诱导细胞凋亡和阻滞细胞在G1期。此外,Luteolin通过降低体内Ki-67、p-LIMK和p-cofilin的表达抑制移植瘤的生长[16]。
课题组前期工作证实,LIMK1在结肠癌高表达与肿瘤分化程度、肿瘤大小、淋巴结转移、临床分期显著相关[10]。大蒜的有效成分二烯丙基二硫(diallyl disulfide,DADS)可下调LIMK1抑制结肠癌细胞迁移与侵袭,沉默LIMK1可增强DADS抑制作用[17-19]。蛋白质组学技术鉴定发现LIMK1是DADS作用人胃癌细胞的潜在靶点[20]。同时证明,DADS通过下调LIMK1抑制人胃癌细胞EMT与侵袭,而沉默LIMK1抑制人胃癌细胞迁移与侵袭[9,21]。然而,DADS是否可阻断LIMK1/cofilin通路抑制结肠癌细胞迁移侵袭,尚待进一步研究。

