抑制IL-17A表达对脓毒血症小鼠急性肾脏损伤的影响
陈俊, 李勇, 何明龙
(南充市中心医院急诊科,四川省南充市 637000)
脓毒血症是机体在感染等因素作用下的不可逆转和不可控的全身炎症反应[1-2]。脓毒血症进展快且病情危重,导致其病死率极高,目前已经是重症监护室最常见的死亡原因之一[3-4]。在全身严重的炎症反应作用下,脓毒血症容易导致多器官功能衰竭,而肾脏是常受累的器官[5-6]。据统计,近年脓毒血症急性肾损伤的发病率逐渐上升,且有年轻化的趋势,严重危害了人们的生命健康。然而,目前尚无有效的策略治疗脓毒血症急性肾损伤。因此,进一步探究脓毒血症急性肾损伤的机制以及有效的治疗策略是急需解决的科学问题。
白细胞介素-17A(interleukin-17A,IL-17A)是机体重要的细胞因子,其具有促进中性粒细胞迁移和诱导细胞因子和趋化因子表达的作用[7-8]。研究显示,IL-17A广泛参与机体的各种细胞活动,包括自身免疫、炎症、肿瘤和感染[9]。在人类败血症中,血液及组织的IL-17A水平是升高的[10]。部分学者将IL-17A作为多发性创伤败血症患者转入重症监护室的评估指标[11]。本文就IL-17A的表达对脓毒血症小鼠急性肾脏损伤的影响报道如下。
1 材料和方法
1.1 主要试剂
IL-17A抑制剂(SGC-CBP30)和脂多糖购自美国MCE公司。HE染色试剂盒和油红染色试剂盒由索莱宝公司提供;广谱的蛋白酶和磷酸酶抑制剂混合物和BCA试剂盒购自碧云天生物有限公司;IL-17A和白细胞介素6(interleukin 6,IL-6)和肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)酶联免疫吸附测定(enzyme linked immunosorbent assay,ELISA)试剂盒购自美国Abcam公司。TUNEL染色试剂盒购自于罗氏公司。
1.2 实验动物及处理
8周龄雄性Balb/c小鼠由北京维通利华实验动物技术有限公司提供,体质量(22.0±1.1)g。小鼠饲养环境温度按照国际啮齿类动物饲养标准执行。24只小鼠按照随机数字表法均分为对照组、模型组和抑制剂组。模型组和抑制剂组小鼠腹腔注射高剂量LPS(10 mg/kg)建立脓毒血症急性肾损伤模型。抑制剂组0.5 h内给与IL-17A抑制剂腹腔注射(30 mg/kg),然后每12 h处理1次,共6次。IL-17A抑制剂的半衰期是24 h,半数致死量200 mg/kg,本研究给药策略是根据半衰期确定的。模型组和对照组小鼠在相同时间点仅给与等量生理盐水注射。
1.3 肾脏炎症因子、血清肌酐和尿素氮的测定
收集小鼠肾脏,经液氮磨碎后,加入RIPA及蛋白酶和磷酸酶抑制剂混合物,ELISA法检测肾脏IL-17A、IL-6和TNF-α含量。收集小鼠血液,低温离心后吸取血清,ELISA法检测血清肌酐、尿素氮及炎症因子含量。具体步骤详见说明书。
1.4 HE染色
收集小鼠肾脏,经多聚甲醛固定后,用乙醇梯度脱水,石蜡5 μm切片,经脱蜡脱水后,进行HE染色。具体步骤为:苏木素染色5 min,5%乙酸分化1 min,再返蓝液处理30 s,伊红染色1 min,70%、80%、90%、100%乙醇梯度脱水,再经二甲苯透明后封片,显微镜下观察。
1.5 免疫组织化学测定
取肾脏切片,经脱蜡后,进行抗原修复,再经3%过氧化氢0.5%Triton溶液处理15 min,用0.01 mol/L磷酸盐缓冲液清洗后,再经3%牛血清白蛋白封闭30 min,再分别加入Caspase 3抗体,在4 ℃冰箱过夜,次日加入相应来源HRP标记的二抗,最后经DAB显色、乙醇脱水后封片。
1.6 肾脏损伤评分
取肾脏切片,按照过碘酸雪夫染色液说明书做糖原染色(PAS染色)。然后在光镜下观察评估50个肾小管。肾脏损害程度标准估计:0分为正常;1分为肾小管损害少于25%;2分为肾小管损害25%~50%;3分为肾小管损害50%~75%;4分为肾小管损害75%~100%[12]。
1.7 免疫蛋白印迹检测Caspase 3、Bax水平
分别收集小鼠主动脉,经液氮磨碎后,加入100 μL RIPA及蛋白酶和磷酸酶抑制剂混合物,裂解细胞,然后用BCA法测蛋白水平后,加入SDS蛋白上样缓冲液配平分装。再取20 μg蛋白样品加入4%~20%预制胶,电泳,转膜,将NC膜移至含5%脱脂奶粉的TBST封闭液中室温封闭2 h,加入稀释的一抗:Caspase 3、Bax(1∶500)以及β-actin(1∶2 000),将NC膜浸泡于一抗孵育液中,4 ℃孵育过夜。用TBST充分洗涤NC膜3次,每次约5 min,然后用血清稀释免疫荧光二抗(1∶5 000),使NC膜浸泡于二抗孵育液中,室温摇床孵育1 h;TBST充分洗去多余二抗,用Odyssey曝光仪检测,用Image J分析灰度值。
1.8 TUNEL染色检测凋亡细胞
取肾脏切片,经脱蜡后,然后按照TUNEL染色试剂盒步骤染色,1 μL rTdT+1 μL生物素标记的dUTP+98 μL平衡液混匀后加入标本上,在暗湿盒中反应37 ℃×1 h,终止反应后用磷酸盐缓冲液清洗,加入POD后再用DAB显色,清洗脱水后封片。
1.9 统计分析
采用SPSS 22.0统计软件进行数据处理和统计学分析,计量资料采用单因素方差分析,计数资料采用χ2检验,P<0.05则认为差异有统计学意义。
2 结 果2.1 各组肾脏IL-17A、IL-6和TNF-α水平的比较
肾脏IL-17A、IL-6和TNF-α水平模型组高于对照组,抑制剂组低于模型组(P<0.05;图1)。
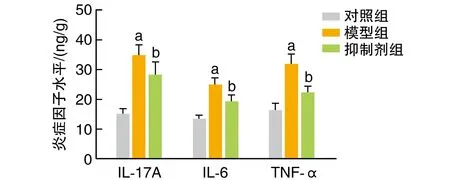
图1 各组肾脏IL-17A、IL-6、TNF-α水平的比较
2.2 各组肾脏损伤情况的比较
HE染色结果显示,模型组小鼠肾脏严重损伤,而IL-17A抑制剂处理能改善肾脏损伤。此外,糖原染色结果显示,肾脏损伤评分模型组高于对照组,抑制剂组低于模型组(P<0.05;图2)。
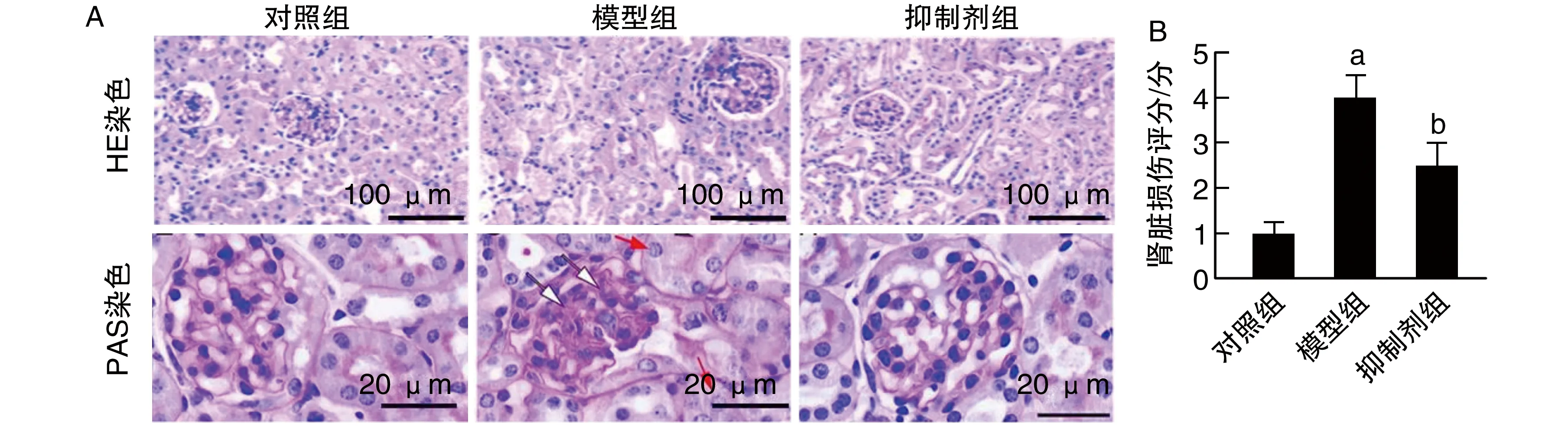
图2 各组肾脏损伤情况的比较
2.3 各组血清肌酐、尿素氮、炎症因子的比较
小鼠血清肌酐和尿素氮水平模型组高于对照组,而抑制剂组低于模型组(P<0.05)。小鼠血清IL-6和TNF-α水平模型组高于对照组,而抑制剂组低于模型组(P<0.05;表1)。

表1 各组血清肌酐、尿素氮、炎症因子的比较
2.4 抑制剂显著抑制肾脏细胞凋亡
免疫组化和免疫蛋白印迹结果显示,小鼠肾脏Caspase 3和Bax蛋白水平模型组高于对照组,而抑制剂组低于模型组(P<0.05;图3)。
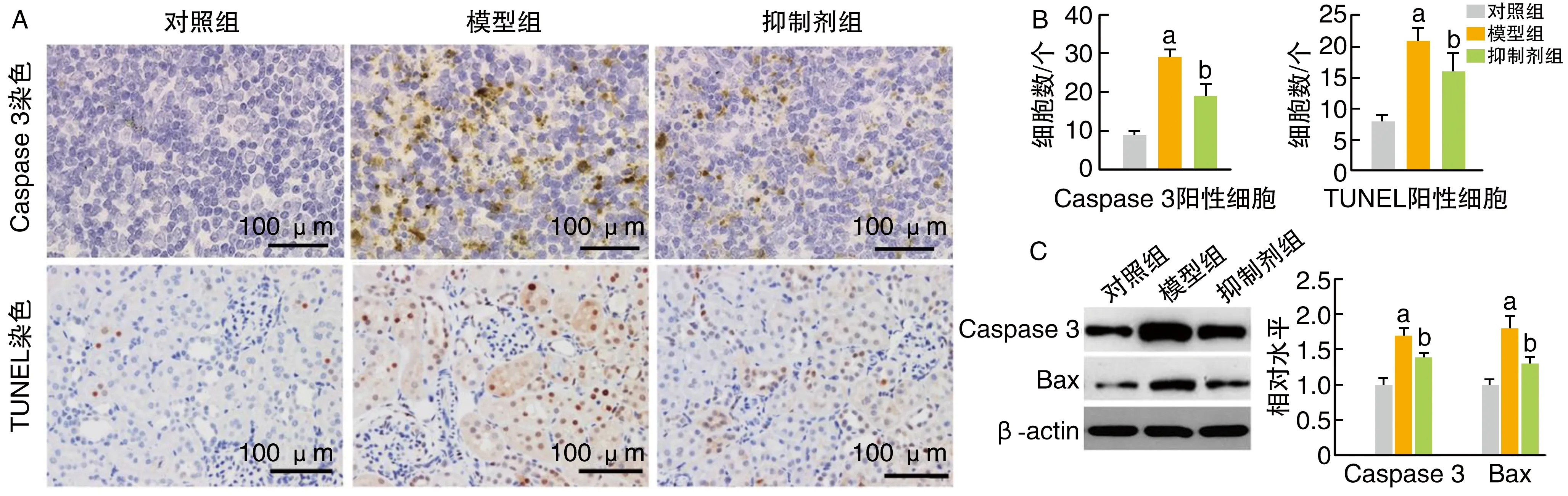
图3 各组肾脏细胞凋亡蛋白水平的比较
3 讨 论
脓毒血症是以全身严重炎症反应为特点的急性综合征,常常累积多器官,造成多器官功能障碍[1]。肾脏是机体的代谢性器官,具有丰富的血运。因此,脓毒血症常常造成急性肾脏损伤,而损伤的机制十分复杂,还有待探究。目前主要的学说有炎症学说和肾脏血流动力学学说。其中,炎症学说是较为广泛接受的学说[13]。减少炎症因子的释放可能是治疗脓毒血症急性肾损伤的重要靶点。虽然目前已经发现了许多抑制脓毒血症炎症因子上调的药物,但是这些药物本身会加重肾脏损伤。因此,应该靶向于内源性的细胞因子来抑制脓毒血症中炎症因子的变化。IL-17A是机体内源性的细胞因子,具有促进促进中性粒细胞迁移和诱导细胞因子和趋化因子表达的作用[7-8]。脓毒血症患者的IL-17A水平是显著上调的,因此,本研究旨在探究抑制内源性IL-17A对脓毒血症急性肾损伤的作用。
本研究首先通过腹腔注射LPS构建了小鼠脓毒血症模型,HE染色、血清肌酐和尿素氮水平的检测都证实了LPS能够诱导小鼠脓毒血症急性肾损伤的发生,IL-17A抑制剂是直接抑制IL-17A的产生和组装,根据KEGG数据库预测,抑制剂可能抑制了NF-κB通路,从而抑制了炎症反应。本研究通过给与脓毒血症急性肾损伤小鼠模型IL-17A抑制剂处理,显著降低了血清肌酐和尿素氮水平,提示抑制IL-17A的表达能够治疗脓毒血症急性肾损伤。临床表型的改善都是基于病理的改善。因此,本研究进一步探究了脓毒血症小鼠肾脏的变化。HE染色和糖原染色结果显示,脓毒血症小鼠肾脏结构紊乱,肾小管严重受损,而IL-17A抑制剂能够显著改善小鼠肾脏损伤,病理结果进一步证实了IL-17A抑制剂处理能够显著改善脓毒血症急性肾损伤。
研究发现,脓毒血症小鼠肾脏的炎症因子水平是显著上调的[14],而采用IL-17A抑制剂处理后,肾脏中炎症因子的水平是下调的。本研究结果显示,脓毒血症小鼠肾脏细胞的Caspase 3和Bax蛋白含量是显著升高。Caspase 3/Bax通路是细胞凋亡途径的重要分子,其表达量的上调代表着细胞凋亡的增加。本研究结果显示,IL-17A抑制剂能够下调Caspase 3和Bax蛋白水平,提示其能够减少肾脏细胞凋亡。

