miR-580-3p靶向COL11A1调控肝癌细胞凋亡
白亮, 王宝太, 高志峰, 蒋安, 梁金强
(西安交通大学第二附属医院普外科,陕西省西安市710004)
肝细胞癌(hepatocellular carcinoma,HCC)为临床常见恶性肿瘤,主要采用肝切除术和原位肝移植治疗方案,HCC极易发生转移和复发,远期预后并不理想。因此,探讨基于分子网络靶点抑制肿瘤细胞增殖、迁移是解决肝癌术后复发的关键。研究发现,miRNA通过与mRNA的3′-非编码区(3′-untranslated region,3′-UTR)结合,可靶向调控蛋白表达和功能,miRNA与肿瘤的发生、转移、复发密切相关[1]。miR-580表达与乳腺癌细胞和骨肉瘤细胞的生长密切相关,其表达水平提高能明显抑制两种肿瘤细胞的生长,并且降低晚期肿瘤的临床分级[2]。miRNA可充当HCC致癌基因或肿瘤抑制基因,调控肝癌发生的始动因素或者下游靶点,例如miRNA-342-3p、miRNA-15a-3p、miRNA-140[3-4],提示miRNA能够作为肝癌防治的靶点,但miR-580尤其是miR-580-3p对肝癌细胞增殖、凋亡等的作用尚不完全明确,因此,本文对此进行了研究。
1 材料和方法
1.1 主要仪器和试剂
TRIzol试剂购自广州捷华生物科技有限公司;cDNA合成试剂盒购自江苏康为世纪生物科技股份有限公司;TaqMan MicroRNA Assay购自北京斯科科技有限公司;TaqMan® Universal PCR Master Mix购自昆明皇宝商贸有限公司;BCA试剂盒购自青岛科创天地生物科技有限公司;Annexin-V-FITC细胞凋亡检测试剂盒购自Biovision公司;HEK-293T细胞购自上海朝瑞生物科技有限公司;转染试剂购自广州一科生物科技有限公司;siRNA(COL11A1)、COL11A1过表达质粒、miR-580-3p inhibitor和miR-580-3p mimics均由北京擎科设计和合成。CCK-8试剂盒购自武汉爱博泰克生物科技有限公司。
1.2 组织和细胞
纳入2019年6月—2021年6月本院42例HCC手术患者的肝癌组织及癌旁组织。所有患者术前均未接受放疗或化疗,均自愿参与本研究。本研究获得了本院伦理委员会批准。人正常肝细胞LO2、QSG-7701和人肝癌细胞系HepG2、Huh-7、Li-7、SK-Hep-1细胞系均购自普诺赛公司,在含10%胎牛血清的RPMI-1640培养基5%CO2、37 ℃培养至生长期。分别将siCOL11A1(COL11A1敲低组)、COL11A1过表达质粒(COL11A1过表达组)、miR-580-3p inhibitor(miR-580-3p敲低组)和miR-580-3p mimics(miR-580-3p过表达组)与转染试剂混合后加入人肝癌细胞系培养板孔中,转染12 h后更换为正常培养基培养。
1.3 qRT-PCR检测miR-580-3p和COL11A1 mRNA表达
采用TRIzol提取总RNA,反转录为cDNA。RT-PCR条件:95 ℃ 2 min;95 ℃ 15 s,60 ℃ 45 s,72 ℃ 45 s共45个循环。采用U6和GAPDH为内参基因,用相对定量法计算基因表达量。引物序列GAPDH-F:5′-TGTGGGCATCAATGGATTTGG-3′,R:5′-AC ACCATGTATTCCGGGTCAAT-3′;U6-F:5′-GAGGGCC TATTTCCCATGATT-3′,R:5′-TAATTAGAATTAATTT GACT-3′;COL11A1-F:5′-ACCCTCGCATTGACCTTC C-3′,R:5′-TTTGTGCAAAATCCCGTTGTTT-3′;miR-580-3p-F:5′-GACTATCGGGACATGTTA-3′,R:5′-GC AGGGTCCGAGGTATTC-3′。
1.4 流式细胞术检测细胞凋亡和细胞周期
转染48 h后,收集各组贴壁细胞。用PBS洗涤细胞3次,将Annexin-V-FITC、PI和HEPES缓冲液按比例配制成Annexin-V-FITC/PI染料溶液(1∶2∶50)用于凋亡细胞的染色,用HEPES缓冲液清洗后,流式细胞仪检测细胞凋亡和细胞周期。将人肝癌细胞系HepG2、Huh-7、Li-7、SK-Hep-1消化并固定在冰冷75%乙醇中,4 ℃过夜,碘化丙啶室温下黑暗中孵育30 min,流式细胞术检测细胞周期。实验重复3次。
1.5 免疫印迹法检测COL11A1、Akt、PI3K、p-Akt、p-PI3K蛋白
提取总蛋白,用BCA试剂盒测定蛋白水平。30 μg总蛋白通过聚丙烯酰胺凝胶电泳分离,80 V恒压35 min,120 V 45 min。将凝胶蛋白转移到PVDF膜上,5%脱脂牛奶室温封闭1 h。COL11A1、Akt、PI3K、p-Akt、p-PI3K、GAPDH抗体稀释后加入膜上,4 ℃孵育过夜。PBST缓冲液(含0.1%Tween-20 PBS缓冲液)洗膜3次,用HRP标记的二抗室温孵育1 h。采用化学发光法显色条带,定量灰度值。
1.6 CCK8法检测细胞增殖
CCK8法检测细胞增殖水平(细胞活力)。相应处理后,将人肝癌细胞系HepG2、Huh-7、Li-7、SK-Hep-1接种在96孔板培养1、2、3天。然后加入CCK-8试剂,孵育2 h后通过酶标仪测定450 nm处光密度(OD),计算细胞活力。细胞活力=实验组或对照组450 nm处OD-空白孔450 nm处OD。
1.7 荧光素酶报告实验
COL11A1 3′UTR区域的序列从肝癌细胞系HepG2的cDNA中进行扩增。将PCR产物克隆到荧光素酶pmirGLO载体中,构建野生型COL11A1-3′UTR-WT和突变型COL11A1-3′UTR-MT载体。然后将荧光素酶报告载体与每个质粒共转染到HEK-293T细胞中,以海肾荧光素酶表达载体pRL-TK为内参。使用Promega的Digital-Luciferase Reporter Assay System检查双荧光素酶活性。
1.8 统计学分析
采用SPSS 21.0软件进行统计学处理。两组比较采用t检验,多组比较采用单因素方差分析,采用Spearman相关性分析,P<0.05为差异具有统计学意义。
2 结 果
2.1 各组miR-580-3p和COL11A1 mRNA表达的比较
与癌旁组织比较,肝癌组织COL11A1 mRNA表达升高、miR-580-3p表达降低;与人正常肝细胞系比较,人肝癌细胞系miR-580-3p表达降低、COL11A1 mRNA表达升高(P<0.05;图1)。Spearman相关性分析发现,肝癌组织中COL11A1 mRNA表达与miR-580-3p表达呈负相关(r=-0.429,P<0.05)。

图1 肝癌组织与癌旁组织、人肝癌细胞系与人正常肝细胞COL11A1和miR-580-3p表达的比较
2.2 过表达或敲低miR-580-3p后肝癌细胞增殖、凋亡、细胞周期的比较
与对照组比较,人肝癌细胞系增殖水平过表达miR-580-3p后降低,敲低miR-580-3p后升高(P<0.05);人肝癌细胞系凋亡率过表达miR-580-3p后升高,敲低miR-580-3p后降低(P<0.05);敲低miR-580-3p能够诱导人肝癌细胞在G1/S细胞周期停滞(P<0.05;图2)。

图2 过表达或敲低miR-580-3p后肝癌细胞增殖、凋亡、细胞周期的比较
2.3 miR-580-3p通过靶向抑制COL11A1调控肝癌细胞凋亡
通过miRBase数据库在线分析发现,miR-580-3p具有多个潜在靶基因,敲低COL11A1时HepG2细胞凋亡率上升(P<0.05,图3)。人肝癌细胞系凋亡率过表达COL11A1后降低,敲低COL11A1后上升;人肝癌细胞COL11A1 mRNA水平过表达miR-580-3p后降低,敲低miR-580-3p后升高(P<0.05;图3)。
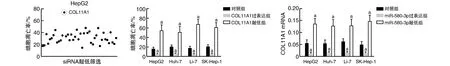
图3 miR-580-3p通过靶向抑制COL11A1调控肝癌细胞的凋亡
2.4 Akt和PI3K参与miR-580-3p/COL11A1介导的生物学效应
肝癌细胞中p-Akt、p-PI3K水平在COL11A1过表达和miR-580-3p敲低后显著升高,而总Akt、PI3K表达保持不变;肝癌细胞中p-Akt、p-PI3K水平在COL11A1敲低或miR-580-3p过表达后降低,而总Akt、PI3K水平不变(图4)。
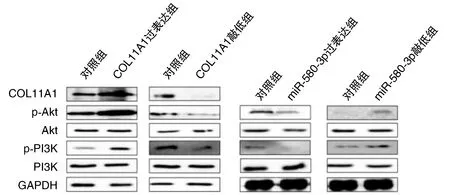
图4 Akt和PI3K 参与miR-580-3p/COL11A1介导的生物学效应
3 讨 论
HCC是第五大侵袭性癌症,已成为全球癌症相关死亡的第三大原因[5],但只有少数早期确诊的病例能够通过手术切除或肝移植治愈[6],大多数患者会因肿瘤复发或远处转移而发展为晚期疾病,导致生存率低[7]。基于小分子网络靶点探索抑制肿瘤发生和转移可能成为肝癌的防治靶点,因此,本文探究了miR-580-3p和COL11A1在肝癌发生中的作用。
miRNA是一种小的非编码单链RNA[8],可以在转录后水平抑制靶基因表达,在肿瘤发生和转移中充当肿瘤抑制因子或启动因子[9]。本研究发现,与癌旁组织比较,肝癌组织中miR-580-3p表达下调。与人正常肝细胞系比较,人肝癌细胞系miR-580-3p表达下调,提示miR-580-3p可能在肝癌的发生中发挥重要作用。随后,本研究发现过表达miR-580-3p后,人肝癌细胞系增殖降低,凋亡率升高。相反,miR-580-3p敲低后,人肝癌细胞增殖升高,凋亡率降低,细胞周期停滞在G1/S期。因此,本研究发现miR-580-3p可以调控细胞周期参与肝癌细胞增殖和凋亡,提示肝癌细胞中miR-580-3p水平降低是肝癌发生的一个始动因素。
如上文所述,miR-580-3p水平降低可能是肝癌发生的一个始动因素,那么miR-580-3p是通过下游什么途径发挥作用的呢?既往研究指出,COL11A1是肝癌细胞增殖过程中的一个下游调控分子,肝癌细胞COL11A1表达水平是升高的[10],这与本文结果类似。那么,COL11A1是否是miR-580-3p的一个调控靶点呢?本研究发现,COL11A1是miR-580-3p的一个调控靶点;过表达miR-580-3p后,人肝癌细胞系COL11A1 mRNA水平降低;敲低miR-580-3p后,人肝癌细胞系COL11A1 mRNA水平升高。因此,miR-580-3p可以靶向调控COL11A1的表达。进一步研究发现,过表达COL11A1后人肝癌细胞凋亡率降低;相反,敲低COL11A1后人肝癌细胞凋亡率上升。以上结果提示,miR-580-3p可以通过COL11A1的表达发挥抗肝癌细胞增殖和促进肝癌细胞凋亡作用。
有研究已发现,COL11A1与多种实体瘤(包括肺癌)中的癌症迁移有关[11],且有望成为有效的非小细胞肺癌诊断标志物[12-13],然而在肝癌中尚无COL11A1相关研究。本研究发现敲低COL11A1能够抑制肝癌细胞凋亡,并且miR-580-3p的抗肿瘤功能能够通过COL11A1介导。那么,COL11A1和miR-580-3p的表达水平变化能否反映肝癌的进程还需要进一步探究。
除了miR-580-3p和COL11A1在肝癌细胞中的生物学作用外,本研究还评估了其潜在的作用机制。据报道,PI3K/Akt是COL11A1的下游介质,而Akt抑制剂具有逆转卵巢癌细胞中的顺铂耐药性的功能[14-15]。与既往研究一致,本研究发现,在肝癌细胞中敲低COL11A1或过表达miR-580-3p后,p-Akt和p-PI3K的表达均显著降低。据此推测,miR-580-3p和COL11A1可能是HCC的潜在治疗靶点。
综上所述,肝癌细胞和肝癌组织中miR-580-3p的表达水平降低,miR-580-3p/COL11A1轴可能通过调控PI3K/Akt通路影响肝癌细胞的凋亡。

