小鼠耳芥MAPKKK基因家族全基因组鉴定及进化与表达
朱前彬,甘志承,李晓翠,张英杰,赵合明,黄先忠
研究报告
小鼠耳芥MAPKKK基因家族全基因组鉴定及进化与表达
朱前彬1,2,甘志承2,李晓翠1,张英杰1,赵合明2,黄先忠2
1. 石河子大学生命科学学院,石河子 832003 2. 安徽科技学院农学院,作物生物技术研究中心,凤阳 233100
丝裂原活化蛋白激酶激酶激酶(Mitogen-activated protein kinase kinase kinases, MAPKKKs)是MAPK级联的重要组成部分,在发育过程和胁迫反应中发挥重要功能。小鼠耳芥()是生活在新疆荒漠中的十字花科短命植物,具有很好的耐盐能力。为了探索小鼠耳芥MAPKKK基因家族的进化和功能,本研究通过全基因组分析从小鼠耳芥基因组中鉴定了143个基因,分属3个亚族:ZIK (20个)、MEKK (36个)和RAF (87个)。共线性分析表明小鼠耳芥与拟南芥和琴叶拟南芥分别存在74和72个共线性基因,说明该家族在小鼠耳芥基因组中发生了明显的扩张;进化分析表明存在64对复制基因对,a/s均小于1,以纯化选择为主。利用RNA-seq数据分析在盐胁迫和不同组织中的表达特征,结果表明在250 mmol/L NaCl胁迫下,大多数基因上调表达,其中/和显著上调表达;而在8个组织中,主要呈现6种表达模式;部分复制基因在盐胁迫和组织中的表达模式存在差异。本研究结果为进一步解析小鼠耳芥MAPKKK基因家族成员响应非生物胁迫信号转导通路的复杂机制奠定了基础。
MAPKKK;小鼠耳芥;短命植物;盐胁迫;基因表达
由于植物的固着生长,一生要面临不同的非生物胁迫。在应对不同的非生物胁迫时,涉及到多个过程,包括信号感知、信号转导、转录、转录产物加工、翻译和翻译后蛋白修饰等[1]。丝裂原活化蛋白激酶(Mitogen-activated protein kinase, MAPK)级联途径是广泛存在于真核生物的一种信号转导途径,每个基本的MAPK通路至少由MAPK激酶激酶(MAPKKK或MEKK)、MAPK激酶(MAPKK、MEK或MKK)和MAPK三种功能上相互连接的蛋白激酶组成[2]。当感受到外界刺激时,MAPKKK最先被磷酸化激活,之后磷酸化激活MAPKK,进而激活MAPK。激活的MAPK可以磷酸化多个下游底物,包括转录因子、蛋白激酶、其他酶或结构蛋白等,进而引起一系列细胞反应[3~5]。
MAPKKK位于MAPK级联的上游,基因家族成员较多,其主要结构和结构域组成的多样性更大[6]。对拟南芥()和水稻() MAPKKK结构域的研究表明,MAPKKK基因家族可分Raf、MEKK和ZIK三个亚家族[6,7]。Raf-like和ZIK-like蛋白具有C端激酶结构域和长N端调控结构域[8]。ZIK亚家族成员具有N端激酶结构域,而MEKK亚家族成员的蛋白结构保守度较低,其中激酶结构域位于N端或C端,或位于蛋白的中心部分[3,9]。
功能研究表明MAPK级联途径参与植物生长发育的各个方面。例如拟南芥MEKK1-MKK4/5- MPK3/6参与植物的免疫反应[10];MAPKKK18/17- MAPKK3-MAPK1/2/7可依赖于脱落酸(abscisic acid, ABA),调控叶片衰老和响应干旱胁迫[11,12];MAPKKK4-MKK4/5-MPK3/6参于植物的生长发育[13]。烟草()NPK1 (nucleus and phragmoplast-localized protein kinase 1)属于MAPKKK家族,NPK1-MEK1-NQK1调控烟草的生长发育及烟草花叶病毒感染的反应[14,15]。陆地棉()可以通过GhMAP3K15- GhMKK4-GhMPK6级联激活转录因子参与陆地棉的干旱响应[16]。OsMAP3K10-OsMKK4- OsMAPK6途径参与调节水稻籽粒大小和粒重[17,18],OsMKKK70-OsMKK4-OsMAPK6调控水稻籽粒大小及叶夹角[19]。
MAPKKK在众多物种中已被系统鉴定,拟南芥中有80个MAPKKK[6],水稻中有75个[7],小麦()中有155个[20],玉米()中有74个[21],陆地棉中有157个[22]。小鼠耳芥()是十字花科鼠耳芥属荒漠短命植物,具备生活周期短、结实量大、光合效率高、抗旱耐盐等特点[23,24]。李晓翠等[25]从小鼠耳芥基因组中鉴定了16个基因,发现存在多对复制基因对。本研究对小鼠耳芥中MAPKKK基因家族的成员进行了全基因组鉴定,分析了基因和蛋白的结构域特征、比较进化、响应盐胁迫及组织表达特征。本研究结果丰富了植物MAPKKK级联信号通路,为后续进一步解析MAPK级联参与小鼠耳芥生长发育和响应逆境胁迫的机制提供理论基础。
1 材料与方法
1.1 植物材料
短命植物新疆小鼠耳芥为本实验室保存,小鼠耳芥种子消毒及室内培养参照Huang等[23]描述的方法进行。采集小鼠耳芥生长8天的下胚轴和子叶,30天的根、茎尖和茎,60天的茎生叶,65天的花和70天的果荚,用于组织表达分析。小鼠耳芥高盐胁迫处理采用250 mmol/L NaCl处理28天小鼠耳芥幼苗,在胁迫处理0、12、24和48 h后分别取叶片组织。以上材料均重复3次取样,后立即液氮冷冻,–80℃保存。
1.2 数据来源
从Ensembl基因组数据库(http://plants.ensembl. org/index.html)下载拟南芥和琴叶拟南芥()的基因组数据。小鼠耳芥基因组数据为本实验室提供(数据暂未公开)。从TAIR网站(https://www. arabidopsis.org/)下载拟南芥MAPKKK氨基酸序列。从NCBI Sequence Read Archive (SRA; http://www. ncbi.nlm.nih.gov/sra)中获取小鼠耳芥MAPKKK基因在盐胁迫不同时间点(0、0.5、3、6、12、12、24和48 h,登录号为PRJNA417986)[24]和不同组织(下胚轴、子叶、成熟根、茎尖、茎、茎生叶、花和果荚,登录号为PRJNA721579)的FPKM值。
1.3 MAPKKK基因家族成员的全基因组鉴定及命名
以拟南芥MAPKKK氨基酸序列作为query,与小鼠耳芥蛋白数据库中进行BLASTP比对,参数设置-value≤1e–5,其余参数为默认值。删去重复序列后,将候选的MAPKKK氨基酸序列提交到PfamScan (http://pfam.xfam.org),进一步鉴定特有的MAPKKK保守结构域-蛋白激酶结构域。使用ExPASy (https://web.expasy.org/protparam/)预测ApMAPKKK蛋白的分子量和等电点。亚细胞定位通过ProtComp 9.0 (http://linux1.softberry.com/berry. phtml)进行预测。参照李晓翠等[25]描述的方法命名小鼠耳芥基因。
1.4 系统进化树构建、基因结构和蛋白motif分布
通过ClustalW程序[26]将拟南芥和小鼠耳芥MAPKKK蛋白进行多重序列比对,参数为默认值。利用MEGA6.0软件构建Neighbor-Joining树[27]。利用小鼠耳芥基因组gff3文件,使用GSDS (http:// gsds.gao-lab.org/)分析ApMAPKKK基因家族的外显子和内含子分布。ApMAPKKK蛋白质的保守motif使用MEME网站(http://meme-suite.org/tools/meme)进行分析,motif长度范围为10~50个氨基酸残基,motif最大发现数目为10个,其他参数设为默认值。
1.5 比较进化分析
共线性分析使用MCScanX软件[28]预测拟南芥、琴叶拟南芥与小鼠耳芥物种间同源基因,参数设为默认值。分别将3个物种的基因组两两BLASTP比对,-value≤1e–5,提取MAPKKK基因家族中的基因重复对信息,筛选出3个物种间的直系同源基因。使用TBtools[29]中的Multiple Synteny Plot功能对MAPKKK直系同源基因的共线关系进行可视化分析。
基因复制事件通过多重序列比对和共线性分析来揭示。旁系同源基因的确定满足条件:比对长度大于较长基因的90%;核苷酸一致性大于90%的情况下才被视为复制基因[21,30]。使用DnaSP 6.0软件[31]计算a (非同义替换率)和s (同义替换率),通过旁系同源基因间的a/s来评估进化过程中对复制基因的选择压力。a/s大于1、小于1或等于1分别表示正、负或中性演化[32]。
1.6 ApMAPKKK表达模式分析
借助R语言中的热图程序包将盐胁迫和不同组织表达数据进行log2(FPKM+1)处理,之后可视化为热图,采用实时荧光定量PCR (qRT-PCR)验证转录组数据。RNA提取及反转录参照Huang[23]等方法,qRT-PCR参照牛西强等[33]描述方法进行,PCR仪为ABI ViiA7实时荧光定量PCR仪(Life Technologies,美国)。使用Primer 3.0工具(https://bioinfo.ut.ee/ primer3-0.4.0/)设计基因的特异性扩增引物(附表1),以为内参基因[25],利用2–ΔCT法计算基因不同组织的相对表达量[34];利用2–ΔΔCT法计算基因响应不同非生物胁迫下的相对表达量[34]。采用SPSS 19.0软件进行显著性分析(<0.05),GraphPad Prism 8.0软件作图。
1.7 ApMAPKKK启动子的顺式作用元件分析
以每个基因起始密码子上游2500 bp序列作为该基因的启动子序列,提交至PlantCARE (http://bioinformatics.psb.ugent.be/webtools/ plantcare/html/),预测启动子区的顺式作用元件。
2 结果与分析
2.1 小鼠耳芥MAPKKK基因家族成员的鉴定、系统进化、基因结构和motif分布
从小鼠耳芥全基因组中一共鉴定到143个基因,它们均具有保守的蛋白激酶结构域(附图1)。这些候选基因的染色体定位、蛋白理化性质等信息见附表2。结果表明MAPKKK蛋白由223个氨基酸()到1380个氨基酸()组成,蛋白质分子量介于25.75~152.11 kDa之间,等电点范围4.14~9.90。蛋白质定位预测结果显示,MAPKKK蛋白主要定位在细胞质和细胞膜。
对小鼠耳芥MAPKKK基因家族进行系统进化分析,结果发现,小鼠耳芥MAPKKK基因家族分为3个亚家族:MEKK (36)、RAF (87)和ZIK (20) (图1,附图2A)。比较3个亚族所含的外显子和内含子个数发现(附图2B),RAF亚族基因的外显子个数在2~17之间,差异较大。MEKK亚族基因结构差异最大,其中14个只含有1个外显子,15个含8~17个外显子,4个含有23~24个外显子,表明该亚家族在进化过程中发生了大量的外显子获取和缺失。ZIK亚族基因结构较为保守,大多数含有7个外显子。
通过MEME在线程序对143个MAPKKK进行保守motif分析,共预测出10个保守的motif,其分布见附图2C。RAF亚族基因基本包含10个motif;MEKK亚族基因大多由9个motif (motif 1~9)构成;ZIK亚族基因基本由8个motif (motif 1~6、motif 8~9)组成,例外的是,ApZIK1-1只包motif 1和motif 4。尽管每个亚族基因的motif组成不同,但它们共有的motif却以完全相同的顺序排列,其中motif 4为保守激酶结构域。
2.2 小鼠耳芥与拟南芥、琴叶拟南芥MAPKKK基因的共线性分析
共线性关系分析发现,拟南芥中存在74个小鼠耳芥共线基因(图 2),、、、、和在小鼠耳芥中没有相对应的共线基因,基因数量约是的两倍,二者直系同源基因存在191对共线性关系。而琴叶拟南芥虽然染色体数量比拟南芥多,但仅含有72个小鼠耳芥共线基因(图2),二者直系同源基因存在185对共线性关系。以上结果表明,MAPKKK基因家族成员在小鼠耳芥中发生了扩张。旁系同源基因对分析表明(附表3),小鼠耳芥MAPKKK基因家族有64个复制基因对,其中//互为旁系同源,///互为旁系同源。另外,、、、、和在小鼠耳芥中没有相对应的旁系同源基因,可能在进化过程中发生了丢失,且复制基因对的a/s皆小于1 (附表4),表明进化中以纯化选择为主。
2.3 ApMAPKKK响应250 mmol/L NaCl胁迫下的表达特征
通过分析小鼠耳芥经250 mmol/L NaCl胁迫7个不同时间点的转录组数据,得到143个基因的差异表达情况。结果表明,有132个基因存在差异表达(附表5),其中MEKK、RAF、ZIK亚族分别包含35、80、17个(图3A)。热图结果显示,132个响应高盐胁迫主要呈现4种表达特征(C1~C4) (图3A)。C1组成员大多在盐胁迫处理后逐渐下调表达;C2组成员在盐胁迫初期和末期表达量高,但在中间时期表达量较低;相反,C3组成员在盐胁迫处理中期表达上调,但在胁迫的初期和后期表达量低;C4组的成员大多在盐胁迫的后期逐渐上调表达。
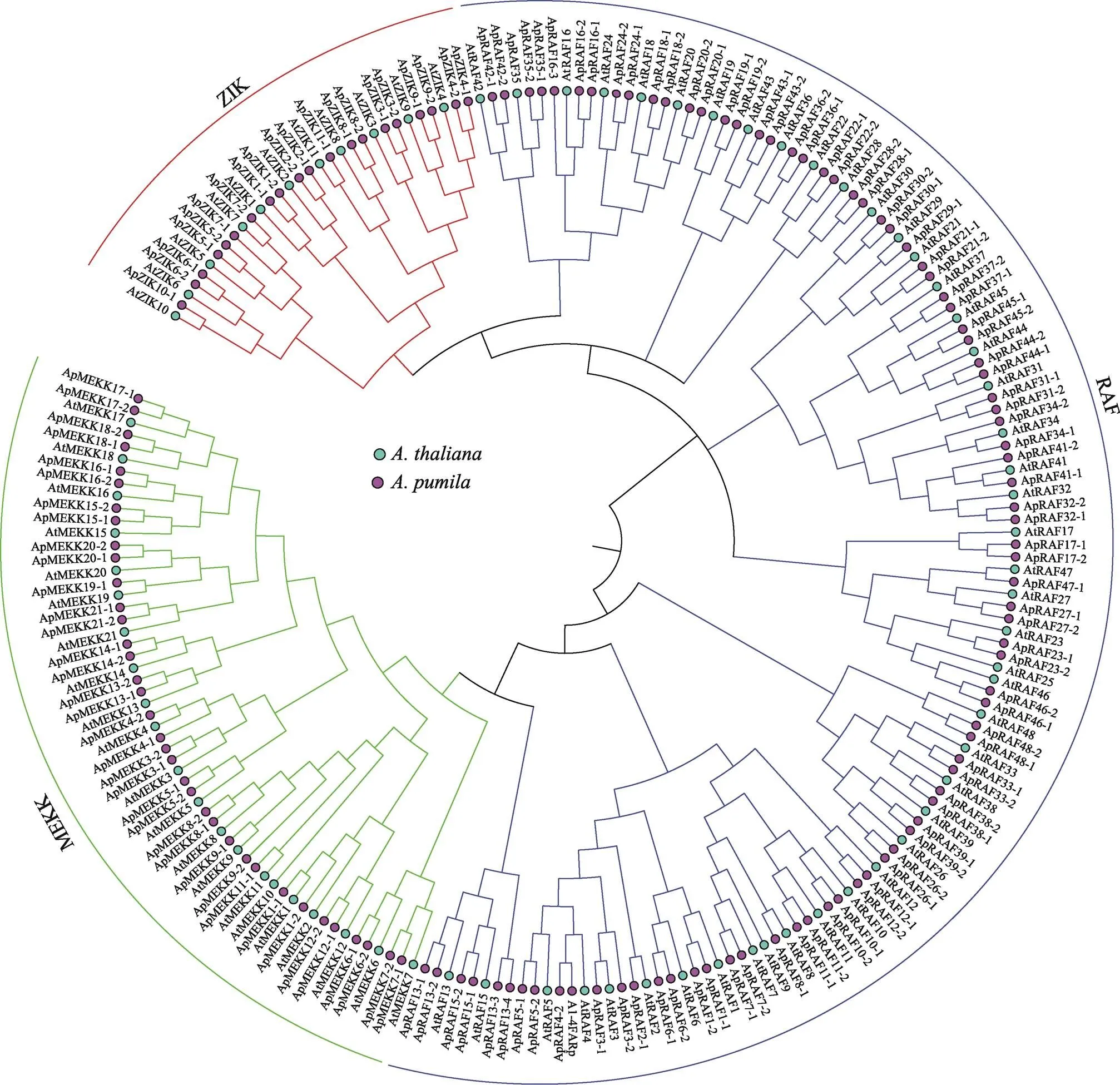
图1 拟南芥和小鼠耳芥MAPKKK家族蛋白序列系统进化树

图2 拟南芥、琴叶拟南芥和小鼠耳芥中MAPKKK基因共线性关系
黑色圆柱分别代表拟南芥、小鼠耳芥、琴叶拟南芥的5条、16条、8条染色体,黑色线条表示物种间共线性关系。

图3 ApMAPKKK基因在250 mmol/L NaCl胁迫下不同时间点的表达特征
A:在盐胁迫不同时间点的表达图谱;B:qRT-PCR分析12个基因(A图中红色字体)盐胁迫的表达特征。不同的小写字母表示统计显著性差异(< 0.05)。
利用qRT-PCR分析了12个基因(、、、、、、、、、、和)在0、12、24和48 h盐胁迫中的表达(图3B),结果与RNA-seq分析结果相一致,进一步证明小鼠耳芥基因响应盐胁迫表达特征。其中,、和在盐胁迫12 h表达上调,但随后逐渐下调表达。在盐胁迫后始终呈下调表达。和在盐胁迫12 h呈下调表达,24 h后又恢复表达。在盐胁迫24 h后呈上调表达。、、和在盐胁迫后始终呈上调表达,在盐胁迫12 h和48 h呈上调表达而在24 h呈下调表达。
2.4 ApMAPKKK基因组织表达特征
为了解基因在小鼠耳芥不同组织中的表达特征,本研究利用小鼠耳芥8种组织(胚轴、子叶、根、茎、茎生叶、花、果荚和茎尖)的RNA-seq绘制表达热图(图4A),结果表明,在8个组织中有125个差异表达的基因(附表6),主要表现6种表达特征(C1~C6)。C1组成员在茎尖表达量较高。C2组成员在花中表达量较高。C3组成员在下胚轴、子叶和根中高表达。C4组成员下胚轴、子叶、茎和茎生叶中高表达,C5组成员大多在下胚轴、子叶、根、茎和茎生叶中高表达而在茎尖低表达,C6组成员均在下胚轴高表达。
利用qRT-PCR进一步分析了12个基因在8种组织中的表达情况(图4B),结果与RNA-seq数据并不完全吻合,但整体表达特征和表达热图一致。在下胚轴、根和茎尖中表达量较高在其他组织中表达量相似。和2只在花中高表达。和在下胚轴高表达而在花中低表达。、和在下胚轴高表达。在下胚轴、根和果荚中高表达。子叶和根中高表达。和在下胚轴和茎中高表达,而在根、茎生叶和花中基本不表达。
3 讨论
本研究从小鼠耳芥基因组中共鉴定出143个基因,大约是拟南芥的1.79倍[6]。系统进化分析表明,小鼠耳芥MAPKKK家族可分为3个亚家族——RAF、MEKK和ZIK。每个亚族均有保守激酶结构域(附图1),其中RAF亚族具有GTxx(W/Y)MAPE保守激酶域;MEKK亚族均包含G(T/S)Px(W/Y/F)MAPEV保守基序;ZIK亚族基因的激酶保守域是TPEFMAPE(L/V)Y。ApRAF29-1关键结构域缺少一个谷氨酸Glu (E),MEKK9、MEKK11和MEKK18相对拟南芥、小鼠耳芥中关键结构域更加保守。分析小鼠耳芥MAPKKK家族成员的motif分布和外显子-内含子结构发现(附图2),MEKK亚族在进化过程中发生了大量的外显子获取和缺失,这与小麦、玉米和陆地棉相一致[20~22]。RAF和ZIK亚族内的大部分基因的基因结构是保守的,但同时也存在一些外显子数量差异较大的基因,甚至在复制基因对之间,也存在此现象,如/及的基因结构存在明显的差异。研究表明,内含子的获取或缺失是进化过程中选择压力的结果,基因倾向于进化成不同的外显子-内含子结构并发挥不同的功能[35,36]。ApMAPKKK基因家族的各亚族成员都具有相似的motif组成,RAF具有所有的10个motif,MEKK含有9个motif,ZIK仅含有8个motif。研究表明,RAF亚族是MAPKKK基因家族的起源[37]。ZIK亚组又被称为WNK (with no lysine),目前尚未被证实可以磷酸化MKK[21],这可能与其缺少2个motif有关。ApMAPKKK家族成员在保持主要功能域结构保守的同时(所有基因都包含motif 4-激酶结构域),还存在许多结构分歧,甚至在复制基因中也存在结构分歧现象(如和;和;和),这些结果表明基因结构的多样性,暗示着进化中小鼠耳芥基因产生了新的功能。
本研究通过共线性分析,发现小鼠耳芥MAPKKK基因家族发生了明显的扩张(图2)。有研究发现须弥芥()为适应青藏高原独特环境,基因组中抗病相关的基因家族发生了明显收缩,而抗紫外线等抗逆基因家族发生了扩张[38]。小鼠耳芥主要生长在新疆古尔班通古特沙漠南缘荒漠地带,是一种和拟南芥近缘的早春短命植物[23,39],MAPKKK基因家族在响应逆境胁迫和生长发育过程中发挥着重要作用[6],而MAPKKK基因家族成员数目在小鼠耳芥中发生扩增,这种扩增可能与之适应荒漠环境有关。
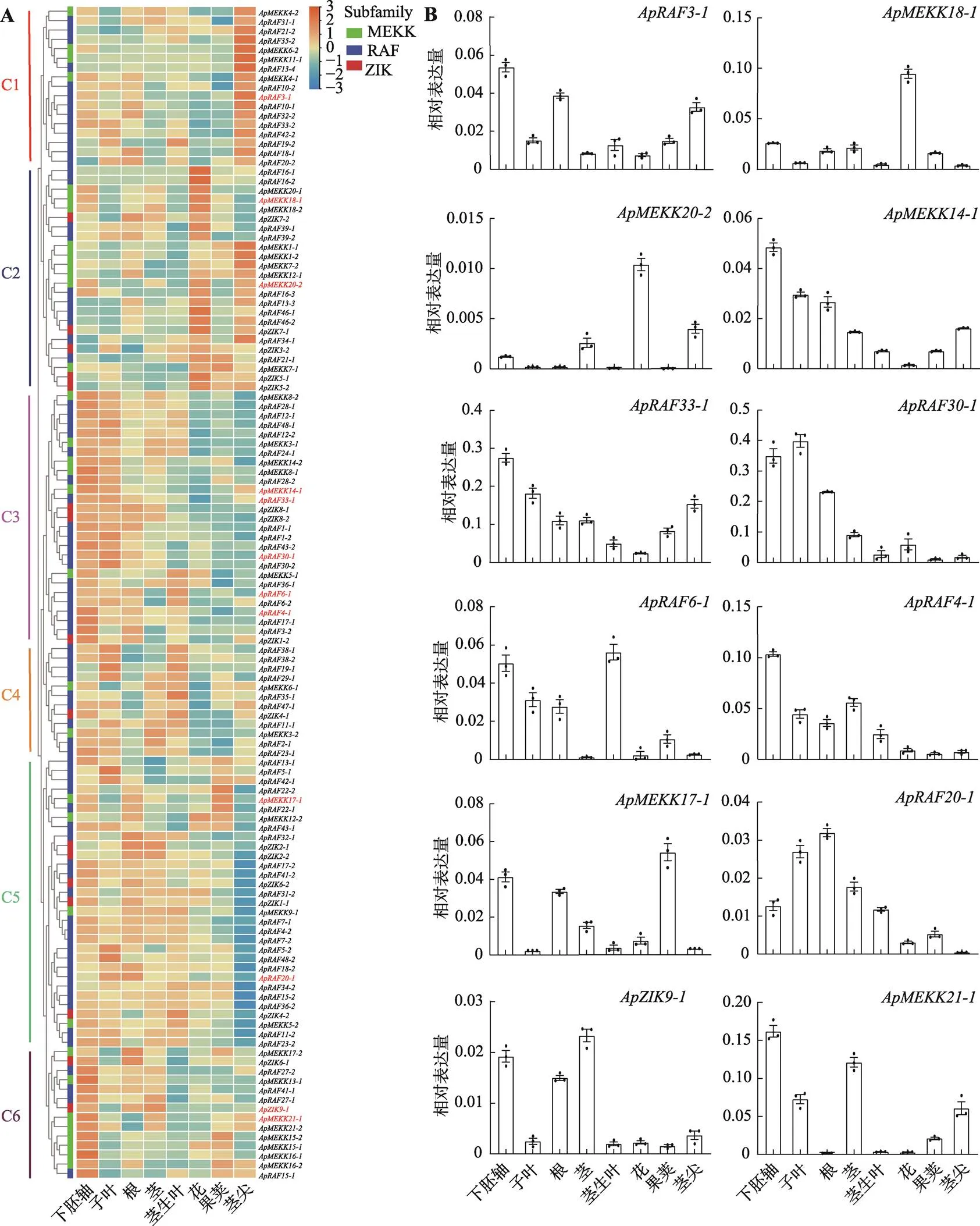
图4 ApMAPKKK基因在小鼠耳芥不同组织中的表达特征
A:基因在8个不同组织中的表达热图;B:qRT-PCR分析12个基因(A图中红色字体)在8个组织中的表达。
基因响应盐胁迫主要表现出4种表达特征(图3),并且3个亚族的成员在4种表达特征中皆有分布,表明各亚族基因具有多样的表达模式。尤其MEKK亚族的大部分基因(24个)在盐胁迫处理后上调表达,这可能与它们启动子区含有大量响应逆境胁迫的顺式作用元件有关(附图3),暗示MEKK亚族的基因积极响应盐胁迫,可能在小鼠耳芥耐盐中起着重要作用。在拟南芥中MEKK1可激活MKK2-MPK4/MPK6级联来正调控盐胁迫[40],基因在盐胁迫后也表达上调。盐胁迫会导致ABA、ROS及H2O2的积累[41~43],////表达均受盐胁迫诱导[44,45]。过表达////表现出对ABA的敏感,而敲除////表现出对ABA的不敏感[44]。本研究发现,在/、/、//和/启动子区域均含有大量的ABA响应元件(附图3),且它们均响应盐胁迫,暗示了它们可能通过ABA信号途径从而响应盐胁迫。AtRAF43参与多种非生物胁迫响应,突变体对盐、H2O2和甘露醇等的耐受性明显降低[46]。本研究发现,小鼠耳芥/基因在盐胁迫后上调表达(图3),暗示/在提高抗盐能力方面起着重要作用。过表达基因可增强拟南芥对高盐的耐受性[47],但本研究发现/基因在盐胁迫处理后下调表达(图3),暗示部分小鼠耳芥中的拟南芥直系同源基因在进化中可能产生了功能分歧。水稻在盐胁迫和H2O2处理下,可在根部特异性诱导(),SERF1可与OsMEKK6结合,从而正调控盐胁迫[48],而本研究也发现小鼠耳芥/在盐胁迫后上调表达(图3),暗示该基因在盐胁迫中的重要作用。但有关基因的具体功能还需今后进一步深入研究。
大部分基因具有广泛的组织表达特征,并有部分基因表现出组织特异性表达(图4),暗示它们在不同组织发育中的重要作用。例如/只在花中高表达,/只在茎尖高表达(图4)。AtMKKK18-AtMKK3-AtMPK1/ 2/7是ABA依赖的信号通路,可调节叶片衰老[11]和干旱胁迫抗性[12]。本研究发现在花中高表达,暗示在调控花发育中具有重要作用。基因复制引起的功能多样性可能导致基因表达水平和蛋白质性质的改变,基因复制是提高植物对新环境适应性的主要驱动因素[49]。在小鼠耳芥中一些旁系同源基因表达模式也有很大的差异。如响应高盐胁迫处理后上调表达,而则下调表达;在茎尖中高表达,而则低表达。这些结果表明,尽管复制基因之间具有高的氨基酸相似性(附表3),但它们在小鼠耳芥进化过程中可能获得了新的功能,从而引起功能分化。
已有的研究发现同一个基因可能参与多种生物学过程,包括生物胁迫和非生物胁迫响应,以及植物的生长发育等。拟南芥中,MEKK1- MKK1/MKK2-MPK4级联响应冷胁迫和盐胁迫[50],并介导先天的免疫应答反应[51,52];大豆中GmMEKK1通过增强GmMPK6的活性、抑制GmMPK3的激活来调节细胞死亡和免疫防御反应[53]。说明MAPKKK基因家族成员的功能具有多样性,同种基因可参与多条MAPK级联信号途径来响应不同的外界胁迫。因此,更多植物基因的鉴定和功能研究,更加有利于揭示植物对外界信号的响应机制。小鼠耳芥生长在新疆干旱、高温的盐碱地环境下,可能有大量的抗逆基因值得挖掘[25],而小鼠耳芥MAPK级联途径作为响应外界环境的信号通路,可帮助人们进行抗逆基因的初探索。
本文对MAPK级联中的MAPKKK基因家族进行了全基因组鉴定、结构与进化特征及响应盐胁迫与组织表达的特征分析,研究结果为今后揭示基因的功能奠定了基础,也为探索植物与环境相适应的分子机制研究提供了线索。今后的研究重点将通过反向遗传学深入分析小鼠耳芥基因在盐胁迫中发挥的功能及调控机制。
附加材料见文章电子版www.chinagene.cn。
[1] Zhu JK. Abiotic stress signaling and responses in plants., 2016, 167(2): 313–324.
[2] Zhang MM, Zhang SQ. Mitogen-activated protein kinase cascades in plant signaling., 2022, 64(2): 301–341.
[3] Ichimura K, Shinozaki K, Tena G, Sheen J, Henry Y, Champion A, Kreis M, Zhang SQ, Hirt H, Wilson C, Heberle-Bors E, Ellis BE, Morris PC, Innes RW, Ecker JR, Scheel D, Klessig DF, Machida Y, Mundy J, Ohashi Y, Walker JC. Mitogen-activated protein kinase cascades in plants: a new nomenclature., 2002, 7(7): 301–308.
[4] Zhang MM, Su JB, Zhang Y, Xu J, Zhang SQ. Conveying endogenous and exogenous signals: MAPK cascades in plant growth and defense., 2018, 45(Pt A): 1–10.
[5] Wang W, Feng BM, Zhou JM, Tang DZ. Plant immune signaling: advancing on two frontiers., 2020, 62(1): 2–24.
[6] Jonak C, Okrész L, Bögre L, Hirt H. Complexity, cross talk and integration of plant MAP kinase signalling., 2002, 5(5): 415–424.
[7] Rao KP, Richa T, Kumar K, Raghuram B, Sinha AK. In silico analysis reveals 75 members of mitogen-activated protein kinase kinase kinase gene family in rice., 2010, 17(3): 139–153.
[8] Wu P, Wang WL, Li Y, Hou XL. Divergent evolutionary patterns of the MAPK cascade genes inand plant phylogenetics., 2017, 4: 17079.
[9] Rodriguez MCS, Petersen M, Mundy J. Mitogen-activated protein kinase signaling in plants., 2010, 61: 621–649.
[10] Asai T, Tena G, Plotnikova J, Willmann MR, Chiu WL, Gomez-Gomez L, Boller T, Ausubel FM, Sheen J. MAP kinase signalling cascade ininnate immunity., 2002, 415(6875): 977–983.
[11] Matsuoka D, Yasufuku T, Furuya T, Nanmori T. An abscisic acid inducibleMAPKKK, MAPKKK18 regulates leaf senescence via its kinase activity., 2015,87(6): 565–575.
[12] Li YY, Cai HX, Liu P, Wang CY, Gao HY, Wu CA, Yan K, Zhang SZ, Huang JG, Zheng CC.MAPKKK18 positively regulates drought stress resistance via downstream MAPKK3., 2017, 484(2): 292–297.
[13] Shao YM, Yu XX, Xu XW, Li Y, Yuan WX, Xu Y, Mao CZ, Zhang SQ, Xu J. The YDA-MKK4/MKK5-MPK3/MPK6 cascade functions downstream of the RGF1-RGI ligand- receptor pair in regulating mitotic activity in root apical meristem., 2020, 13(11): 1608–1623.
[14] Soyano T, Nishihama R, Morikiyo K, Ishikawa M, Machida Y. NQK1/NtMEK1 is a MAPKK that acts in the NPK1 MAPKKK-mediated MAPK cascade and is required for plant cytokinesis., 2003, 17(8): 1055–1067.
[15] Liu YL, Schiff M, Dinesh-Kumar SP. Involvement of MEK1MAPKK, NTF6 MAPK, WRKY/MYB transcription factors,andin N-mediated resistance to tobacco mosaic virus., 2004, 38(5): 800–809.
[16] Li FJ, Li MY, Wang P, Cox KL, Duan LS, Dever JK, Shan LB, Li ZH, He P. Regulation of cotton () drought responses by mitogen-activated protein (MAP) kinase cascade-mediated phosphorylation of., 2017, 215(4): 1462–1475.
[17] Xu R, Duan PG, Yu HY, Zhou ZK, Zhang BL, Wang RC, Li J, Zhang GZ, Zhuang SS, Lyu J, Li N, Chai TY, Tian ZX, Yao SG, Li YH. Control of grain size and weight by the OsMKKK10-OsMKK4-OsMAPK6 signaling pathway in rice., 2018, 11(6): 860–873.
[18] Guo T, Chen K, Dong NQ, Shi CL, Ye WW, Gao JP, Shan JX, Lin HX.negatively regulates the OsMKKK10-OsMKK4-OsMPK6 cascade to coordinate the trade-off between grain number per panicle and grain size in rice., 2018, 30(4): 871–888.
[19] Liu ZQ, Mei EY, Tian XJ, He ML, Tang JQ, Xu M, Liu JL, Song L, Li XF, Wang ZY, Guan QJ, Xu QJ, Bu QY. OsMKKK70 regulates grain size and leaf angle in rice through the OsMKK4-OsMAPK6-OsWRKY53 signaling pathway., 2021, 63(12): 2043–2057.
[20] Wang M, Yue H, Feng KW, Deng PC, Song WN, Nie XJ. Genome-wide identification, phylogeny and expressional profiles of mitogen activated protein kinase kinase kinase (MAPKKK) gene family in bread wheat (.)., 2016, 17(1): 668.
[21] Kong XP, Lv W, Zhang D, Jiang SS, Zhang SZ, Li DQ. Genome-wide identification and analysis of expression profiles of maize mitogen-activated protein kinase kinase kinase., 2013, 8(2): e57714.
[22] Zhang JB, Wang XP, Wang YC, Chen YH, Luo JW, Li DD, Li XB. Genome-wide identification and functional characterization of cotton () MAPKKK gene family in response to drought stress., 2020, 20(1): 217.
[23] Huang XZ, Yang LF, Jin YH, Lin J, Liu F. Generation, annotation, and analysis of a large-scale expressed sequence tag library fromto explore salt-responsive genes., 2017, 8: 955.
[24] Yang LF, Jin YH, Huang W, Sun Q, Liu F, Huang XZ. Full-length transcriptome sequences of ephemeral plantprovides insight into gene expression dynamics during continuous salt stress., 2018, 19(1): 717.
[25] Li XC, Kang KC, Huang XZ, Fan YB, Song MM, Huang YJ, Ding JJ. Genome-wide identification, phylogenetic analysis and expression profiling of the MKK gene family in., 2020, 42(4): 403–421.
李晓翠, 康凯程, 黄先忠, 范永斌, 宋苗苗, 黄韵杰, 丁佳佳. 小拟南芥MKK基因家族全基因组鉴定及进化和表达分析. 遗传, 2020, 42(4): 403–421.
[26] Thompson JD, Gibson TJ, Higgins DG. Multiple sequence alignment using ClustalW and ClustalX., 2002, Chapter 2: Unit 2.3.
[27] Tamura K, Stecher G, Peterson D, Filipski A, Kumar S. MEGA6: molecular evolutionary genetics analysis version 6.0., 2013, 30(12): 2725–2729.
[28] Wang YP, Tang HB, Debarry JD, Tan X, Li JP, Wang XY, Lee TH, Jin HZ, Marler B, Guo H, Kissinger JC, Paterson AH.: a toolkit for detection and evolutionary analysis of gene synteny and collinearity., 2012, 40(7): e49.
[29] Chen CJ, Chen H, Zhang Y, Thomas HR, Frank MH, He YH, Xia R. TBtools: an integrative toolkit developed for interactive analyses of big biological data., 2020, 13(8): 1194–1202.
[30] Tang K, Dong CJ, Liu JY. Genome-wide comparative analysis of the phospholipase D gene families among allotetraploid cotton and its diploid progenitors., 2016, 11(5): e0156281.
[31] Rozas J, Ferrer-Mata A, Sánchez-DelBarrio JC, Guirao- Rico S, Librado P, Ramos-Onsins SE, Sánchez-Gracia A. DnaSP 6: DNA sequence polymorphism analysis of large data sets., 2017, 34(12), 3299–3302.
[32] Yadav CB, Bonthala VS, Muthamilarasan M, Pandey G, Khan Y, Prasad M. Genome-wide development of transposable elements-based markers in foxtail millet and construction of an integrated database., 2015, 22(1): 79–90.
[33] Niu XQ, Luo XY, Kang KC, Huang XZ, Hu NB, Sui YH, Ai H. Genome-wide identification, comparative evolution and expression analysis of PEBP gene family from., 2021, 48(5), 947–959.
牛西强, 罗潇云, 康凯程, 黄先忠, 胡能兵, 隋益虎, 艾昊. 辣椒PEBP基因家族的全基因组鉴定、比较进化与组织表达分析. 园艺学报, 2021, 48(5), 947–959.
[34] Livak KJ, Schmittgen TD. Analysis of relative gene expression data using real-time quantitative PCR and the 2 (-Delta Delta C(T)) method., 2001, 25(4): 402- 408.
[35] Altenhoff AM, Studer RA, Robinson-Rechavi M, Dessimoz C. Resolving the ortholog conjecture: orthologs tend to be weakly, but significantly, more similar in function than paralogs., 2012, 8(5): e1002514.
[36] Mattick JS. Introns: evolution and function., 1994, 4(6): 823–831.
[37] Ye JQ, Yang H, Shi HT, Wei YX, Tie WW, Ding ZH, Yan Y, Luo Y, Xia ZQ, Wang WQ, Peng M, Li KM, Zhang H, Hu W. The MAPKKK gene family in cassava: genome- wide identification and expression analysis against drought stress., 2017, 7(1): 14939.
[38] Zhang TC, Qiao Q, Novikova PY, Wang Q, Yue JP, Guan YL, Ming SP, Liu TM, De J, Liu YX, Al-Shehbaz IA, Sun H, Van Montagu M, Huang JL, Van de Peer Y, Qiong L. Genome of, a close relative of, shows ecological adaptation to high altitude., 2019, 116(14): 7137–7146.
[39] Mao ZM, An ZX, Zhou GL, Yang CY, Han YL, Li XY, Zhang YF. Flora of Xinjiang (vol. 2, part 2). Urumqi: Xinjiang Science and Technology Health Press, 1995, 145–146.
毛祖美, 安争夕, 周桂玲, 杨昌友, 韩英兰, 李学禹, 张彦福. 《新疆植物志》(第二卷第二分册). 乌鲁木齐: 新疆科技卫生出版社, 1995, 145–146.
[40] Teige M, Scheikl E, Eulgem T, Dóczi R, Ichimura K, Shinozaki K, Dangl JL, Hirt H. The MKK2 pathway mediates cold and salt stress signaling in., 2004, 15(1): 141–152.
[41] Julkowska MM, Testerink C. Tuning plant signaling and growth to survive salt., 2015, 20(9): 586–594.
[42] Hong CY, Chao YY, Yang MY, Cheng SY, Cho SC, Kao CH. NaCl-induced expression of glutathione reductase in roots of rice (L.) seedlings is mediated through hydrogen peroxide but not abscisic acid., 2009, 320: 103–115.
[43] Bienert GP, Schjoerring JK, Jahn TP. Membrane transport of hydrogen peroxide., 2006, 1758(8): 994–1003.
[44] Choi SW, Lee SB, Na YJ, Jeung SG, Kim SY.MAP3K16 and other salt-inducible MAP3Ks regulate ABA response redundantly., 2017, 40(3): 230–242.
[45] Matsuoka D, Soga K, Yasufuku T, Nanmori T. Control of plant growth and development by overexpressing MAP3K17, an ABA-inducible MAP3K, in.(), 2018, 35(2): 171–176.
[46] Virk N, Li DY, Tian LM, Huang L, Hong YB, Li XH, Zhang YF, Liu B, Zhang HJ, Song FM.Raf-Like mitogen-activated protein kinase kinase kinase geneis required for tolerance to multiple abiotic stresses., 2015, 10(7): e0133975.
[47] Kim JM, Woo DH, Kim SH, Lee SY, Park HY, Seok HY, Chung WS, Moon YH. Arabidopsis MKKK20 is involved in osmotic stress response via regulation of MPK6 activity., 2012, 31(1): 217–224.
[48] Schmidt R, Mieulet D, Hubberten HM, Obata T, Hoefgen R, Fernie AR, Fisahn J, San Segundo B, Guiderdoni E, Schippers JHM, Mueller-Roeber B. Salt-responsive ERF1 regulates reactive oxygen species-dependent signaling during the initial response to salt stress in rice., 2013, 25(6): 2115–2131.
[49] Kondrashov FA. Gene duplication as a mechanism of genomic adaptation to a changing environment., 2012, 279(1749): 5048–5057.
[50] Zhao CZ, Wang PC, Si T, Hsu CC, Wang L, Zayed O, Yu ZP, Zhu YF, Dong J, Tao WA, Zhu JK. MAP kinase cascades regulate the cold response by modulating ICE1 protein stability., 2017, 43(5): 618–629.e5.
[51] Qiu JL, Zhou L, Yun BW, Nielsen HB, Fiil BK, Petersen K, Mackinlay J, Loake GJ, Mundy J, Morris PC.mitogen-activated protein kinase kinases MKK1 and MKK2 have overlapping functions in defense signaling mediated by MEKK1, MPK4, and MKS1., 2008, 148(1): 212–222.
[52] Kong Q, Qu N, Gao MH, Zhang ZB, Ding XJ, Yang F, Li YZ, Dong OX, Chen S, Li X, Zhang YL. The MEKK1-MKK1/MKK2-MPK4 kinase cascade negatively regulates immunity mediated by a mitogen-activated protein kinase kinase kinase in., 2012, 24(5): 2225–2236.
[53] Xu HY, Zhang C, Li ZC, Wang ZR, Jiang XX, Shi YF, Tian SN, Braun E, Mei Y, Qiu WL, Li S, Wang B, Xu J, Navarre D, Ren DT, Cheng NH, Nakata PA, Graham MA, Whitham SA, Liu JZ. The MAPK kinase kinase GmMEKK1 regulates cell death and defense responses., 2018, 178(2): 907–922.
Genome-wide identification, phylogenetic and expression of MAPKKK gene family in
Qianbin Zhu1,2, Zhicheng Gan2, Xiaocui Li1, Yingjie Zhang1, Heming Zhao2, Xianzhong Huang2
Mitogen-activated protein kinase kinase kinases (MAPKKKs) are important components of the MAPK cascade and play crucial roles in development and stress responses.is an ephemeral Brassicaceae plant growing in Xinjiang desert regions, which possesses salt tolerance. To explore the evolution and function of the MAPKKK gene family in, 143 ApMAPKKK genes were identified fromgenome by genome-wide analysis, which were categorized into three subfamilies: ZIK (20), MEKK (36) and RAF (87). There existed 74 and 72 colinear genes between,and, respectively, indicating that this gene family expanded obviously ingenome. Evolutionary analysis revealed that there were 64 duplicated gene pairs witha/s less than 1, and purifying selection was dominant. RNA-seq data were used to analyze the expression characteristics ofgenes in response to salt stress and in different tissues. The results showed that mostgenes were up-regulated under 250 mmol/L NaCl stress. For example,/and/were substantially up-regulated. Tissue expression profiles showed thatmainly presented six expression patterns. Some duplicated genes were differentially expressed in response to salt stress and in different tissues. These results lay a foundation for further understanding the complex mechanism of MAPKKK gene family transduction pathway in response to abiotic stresses in.
MAPKKK;;ephemeral plant; salt stress; gene expression
2022-08-03;
2022-09-18;
2022-09-30
国家自然科学基金项目(编号:32270385, U1303302, 31060149)和安徽科技学院学科带头人引进人才启动经费项目(编号:NXYJ202001)资助[Supported by the National Natural Science Foundation of China (Nos. 32270385, U1303302, 31060149),the Talent Introduction Start-up Fund Project of Anhui Science and Technology University (No. NXYJ202001)]
朱前彬,在读硕士研究生,专业方向:生物与医药。E-mail: qianbinzhu@126.com
黄先忠,博士,教授,研究方向:植物响应逆境生理生态适应的分子机制。E-mail: huangxz@ahstu.edu.cn
10.16288/j.yczz.22-261
(责任编委: 孔凡江)

