钙镁离子改性TiO2对水中氟离子的吸附行为
冯江涛,张娟涛,闫炫冶,付娆,朱金薇,2,延卫
(1.西安交通大学能源与动力工程学院环境工程系,710049,西安;2.陕西电器研究所,710025,西安)
水体氟离子(F-)污染是公认的严重污染之一[1]。自然和人为来源的氟化物对水体的污染已经在世界范围内至少25个国家引起氟中毒问题[2-3]。过量摄入氟化物会导致牙齿和骨骼氟中毒,并伴有代谢过程损害[4]。因此,世界卫生组织(WHO)建议饮用水中F-质量浓度的允许范围为0.5~1.5 mg·L-1[3,5],我国的《生活饮用水卫生标准》(GB 5749—2022)规定饮用水中氟化物的含量应控制在1.0 mg·L-1以下。
目前,已有化学沉淀[6-7]、吸附[1]、电凝[8]、电渗析[9]、离子交换法[10]和反渗透[11]等方法可用来去除水中的氟离子。其中,吸附法由于效率高、成本低、操作和维护简单,被认为是一种很有潜力的方法[12],而性能优良的吸附剂是吸附法的关键。
二氧化钛(TiO2)由于具有优异的物理化学性能和环境友好性,近年来被广泛应用于去除水体中的污染物。目前,已有关于TiO2吸附去除水中氟离子的报道:如杨丽君等[13]研究发现纳米TiO2对水体中氟离子的吸附容量可以达到7.48 mg·g-1,并且可以在2 min内基本达到吸附平衡;Zeng等[14]将TiO2与SiO2复合,可以提高TiO2对水中F-的吸附容量。然而,商用的P25和纯的TiO2吸附F-适用的pH范围大多小于5[15],这大大限制了TiO2吸附去除水中F-的应用。
研究表明,对TiO2进行改性可以提高其对氟离子的吸附性能[16-17]。本研究通过水体中常见的钙离子和镁离子对TiO2进行改性,扩展了TiO2对水体F-吸附的pH适用范围,同时研究了其吸附机理,对采用环境友好的TiO2材料去除水中污染物具有重要意义。
1 材料与方法
1.1 材料
钛酸异丙酯、异丙醇、四水合硝酸钙(Ca(NO3)2·4H2O)、六水合硝酸镁(Mg(NO3)2·6H2O)、硝酸(HNO3,65%~68%)、氢氧化钠(NaOH)、氟化钠(NaF)等试剂购于国药集团化学试剂有限公司,均为分析纯;去离子水采用南京易普易达公司生产的EPED-40TF型纯水机制备。
1.2 分析测试仪器
场发射扫描电子显微镜(SEM,附带X射线光谱元素分析(EDS)),JSM-7800F型,日本JEOL公司;X射线衍射(XRD)测试使用荷兰帕拉克公司生产的X’Pert MPD Pro型X射线衍射仪,以Cu-Kα为靶(λ=0.154 16 nm),电压为40 kV,电流为40 mA,扫描范围为10°~80°。氮气吸脱附分析仪(对氮气吸脱附结果进行Brunauer-Emmett-Teller(BET)和Barrett-JoynerHalenda(BJH)分析),ASAP 2020型,美国Micromeritics公司;电位测定仪,Malvern Zetasizer Nano ZS90型,英国马尔文仪器有限公司;日本岛津生产的ICPE-9000型电感耦合等离子体发射光谱仪(ICP);傅里叶变换红外光谱仪,Bruker Tensor 3,德国布鲁克公司。
水中氟离子浓度采用PXS-270型离子计(上海雷磁,配PF-2-01型氟离子选择电极)测试。分别配制1、3、5、10、20、50 mg·L-1的NaF标准液,采用离子选择电极做出标准曲线,依据标准曲线测试水中的氟离子浓度。
1.3 吸附剂的制备
将一定量的Ca(NO3)2·4H2O或Mg(NO3)2·6H2O溶于浓度为0.1 mol·L-1的硝酸溶液中,配制成A溶液。向4 mL异丙醇中加入10 mL钛酸四异丙酯,室温下搅拌10 min,配制成B溶液。将200 ml的A溶液加热至50 ℃,搅拌状态下将B溶液逐滴缓慢加入到A溶液中,按照n(Ca)∶n(Ti)=1∶1或n(Mg)∶n(Ti)=1∶1控制A溶液中钙盐和镁盐的加入量。于50 ℃下持续搅拌2 h后停止加热,搅拌至室温。将所得沉淀物过滤、水洗,50 ℃烘干24 h,研磨,产物分别记为TiO2-Ca或TiO2-Mg(产率分别为78.81%、80.01%)。
为了进行比较,本研究也合成了未掺杂的TiO2。除了未在A溶液中添加Ca(NO3)2·4H2O或Mg(NO3)2·6H2O外,合成过程都与以上方法相同。
1.4 吸附实验方法
所有的吸附实验都是在转速为200 r·min-1的恒温摇床中进行的,控制温度为(25±1) ℃,待吸附平衡后,将混合液以0.45 μm滤膜过滤,滤液加入总离子强度缓冲液,用电极法测定氟离子浓度。通过下式分别计算TiO2样品对氟离子的吸附容量[18]和吸附去除率
(1)
(2)
式中:Qe为平衡吸附容量;C0为氟离子的初始浓度;Ce为吸附平衡时氟离子的浓度;η为除氟效率;m为TiO2样品的质量;V为含氟溶液体积。
(1)吸附剂投加量对除氟效率的影响。按照0.5、1、1.5、2、2.5、3 g·L-1的投加量称取不同质量的TiO2样品,分别加入到质量浓度为5.0 mg·L-1、pH为5的25 mL氟离子溶液中,置于恒温振荡摇床中振荡吸附3 h后取出过滤,测定滤液中氟离子浓度。
(2)溶液pH对除氟效率的影响。对25 mL质量浓度为5.0 mol·L-1的氟离子溶液,分别使用0.1 mol·L-1的HNO3和NaOH溶液,调节其pH为2、3、4、5、6、7、8、9、10,按1.5 g·L-1的用量称取TiO2样品加入到不同pH的氟离子溶液中,置于恒温振荡摇床中振荡吸附3 h后取出过滤,测定滤液中氟离子浓度。
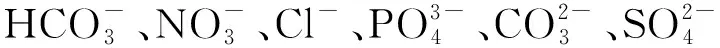
(4)吸附等温线实验。在最佳投加量及最佳溶液pH时,将不同梯度浓度的氟离子溶液与TiO2样品置于恒温振荡摇床中振荡吸附(T=15,25,35,45 ℃),达到吸附平衡后,测定其中的氟离子平衡浓度Ce,并以式(1)计算出平衡吸附容量Qe。以溶液中氟离子的平衡浓度Ce为横坐标、吸附剂的平衡吸附容量qe为纵坐标,绘制吸附等温线图,并对其进行等温线模型拟合。
(5)吸附动力学实验。在最佳投加量及最佳溶液pH条件下,选取初始质量浓度为5、10、20 mg·L-1的氟离子溶液,在常温下按照2、5、10、20、30、60、90、120、180 min的时间间隔取样,过滤后测定滤液中氟离子浓度,分别按照式(1)、(2)计算不同吸附时间下TiO2样品对氟离子的去除率和吸附容量。以取样时间t为横坐标、t时刻的吸附容量Qt为纵坐标绘制吸附动力学图,并对其进行动力学模型拟合。
(6)TiO2样品吸脱附稳定性实验。将吸附平衡后的TiO2样品干燥后取0.15 g置于0.1 mol·L-1的NaOH溶液中脱附20 min,用去离子水洗净干燥后,再以0.1 mol·L-1的HNO3溶液活化20 min。之后,加入到100 mL质量浓度为5.0 mg·L-1的氟离子溶液中,置于恒温振荡摇床中振荡吸附3 h后取出,过滤后测定滤液中氟离子浓度。重复实验,研究TiO2样品多次吸脱附的稳定性。
2 实验结果与讨论
2.1 合成材料的物理化学性能表征
2.1.1 SEM和EDS分析

表1 3种样品中各元素的摩尔分数
2.1.2 XRD分析
图2为TiO2-Ca、TiO2-Mg和TiO2的XRD图。由图可知合成的3种TiO2样品在2θ为25.13°、37.84°、47.94°、53.99°、63.78°处出现了对应锐钛矿相TiO2(101)、(004)、(200)、(211)、(204)晶面的衍射峰(JCPDS 21—1272)[20]。虽然钙离子和镁离子的掺杂使得TiO的衍射峰减弱并变宽,但是并没有改变TiO2的晶型[15],这与EDS测试结果吻合,说明确实合成了Ca2+和Mg2+掺杂的TiO2材料,并且为锐钛矿相。
2.1.3 氮气吸脱附等温线
图3为TiO2-Ca、TiO2-Mg和TiO2的N2吸脱附等温线,用Brunner-Emmet-Teller(BET)比表面积测试理论计算的结果见表2。
如图3所示,3种样品的N2吸附等温线在较低的相对压力下吸附量迅速上升,曲线上凸,属于BDDT分类中的Ⅱ型吸附曲线。两种样品的吸脱附曲线都存在脱附滞后环,其中,TiO2-Ca样品存在H3型滞后环,一般由其孔结构位狭缝型;TiO2-Mg样品存在H2型滞后环,说明样品内形成了具有瓶颈状的孔结构[21]。由表2可知,3种样品的比表面积分别达到了170 m2·g-1、247.08 m2·g-1和289.47 m2·g-1,Ca2+和Mg2+的改性使TiO2的孔体积略有降低,孔半径明显增大。

表2 3种样品的表面特性参数
2.1.4 Zeta电位分析
测定了TiO2-Ca、TiO2-Mg和TiO2的Zeta电位随pH的变化情况,结果见图4。在经过Ca2+、Mg2+修饰之后,样品的等电点从原来的3.04(TiO2)分别提升到了4.51和5.08,这有利于提高样品吸附水体中阴离子的pH适用范围。在低于等电点的pH范围内,材料表面带正电荷,而在高于等电点的pH范围内,材料表面带负电荷。材料表面荷电情况有利于材料与水体中的带有相反电荷的离子型污染物发生静电吸附作用而将污染物去除[22]。
2.2 吸附实验结果与分析
2.2.1 吸附性能影响因素
(1)投加量对除氟效率的影响。投加量的多少不仅直接影响吸附剂对水体污染物的去除效率,而且对吸附剂工业化应用的成本也有非常重要的影响[23]。在氟离子初始质量浓度为5 mg·L-1、溶液初始pH为4、温度为25 ℃时,3种TiO2样品的投加量对吸附的影响结果见图5。
由图5可知,在投加量从0.5 g·L-1增加到1.5 g·L-1时,3种材料对氟离子的去除率急剧增加,达到1.5 g/L以后,再增加吸附剂的投加量,吸附去除率不再增加。这主要是因为随着投加量的不断增加,提供了更多的吸附位点。在投加量较低时,较少的吸附位点不足以将体系中的F-完全吸附,当吸附剂投加量达到1.5 g·L-1时,所有的吸附位点刚好与体系中的F-完全结合,达到了最优的吸附位点利用率,此时吸附去除率达到最高值。相应地,随着吸附剂投加量的增加,因为体系中F-的量不变,所以吸附容量不断减小。考虑到吸附过程的去除效率和经济性等因素,选取1.5 g·L-1为后续吸附实验中的最佳吸附剂投加量。
(2)溶液初始pH对除氟效率的影响。溶液的pH值会影响吸附剂表面的物理化学特性,如表面电位的变化(见Zeta电位结果)。同时,溶液的pH值对吸附质的存在形态也会产生较大影响。对于氟离子而言,当溶液的pH大于3.2时,氟以F-的形态存在,当pH小于3.2时,氟以HF分子形态存在[24],因此考察溶液pH对材料吸附性能的影响非常必要。图6为溶液初始pH值对合成的3种TiO2样品吸附除氟效果的影响。
由图6可见,随溶液pH值上升,两种材料的吸附效率逐渐降低。对于TiO2-Ca来说,在pH为2~5的范围内,除氟效率都保持在90%以上;对于TiO2-Mg来说,在pH为2~6的范围内,除氟效率都可以维持在90%以上,只有pH为7时,吸附效率才出现明显的下降。而未改性TiO2的pH适用范围在4以下,说明Ca2+、Mg2+改性有利于提高TiO2吸附氟离子的pH适用范围,而Mg2+改性更有利于提高TiO2吸附水体F-的pH适用范围。因此,在后续的实验中,将pH=5与pH=6分别定为TiO2-Ca与TiO2-Mg的吸附最佳pH值。

表3 Ca与Mg类化合物的溶度积[26]
2.2.2 对氟离子吸附的数学模型分析
(1)吸附等温线分析
采用Langmuir模型(式3)、Freundlich模型(式4)与Temkin模型(式5)分别对25 ℃下吸附不同浓度氟离子的实验数据进行拟合[27]
(3)
(4)
(5)
式中:Qmax为Langmuir最大吸附容量;KL为Langmuir吸附平衡常数;KF为Freundlich吸附平衡常数;1/n为与吸附亲和力相关的常数;bT为Temkin等温线吸附热;KT为平衡键常数;R=8.314 J·(mol·K)-1为通用气体常数;T为绝对温度。
图8为得到的3种材料的吸附数据拟合曲线,表4为对应的方程参数与数据拟合结果。结合图8和表4可见,合成的3种TiO2材料对氟离子的吸附过程拟合得到的相关系数R2均是Langmuir模型更高,25 ℃下TiO2-Ca对氟离子的拟合最大吸附量可达22.51 mg·g-1,TiO2-Mg对氟离子的拟合最大吸附量可达20.87 mg·g-1,而纯的TiO2对氟离子的吸入容量为16.01 mg·g-1,说明Ca2+、Mg2+的改性可以提高TiO2对氟离子的吸附容量。Freundlich模型中的1/n都小于0.5,说明吸附过程容易进行。Temkin方程的R2拟合值大于0.9,说明这两种材料对氟离子的吸附过程涉及化学吸附过程[28]。

表4 3种样品对氟离子的吸附等温线拟合参数
(2)吸附动力学分析
分别采用准一级动力学模型(式6)和准二级动力学模型(式7)对吸附动力学数据进行拟合[29]
Qt=Qe(1-e-k1t)
(6)
(7)
式中:Qt为t时刻的吸附容量;k1为准一级动力学模型的吸附速率常数;k2为准二级动力学模型的吸附速率常数。
图9为合成的3种TiO2材料吸附氟离子动力学模型的拟合曲线,表5列出了对应的动力学拟合参数。由图9可知,对于TiO2-Ca和TiO2-Mg,吸附过程在20 min内即可基本达到吸附平衡,而纯的TiO2达到吸附平衡的时间为40 min。结合图9和表5,可以看出3种材料的准二级动力学模型的拟合相关系数R2要高于准一级动力学模型,合成的3种TiO2材料对溶液中氟离子的吸附过程更符合准二级动力学模型,表明该吸附过程为化学吸附机制控制的吸附行为[30]。综合对比分析吸附等温线与吸附动力学模型,表明TiO2-Ca与TiO2-Mg对氟离子的吸附过程既有化学吸附,也有物理吸附。

表5 3种样品对氟离子的吸附动力学拟合参数
(3)吸附热力学分析
根据下式[31]计算的3种材料对氟离子吸附的热力学参数如表6所示
ΔG=ΔH-TΔS
(8)
(9)
式中:ΔG为吉布斯自由能变化;ΔH为焓变;ΔS为熵变;Qe和Ce分别为吸附平衡时的吸附容量和溶液中的氟离子质量浓度。

表6 3种材料吸附氟离子的热力学参数
从表6中数据可以看出,ΔG均为负值,表明吸附材料合成的3种TiO2材料对氟离子的吸附过程可以自发进行,随着吸附过程中温度的升高,ΔG降低,表明高温有利于TiO2材料对氟离子的吸附,也说明了合成的TiO2材料对氟离子的吸附过程是吸热过程,这与ΔH的计算结果一致。ΔS为正值,可能是吸附过程中材料表面或者孔结构中的水被置换出来,使体系的墒增加[32]。
2.2.3 沉降性能和循环再生性能
(1)沉降性能。在温度为25 ℃,吸附材料投加量为1.5 g·L-1,氟离子初始质量浓度为10 mg·L-1条件下,对比研究了TiO2、TiO2-Ca和TiO2-Mg对氟离子吸附后的沉降性能。图10记录了以上3种吸附材料随时间变化的自然沉降过程。由图可知,TiO2-Ca和TiO2-Mg可以在30 min内沉降完全,而TiO2在30 min内并没有完全沉降,说明Ca2+与Mg2+改性使TiO2具有更好的沉降性能,更利于吸附之后TiO2材料与水的固液分离,降低吸附材料的分离难度和回收再利用成本。
(2)循环再生性能。使用0.1 mol·L-1的NaOH溶液对吸附氟离子后3种TiO2样品进行脱附,然后使用0.1 mol·L-1的HNO3溶液进行活化再生,研究脱附再生后的材料对氟离子吸附效率的影响,实验结果如图11所示。采用ICP法测定TiO2-Ca与TiO2-Mg吸附剂5次循环内溶液中Ti、Ca、Mg离子的析出量,结果见图12。
由图11可见,20次吸脱附再生后,TiO2-Ca与TiO2-Mg吸附剂的除氟效率仍维持在80%以上,TiO2-Mg的吸附稳定性强于TiO2-Ca,表现在吸脱附循环初期和20次之后,其吸附去除效率都高于TiO2-Ca,表明Mg2+改性更有利于提高TiO2材料的吸附稳定性。其中,前5次吸脱附循环除氟效率下降较明显,5次之后吸附性能几乎不再降低。由图12可知,前5次吸脱附循环中,伴随着每一次的吸脱附操作,都会有少量Ca、Mg析出,而Ti元素的析出几乎可以忽略,这说明金属元素Ca和Mg与TiO2的结合并不是非常牢固。同时,两种改性TiO2材料中Mg的析出量明显小于Ca的析出量,并且在循环吸脱附到第5次时就已经没有Ca和Mg析出,这也能够解释循环脱附再生实验结果中前5次吸附效率有明显减小,之后不再变化,并且TiO2-Mg循环稳定性优于TiO2-Ca的现象。纯TiO2不存在Ca和Mg析出问题,因此循环脱附再生性能要更加稳定。
同时,TiO2-Ca与TiO2-Mg两种材料在分别循环再生5次时其分子结构中的钙离子和镁离子含量降低非常明显,质量分数分别由最初的10.42%和5.14%降低到9.58%和4.62%,而在循环10次和20次时,钙离子和镁离子质量分数几乎不再下降,TiO2-Ca中的钙离子质量分数分别降低到了9.37%和9.46%,TiO2-Mg中的镁离子质量分数分别降低到了4.55%和4.48%,与水体中钙离子和镁离子的溶出趋势及TiO2-Ca和TiO2-Mg两种材料的循环再生性能相一致。这说明在循环再生过程中,TiO2-Ca和TiO2-Mg对氟离子的去除率降低主要是由于钙镁离子流失造成。
2.3 吸附机理
为了研究TiO2-Ca与TiO2-Mg吸附剂对氟离子的吸附机理,对TiO2-Ca与TiO2-Mg经过0.1 mol·L-1的HNO3溶液处理后(吸附前)和吸附饱和后的样品分别进行了FT-IR分析,以研究吸附前后TiO2-Ca与TiO2-Mg材料中基团等相关变化情况,结果如图13所示。
(10)
式中Me-TiO2材料中的改性金属离子Ca2+或Mg2+。
3 结 论
(1)通过在水解过程中加入Ca2+或Mg2+制备得到了TiO2-Ca和TiO2-Mg材料,合成材料的微观形貌、晶型与主要功能基团与传统方法制备的TiO2没有明显区别,但是其等电点分别提高到了4.51(TiO2-Ca)和5.08(TiO2-Mg)。

(3)TiO2-Ca与TiO2-Mg在常温条件下对氟离子的吸附数据更符合Langmuir等温线模型,它们对F-的最大吸附容量分别为22.51 mg·g-1和20.87 mg·g-1,并且对F-的吸附为单层化学吸附机制控制的吸附过程。吸附热力学分析表明TiO2-Ca与TiO2-Mg对氟离子的吸附过程是一个自发且吸热的过程。
(4)经过20次的循环再生后,两种材料对氟离子的去除效率依然维持在80%以上,但前5次因金属离子析出导致除氟效率下降较明显。沉降实验表明,这两种改性的TiO2较未改性的TiO2具有更好的沉降性能;TiO2-Ca与TiO2-Mg对F-的吸附机理主要为离子交换过程。
虽然Ca2+和Mg2+改性使得TiO2-Ca和TiO2-Mg对F-吸附的pH范围扩展到了5~6,但是仍然低于我国《生活饮用水卫生标准》(GB 5749—2022)规定的6.5~8.5。此外,Ca2+或Mg2+与TiO2结合并不非常稳固,合成材料的结构稳定性和吸附稳定性都有待提高。因此,寻找更加稳定的改性离子以提高改性TiO2的稳定性和提高其pH适用范围将是以后的研究方向之一。

