藏区慢性乙型肝炎患者使用PAGE-B模型对肝细胞癌的风险预测研究
赵耕,张盈莹,卓永,陈晓鸥
(1.天津医科大学朱宪彝纪念医院检验科,国家卫生健康委员会激素与发育重点实验室,天津市代谢性疾病重点实验室,天津医科大学朱宪彝纪念医院&天津市内分泌研究所,天津 300134;2.西藏自治区昌都市藏医院检验科,昌都 854000;3.天津中医药大学第一附属医院心身科,天津 300193)
肝细胞癌(HCC)是一种严重的原发性肝癌,乙型肝炎病毒(HBV)感染是HCC的主要病因[1]。HBV的不断复制及其引发的慢性炎症,都可成为促进HCC发生和发展的独立机制[2]。同时,我国是乙型肝炎(乙肝)流行大国,HBV携带者大约有1.2亿[3],西藏自治区HBV感染率为13.23%,高于全国平均水平,属于乙肝高流行地区[4]。该地区由HBV感染引发肝癌的比例高达74.89%[5],80%的患者在首次诊断时已属晚期阶段,因此,在藏区建立HCC预测模型、识别高危人群、进行风险评估对HCC的早发现、早治疗和改善预后尤为重要,对慢性肝炎(CHB)患者发生HCC的风险分层具有重要意义。目前有REACH-B、CU-HCC、PAGE-B等几种乙肝患者肝癌风险预测模型。研究表明,PAGE-B模型(基于患者基线年龄、性别和血小板计数)对CHB患者发生HCC、肝功能衰竭、移植或死亡等各种临床事件的预测性能最高,受试者工作特征曲线(ROC)的曲线下面积(AUC)分别为0.86、0.91和0.83,而REACH-B[基于患者性别、年龄、血清丙氨酸氨基转移酶(ALT)水平、乙型肝炎e抗原(HBeAg)阳性状态和乙肝病毒脱氧核糖核酸(HBV DNA)]、CU-HCC(基于患者年龄、白蛋白、胆红素、HBV DNA水平和肝硬化状态)临床事件的AUC分别为0.70、0.73和0.71,可见PAGE-B模型的预测性能明显高于REACH-B和CU-HCC[6]。本研究即采用PAGE-B模型,验证其在藏区对CHB患者HCC风险的预测价值,并将其准确性与传统风险预测模型CU-HCC、REACH-B进行比较。
1 对象与方法
1.1 研究对象 选择2014年6月—2017年3月就诊于昌都市藏医院,并接受恩替卡韦(ETV)或富马酸替诺福韦酯(TDF)治疗的HBV染患者896例。诊断标准依照中华医学会感染病学分会和肝病学分会制定的《慢性乙型肝炎防治指南(2019年版)》[7],随机分为REACH-B组、CU-HCC组、PAGE-B组。
纳入标准:(1)年龄≥18岁。(2)乙型肝炎表面抗原(HbsAg)和(或)HBV DNA阳性6个月以上。(3)接受ETV或TDF治疗至少12个月,并能在昌都市藏医院进行至少3~5年定期随访。排除标准:(1)有HCC或肝功能失代偿史。(2)合并丙型肝炎或其他严重医学疾病。(3)合并酒精性/非酒精性脂肪性肝病、自身免疫性肝病等其他肝脏相关疾病。(4)处于妊娠期或哺乳期。
1.2 研究方法 在基线检查时,患者接受评估,包括完整的病史、体检、常规生化检查、HBsAg、HbeAg和抗体、血清HBV DNA水平、超声检查和甲胎蛋白(AFP)。HBsAg和HBeAg使用罗氏601全自动免疫分析仪检测。建立资料Excel数据库,录入所有符合纳入标准的临床相关数据。每6个月随访1次,根据超声检查和实验室检查(包括AFP)评估所有患者数据。随访至2021年11月或确诊为HCC为止。
肝硬化通过组织学诊断或超声诊断,HCC的诊断依据《原发性肝癌诊疗规范(2019年 版)》[8]或经病理确诊。根据研究登记时患者的临床和实验室参数计算3种常规HCC风险预测模型CU-HCC[9]、REACH-B[10]和PAGE-B[11]模型。CU-HCC、REACHB和PAGE-B的截止值分别为5、8和10。
2 结果
2.1 患者特征 患者的基线临床特征如表1所示。
表1 基线临床特征[±s,n(%)]Tab 1 Baseline clinical features[±s,n(%)]
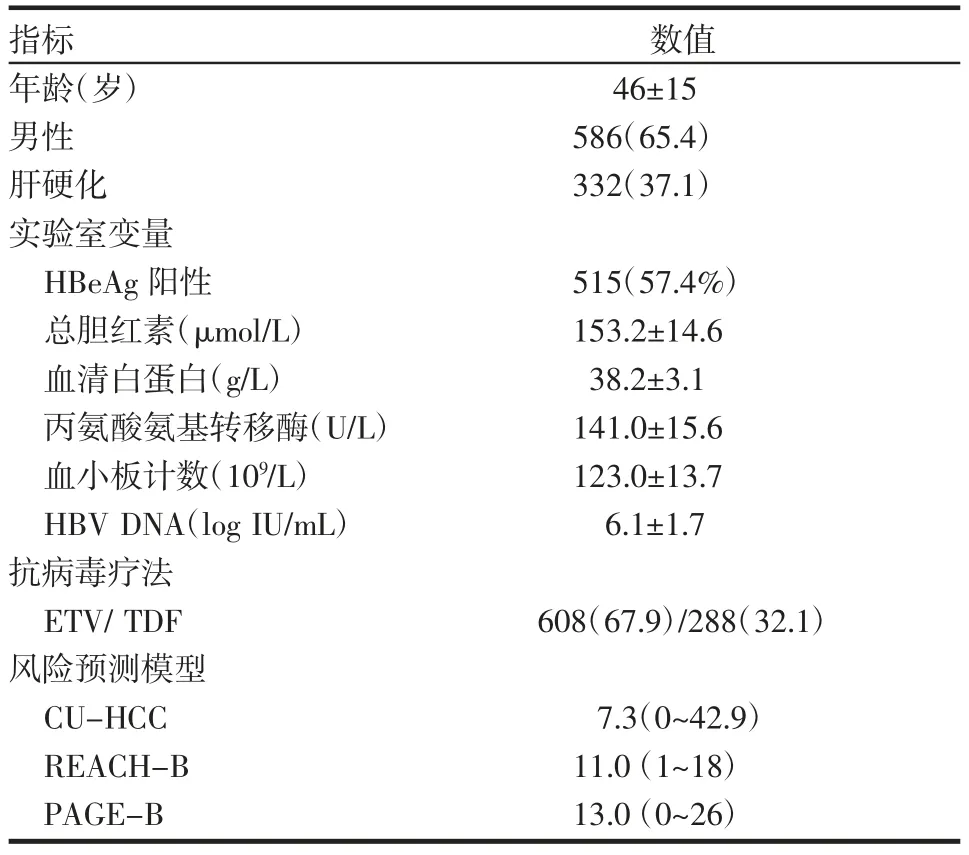
表1 基线临床特征[±s,n(%)]Tab 1 Baseline clinical features[±s,n(%)]
注:HbeAg:乙型肝炎e抗原;HBV DNA:乙肝病毒脱氧核糖核酸;ETV/TDF:恩替卡韦或富马酸替诺福韦酯;CU-HCC:基于患者年龄、白蛋白、胆红素、HBV DNA水平和肝硬化状态的乙肝患者肝癌风险预测模型;REACH-B:基于患者性别、年龄、血丙氨酸氨基转移酶水平、HBeAg阳性状态和HBV DNA的乙肝患者肝癌风险预测模型;PAGE-B:基于患者基线年龄、性别和血小板计数的乙肝患者肝癌风险预测模型
指标年龄(岁)男性肝硬化实验室变量HBeAg阳性总胆红素(μmol/L)血清白蛋白(g/L)丙氨酸氨基转移酶(U/L)血小板计数(109/L)HBV DNA(log IU/mL)抗病毒疗法ETV/TDF风险预测模型CU-HCC REACH-B PAGE-B数值46±15 586(65.4)332(37.1)515(57.4%)153.2±14.6 38.2±3.1 141.0±15.6 123.0±13.7 6.1±1.7 608(67.9)/288(32.1)7.3(0~42.9)11.0(1~18)13.0(0~26)
2.2 HCC的累积发病率32例(3.6%)患者在39.2个月发生HCC。3年和5年的HCC累积发病率分别为2.1%和4.0%。在332例肝硬化患者中,25例发展为HCC,3年时HCC的累积发病率为6.6%,5年时为11.9%。在564例无肝硬化的患者中,7例发生了HCC,3年和5年的HCC累积发病率为0.5%和0.8%。肝硬化患者的HCC累积发病率显著高于非肝硬化患者(χ2=21.67,P<0.05),见图1。
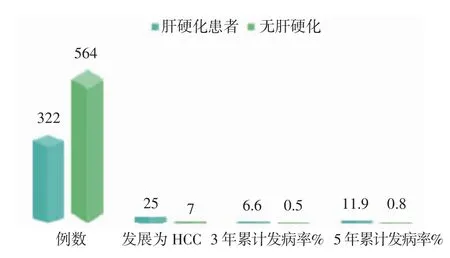
图1 肝硬化及无肝硬化患者的HCC累积发病率对比分析Fig 1 Comparison of the cumulative incidence of HCC in patients with cirrhosis and withowt cirrhosis
2.3 HCC患者与非HCC患者基线特征的比较 随访期间发生HCC的患者32例(3.6%),未发生HCC的患者864例(96.4%)。发生HCC患者的年龄、男性比例、肝硬化和总胆红素显著高于未发生HCC的患者(均P<0.05),而发生HCC患者的HBeAg阳性率、血清白蛋白和血小板计数显著低于未发生HCC的患者(均P<0.05),见表2。
2.4 HCC发展的独立预测因子 在表2的单变量分析中,年龄较大、男性和血小板计数较低显著预测HCC的发生(均P<0.05)。随后通过Logistic回归分析进行多变量分析,结果显示,年龄较大、男性和血小板计数较低是HCC发展的独立预测因子(表3)。
表2 发生HCC患者与未发生HCC患者的基线特征比较[±s,n(%)]Tab 2 Comparison of baseline characteristics between patients with HCC and those without HCC[±s,n(%)]
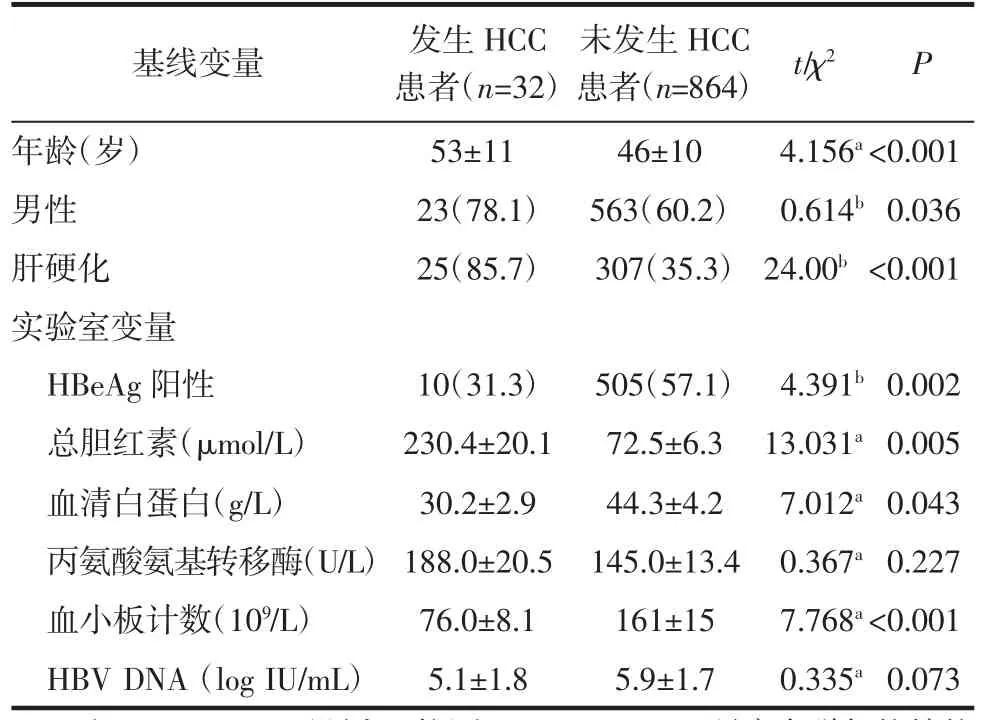
表2 发生HCC患者与未发生HCC患者的基线特征比较[±s,n(%)]Tab 2 Comparison of baseline characteristics between patients with HCC and those without HCC[±s,n(%)]
注:HbeAg:乙型肝炎e抗原;HBV DNA:乙肝病毒脱氧核糖核酸;HCC:肝细胞癌;a:t值;b:χ2值
基线变量 发生HCC患者(n=32)未发生HCC患者(n=864)t/χ2 P年龄(岁) 53±11 46±10 4.156a<0.001男性 23(78.1)563(60.2)0.614b 0.036肝硬化 25(85.7)307(35.3)24.00b<0.001实验室变量HBeAg阳性 10(31.3)505(57.1)4.391b 0.002总胆红素(μmol/L) 230.4±20.1 72.5±6.3 13.031a 0.005血清白蛋白(g/L) 30.2±2.9 44.3±4.2 7.012a 0.043丙氨酸氨基转移酶(U/L)188.0±20.5 145.0±13.4 0.367a 0.227血小板计数(109/L) 76.0±8.1 161±15 7.768a<0.001 HBV DNA(log IU/mL) 5.1±1.8 5.9±1.7 0.335a 0.073
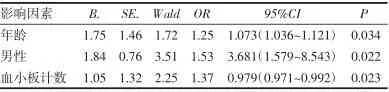
表3 影响HCC发展的多因素分析结果Tab 3 Results of multivariate analysis of influencing the development of HCC
2.5 传统HCC风险预测模型的预测性能和PAGE-B的比较PAGE-B模型预测3年时和5年时HCC发展的AUC分别为0.783和0.807,而CUHCC模型分别为0.724、0.765,REACH-B模型分别为0.621、0.582。PAGE-B和CU-HCC的AUC在统计学上无差异(P>0.05)。而REACH-B的AUC明显低于其他两组风险预测模型(P<0.05),见图2、3。当使用10的最优截止值时,PAGE-B在预测HCC发展方面显示出最高的灵敏度(3年时为93.7%,5年时为96.3%)和阴性预测值(NPV)(3年和5年时分别为97.8%和98.6%),见表4。
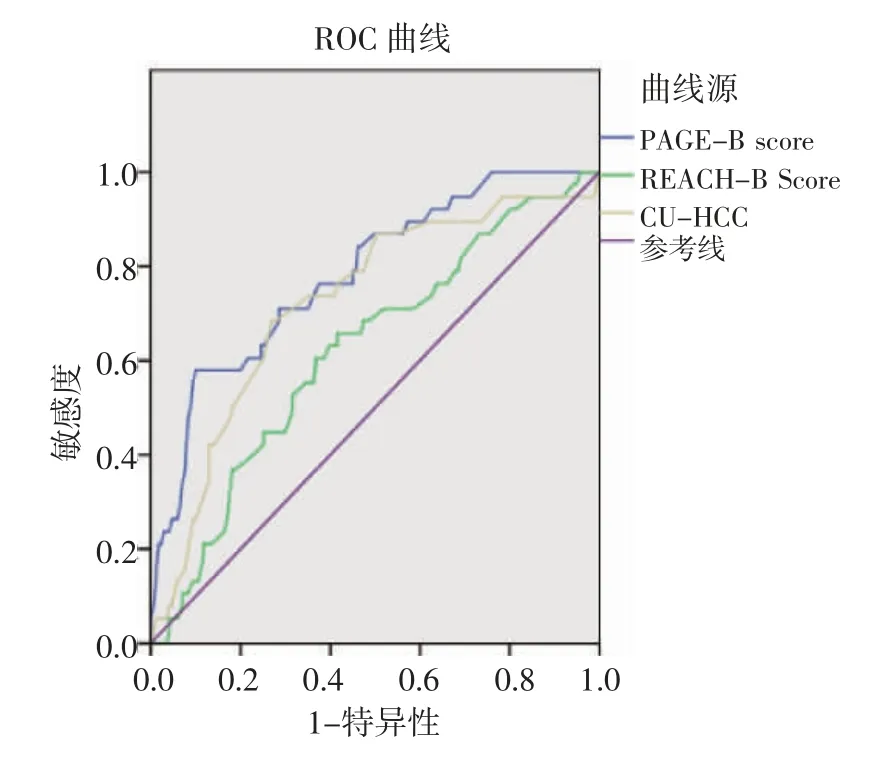
图2 PAGE-B与传统HCC风险预测模型在预测3年发展为HCC的AUCFig 2 Page-B versus traditional HCC risk prediction models for AUC in predicting the progression of HCC at 3 years

表4 各风险预测模型的预测性能Tab 4 Prediction performance of each risk prediction model
2.6 利用风险预测模型进行风险分层 表5显示了3年和5年的HCC累积发病率。使用CU-HCC的低危组和高危组的患者比例分别为46.9%(n=420)和53.1%(n=476),使用REACH-B的患者比例分别为12.1%(n=108)和87.9%(n=788),使用PAGE-B的患者比例分别为22.6%(n=202)和77.4%(n=694)。在CU-HCC和PAGE-B模型中发现3年和5年时高危组患者发生HCC的概率显著高于低危组患者(χ2=29.39、68.97,均P<0.05;χ2=20.94、57.07,均P<0.05),而REACH-B模型在高危组和低危组之间没有差异(均P>0.05)。
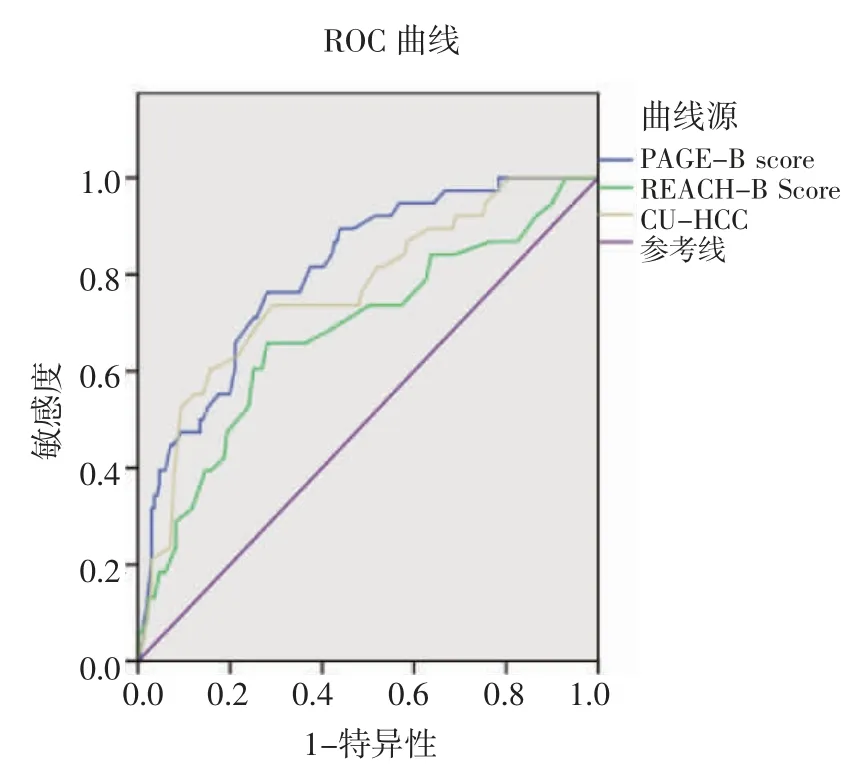
图3 PAGE-B与传统HCC风险预测模型在预测5年发展为HCC的AUCFig 3 Page-B versus traditional HCC risk prediction models for AUC in predicting the progression of HCC at 5 years
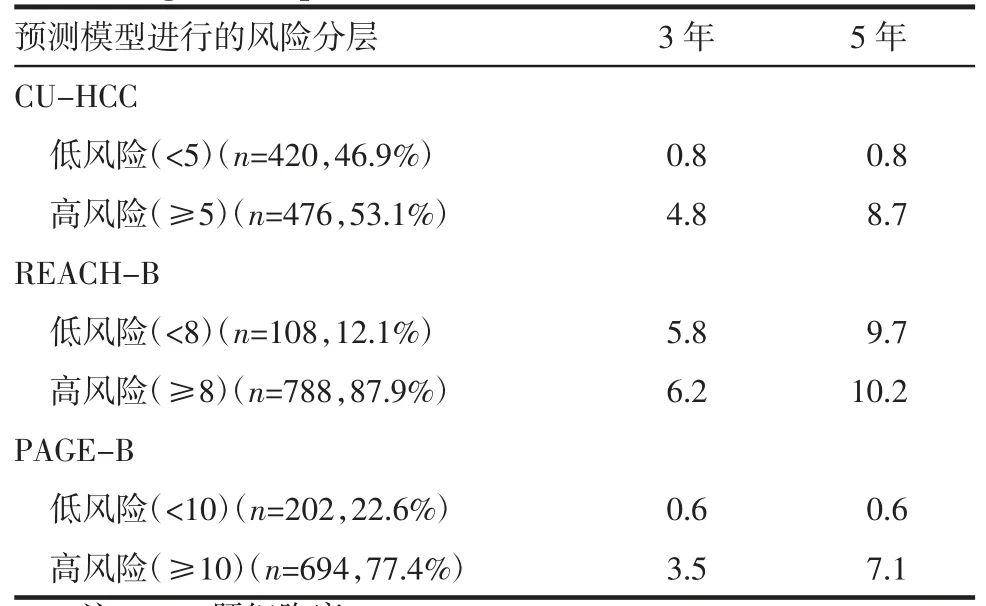
表5 根据使用风险预测模型进行风险分层的HCC累积发病率Tab 5 Cumulative HCC incidence based on risk stratification using the risk prediction model
3 讨论
根据GLOBOCAN 2018,中国HCC患者约占全球的46.71%,粗发病率是全球粗发病率的2.51倍[14]。中国国家癌症中心报道2012—2015年中国HCC 5年生存率为12.1%。HCC已成为我国癌症死亡顺位第2位[15]。藏区是我国HBV感染的高发区,感染率接近我国平均水平的2倍,高达13.23%[16]。而HBV是引起肝脏疾病的主要病毒性病原体,是导致慢性肝炎、肝硬化、HCC的最主要原因[17]。有统计表明,HCC已位居西藏地区恶性肿瘤发病率第1位[18]。因此,在该地区早期识别HBV相关性HCC高风险患者尤其重要,可使患者得到早期干预,促进高风险人群积极治疗,从而降低死亡率。由于西藏地区地广人稀,经济条件落后,医疗卫生条件差,所以需要更为简便易行,经济可靠的风险预测模型。
目前,在亚洲慢性乙型肝炎自然历史队列人群中开发了几种HCC风险预测模型,如CU-HCC、GAG-HCC、LSM-HCC、REACH-B、PAGE-B模型等。虽然风险预测因子的权重和选择略有不同,但这些评分具有类似的独立预测因子[19]。CU-HCC和REACH-B风险预测模型是在19世纪末和20世纪初制定的,由于在开发这些预测模型时没有合适的抗病毒治疗,HBV DNA水平被用作HCC发展的重要预测因子,其基础是HBV DNA水平与HCC发展的风险相关。而目前,强效口服抗病毒药物恩ETV和TDF的出现对CHB的治疗产生了重大影响。ETV和TDF可抑制绝大多数患者的HBV复制并改善纤维化[20],对HBV DNA抑制率为61%~92%[21],并具有强大的抗病毒活性和高抗药性遗传屏障,因此,被国际指南推荐作为一线抗病毒药物。抗病毒治疗可修改变量HBV DNA、HBeAg状态和ALT等,但变量年龄、性别不受抗病毒治疗的影响。经过抗病毒治疗,虽然部分患者从高风险转变为低风险,但其HCC发病率仍然高于基线时风险评分低的患者,发展为HCC的风险却不能完全消除[19,22]。而过去依赖HBV DNA水平的风险预测可能不再适用于接受治疗的患者,因此需要更加准确的预测模型来对抗病毒治疗的CHB患者进行危险分层。
PAGE-B模型是在接受ETV或TDF治疗的白种人群CHB患者中衍生出来风险评分模型[23],是第一个在使用ETV或TDF这两种推荐的一线抗病毒方案治疗患者中衍生出来的模型。该模型非常简单,易于在常规临床实践中使用,因为它仅基于患者的年龄、性别和血小板计数。而这种简单有效的模型非常适合在西藏地区使用,所以本研究在西藏地区,对接受ETV或TDF治疗的慢性乙型肝炎患者进行验证PAGE-B,并将其预测性能与其他常规HCC风险预测模型进行比较。
在本研究中,组成PAGE-B的3个因素:年龄、性别和血小板计数,被确定为HCC发生的独立预测因子。其中,男性和年长者已成为众所周知的HCC危险因素[24]。此外,血小板计数也是肝病严重程度和HCC发展的重要预测指标[11]。本研究显示,PAGE-B的预测性能与CU-HCC相当(P>0.05),显著高于REACH-B(P<0.05)。此外,PAGE-B模型在预测HCC发展方面显示出最高的NPV(3年和5年时为97.8%及98.6%),可能表明PAGE-B模型可用于识别低风险组。
本研究在西藏地区,用较大样本量的患者验证了PAGE-B的预测性能,并将其性能与其他风险预测模型进行了比较。另外,PAGE-B可以在西藏这种资源有限的地区中使用,因为它不需要HBV DNA滴度或纤维负荷的详细评估,如瞬时弹性成像等复杂的检测手段。在本研究中,存在几个问题尚未解决。首先,尽管样本量较大,但随访期相对较短,后续还应做较长随访期的研究,期望能更精确地估计风险预测模型的准确性。其次,未能与最近新开发的基于肝脏硬度的HCC风险预测模型进行比较[24],后者在抗病毒治疗的CHB患者中也显示出比传统模型更高的HCC发展预测性能。
总之,本研究验证了PAGE-B在接受ETV或TDF治疗的西藏地区CHB患者中的适用性,并发现PAGE-B的表现与CU-HCC相当,高于REACH-B,适合在医疗条件较差的西藏地区进行推广,并需要进一步的研究,对接受抗病毒治疗的CHB患者,应建立使用PAGE-B进行HCC监测的策略。

