金刚烷席夫碱类衍生物的设计合成及其初步抗肿瘤活性研究
宫旭阳,郭瑞春,2,朱佳慧,2,夏 艳,2*
(1.长春工业大学 化学与生命科学学院, 吉林 长春 130012;2.长春工业大学 材料高等研究院, 吉林 长春 130012)
0 引 言
研究发现,席夫碱化合物可以广泛地应用于催化[10]、药物[11]和光电材料[12]等领域,同样,席夫碱衍生物的电分析应用也很热门[13-16]。金刚烷席夫碱类化合物一方面有金刚烷类化合物优良的热稳定性、脂溶性好等特点,同时也具有席夫碱化合物的结构特点和较大的π共轭体系,预期将金刚烷骨架与席夫碱结构相结合会得到结构新颖和性能独特的新化合物。文中以金刚烷为母体,通过一系列化学反应合成得到金刚烷席夫碱衍生物5a-f,并进行了抗癌细胞增殖活性的研究。目的为了筛选出结构新颖、低毒性和抗癌效果好的先导化合物。
目标化合物5a-f的合成路线如图1所示。
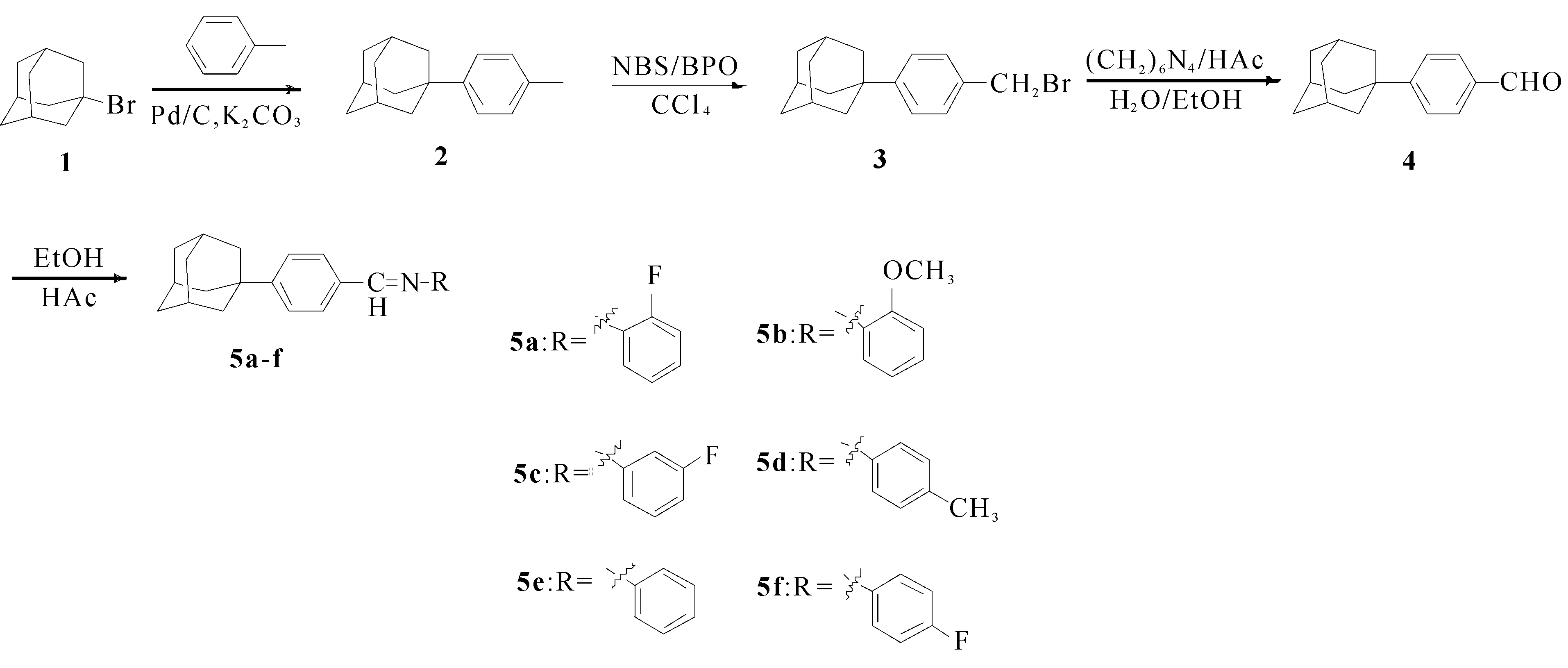
图1 目标化合物5a-f的合成路线
1 实验部分
1.1 试剂和仪器
实验中所需药品购于北京百灵威科技有限公司;
试剂购于北京化工厂;
实验中甲苯应实验前用钠和二苯甲酮除水、回流精制;
其他试剂均为市售分析纯。
AVANCE 400核磁共振波谱仪,购于Bruker瑞士公司;
日前,中国农业大学果树园艺系教授李光晨通过多年研究、选育,培育出我国首个具有自主知识产权的鲜食型芭蕾苹果优良新品种“金蕾1号”和“金蕾2号”。
Autoflex speed MALDI-TOF飞行时间质谱仪,购于Bruker德国公司;
Lambda 25紫外-可见吸收光谱仪,购于美国Perkin Elmer公司;
RFG5301PC荧光光谱仪,购于日本岛津公司。
1.2 实验过程
1.2.1 1-(对甲苯)金刚烷2的合成
向反应瓶(100 mL)中加入金刚烷溴(1 g),加入无水K2CO3(321 mg),量取15 mL精制甲苯加入反应瓶,再加入10%Pd/C 搅拌均匀。氮气保护下115 ℃加热回流反应24 h。反应结束待温度降至40 ℃后,过滤,用二氯甲烷多次冲洗,得到透明溶液,旋出多余溶剂,选择合适的洗脱剂(石油醚),用柱层析法纯化,最后得到白色固体0.870 5 g,产率82.9%。1H-NMR (CDCl3,400 MHz)δ7.28(d,J=8 Hz,2H),7.14(d,J= 8 Hz,2H),2.33(s,3H),2.10(s,3H),1.91(s,6H),1.81~1.74(m,6H);13C-NMR (CDCl3,100 MHz)δ148.49,134.88,128.82,124.72,49.39,43.34,36.90,29.07。
1.2.2 1-[4-(溴甲基)苯基]金刚烷3的合成
向反应瓶(100 mL)中加入中间体2(200 mg),加入NBS(188.72 mg),加入BPO(10 mg),量取10 mL四氯化碳加入反应瓶。氮气保护下80 ℃加热回流反应16 h。反应结束待温度降至40 ℃后,用四氯化碳多次冲洗,过滤,旋出多余溶剂,选择合适的洗脱剂(DCM∶PE(v∶v)=1∶30),用柱层析法纯化,最后得到淡黄色固体166.7 mg,产率62%。1H-NMR (CDCl3,400 MHz)δ7.19(s,4H),4.43(s,2H),2.03(b,3H),1.83(s,6H),1.71~1.69 (m,6H);13C-NMR(CDCl3,100 MHz)δ151.78,134.80,128.82,125.37,43.13,36.79,28.95。
1.2.3 4-(1-金刚烷基)苯甲醛4的合成
向反应瓶(100 mL)中加入中间体3(100 mg),加入(CH2)6N4(64.29 mg),依次向反应瓶中加入乙醇(5 mL)和水(5 mL)。氮气保护下85 ℃加热回流反应30 min后,将量取好的冰醋酸倒入恒压液滴漏斗中,并逐滴加入上述溶液中。反应3~4 h,TLC追踪反应,反应结束冷却到室温,逐滴加入浓HCl(1 mL)到反应液中,继续反应1.5 h。反应结束待温度降至室温,用氢氧化钠溶液调整pH至中性,用二氯甲烷萃取,过滤,用无水硫酸镁干燥,减压抽滤,旋出多余溶剂,选择合适的洗脱剂(EA∶PE(v∶v)=1∶20),用柱层析法纯化。最后得到白色固体(52.7 mg),产率66.9%。1H-NMR(CDCl3,400 MHz)δ9.98(s,1H),7.83(d,J=8 Hz,2H),7.53(d,J=8 Hz,2H),2.12(s,3H),1.94(b,6H),1.83~1.75(m,6H);13C-NMR (CDCl3,100 MHz)δ191.82,158.43,129.65,125.56,42.94,36.69,29.10。
1.2.4 目标产物的合成
向反应瓶(100 mL)中加入化合物4(1当量),加入乙醇,使其充分溶解,将含有不同取代基的苯胺(1.2当量)溶于乙醇中,并将其逐滴加入化合物4的乙醇溶液中,加入少量冰乙酸。氮气保护下混合物在80 ℃加热回流反应24 h。待反应冷却至室温,过滤,乙醇多次冲洗,粗产物经过柱层析色谱得到席夫碱衍生物5a-f。
5a:1H-NMR (CDCl3,400 MHz)δ8.49(s,1H),7.88(d,J=8 Hz,2H),7.48(d,J=8 Hz,2H),7.15(s,4H),2.13(s,3H),1.96(s,6H),1.84~1.76(m,6H);13C-NMR (CDCl3, 100 MHz)δ162.88,155.55,153.94,140.40,133.49,128.87,126.36,125.49,124.42,122.09,116.18,42.95,36.73,28.90;FT-IR(KBr,cm-1):2 898,2 848(C-H),1 626(C=N),1 239,1 093(C-N),975(=C-H);TOF-MS:m/z334.198 7 [M+H]+。
5b:1H-NMR(CDCl3,400 MHz)δ8.43(s,1H),7.88(d,J=8 Hz,2H),7.47(d,J=8 Hz,2H),7.15~7.10(m,1H),6.98~6.96(m,3H),3.88(s,3H),2.13(s,3H),1.95(s,6H),1.84~1.76(m,6H);13C-NMR(CDCl3, 100 MHz)δ161.33,155.05,152.25,142.38,133.84,128.79,126.33,125.44,121.06,120.34,111.66,55.93,42.97,36.66,28.86;FT-IR(KBr,cm-1):2 904,2 843(C-H),1621(C=N),1 291,1 256(C-N),971(=C-H);TOF-MS:m/z346.228 9[M+H]+。
5c:1H-NMR(CDCl3,400 MHz)δ8.40(s,1H),7.89~7.83(m,2H),7.48(d,J=8 Hz,2H),7.36~7.27(m,1H),6.98~6.90(m,4H),2.16(s,3H),1.95(s,6H),1.81~1.76(m,6H);13C-NMR (CDCl3,100 MHz)δ164.55,161.17,154.93,154.22,133.35,130.41,128.85,125.51,116.68,112.32,108.13,42.95,36.68,28.90;FT-IR (KBr,cm-1):2 894,2 843(C-H),1 637(C=N),1 306,1 256(C-N),977(=C-H);TOF-MS:m/z334.201 0[M+H]+。
5d:1H-NMR (CDCl3,400 MHz)δ8.44(s,1H),7.85(d,J=8 Hz,2H),7.47(d,J=8 Hz,2H),7.20(d,J=8 Hz,2H),7.13(d,J=8 Hz,2H),2.38(s,3H),2.13(s,3H),1.96(s,6H),1.84~1.76(m,6H);13C-NMR(CDCl3,100 MHz)δ159.58,154.94,149.84,135.49,133.83,129.72,128.59,125.32,120.79,43.04,36.69,28.92,20.98;FT-IR(KBr,cm-1):2 904,2 844(C-H),1 596(C=N),1 317,1 251(C-N),957(=C-H);TOF-MS:m/z 330.214 5[M+H]+。
5e:1H-NMR (CDCl3,400 MHz)δ8.51(s,1H),7.85(d,J=8 Hz,2H),7.48(d,J=8 Hz,2H),7.41~7.37(m,2H),7.22~7.19(m,3H),2.12(s,3H),1.95(s,6H),1.83~1.75(m,6H);13C-NMR(CDCl3,100 MHz)δ160.36,155.14,152.43,133.68,129.10,128.68,125.68,125.36,120.85,43.02,36.69,28.90;FT-IR(KBr,cm-1):2 898,2 838(C-H),1 626(C=N),1 301,1 174(C-N),977(=C-H);TOF-MS:m/z 316.201 3[M+H]+。
5f:1H-NMR(CDCl3,400 MHz)δ8.50(s,1H),7.83(d,J=8 Hz,2H),7.46(d,J=8 Hz,2H),7.17(t,J=8 Hz,2H),7.06(t,J=8 Hz,2H),2.12(s,3H),1.94(s,6H),1.83~1.75(m,6H);13C-NMR(CDCl3,100 MHz)δ162.35,160.12,155.23,148.43,133.56,128.67,125.38,122.24,115.84,43.03,36.70,28.99;FT-IR(KBr,cm-1):2 904,2 844(C-H),1 616(C=N),1 309,1 193(C-N),978(=C-H);TOF-MS:m/z 334.200 9[M+H]+。
2 结果与讨论
2.1 结构表征
由图1可知,以1-溴金刚烷为原料,经过付克烷基化反应、自由基取代、氧化反应和脱水反应得到目标化合物5a-f。在FT-IR谱图中,目标化合物在1 600~1 650 cm-1左右出现C=N 双键的吸收峰,1 000~700 cm-1左右出现=C-H双键的吸收峰;1H NMR谱图中,席夫碱基-CH=N-上的质子信号在8.51和8.44左右处,在δ1.94,1.85和1.41处为金刚烷骨架的质子信号,化合物5f的核磁共振氢谱如图2所示。
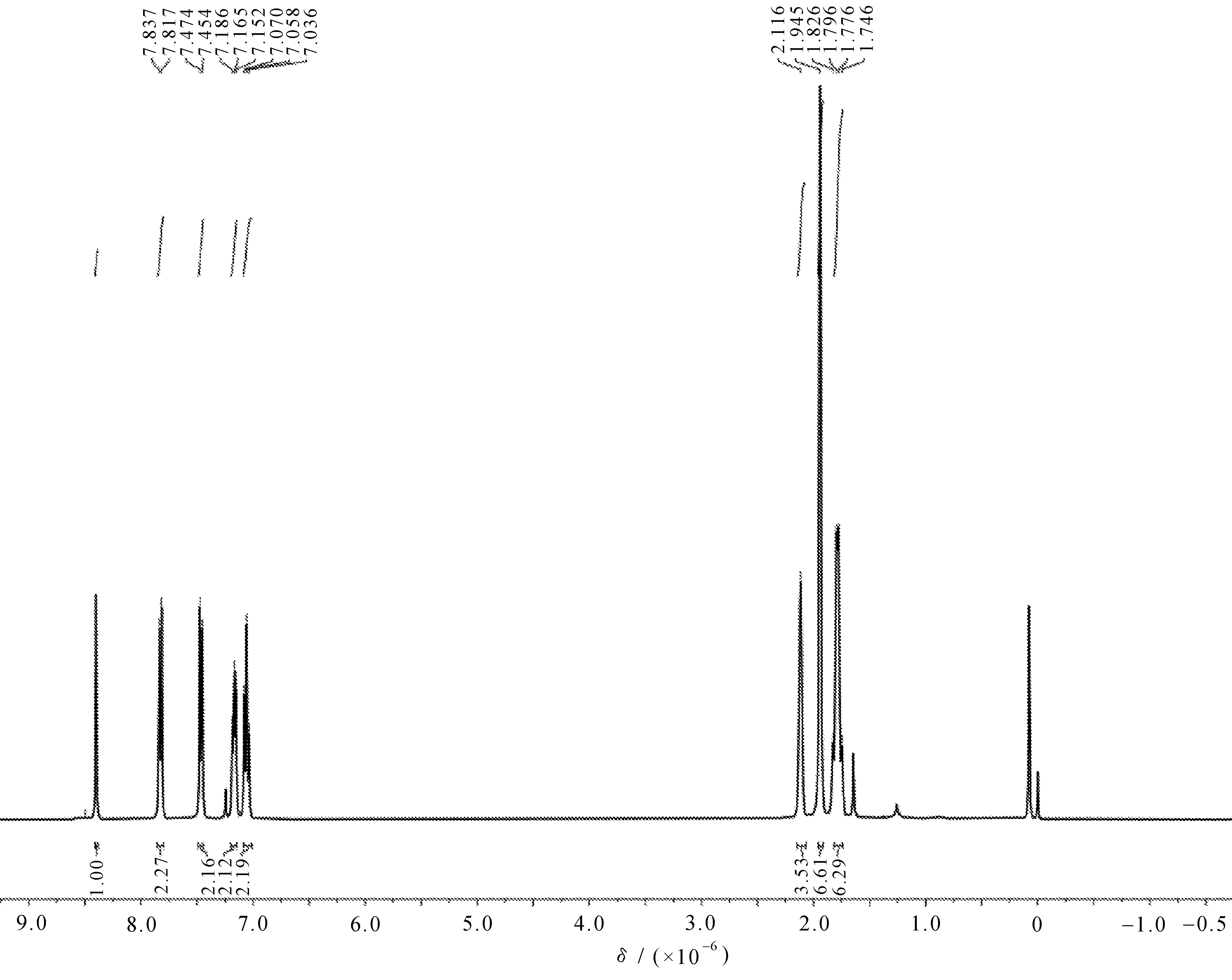
图2 化合物5f的核磁共振氢谱
TOF-MS谱图中,所有化合物均出现[M+1]+峰。
2.2 细胞毒活性
为了筛选具有抗肿瘤活性的先导化合物,用CCK-8法测定化合物对三种肿瘤癌细胞系(HeLa、MCF-7和A549)以及一种正常细胞(HEK-293)的生长抑制活性,20 μM浓度下化合物的抑制活性见表1。
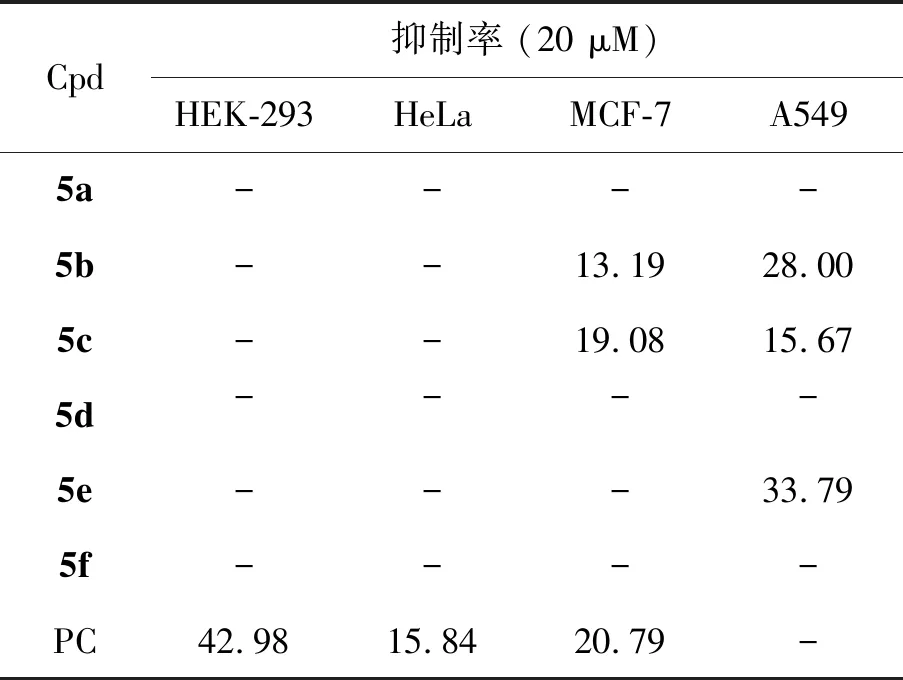
表1 化合物对细胞的生长抑制活性 %
具体步骤如下:收集对数期细胞,调整细胞悬液浓度约为5×103cell/mL,接种于96孔板,每孔加入100 μL;37 ℃,5%CO2孵育至细胞单层铺满孔板,加入浓度梯度的小分子,待测小分子的终浓度分别为2.5,5.0,10.0,20.0,40.0 μmol/L;37 ℃,5%CO2孵育48 h,倒置显微镜下观察;每孔加入100 μL的CCK-8溶液,继续培养1 h;终止培养,选择490 nm波长,在酶联免疫监测仪上测定各孔光吸收值,记录结果,以时间为横坐标,吸光值为纵坐标绘制细胞生长曲线,以5-氟尿嘧啶作为阳性参照。从表中可以看出,合成的化合物对宫颈癌细胞没有抑制作用,而邻位上有甲氧基的化合物5f相对于间位上有氟原子的5a对人乳腺癌细胞的抑制活性好,但是跟阳性对照相比稍差。而化合物5b比5c对人肺癌细胞有更好的抑制活性,不带取代基的化合物5e对人肺癌细胞的抑制活性最好,阳性对照则对人的肺癌细胞无抑制活性。以上结果说明基团的空间位阻也可以影响化合物对癌细胞活性,为以后计算机辅助设计该类化合物起到了指导性作用,此类化合物的构效关系和作用机理有待进一步研究。
3 结 语
利用经典而有效的制备途径,首次合成了新型含金刚烷结构的席夫碱类衍生物5a-f。通过研究化合物对肿瘤细胞的抑制活性实验发现:相对于阳性参照5-氟尿嘧啶目标化合物5e对人肺癌细胞A549有较好的抑制活性,充分说明此设计达到了预期的效果。该研究对设计新型具有抗癌活性含金刚烷骨架的化合物、构效关系以及作用机理的研究有一定的参考价值。

