超声造影在检测冠心病颈动脉斑块内新生血管中的作用及与血清Hcy的关系
孙 翔, 谭 杰
武汉市汉口医院超声科, 湖北 武汉 430022
颈动脉斑块内新生血管(IPN)是斑块易损性的主要特征[1]。然而,导致斑块易损性的重要因素仍未确定。新生血管是斑块内出血的一个明显的重要来源,而斑块内出血与斑块破裂的进展有关。有研究表明,IPN与患者症状、心血管危险因素和中风发生率之间存在关联[2]。超声造影(CEUS)是一种新兴技术,对于早期动脉粥样硬化和高危人群中的易损斑块检测是一种有价值的方法[3]。颈动脉斑块造影剂增强与新生血管的组织学密度相关[4]。尽管颈动脉IPN与斑块易损性相关,但其预后价值尚不清楚。因此,本研究使用CEUS评估了IPN的临床和血流动力学特征,并调查了IPN的存在与冠心病患者血清Hcy和血脂表达及预后之间的关系。
1 资料与方法
1.1 一般资料
选择2017年3月至2018年3月,我院167例稳定型冠心病(CAD)伴颈动脉斑块(厚度≥1.5 mm)患者作为研究对象,斑块厚度通过颈动脉超声检查确认。所有患者均行CEUS检查。所有患者均已签署知情同意书。纳入标准:稳定性CAD患者;厚度≥1.5 mm;年龄为18~85岁;患者无其他严重器官病变、恶性肿瘤、认知障碍等严重疾病;患者知情同意。排除标准:具有经皮颈动脉介入或动脉内膜切除术的病史;伴有明显的瓣膜功能障碍、结缔组织病、恶性肿瘤;年龄<18岁或>85岁;孕妇;存在认知障碍。本研究得到了我院伦理委员会批准。
1.2 方法
1.2.1临床和实验室指标检查
从患者病历中收集每位患者的基本病史、血压、心电图结果。患者常规禁食12 h后,于次日清晨空腹取静脉血并进行离心,采用奥林巴斯AU2700全自动生化分析仪检测患者的血脂代谢指标,包括总胆固醇(TC)、甘油三酯(TG)、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)。同型半胱氨酸(Hcy)通过Hcy ELISA测定试剂盒(货号:1329,上海广锐生物科技有限公司)进行测定。
1.2.2常规颈动脉多普勒超声和CEUS
仪器采用GE Healthcare Vivid E9超高档彩色多普勒超声诊断系统,探头频率为15 MHz,具有CEUS功能。分别扫描颈总动脉(CCA)、颈内动脉(ICA)和颈外动脉(ECA)。所有颈动脉测量均使用半自动血管壁检测软件进行。在短轴图像采集之后,长轴B模式图像用于后续测量。使用自动边缘检测系统,在CCA的远端壁上距颈动脉近1 cm处测量颈动脉内中膜厚度(IMT)。斑块定义为血管壁伸入动脉腔至少0.5 mm,IMT>周围部位的50%或大于1.5 mm[5]。使用半自动分析系统在CCA、ECA和ICA中测量收缩期峰值速度(PSV)和舒张期末期速度(EDV),血管阻力指数(RI)=(PSV-EDV)/PSV。CEUS检查造影剂使用六氟化硫微泡(声诺维,意大利Bracco Suisse SA公司),通过外周静脉推注2 mL造影剂,然后推注5 mL盐水。注射造影剂后,通过纵向成像评估斑块内新生血管(IPN)。代表性图例见图1。
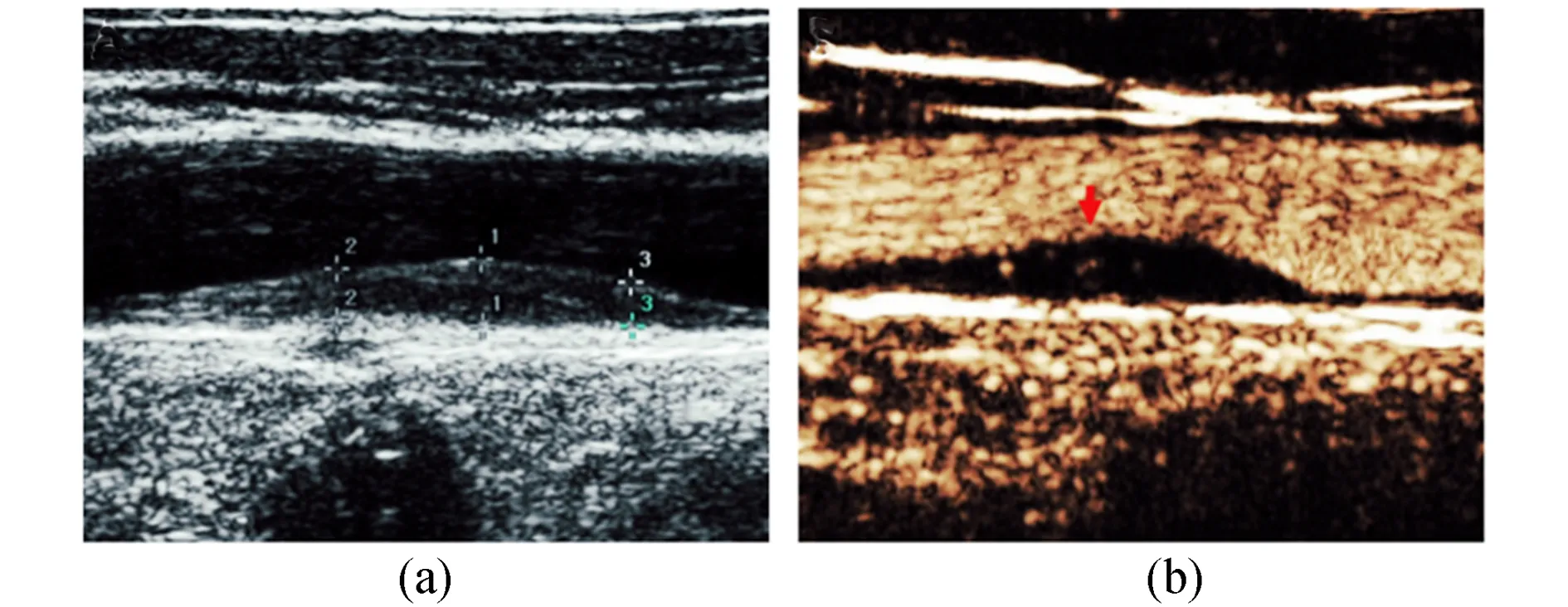
图1 典型IPN病例的超声影像图
根据患者是否存在IPN,将患者分为非IPN组(n=85)和IPN组(n=82)。
1.2.3随访
通过病历审查或电话采访进行临床随访。主要终点是主要不良心血管事件(MACE),包括心源性死亡、急性心肌梗死(AMI)、需要冠脉血运重建的CAD或中风/短暂性脑缺血发作(TIA)。
1.3 统计分析
2 结果
2.1 患者的基线特征
患者的基线特征列于表1。入组患者的平均年龄为(66.74±11.68)岁,包括男性97例,女性70例。非IPN组与IPN组年龄、性别、高血压、糖尿病、吸烟史、初始房颤、中风病史、收缩压、舒张压和心率比较,差异均无统计学意义(P>0.05)。

表1 患者的基线特征
2.2 IPN患者的颈动脉超声特征
表2中描述了患者的颈动脉多普勒超声特征。IPN组的斑块最大厚度高于非IPN组(P<0.05)。两组患者的CCA PSV、CCA EDV、ICA PSV、ICA EDV、CCA的平均RI比较,差异无统计学意义(P>0.05)。
2.3 IPN患者的血脂代谢指标及血清Hcy水平
如表3所示,两组患者的TC、TG、HDL-C和LDL-C差异无统计学意义;IPN组的血清Hcy水平显著高于非IPN组(P<0.05)。

表3 患者的血脂代谢指标及血清Hcy水平
2.4 稳定型CAD患者的MACE发生率
本研究中,平均随访时间为(879.50±342.33) d,其中,主要不良心血管事件(MACE)的总发生率为7.19%(12/167),这些事件中,1例为心源性死亡,5例为新发的急性心肌梗死,3例为不稳定型心绞痛,3例为稳定型心绞痛,需要冠状动脉血运重建术。非IPN组患者中3例发生MACE,IPN组患者中9例发生MACE。两组患者的MACE发生率差异无统计学意义(t=3.470,P=0.062)。患者MACE的Kaplan-Meier生存曲线显示(图2),两组的MACE发生时间差异有统计学意义(χ2=4.113,P=0.043),IPN组患者在随访时的MACE发生时间早于非IPN组患者。

图2 患者MACE的Kaplan-Meier生存曲线
3 讨论
动脉粥样硬化是一种进行性的、动态的动脉壁病理过程,可导致严重的临床表现,如心肌梗死和缺血性中风。因此,早期准确识别容易发生动脉粥样硬化的高危人群可避免CAD及其他相关疾病的发生。目前,非侵入性成像如CEUS可以直接显示动脉粥样硬化,能够更好地诊断心血管事件的发生风险[6]。临床和实验研究表明,除了狭窄的严重程度,动脉粥样硬化斑块的其他特征也可以预测动脉粥样硬化相关并发症的发展[7]。新生血管是斑块易损性的标志,可以用CEUS进行无创性评估。CEUS可以直接显示动脉粥样硬化患者的颈动脉中的动脉血管和IPN[8]。IPN已被证明可能通过白细胞募集和斑块内出血促进斑块不稳定。IPN的扩张与晚期斑块内的炎性浸润可导致细胞外基质降解、巨噬细胞浸润和坏死核增大,从而削弱动脉壁并促进斑块破裂[9]。因此,本研究考察了CEUS在检测冠心病颈动脉IPN中的作用,结果表明,IPN患者的斑块最大厚度高于非IPN患者,提示斑块厚度与IPN的形成密切相关,有学者认为,IPN密度与斑块厚度呈正相关[10],颈动脉粥样硬化内斑块厚度与IPN分级呈正相关[11],与本研究结果一致。
Demeure等[4]报道,由于造影剂的血管内特性,CEUS反映的是新生血管,而不是内皮通透性,因此CEUS无法有效反映内皮通透性,此外,组织学证实的新生血管和使用CEUS检查出的IPN并不总是一致的,特别是在轻度IPN的情况下。现有文献证实,Hcy是内皮损伤的重要标志物,并且Hcy也是心血管疾病的独立危险因素,Hcy不仅可以诱发原发性高血压,还可以诱发CAD、动脉粥样硬化、脑卒中等严重心脑疾病[12]。据报道,Hcy每升高3 μmol/L,CAD发生风险可增加11%[13]。Hcy加速心血管疾病形成的主要机制是其可损伤内皮细胞和中层平滑肌细胞,促进间质胶原纤维的形成,引起血管壁硬化[14]。因此,本研究检测了CAD患者的血清Hcy水平,结果表明IPN患者的血清Hcy水平高于非IPN患者。说明Hcy水平与IPN的形成有密切关联,本研究推测高水平的Hcy损伤了血管内皮,引起了血管壁硬化,这种改变又进一步引起了局部缺血,以及随后的血管生成。因此,在检查IPN的基础上联合检测Hcy水平,可同时获得患者血管形成和内皮损伤情况,便于对疾病的预防和控制。
在其他的研究中,IPN的存在与1年心血管预后无关[15]。van den Oord等[16]的研究显示,在无症状糖尿病患者中,IPN的数量与并发症的出现之间没有相关性。本研究也显示,IPN患者与非IPN患者的MACE发生率差异无统计学意义。然而,值得注意的是,本研究发现IPN组患者在随访时的MACE发生时间早于非IPN组患者。这个结果提示IPN的发生可能促进了MACE的发生。本研究有几个局限性:首先,本研究为一项单中心研究,纳入的病例较少;其次,研究的对象具有异质性疾病和不同的动脉粥样硬化程度;再次,本研究未进行IPN分级。此外,造影剂的类型可能影响研究结果。
总之,颈动脉IPN、斑块厚度和血清Hcy水平可能是冠心病患者不良心血管事件的预测因子,上述指标的联合检测可能有助于提高冠心病患者的预后。

