超声造影联合剪切波弹性成像评估乳腺癌病灶可切除性的研究
宫文亮, 周 建, 朱道伟
安徽医科大学附属滁州医院(滁州市第一人民医院)超声科, 安徽 滁州 239000
乳腺癌是临床常见女性恶性肿瘤,发病率居于女性恶性肿瘤首位,且呈逐年升高趋势,对女性身心健康造影严重威胁[1]。大量临床实践证实,乳腺癌具有相对较高的恶性程度和转移风险,对放化疗敏感性欠佳,故早期准确评估乳腺癌手术可切除性对提高治疗效果、改善预后具有重要意义[2,3]。常规超声是临床评估乳腺癌可切除性的主要影像学检查手段,但存在较多局限性,如图像质量欠佳、对乳腺及周围血供显示不清、伪影等,从而导致评估准确性有待提高。超声造影(CEUS)是一种利用造影剂实时动态显示脏器微循环灌注情况的超声影像学检查技术,可量化增强数据,为临床诊断、评估病情提供依据[4]。剪切波弹性成像(SWE)属于新型超声弹性量化诊断技术,可根据受检组织实际硬度定量检测并获取弹性模量值,能够避免主观因素判断[5]。但关于两者联合在乳腺癌病灶可切除性中的评估价值少有研究,为此,本研究尝试对此进行探讨,旨在为临床准确评估乳腺癌病灶的可切除性提供参考依据。
1 资料与方法
1.1 一般资料
选取2019年9月至2021年3月我院的103例乳腺癌患者作为研究对象,年龄28~61岁,平均年龄(44.72±5.30)岁,肿瘤直径0.65~4.02 cm,平均肿瘤直径(2.33±0.46)cm。纳入标准:均经病理检查证实为乳腺癌,且均为单侧单发病灶;均为女性;患者及家属均知情,签订知情承诺书。排除标准:合并凝血功能障碍者;伴有免疫系统疾病者;有认知障碍、精神异常者;存在超声造影剂过敏或禁忌者;妊娠期、哺乳期女性;心肝肾等重要脏器功能障碍者;具有可切除性但选择保守治疗的乳腺癌患者。
1.2 方法
选择迈瑞Resona彩色多普勒超声诊断仪及L14-3WU线阵探头进行扫描检查,探头频率设置为5.0~12.0 MHz,首先行常规平扫,观察病灶组织形态、大小、位置等情况。启动CEUS模式,取25 mg声诺维冻干粉剂+5 mL生理盐水(0.9%氯化钠溶液)充分混匀,制备成混悬液,抽取4.8 mL经肘静脉团注,再注射5 mL生理盐水(0.9%氯化钠溶液),于开始注射时就存储动态图像,时间约为3 min。测量CEUS定量参数[峰值强度(PI)、达峰时间(TTP)、上升支斜率(WIS)],均重复测量3次,取平均值作为最终结果。启动SWE模式,轻置探头不施压,叮嘱患者屏气,选取合适感兴趣区后静置3 s,确认图像稳定后冻结并存储。均选取在肿瘤病灶或紧邻肿瘤病灶周边最硬处和周围正常脂肪组织距离直径为2 mm作为感兴趣区,测量病灶弹性杨氏模量值平均值(Emean)、最小值(Emin)、最大值(Emax),均重复测量3次,取平均值作为最终结果。根据Tozaki等[6]提出的弹性图像分类法将肿瘤分为4种类型:阴性型、垂直亮征型、硬环征型、多彩色变型,其中阴性型和垂直亮征型为良性肿块,硬环征型和多彩色变型为恶性肿瘤。
所有图像均由2名有丰富临床经验的中级及其以上职称超声科医师进行阅片,若意见不一致,则请1名副高及以上职称病理医师确认诊断。
乳腺癌病灶不可切除判定标准[7]:均经病理切片检查显示局部肿瘤扩展;远处转移;侵犯邻近器官;累及腹水和胰腺周围血管。根据临床实际分为手术切除组与不可手术切除组。
1.3 统计学分析
2 结果
2.1 两组CEUS、SWE影像学表现
CEUS影像学表现:手术切除组患者病灶呈不规则形态、边界不清晰,造影剂分布不均匀,可见充盈缺损区,且造影后病灶周围可见穿入或扭曲血管;不可手术切除组病灶呈不规则形态、边界不清晰,造影后可见肿瘤病灶侵犯邻近组织、累及胰腺和腹水等周围血管,且局部病灶扩展,伴有远处转移,见图1。SWE影像学表现:手术切除组患者弹性图像分型以硬环征型为主,少数呈多彩色变型改变;不可手术切除组患者弹性图像分型以多彩色变型改变为主,少数呈硬环征型,见图2。

图1 手术切除组(a)与不可手术切除组患者(b)的CEUS影像学表现

图2 手术切除组(a)与不可手术切除组患者(b)的SWE影像学表现
2.2 两组CEUS、SWE定量参数
不可手术切除组TTP短于手术切除组,PI、WIS、Emean、Emin、Emax高于手术切除组(P<0.05)。见表1。
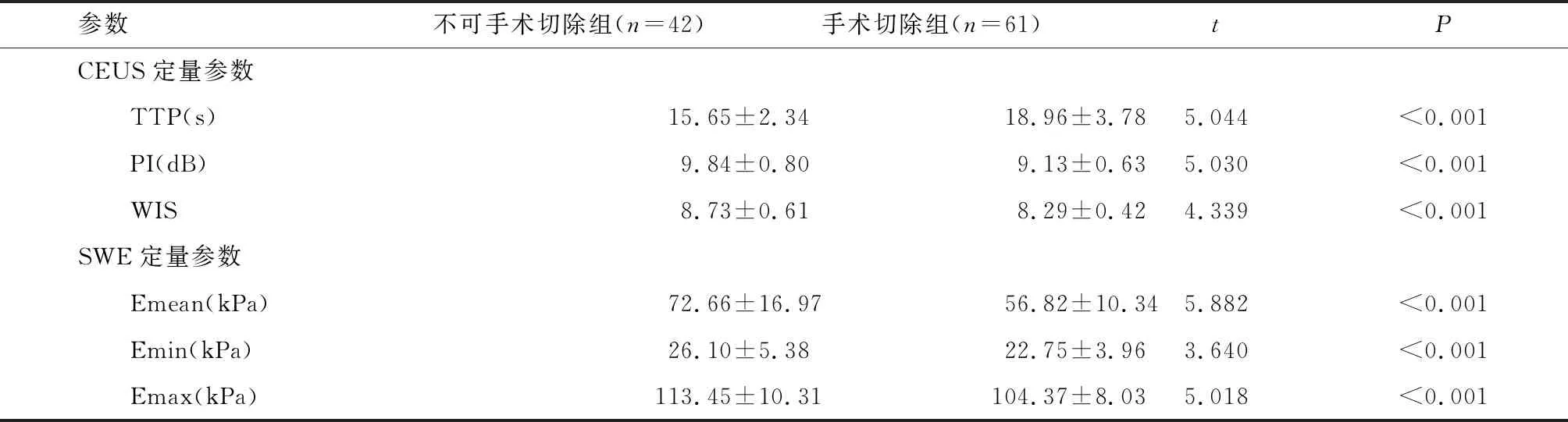
表1 两组CEUS、SWE定量参数比较
2.3 CEUS定量参数与SWE定量参数的相关性
Pearson相关性分析,TTP与Emean、Emin、Emax呈负相关,PI、WIS与Emean、Emin、Emax呈正相关(P<0.05)。见表2。

表2 CEUS定量参数与SWE定量参数的相关性
2.4 CEUS、SWE定量参数对乳腺癌可切除性的影响
以所有乳腺癌患者CEUS、SWE定量参数平均值为界分为高水平与低水平。危险度分析,TTP低水平患者不可手术切除的风险是高水平患者的2.084倍;PI、WIS、Emean、Emin、Emax高水平患者不可手术切除的风险是低水平患者的1.883倍、2.179倍、2.443倍、1.894倍、2.003倍。见表3。

表3 CEUS、SWE定量参数对乳腺癌可切除性的影响
2.5 CEUS、SWE对乳腺癌可切除性的评估价值
以不可手术切除组作为阳性样本,手术切除组作为阴性样本,绘制ROC曲线,分析结果显示,TTP、PI、WIS、Emean、Emin、Emax评估乳腺癌可切除性的曲线下面积(AUC)分别为0.770、0.710、0.796、0.808、0.716、0.738。见表4。

表4 CEUS、SWE对乳腺癌可切除性的评估价值
2.6 CEUS联合SWE对乳腺癌可切除性的评估价值
将TTP、PI、WIS、Emean、Emin、Emax进行Logistic二元回归拟合,返回预测概率Logit(p)作为独立检验变量,获取联合评估的AUC为0.916,95%CI为0.845~0.962,敏感度为85.71%,特异度为83.61%,优于各参数单独评估。
3 讨论
目前,外科手术是治疗乳腺癌的最有效方案,可通过切除肿瘤病灶达到治疗目的,但此类手术较为复杂,具有高风险、高并发症率的特点,且针对乳腺癌患者,临床既不主张轻易放弃手术切除的机会,也不主张盲目追求切除率或扩大切除率[8,9]。因此,术前准确评估乳腺癌病灶手术可切除性是临床选择外科手术治疗与否的关键所在。
超声造影是一种利用造影剂使得受检组织显影的超声检查方法,声诺维的微泡造影剂稳定性良好,即使在低声压下也不易被震破,从而能在检查过程中产生良好的谐波信号,获取质量优、清晰度高的实时谐波图像,在多种恶性肿瘤诊断中具有可靠的应用价值[10,11]。SWE是通过探头向受检组织发射声辐射脉冲,在不同组织深度连续聚焦,同时基于“马赫锥”原理生成剪切波,从而获取实时弹性成像图,并可根据受检组织的软硬程度定量测量其弹性杨氏模量值,从而为临床鉴别肿瘤良恶性提供参考依据,且该检查方式对操作人员依赖性小,能明显减少因主观因素所致的误诊、漏诊现象[12,13]。既往临床多将上述两种超声检查方式应用于乳腺癌诊断中,较少有研究分析其在评估乳腺癌病灶可切除性的应用价值。
CEUS定量参数TTP可有效反映微泡流动速度;PI表示单位时间内进入病灶的造影剂最大值;WIS表示造影剂进入病灶内的血流速度,三者可反映不同类型肿瘤病灶造影模式的差异[14]。本研究结果显示,不可手术切除组TTP短于手术切除组,PI、WIS、Emean、Emin、Emax高于手术切除组,提示TTP低水平及PI、WIS、Emean、Emin、Emax高水平会显著增加乳腺癌不可手术切除的风险,原因主要在以下几个方面:从乳腺癌病理方面来说,乳腺癌肿瘤细胞生长过程中微小血管难以供应其所需的营养,导致病灶内部出现缺血坏死,从而使得肿瘤细胞侵犯周围血管,累及邻近脏器组织,在CEUS检查时表现为乳腺癌病灶内造影剂出现充盈缺损或分布不均匀,除了能准确定位病灶位置之外,还能有效反映病灶组织密度、血供情况、纤生理运动、伪影程度等,也可在微观水平呈现组织结构特点,进而为临床治疗选择提供指导信息[15,16]。SWE定量参数Emean、Emin、Emax是反映受检组织硬度的客观指标,乳腺恶性病变间质会促使致密纤维组织增生,而肿瘤细胞在纤维间质中浸润性生长、增殖,便造成病变周围弹性减少、活动性降低,导致病灶组织硬度明显增加,且有研究表明,乳腺癌病灶组织与其病理进展密切相关,硬度越高,恶性程度越高,从而能为临床制定治疗方案提供参考依据[17,18]。
本研究结果还显示,TTP与Emean、Emin、Emax呈负相关,PI、WIS、SWE与Emean、Emin、Emax呈正相关,由于CEUS、SWE定量参数均与乳腺癌病理改变、肿瘤进展情况联系紧密,因而使上述检查参数之间产生明显的相关性。为此,本研究初次尝试探讨CEUS、SWE定量参数联合评估乳腺癌病灶可切除性的价值,结果显示,TTP、PI、WIS、Emean、Emin、Emax联合评估的AUC高达0.916,敏感度为85.71%,特异度为83.61%,明显优于各参数单独评估,提示CEUS联合SWE应用于乳腺癌病灶可切除性评估中具有较为可靠的临床价值。
综上可知,CEUS联合SWE评估乳腺癌病灶可切除性的价值较为可靠,可为临床准确评估手术可行性提供参考依据。不足之处在于未详细探讨CEUS、SWE定量参数对乳腺癌手术切除效果的影响,今后需作进一步分析,以获取更为全面的数据支持。

