高钙煤气化渣和燃烧渣对模拟废水中Pb2+的脱除作用对比研究*
吕飞勇 初 茉 袁旖璠 孙星博 刘彦妤 王浩阳
(中国矿业大学(北京)化学与环境工程学院,100083 北京)
0 引 言
近年来,以燃煤发电和煤气化为基础的煤炭工业在我国繁荣发展,大规模粉煤灰和气化渣伴随产生,粉煤灰和气化渣的年排放量已分别超过6×104万t和3 300万t[1-2]。为了协同脱硫或降低灰熔点而引入钙添加剂使得大量煤气化渣和燃煤渣中钙含量偏高[3],出现高碱问题,不利于灰渣的资源化利用[4],致使大量高钙灰渣堆存,占用土地,污染环境。目前,高钙灰渣治理重金属的研究主要集中在利用灰渣制备地聚物固化稳定化重金属[4-5]、制备沸石吸附重金属[6-8]和改性、多源协同脱除回收重金属[9-10]等方面,但都存在制备成本高、工业化推广受限问题。常见的去除废水中重金属的方法包括化学沉淀法、氧化还原法、离子交换法、膜分离法和吸附法等,其中化学沉淀法因操作简单和用料经济已成为当前使用最广泛的脱除废水中重金属的方法[11]。高钙炉渣中易水解的CaO可作为合适的碱源,部分易水解的Al,Fe基团可提供絮凝作用,将其直接用于废水治理中既可以通过形成氢氧化物沉淀的方式稳定脱除重金属,又可将灰渣pH值降至安全范围,适合重金属离子浓度高、废水量大的处理场景,对高钙灰渣的资源化利用具有现实意义。
不同的形成过程使得煤气化渣和煤燃烧渣中钙元素的存在形态有明显差异,致使两种灰渣治理废水中重金属的潜力存在差异,目前未见相关的对比研究。煤气化渣中钙元素主要以钙长石、钙黄长石及其他含钙的硅铝铁盐等形式存在[12],同时也存在一定量的游离CaO,但经高温煅烧、高压水冷后的游离CaO结构致密,不易水解[13]。循环流化床煤燃烧渣中钙元素主要以CaO、CaSO4和钙长石等形式存在,其中游离CaO的含量占总钙含量的40%,大部分存在于灰表面[14],且游离CaO的含量一般随灰粒粒径的减小而增大[15]。本实验采用高钙煤气化渣和煤燃烧渣作为原料,开展对Pb2+脱除的对比实验研究,考察了接触时间、炉渣投加量、Pb2+溶液初始pH值等因素对灰渣脱除Pb2+的影响,分析了灰渣中钙在脱除Pb2+过程中的作用,明确了脱除机制,为高钙灰渣资源化利用提供了基础数据支撑。
1 实验部分
1.1 实验材料
实验所用四种样品均取自于宁东煤化工基地,包括两种循环流化床燃煤炉底渣(BS1,BS2)以及四喷嘴水煤浆气化渣(GS1)和GSP干煤粉气化渣(GS2)。将样品在105 ℃下干燥2 h并筛分,得到粒径小于1 mm的样品用于实验。四种样品的化学组成如表1所示。由表1可知,四种样品的主要氧化物均为SiO2,质量分数约为50%,其次是Al2O3,CaO和Fe2O3。BS1样品的CaO质量分数最高,为24.14%。BS2,GS1和GS2中CaO的质量分数均超过10%,均属于高钙灰渣[16]。
实验试剂有:硝酸铅(AR级),由上海阿拉丁试剂有限公司生产;二甲酚橙(AR级),由上海麦克林生化科技有限公司生产;氯代十六烷基吡啶(AR级),由上海毕得医药科技有限公司生产;醋酸(AR级),由上海麦克林生化科技有限公司生产;三水合醋酸钠(AR级),由北京沃凯生物科技有限公司生产;盐酸(AR级),由国药集团化学试剂有限公司生产;氢氧化钠(AR级),由天津市大茂化学试剂厂生产。

表1 灰渣样品的化学组成(w/%)Table 1 Chemical composition of ash samples(w/%)
1.2 Pb2+静置脱除实验
采用静置法开展Pb2+的脱除实验,反应容器为玻璃烧杯(100 mL),通过控制变量法探究接触时间、灰渣投加量、Pb2+溶液初始pH值对模拟Pb2+废水溶液中Pb2+脱除的影响。
1.2.1 接触时间对Pb2+脱除的影响
设定Pb2+初始质量浓度为100 mg/L、Pb2+溶液初始pH值为5、模拟废水体积为50 mL以及灰渣投加量为0.20 g,接触时间分别为1 h,2 h,4 h,8 h,24 h,48 h,72 h。在相应接触时间吸取溶液1 mL,采用分光光度法测定Pb2+的质量浓度。
1.2.2 灰渣投加量对Pb2+脱除的影响
设定Pb2+初始质量浓度为100 mg/L、Pb2+溶液初始pH值为5、模拟废水体积为50 mL以及接触时间为24 h,灰渣投加量分别为0.05 g,0.10 g,0.15 g,0.20 g。接触时间为24 h时吸取灰渣投加量不同的溶液1 mL,采用分光光度法分别测定Pb2+的质量浓度。
1.2.3 Pb2+溶液初始pH值对Pb2+脱除的影响
设定Pb2+初始质量浓度为100 mg/L、模拟废水体积为50 mL、灰渣投加量为0.20 g以及接触时间为24 h,Pb2+溶液初始pH值在2.5~6.0的范围内且尽可能保证pH值上升梯度为0.5。接触时间为24 h时吸取初始pH值不同的溶液1 mL,采用分光光度法分别测定Pb2+质量浓度并同步测定Pb2+溶液的pH值。
1.3 紫外分光光度法测定溶液中Pb2+质量浓度
溶液中Pb2+质量浓度采用Pb(Ⅱ)-XO分光光度法[17]测定,并对部分环节进行了优化。
依次向比色管(25 mL)中加入10 mL去离子水、2 mL醋酸钠-醋酸缓冲溶液(pH=4.2)、2 mL二甲酚橙溶液(1 g/L)、1 mL氯代十六烷基吡啶溶液(1.6 g/L),摇匀。加入1 mL不同Pb2+质量浓度(0 mg/L,5 mg/L,10 mg/L,20 mg/L,40 mg/L,60 mg/L,80 mg/L,100 mg/L)的硝酸铅溶液,摇匀,用水稀释至刻度线。15 min后,在581 nm波长处,以水作参比,测定吸光度。拟合直线获得标准方程如下式所示:
A=0.070 3ρ(Pb2+)+0.1595,R2=0.998 7
式中:A表示吸光度;ρ(Pb2+)表示Pb2+质量浓度,mg/L;R2表示相关系数。
Pb2+静置脱除实验中的Pb2+质量浓度测试步骤同上,仅需将已知Pb2+质量浓度的硝酸铅溶液更换为待测溶液即可。
1.4 分析表征
采用上海美谱达仪器有限公司生产的UV-1100型紫外可见分光光度计测试溶液中Pb2+的质量浓度;采用上海福玛实验设备有限公司生产的DZX-1型真空干燥箱对沉淀样品进行真空干燥;采用瑞士梅特勒-托利多公司生产的Five系列FE20/FG2型实验室pH计测定溶液的pH值;采用日本Rigaku公司生产的D/max-2500型X射线衍射仪对灰样和沉淀样品进行物相分析,扫描角度为5°~85°,扫描速度为10°/min,步宽为0.02°,管电压为40 kV,电流为150 mA;采用荷兰PANalytical公司生产的Axios型X射线荧光光谱仪对灰样进行化学成分分析;采用美国FEI公司生产的MLA250型矿物解离分析仪对灰样进行微观形貌和能谱分析。
2 结果与讨论
2.1 接触时间对Pb2+脱除率的影响
接触时间对Pb2+脱除率的影响如图1所示。由图1可知,随着接触时间的增加,四种灰渣对Pb2+的脱除率的变化可分为三个阶段:陡增期(接触时间小于4 h)、缓增期(接触时间为4 h~24 h)、稳定期(接触时间大于24 h),接触时间超过24 h后,Pb2+脱除率的变化不再明显。在接触时间为24 h时,BS1和BS2对Pb2+的脱除率高达93%和94.5%,脱除效果优良;GS1和GS2对Pb2+的脱除率分别为99.5%和50%,差异较大,可能由两种气化渣中水溶态碱性物质质量分数及残碳质量分数的不同造成。
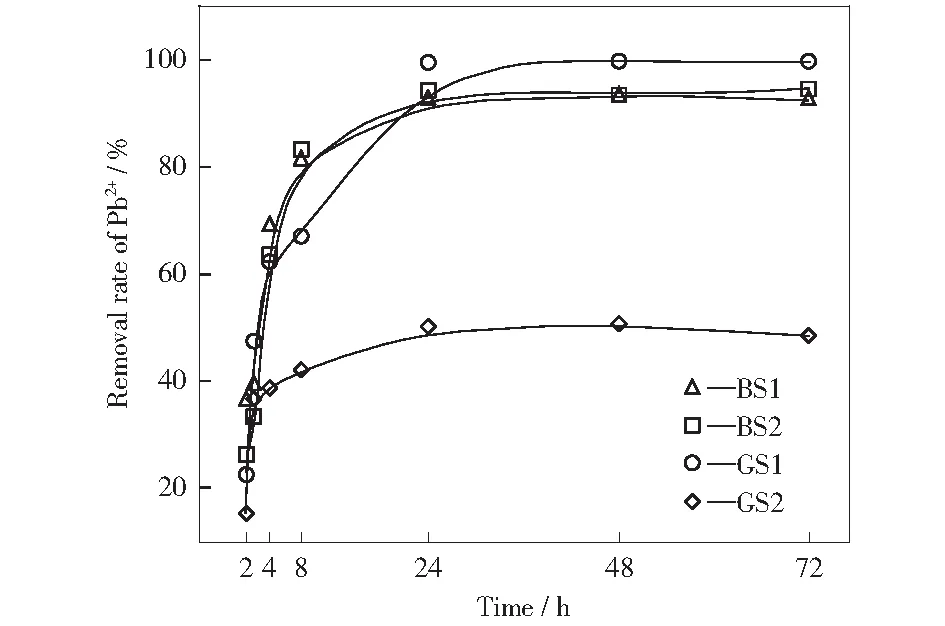
图1 接触时间对Pb2+脱除率的影响Fig.1 Effect of contact time on removal rate of Pb2+
2.2 灰渣投加量对Pb2+脱除率的影响
灰渣投加量对Pb2+脱除率的影响如图2所示。由图2可知,四种灰渣对Pb2+的脱除率都随灰渣投加量的增加而升高。低灰渣投加量(0.05 g)时,BS1和BS2对Pb2+的脱除率比较高,脱除率分别为92%和76%,此时,BS1和BS2体系中OH-的产生数量较为充足,灰渣投加量继续增大时,其对Pb2+的脱除率影响不大;低灰渣投加量(0.05 g)时,GS1和GS2对Pb2+的脱除率并不高,脱除率分别为50%和30%,随着投加量的增大,Pb2+脱除率逐渐升高,投加量增大到0.20 g时,Pb2+脱除率分别升至99.5%和50%。

图2 灰渣投加量对Pb2+脱除率的影响Fig.2 Effect of ash dosage on removal rate of Pb2+
2.3 Pb2+溶液初始pH值对Pb2+脱除率的影响
Pb2+溶液初始pH值对Pb2+脱除率的影响如图3所示。由图3a和图3b可知,BS1和BS2对Pb2+的脱除率都随Pb2+溶液初始pH值增大而升高。低初始pH值时,BS1和BS2对Pb2+的脱除率差异较大,其中,初始pH值为3.0时,BS1和BS2对Pb2+的脱除率分别为76.71%和21.05%,接触24 h后,pH值分别上升至7.9和5.5,均达到了Pb2+的碱沉淀pH值。这是由于BS1中CaO质量分数高于BS2中CaO质量分数,同一条件下可以水解产生更多的OH-,对Pb2+的脱除率更高。当初始pH值为3.3时,BS1和BS2对Pb2+的脱除率分别陡增至94.84%和93.42%,接触24 h后,pH值均上升至8.3,这是由于BS1和BS2水解产生OH-充足,沉淀接近完全。随着初始pH值继续增加,Pb2+脱除率趋于平稳,此时BS1和BS2对Pb2+的脱除率均在90%以上,接触24 h后,pH值均维持在8~9。由图3c和图3d可知,GS1和GS2对Pb2+的脱除率随Pb2+溶液初始pH值增大而升高,但同样的初始pH值条件下,GS1对Pb2+的脱除率明显高于GS2对Pb2+的脱除率。当初始pH值为2.6时,GS1和GS2对Pb2+的脱除率都几乎为零,此时溶液中H+浓度较高,在竞争吸附中优先占据结合位点。随着初始pH值继续增加,Pb2+脱除率均逐渐上升,当初始pH值为5.5时,GS1对Pb2+的脱除率高达99.5%,接触24 h后,pH值为6.2;而GS2对Pb2+的脱除率仅为50%,接触24 h后,pH值为5.7,反应前后Pb2+溶液pH值变化很小。

图3 初始pH值对Pb2+脱除率的影响Fig.3 Effect of initial pH value on removal rate of Pb2+a—BS1;b—BS2;c—GS1;d—GS2
2.4 燃煤炉渣和煤气化渣对Pb2+脱除作用对比
2.4.1 灰渣中的钙在Pb2+脱除过程中的作用
以游离CaO为主的碱性物质水解产生OH-是Pb2+化学沉淀的基础,灰渣浸泡过程中水溶液pH值的变化如图4所示。由图4可知,浸泡初期,燃煤渣浸泡水溶液的pH值远大于气化渣浸泡水溶液的pH值。其中,BS1和BS2浸泡水溶液的pH值在浸泡2 h后分别高达11.0和10.4,GS1和GS2浸泡水溶液的pH值在浸泡4 h后分别高达8.2和7.8。燃煤渣和气化渣浸泡过程中水溶液pH值随浸泡时间的变化规律一致,均呈现先升高后降低的趋势,并在72 h后趋于稳定,分别维持在8和7.7左右。灰渣中以游离态CaO为主的碱性物质水解产生OH-以及碱性物质对空气中CO2的吸收导致了水溶液pH值变化。复杂的组成结构导致灰渣水解过程时间较长,同时伴随着对空气中CO2的吸收,OH-的产生与消耗会共存于体系中,因而水溶液pH值存在峰值。燃煤渣(BS1和BS2)浸泡初期水溶液pH值高的主要原因是循环流化床燃煤渣表面游离态CaO质量分数高,结构蓬松,更易水解。而气化渣(GS1和GS2)结构致密,表面高度玻璃化,且钙元素主要与硅铝铁等赋存在一起,阻碍了表面成分水解,致使其水溶液的pH值随时间的延长变化较小。

图4 灰渣浸泡过程中水溶液pH值的变化Fig.4 Change of pH value of aqueous solution during ash soaking
2.4.2 两种灰渣脱除Pb2+的机制对比分析
1) 燃煤渣脱除Pb2+的作用机制
循环流化床燃煤渣脱除Pb2+的过程包括灰渣水解产OH-、析出Pb(OH)2晶粒并吸收空气中CO2转变为碱式碳酸铅[Pb3(CO3)2(OH)2]以及絮凝沉淀三个阶段,属于化学沉淀作用,燃煤渣脱除Pb2+的状态变化如图5所示。
由图5可知,第一阶段,炉渣表面质量分数较高的游离态CaO发生水解反应产生OH-,其他基团水解程度有限。此过程是一个两相扩散化学反应过程,反应速度和程度受多因素影响。

图5 燃煤渣脱除Pb2+的状态变化Fig.5 State change of Pb2+ removal from coal cinder
第二阶段,OH-与溶液中Pb2+反应生成Pb(OH)2并析出晶核,同时伴随着溶液对空气中CO2的吸收,不断生成碱式碳酸铅[Pb3(CO3)2(OH)2],晶粒逐步发育长大。
第三阶段,晶粒自身发育到一定粒径后开始沉降,接触24 h后,在底部形成颗粒明显的一层白色沉淀。随接触时间继续延长,在燃煤渣水解产生的含铝、铁絮凝基团作用下,接触72 h后,颗粒状的沉淀慢慢粘连在一块,形成致密的片状沉淀物。
反应前后燃煤渣和白色沉淀的物相分析可更直观地表达燃煤渣脱除Pb2+过程中的物相变化和作用机制。燃煤渣和白色沉淀的X射线衍射谱如图6所示。由图6可知,燃煤渣中含钙物相[14](包括CaO、CaSO4、钙长石(CaAl2Si2O8))的衍射峰消失或强度减弱,其他矿物物相无明显变化。说明含钙物相在化学沉淀过程中起主要作用;白色沉淀物以碱式碳酸铅为主,同时有CaCO3的生成,与上述的化学沉淀过程相吻合。
2) 气化渣脱除Pb2+的作用机制
气化渣脱除Pb2+是化学沉淀和物理吸附共同作用的结果。气化灰渣是熔融渣高压水冷后的产物,高度玻璃化,水溶态组分有限,灰渣以介孔为主,具有吸附功能,且不规则多孔颗粒越多,其吸附性能越好[18]。对GS1和GS2的烧失量进行测定,烧失量分别为16%和3%,烧失质量损失主要来源于残碳。GS1由于拥有更高的残碳含量[19]及更多的表面水溶性碱性元素[20],使得其对Pb2+的吸附效果优于GS2对Pb2+的吸附效果。
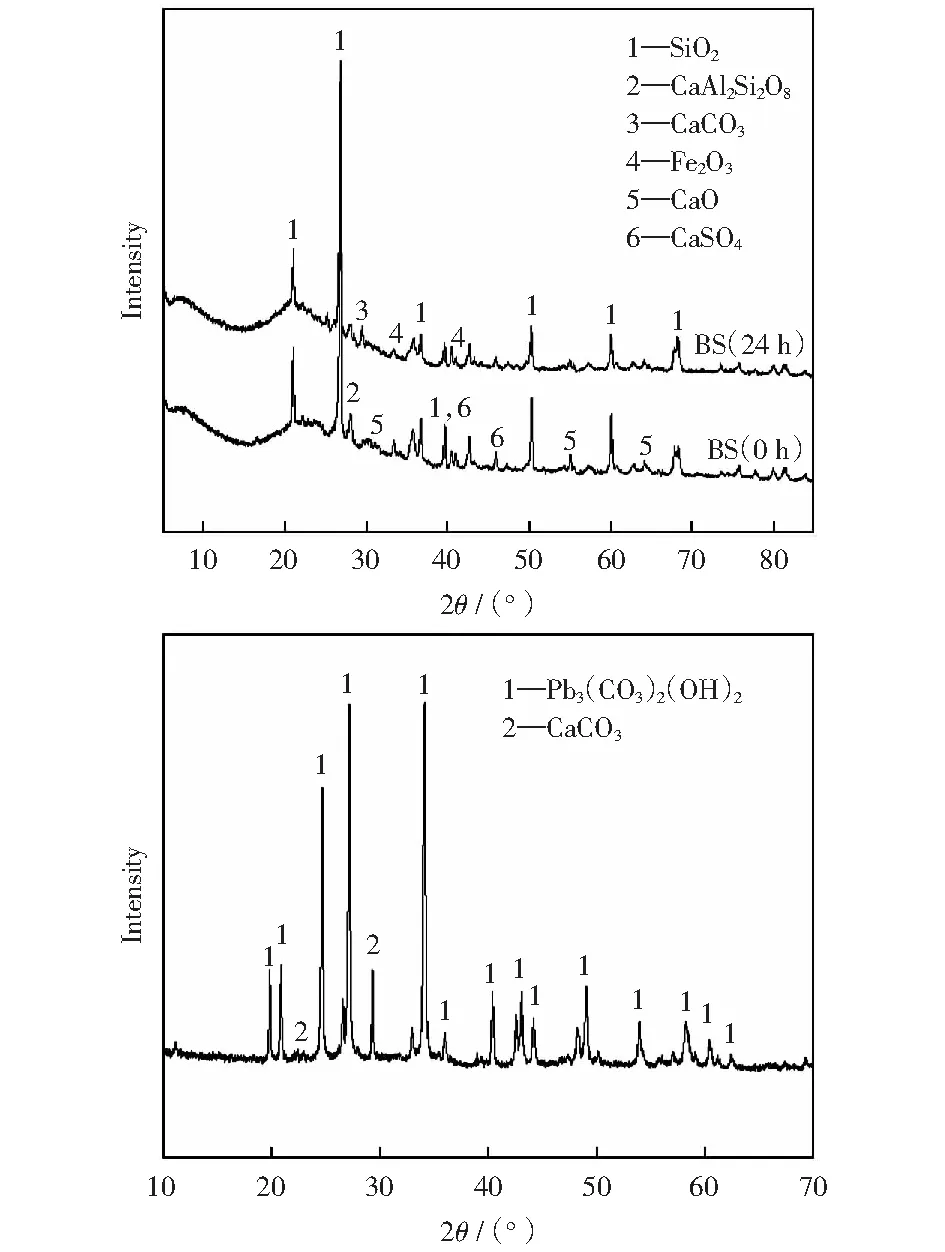
图6 燃煤渣和白色沉淀的X射线衍射谱Fig.6 XRD of coal cinder and white precipitationa—Coal cinder;b—White precipitation
GS1和GS2吸附Pb2+前后的SEM照片及EDS能谱分别如图7和图8所示。由图7a可知,GS1由尺寸不一的不规则颗粒粘连组成,灰粒的平均尺寸较大,残碳颗粒呈现多孔蜂窝状,与活性炭的结构较为相似,这有利于物理吸附的发生[21]。由图7d可知,吸附Pb2+后的GS1颗粒表面变得粗糙,尺寸明显缩减。对GS1吸附Pb2+后新生成的明亮色颗粒(见图7d)进行能谱分析,结果(见图7e和图7f)表明,两者均是以Pb,C,O三种元素为主的化合物,推断两者为碱式碳酸铅[Pb3(CO3)2(OH)2],在灰渣中呈零星分布,尺寸为0.5 μm~3.5 μm。由图8a可知,GS2原样颗粒尺寸较小,分布较为独立,残碳吸附在灰粒表面,占据部分孔道,阻碍进一步吸附。由图8d可知,吸附Pb2+后GS2中无明显的小尺寸明亮色颗粒,Pb2+主要进入到孔道内发生吸附。

图7 GS1吸附Pb2+前后的SEM照片及EDS能谱Fig.7 SEM photos and EDS energy spectra of GS1 before and after adsorption of Pb2+a—Before adsorption of Pb2+;b—EDS energy spectrum of particle 1;c—EDS energy spectrum of particle 2;d—After adsorption of Pb2+;e—EDS energy spectrum of particle 3;f—EDS energy spectrum of particle 4
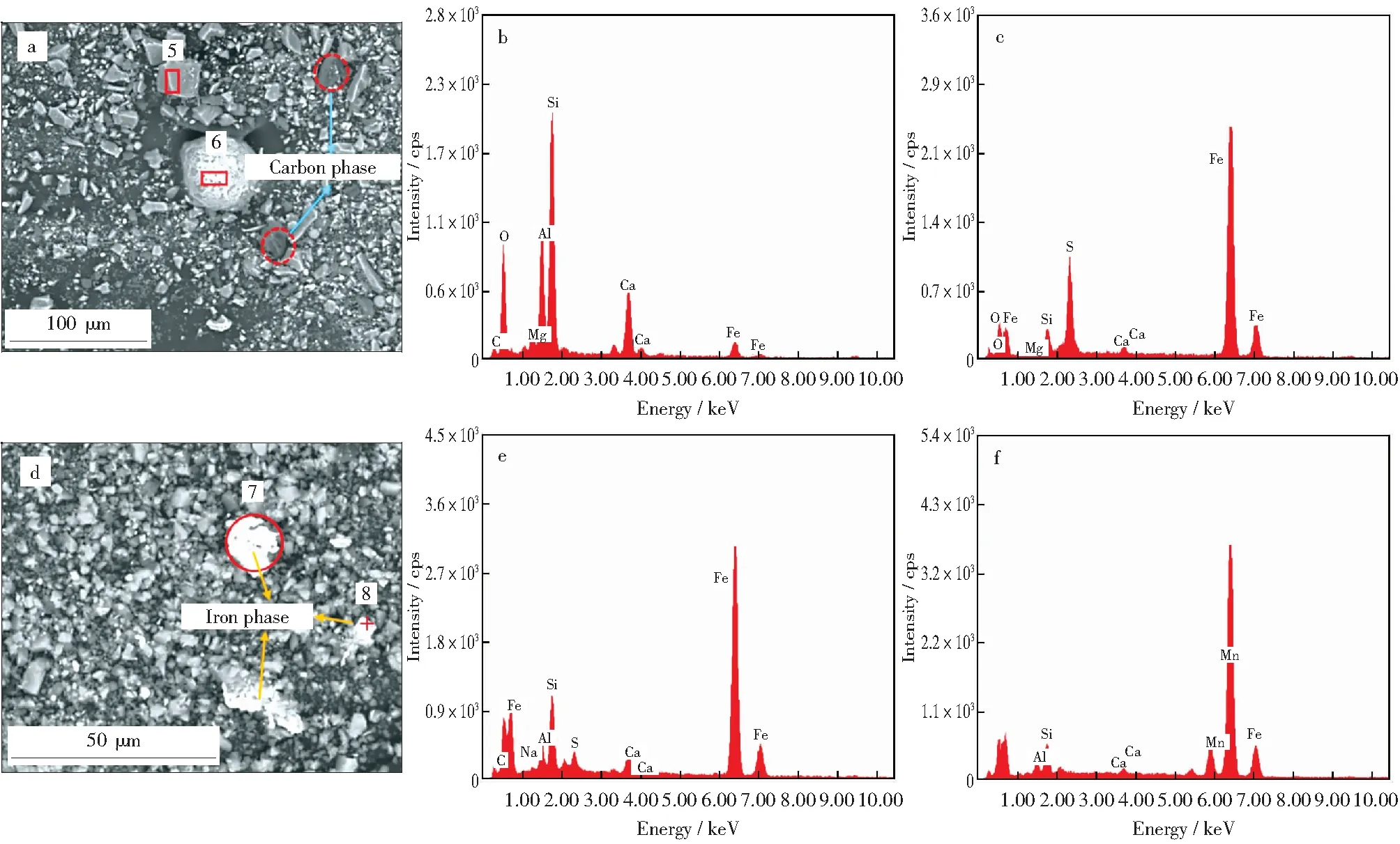
图8 GS2吸附Pb2+前后的SEM照片及EDS能谱Fig.8 SEM photos and EDS energy spectra of GS2 before and after adsorption of Pb2+a—Before adsorption of Pb2+;b—EDS energy spectrum of particle 5;c—EDS energy spectrum of particle 6;d—After adsorption of Pb2+;e—EDS energy spectrum of particle 7;f—EDS energy spectrum of particle 8
3 结 论
1) Pb2+初始质量浓度为100 mg/L、模拟废水体积为50 mL、接触时间为24 h、灰渣投加量为0.2 g、初始pH值为5时,灰渣对Pb2+脱除效果最优,燃煤渣和气化渣对Pb2+的脱除率分别高达94.5%和99.5%。
2) 循环流化床燃煤渣脱除Pb2+的过程包括灰渣水解产OH-、析出Pb(OH)2晶粒并吸收空气中CO2转变为碱式碳酸铅[Pb3(CO3)2(OH)2]、最终絮凝沉淀三个阶段,属于化学沉淀作用,溶液中Pb2+最终以沉淀形式稳定存在。
3) 气化渣脱除Pb2+除化学沉淀作用外,灰渣中多孔不规则残碳颗粒的物理吸附也起到了促进作用。
4) 本研究对高钙煤气化渣和煤燃烧渣脱除废水中Pb2+的效果和其作用机制进行了研究,为高钙灰渣的资源化、增值化利用提供理论和基础数据支持。

