槲皮素通过诱导铁死亡抑制A549细胞增殖的作用及机制研究
李 畅,王 浩,贺千羽,郭向宇,姜彤伟*,郭 焱*
槲皮素通过诱导铁死亡抑制A549细胞增殖的作用及机制研究
李 畅1,王 浩2,贺千羽1,郭向宇1,姜彤伟1*,郭 焱1*
1. 长春中医药大学临床医学院,吉林 长春 130117 2. 集安市医院,吉林 集安 134200
基于铁死亡信号通路探究槲皮素对人非小细胞肺癌A549细胞增殖的影响及其作用机制。CCK-8法筛选槲皮素作用于A549细胞的实验浓度;平板克隆法检测槲皮素对A549细胞集落形成能力的影响;利用试剂盒检测槲皮素对A549细胞内谷胱甘肽(glutathione,GSH)水平的影响;采用Western blotting检测槲皮素对A549细胞铁死亡相关蛋白及线粒体凋亡蛋白表达的影响;采用流式细胞仪检测槲皮素对A549细胞内线粒体活性氧(mitochondrial reactive oxygen species,mtROS)、脂质过氧化物水平及细胞凋亡的影响。联合铁死亡抑制剂(Ferrostatin-1)或ROS清除剂-乙酰半胱氨酸(-acetylcysteine,NAC)检测槲皮素对A549细胞内GSH水平及铁死亡相关蛋白表达的影响。与对照组比较,槲皮素显著抑制A549细胞存活率,且呈时间和剂量相关性(<0.01);槲皮素呈剂量相关性地抑制A549细胞集落形成(<0.01),显著降低A549细胞内GSH水平(<0.01),上调细胞内mtROS及脂质过氧化物水平(<0.05、0.01),诱导细胞凋亡(<0.01);显著促进铁死亡相关蛋白p53表达(<0.05、0.01),并抑制谷胱甘肽过氧化物酶4(recombinant glutathione peroxidase 4,GPX4)及胱氨酸/谷氨酸逆向转运蛋白溶质载体家族7成员11(solute carrier family 7 member 11,SLC7A11)蛋白表达(<0.01);显著促进线粒体凋亡相关蛋白半胱氨酸天冬氨酸蛋白酶-3(cystein-asparate protease-3,Caspase-3)、Caspase-9、细胞色素C(cytochrome C,Cyt C)和B淋巴细胞瘤-2(B cell lymphoma-2,Bcl-2)相关X蛋白(Bcl-2 associated X protein,Bax)蛋白表达(<0.05、0.01),并抑制抗凋亡因子Bcl-2蛋白表达(<0.01)。与槲皮素组比较,槲皮素+NAC组与槲皮素+Ferrostatin-1组均不同程度恢复槲皮素引起的细胞存活率下降(<0.05、0.001),Ferrostatin-1可显著上调GPX4及SLC7A11蛋白表达水平(<0.05),并回调GSH水平(<0.05)。槲皮素能够抑制A549细胞增殖并诱导铁死亡,进而导致细胞凋亡,具有诱导A549细胞铁死亡的生物学效应。
非小细胞肺癌;槲皮素;铁死亡;细胞增殖;线粒体活性氧;脂质过氧化物
肺癌是常见的恶性肿瘤,其发病率和死亡率均居肿瘤首位,5年生存率不到20%[1]。其中非小细胞肺癌(non-small cell lung cancer,NSCLC)占肺癌的85%[2]。现有的治疗方法主要是外科手术以及放疗、化疗治疗,但放化疗具有不良反应多、耐受性等问题[3]。中药因具有毒性较小、不易产生耐受性等优势逐步成为研究重点,中药诱导肿瘤细胞凋亡、抑制增殖是当前寻找有效癌症治疗的一个新的研究领域。
槲皮素是植物中广泛存在的天然黄酮类化合物,是贯叶连翘L.的主要有效成分[4],具有止咳、平喘、抗病毒、抗氧化等药理活性[5]。研究表明,槲皮素对多种肿瘤细胞系具有细胞毒活性[6],在内科疾病、骨科疾病、神经系统疾病中具有一定治疗作用[7],同时在肺癌中也有良好的治疗作用。现代药理学研究证实槲皮素及其衍生物能够通过调节丝裂原活化蛋白激酶(mitogen-activated protein kinases,MAPK)/磷酸腺苷活化蛋白激酶(AMP-dependent/activated protein kinase,AMPK)信号通路抑制细胞增殖,促进人肺癌A549细胞凋亡[8]。表明槲皮素是一种潜在的抗肿瘤药物,对肿瘤细胞的增殖具有抑制作用,但槲皮素对NSCLC的干预效果仍需进一步的研究。
2012年,Dixon等[9]首次报道了铁死亡这一新型细胞死亡方式,其特点是细胞内脂质活性氧(reactive oxygen species,ROS)增加超过细胞内抗氧化系统的代偿,进而诱导细胞发生死亡。铁死亡在形态、生化、遗传和功能上明显不同于细胞坏死、凋亡和自噬,其与肿瘤的发生、发展、治疗和耐药等密切相关[10]。铁是人体内重要的微量元素,过量的铁会催化芬顿反应产生ROS,从而促进脂质过氧化导致铁死亡,同时铁代谢生物学过程中铁可从各个环节调控铁死亡[11]。研究报道,铁代谢失调与肺癌的发生发展密切相关,NSCLC可能通过铁代谢途径发生铁死亡[12]。同时在肾癌、结直肠癌及乳腺癌等肿瘤研究中已证实调控铁死亡可抑制肿瘤细胞的增殖[13]。此外,槲皮素具有促进肿瘤细胞铁蛋白积累并诱导肿瘤细胞铁代谢失常的作用,最终引起机体铁稳态失衡[14]。因此,本研究基于铁死亡通路,以A549细胞为研究对象,探究槲皮素对A549细胞增殖以及铁死亡的影响,进而探讨槲皮素通过诱导A549细胞发生铁死亡生物学效应发挥对肿瘤细胞的杀伤作用,以期为其临床治疗NSCLC提供研究基础。
1 材料
1.1 细胞株
A549细胞购自中国科学院上海细胞库。
1.2 药品与试剂
槲皮素(质量分数≥98%,批号C28J11Y116820)购自上海源叶生物科技有限公司;胎牛血清(批号2148389)购自以色列BI公司;DMEM培养基(批号AG29719232)、胰蛋白酶(批号2403077)购自美国Gibco公司;PBS缓冲液(批号I30FD0151)购自上海生工公司;二甲基亚砜(dimethyl sulfoxide,DMSO,批号BCCD8942)、-乙酰半胱氨酸(-acetylcysteine,NAC,批号WXBC5687V)购自美国Sigma-Aldrich公司;BCA蛋白定量试剂盒(批号092221220118)、CCK-8细胞活力试剂盒(批号031821210930)、FITC偶联Annexin-V凋亡试剂盒(批号092120210513)购自上海碧云天公司;MitoSoxTM Red线粒体活性氧(mitochondrial reactive oxygen species,mtROS)检测探针(批号2286876)购自美国Thermo Fisher Scientific公司;谷胱甘肽(glutathione,GSH)测定试剂盒(批号20200616)购自南京建成生物工程研究所;ECL超敏化学发光液(批号01621098)购自上海雅酶生物医药科技有限公司;谷胱甘肽过氧化物酶4(recombinant glutathione peroxidase 4,GPX4)抗体(批号334286)、胱氨酸/谷氨酸逆向转运蛋白溶质载体家族7成员11(solute carrier family 7 member 11,SLC7A11)抗体(批号334063)购自上海Abmart生物医药公司;β-actin抗体(批号ab8227)、p53抗体(批号GR146370-9)、细胞色素C(cytochrome C,Cyt C)抗体(批号GR247561-2)、B淋巴细胞瘤-2(B cell lymphoma-2,Bcl-2)抗体(批号GR196071-15)、Bcl-2相关X蛋白(Bcl-2 associated X protein,Bax)抗体(批号GR151406-19)购自英国Abcam公司;半胱氨酸天冬氨酸蛋白酶-3(cystein-asparate protease-3,Caspase-3)抗体(批号00101520)、Caspase-9抗体(批号00097424)购自美国Proteintech生物公司;HRP标记的山羊抗小鼠IgG抗体(批号214800915)、HRP标记的山羊抗兔IgG抗体(批号219761108)购自北京中衫金桥生物技术公司;Liperfluo细胞脂质过氧化物检测探针(批号TM607)购自日本同仁化学公司;铁死亡特异性抑制剂(Ferrostatin-1,批号148475)购自上海陶素药业有限公司。
1.3 仪器
FORMA3111型CO2恒温培养箱(美国Thermo Fisher Scientific公司);BD Accuri C6TM流式细胞仪(美国BD公司);Infinite M200 Pro型多功能酶标仪(瑞士Tecan公司);1645050型蛋白质电泳仪、Mini-PROTEAN®Tetra Cell Systems电泳槽、Trans-Blot®SD System半干转仪(美国Bio-Rad公司);Milli-Q Advantage A10型超纯水系统(美国Millipore公司)。
2 方法
2.1 槲皮素母液的配制
精密称取槲皮素10 mg溶于3.3 mL DMSO中,配成浓度为10 mmol/L的槲皮素母液,经0.22 μm微孔滤膜滤过,于4 ℃避光保存,使用时用培养基稀释。
2.2 细胞培养
A549细胞用含10%胎牛血清、100 U/mL青霉素、100 U/mL链霉素的DMEM培养基,于37 ℃、5% CO2的培养箱中培养。
2.3 CCK-8法检测细胞增殖能力
取对数生长期的A549细胞,胰蛋白酶消化后以5×103/孔接种到96孔板中。待细胞贴壁后,弃去培养基,分别加入含槲皮素终浓度为0、50、100、150、200、250、300 μmol/L的培养基,于培养箱中培养24、48、72 h,然后每孔加入10 μL CCK-8溶液,于培养箱中继续孵育30 min,采用酶标仪测定450 nm处各孔吸光度()值,以培养基为空白孔调零,计算细胞存活率,并计算槲皮素对A549细胞的半数抑制浓度(half inhibitory concentration,IC50),根据IC50值设置后续实验的给药浓度,设置低、中、高3个剂量。
细胞存活率=(给药-空白)/(对照-空白)
2.4 细胞克隆形成实验
取对数生长期的A549细胞,以2×103个/孔接种于6孔板中,培养24 h。设置对照组(不加药物)和槲皮素低、中、高剂量(100、150、200 μmol/L)组,每组设置3个复孔,培养14 d,直至形成肉眼可见的细胞克隆。弃去细胞培养液,PBS清洗2次,结晶紫染色10 min,弃掉染液,PBS清洗2次,拍照。加入DMSO溶解结晶紫,采用酶标仪测定590 nm处各孔值。
2.5 细胞内GSH水平测定
取对数生长期的A549细胞,以2×105个/孔接种于6孔板中,于37 ℃、5% CO2培养箱中培养过夜。设置对照组(不加药物)和槲皮素低、中、高剂量(100、150、200 μmol/L)组,加入含相应药物的培养基处理24 h,收集细胞,按试剂盒说明书测定GSH水平。
2.6 Western blotting检测铁死亡相关蛋白表达和线粒体凋亡蛋白表达的影响
按“2.5”项下方法进行分组和给药,收集细胞,加入RIPA裂解液提取蛋白,采用BCA蛋白定量试剂盒测定上清液中的蛋白质量浓度。蛋白样品经十二烷基硫酸钠-聚丙烯酰胺凝胶电泳,转至PVDF膜,加入5%脱脂牛奶,室温封闭3 h,加入相应一抗孵育过夜;TBST充分洗膜后,加入二抗,室温孵育40 min,TBST充分洗膜,加入显影液曝光,采用Image J软件分析条带灰度值。
2.7 细胞内mtROS水平测定
按“2.5”项下方法进行分组和给药,收集细胞,PBS洗涤3次,加入1 mL MitoSox(2 μmol/L),37 ℃避光孵育20 min,PBS洗涤3次,采用流式细胞仪进行分析。
2.8 细胞内脂质过氧化物水平测定
按“2.5”项下方法进行分组和给药,收集细胞,PBS洗涤1次,用Liperfluo荧光探针染液(10 μmol/L)重悬细胞沉淀,37 ℃避光孵育30 min,PBS洗涤3次,用PBS将细胞重悬后,采用流式细胞仪进行分析。
2.9 细胞凋亡率检测
按“2.5”项下方法进行分组和给药,收集细胞,1000 r/min离心3 min,PBS洗涤3次,加入500 μL Binding Buffer重悬细胞,加入5 μL Annexin V/FITC混匀,再加入碘化丙啶(PI)染液,37 ℃避光孵育15 min,采用流式细胞仪检测细胞凋亡率。
2.10 Ferrostatin-1及NAC与槲皮素联合处理对A549细胞存活率的影响
取对数生长期的A549细胞,胰蛋白酶消化后以5×103/孔接种到96孔板中。设置对照组(不含药物)、槲皮素(200 μmol/L)组、Ferrostatin-1(1 μmol/L)组、槲皮素+Ferrostatin-1组、NAC(5 mmol/L)组和槲皮素+NAC组。待细胞贴壁后,对照组仅加入DMEM培养基,各给药组分别加入含相应药物的等体积培养基,每组设置3个复孔,于培养箱中培养24 h,按“2.3”项下方法测定细胞存活率。
2.11 Ferrostatin-1与槲皮素联合处理对A549细胞铁死亡相关蛋白表达及GSH水平的影响
取对数生长期的A549细胞,以2×105个/孔接种于6孔板中,于37 ℃、5% CO2培养箱中培养过夜。设置对照组(不含药物)、槲皮素(200 μmol/L)组、Ferrostatin-1(1 μmol/L)组和槲皮素+Ferrostatin-1组,待细胞贴壁后,弃去培养基,分别加入含相应药物的培养基,于培养箱中培养24 h。收集细胞,按“2.6”项下方法测定铁死亡相关蛋白表达,按试剂盒说明书测定GSH水平。
2.12 统计学方法
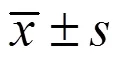
3 结果
3.1 槲皮素对A549细胞活力的影响
为检测槲皮素对A549细胞活力的影响并确定药物作用浓度,采用不同浓度槲皮素分别处理细胞24、48、72 h,其IC50分别为160、77.47、63.58 μmol/L。如图1所示,与对照组比较,槲皮素(100、150、200 μmol/L)组在24、48、72 h时的细胞存活率均明显降低(<0.01),且呈时间和剂量相关性。从48 h开始,与对照组比较,给药组细胞的增殖活力受到明显抑制,由于作用48、72 h细胞死亡较多,因此选择药物作用24 h作为后续实验的药物最佳作用时间。参考以上结果,确定24 h为槲皮素的作用时间,100、150、200 μmol/L为槲皮素的作用剂量。
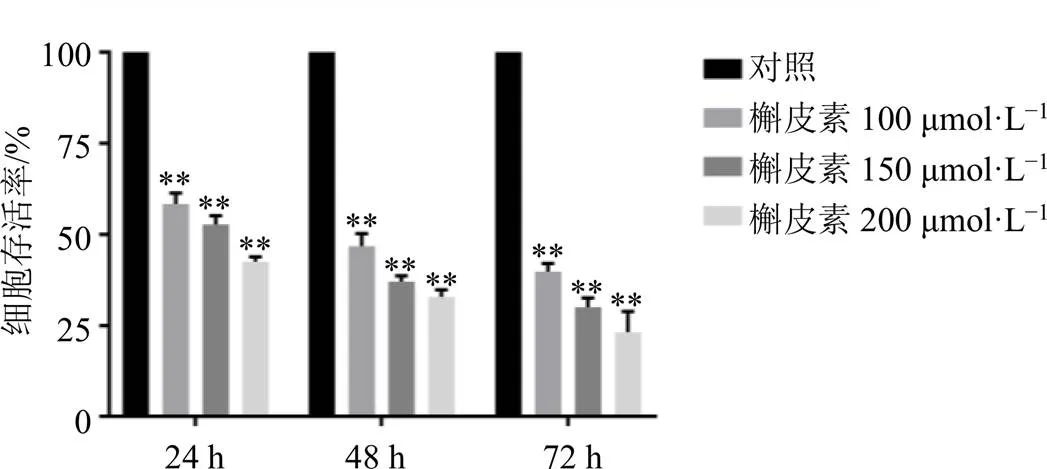
3.2 槲皮素对A549细胞克隆形成能力的影响
如图2所示,与对照组比较,随着槲皮素组浓度升高,细胞克隆形成数均显著降低(<0.01),且呈剂量相关性,表明槲皮素能够抑制A549细胞集落形成能力,即抑制A549细胞增殖。
与对照组比较:*P<0.05 **P<0.01 ***P<0.001,下图同
图2 槲皮素对A549细胞克隆形成能力的影响(, n = 3)
3.3 槲皮素对A549细胞内GSH水平的影响
铁死亡的发生伴随着GSH水平下降。如图3所示,与对照组比较,各剂量的槲皮素组细胞内GSH水平均显著降低(<0.01),且呈剂量相关性。
3.4 槲皮素对A549细胞铁死亡相关蛋白表达的影响
如图4所示,与对照组比较,各剂量的槲皮素组细胞内p53蛋白表达水平显著升高(<0.05、0.01),GPX4、SLC7A11蛋白表达水平均明显下降(<0.01),且呈剂量相关性。p53、SLC7A11及GPX4为铁死亡相关蛋白,表明槲皮素可调控铁死亡通路相关蛋白表达从而激活铁死亡。
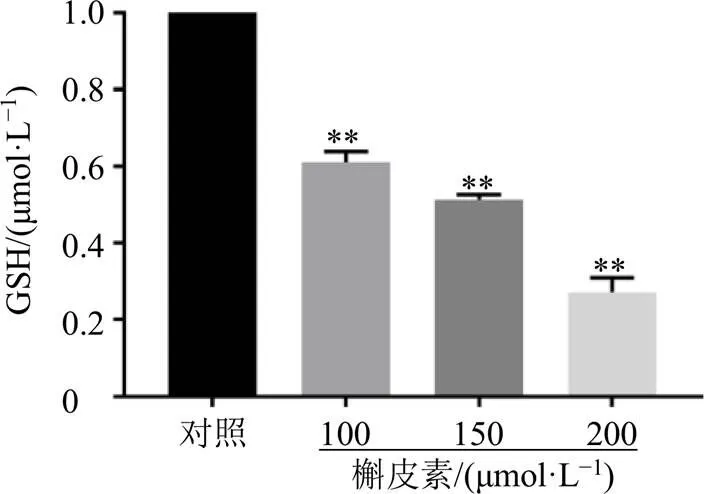
图3 槲皮素对A549细胞内GSH水平的影响(, n = 3)
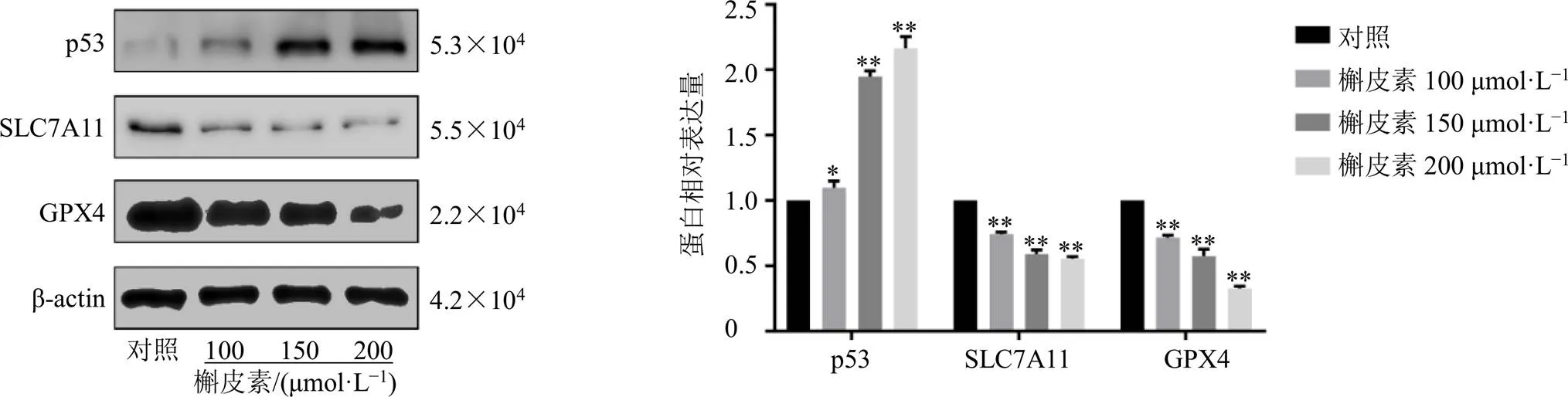
图4 槲皮素对A549细胞铁死亡相关蛋白表达的影响(, n = 3)
3.5 槲皮素对A549细胞内mtROS水平的影响
如图5所示,与对照组比较,各剂量的槲皮素组细胞内mtROS荧光强度显著增强(<0.01),且呈剂量相关性,表明槲皮素能够激活细胞内mtROS的产生。
3.6 槲皮素对A549细胞内脂质过氧化物水平的影响
如图6所示,与对照组比较,150、200 μmol/L槲皮素组细胞内Liperfluo脂质过氧化物荧光强度显著增强(<0.05、0.01),且呈剂量相关性,表明槲皮素能够诱导细胞发生脂质过氧化反应。
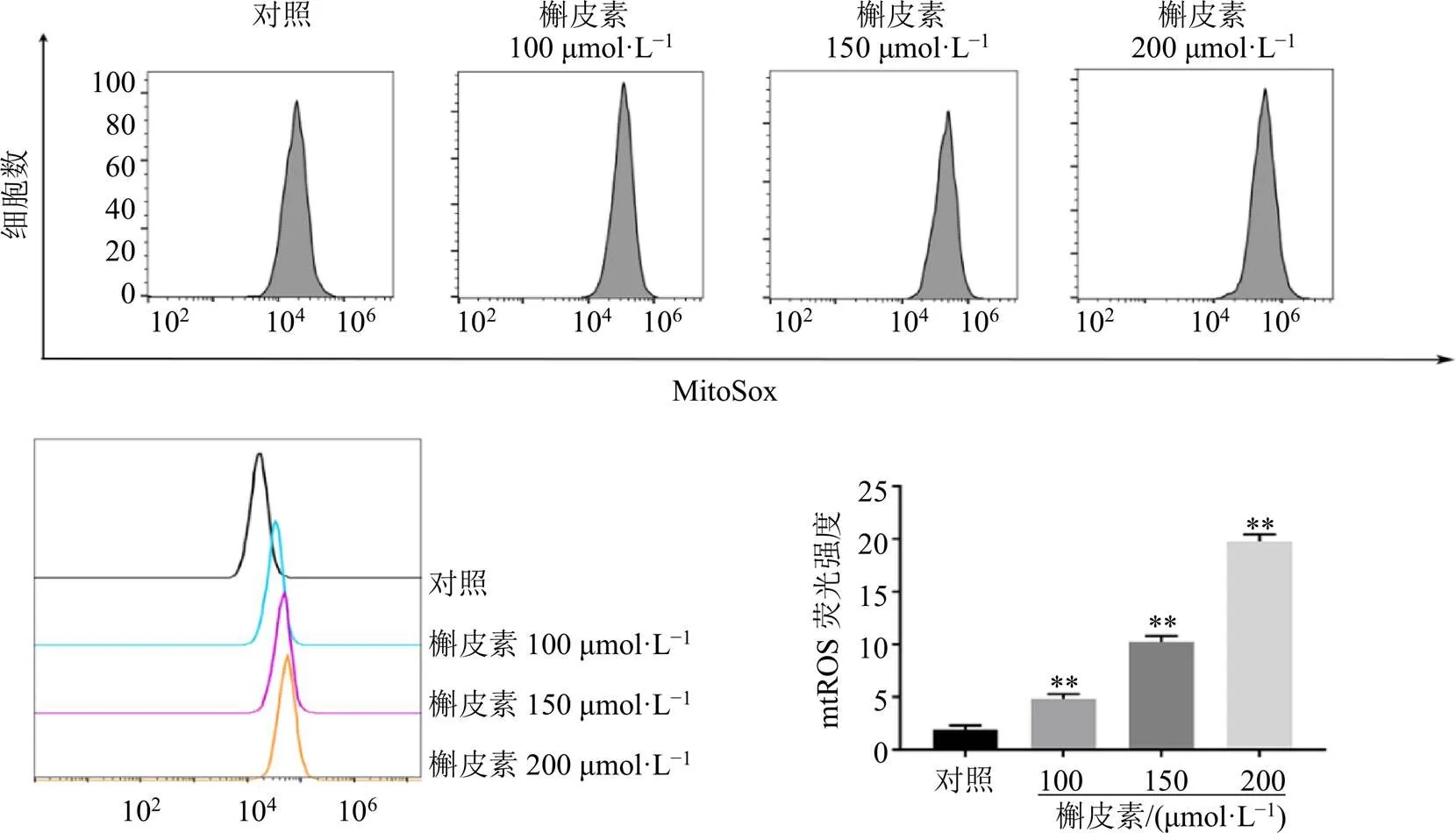
图5 槲皮素对A549细胞内mtROS水平的影响(, n = 3)
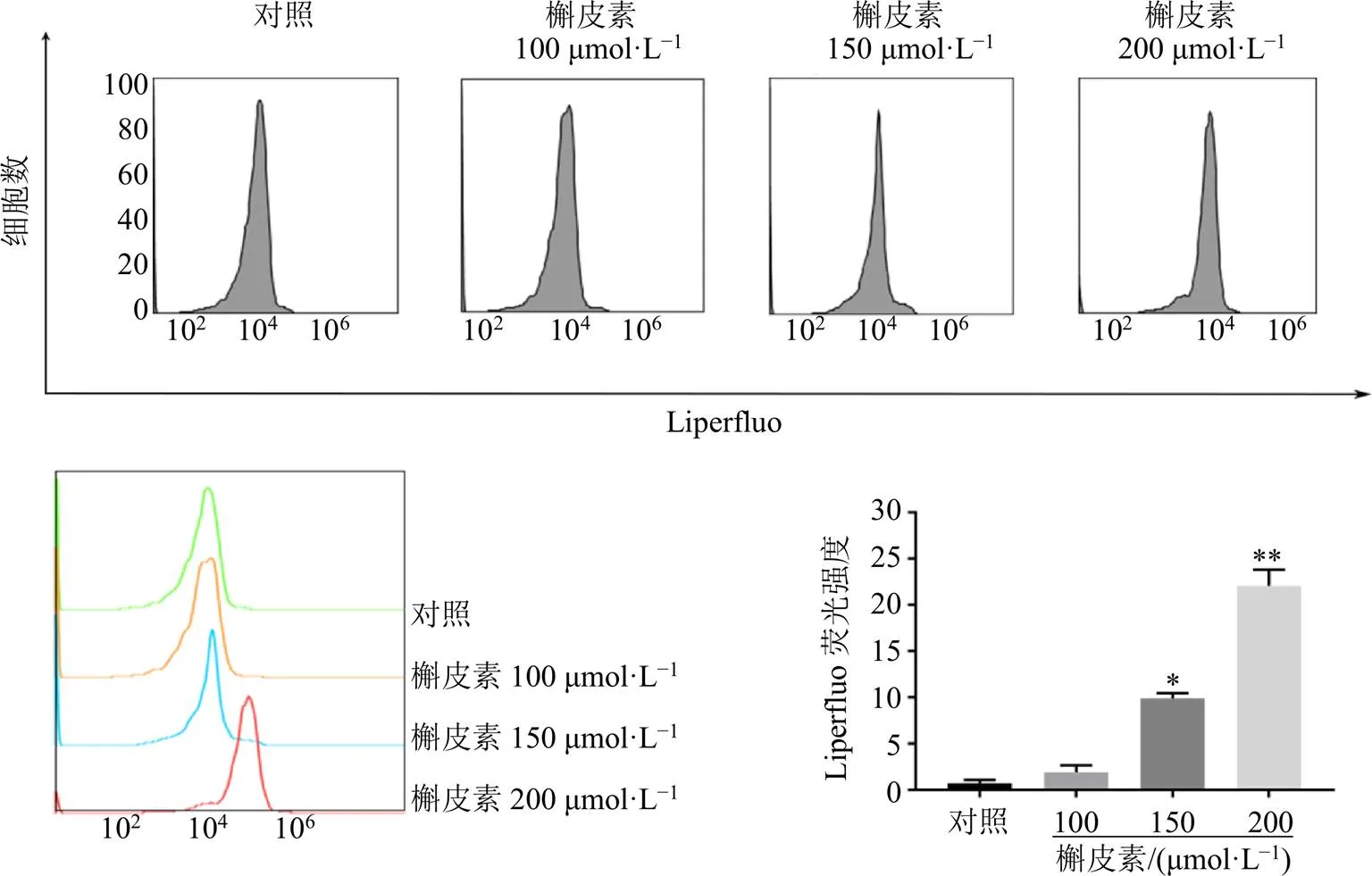
图6 槲皮素对A549细胞内脂质过氧化物水平的影响(, n = 3)
3.7 Ferrostatin-1及NAC与槲皮素联合处理对A549细胞存活率的影响
分别联合Ferrostatin-1及NAC处理细胞,观察200 μmol/L槲皮素处理下各抑制剂对槲皮素引起的细胞活力下降恢复效果。如图7所示,不同小分子抑制剂对槲皮素所致的细胞活力下降均有恢复作用(<0.05、0.001),进一步说明槲皮素诱导A549细胞的死亡方式为铁死亡。
3.8 Ferrostatin-1与槲皮素联合处理对A549细胞铁死亡相关蛋白表达及GSH水平的影响
如图8-A所示,与槲皮素组比较,Ferrostatin-1显著上调槲皮素诱导的SLC7A11与GPX4蛋白表达水平降低(<0.05)。如图8-B所示,与槲皮素组比较,Ferrostatin-1显著回调槲皮素诱导的细胞内GSH水平降低(<0.05)。
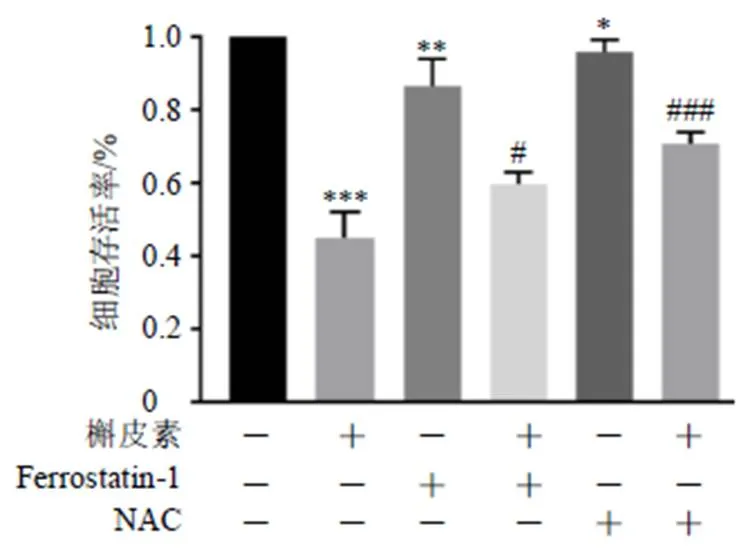
与槲皮素组比较:#P<0.05 ###P<0.001,图8同

图8 Ferrostatin-1与槲皮素联合处理对A549细胞铁死亡相关蛋白表达(A) 及GSH水平(B) 的影响(, n = 3)
3.9 槲皮素对A549细胞凋亡及线粒体凋亡蛋白表达的影响
如图9所示,与对照组比较,槲皮素组细胞凋亡率明显升高(<0.01),且呈剂量相关性。如图10所示,与对照组比较,槲皮素组Caspase-9、Caspase-3、Bax和Cyt C蛋白表达水平均显著升高(<0.05、0.01),Bcl-2蛋白表达水平显著降低(<0.01),表明槲皮素可诱导A549细胞凋亡。
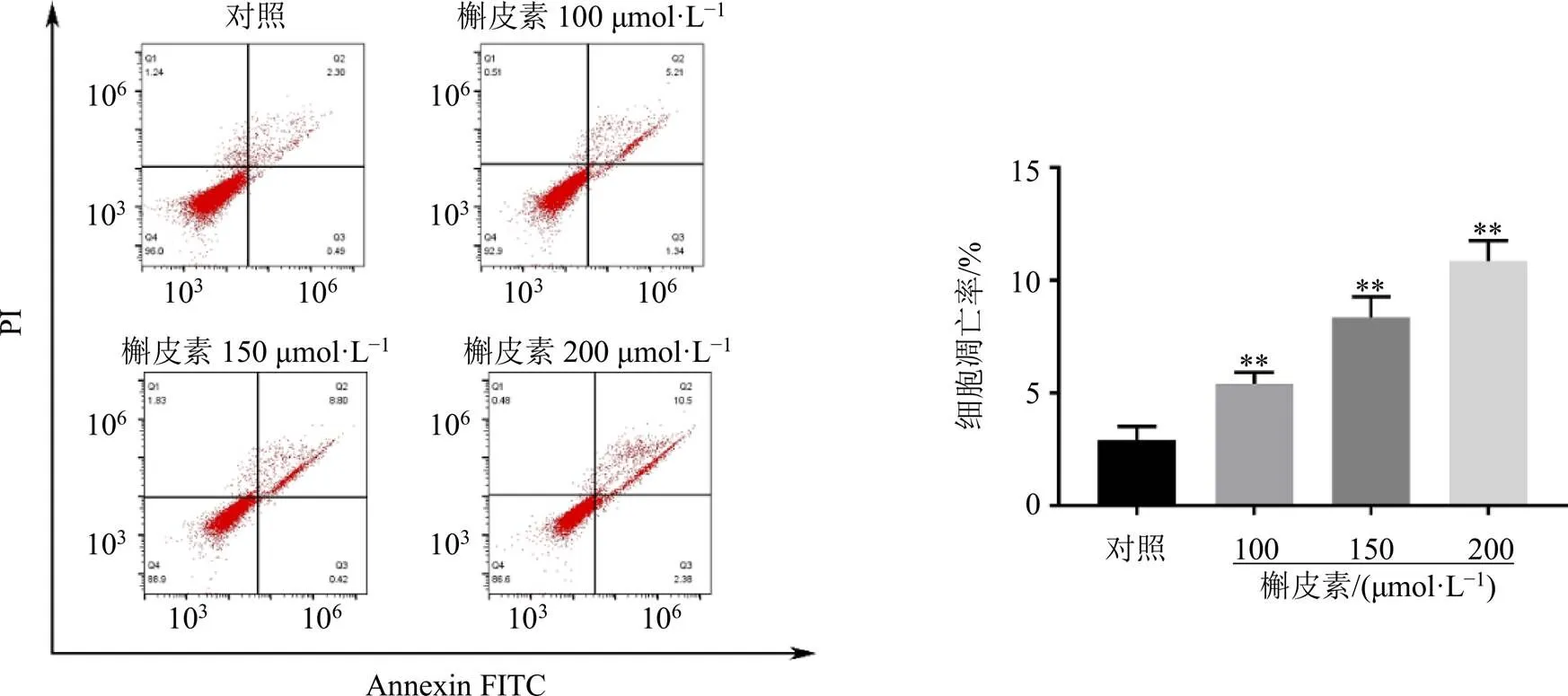
图9 槲皮素对A549细胞凋亡的影响(, n = 3)
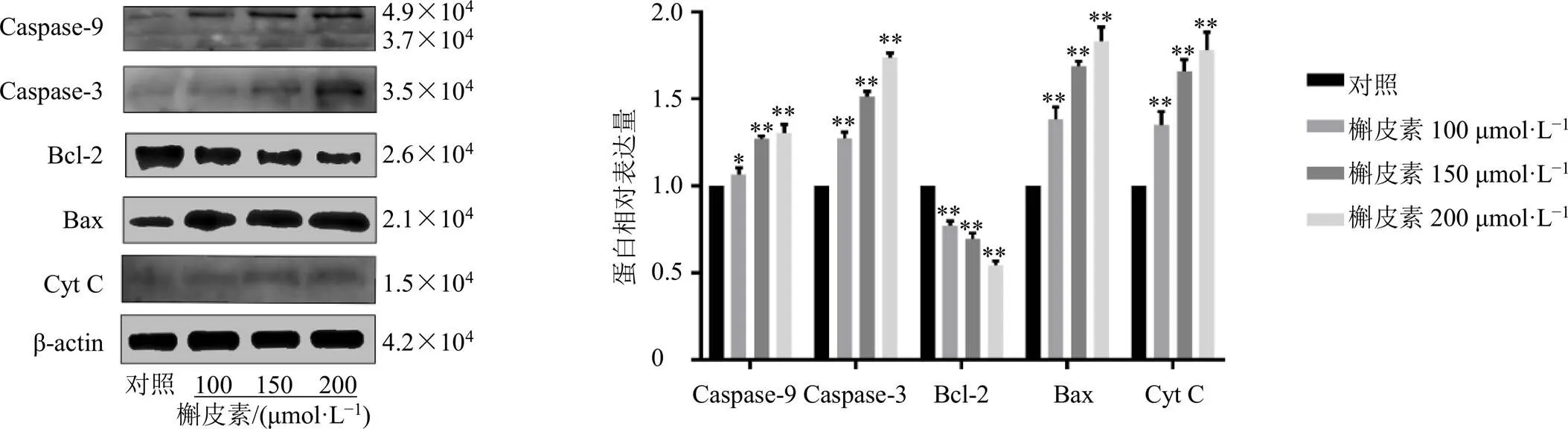
图10 槲皮素对A549细胞线粒体凋亡蛋白表达的影响(, n = 3)
4 讨论
近30年来,肺癌是我国最常见且发生率增长最快的恶性肿瘤。癌细胞侵袭转移能力很强,这是制约肺癌手术后生存率提高的主要原因[15]。本研究评估了槲皮素对A549细胞铁死亡的作用,并探讨了铁死亡被诱导后槲皮素对A549细胞增殖的影响。
近年研究发现,槲皮素具有广谱抗肿瘤作用,其抗肿瘤机制主要集中在诱导自噬、阻滞细胞周期、诱导细胞凋亡等方面,并对乳腺癌、结肠癌有较好的抑制作用[16-18]。本研究结果显示,经槲皮素处理后,A549细胞存活率显著降低,且呈剂量相关性,同时细胞克隆形成能力下降亦呈剂量相关性,以上结果表明槲皮素可抑制A549细胞增殖。
铁死亡发生时主要表现为线粒体缩小、膜致密增厚、SLC7A11与GPX4蛋白活性降低、GSH含量消耗和mtROS过量积累造成细胞膜上脂质过氧化物升高[19]。本研究发现,经槲皮素处理后,A549细胞中GSH水平降低,mtROS与脂质过氧化物水平升高,且呈剂量相关性,提示槲皮素可诱导A549细胞发生铁死亡。
p53蛋白在调控细胞铁死亡方面发挥着重要的作用[20],p53蛋白可通过抑制SLC7A11蛋白表达,从而抑制GSH活性,降低GPX4蛋白的表达并促进铁死亡[21],GPX4失活导致致命性的代谢失衡是细胞内铁死亡的执行者[22]。研究发现,槲皮素可诱导p53依赖性癌细胞铁死亡,并与肺癌的发生及发展密切相关[23]。本研究发现,经槲皮素处理后,A549细胞中p53蛋白表达水平升高,SLC7A11以及GPX4蛋白表达水平降低,且呈剂量相关性,提示槲皮素通过抑制p53/SLC7A11/GPX4通路,诱导A549细胞铁死亡。为进一步探讨铁死亡通路是否影响槲皮素对A549细胞的抑制作用,本研究首先对A549细胞进行槲皮素预处理,然后联合铁死亡特异性抑制剂Ferrostatin-1和ROS清除剂NAC处理细胞。Ferrostatin-1作为一种亲脂性自由基捕获抗氧化剂,可以预防铁死亡。研究报道,在肝癌细胞中,Ferrostatin-1与NAC可阻止二氢青蒿素诱导的肝癌细胞死亡[24]。结果显示,与单独使用槲皮素组相比,槲皮素+Ferrostatin-1组、槲皮素+NAC组细胞活力均有恢复,提示铁死亡可能影响槲皮素抑制A549细胞增殖。进一步探讨铁死亡特异性抑制剂Ferrostatin-1对槲皮素诱导的A549细胞内GSH水平、SLC7A11及GPX4蛋白表达恢复的影响。结果显示,Ferrostatin-1可恢复槲皮素导致的GSH水平下降以及SLC7A11、GPX4蛋白表达下调。
另有研究表明,槲皮素可抑制A549细胞增殖并诱导其凋亡[25]。结果显示,槲皮素可诱导A549细胞凋亡。线粒体形态与铁死亡进展存在重要的联系,Cyt C表达于线粒体内膜,可作为线粒体损伤的标志物。当线粒体发生损伤时,Cyt C释放至胞质触发Caspase级联反应,最终导致细胞凋亡[26]。本研究发现经槲皮素处理后,Cyt C、Caspase-3、Caspase-9及Bax蛋白表达均显著升高,Bcl-2蛋白表达显著降低。提示槲皮素可显著诱导A549细胞凋亡并调节线粒体凋亡蛋白表达,进一步说明槲皮素激活肺癌细胞铁死亡过程中有线粒体凋亡途径的参与。
综上,本研究发现,槲皮素对A549细胞具有增殖抑制作用,可能不仅局限于诱导细胞凋亡,铁死亡在槲皮素抗肺癌作用机制中也发挥着重要作用。但铁死亡与细胞凋亡在共同抑制肺癌细胞活性中是否存在相互作用及联系仍有待进一步研究。
利益冲突 所有作者均声明不存在利益冲突
[1] Sung H, Ferlay J, Siegel R L,. Global cancer statistics 2020: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries [J]., 2021, 71(3): 209-249.
[2] Malyla V, Paudel K R, Shukla S D,. Recent advances in experimental animal models of lung cancer [J]., 2020, 12(7): 567-570.
[3] Zappa C, Mousa S A. Non-small cell lung cancer: Current treatment and future advances [J]., 2016, 5(3): 288-300.
[4] 刘妍如, 唐志书, 白宏博, 等. 贯叶连翘不同部位黄酮类成分差异与抗炎活性相关性分析 [J]. 中草药, 2017, 48(21): 4465-4470.
[5] Granato M, Rizzello C, Gilardini Montani M S,. Quercetin induces apoptosis and autophagy in primary effusion lymphoma cells by inhibiting PI3K/AKT/mTOR and STAT3 signaling pathways [J]., 2017, 41: 124-136.
[6] Maleki Dana P, Sadoughi F, Asemi Z,. Anti-cancer properties of quercetin in osteosarcoma [J]., 2021, 21(1): 349.
[7] 党树伟, 李国东, 刘明. 槲皮素逆转肿瘤多药耐药机制的研究进展 [J]. 中国肿瘤, 2017, 26(10): 802-807.
[8] 贾静, 刘增娟, 朱臻宇, 等. 槲皮素抗阿霉素诱导心肌毒性的网络多靶标研究 [J]. 中草药, 2019, 50(18): 4364-4371.
[9] Dixon S J, Lemberg K M, Lamprecht M R,. Ferroptosis: An iron-dependent form of nonapoptotic cell death [J]., 2012, 149(5): 1060-1072.
[10] 徐畅, 黄楠, 孙奋勇. 铁死亡在肿瘤中的研究进展 [J]. 同济大学学报: 医学版, 2021, 42(3): 432-440.
[11] Zhou B R, Liu J, Kang R,. Ferroptosis is a type of autophagy-dependent cell death [J]., 2020, 66: 89-100.
[12] Toyokuni S, Ito F, Yamashita K,. Iron and thiol redox signaling in cancer: An exquisite balance to escape ferroptosis [J]., 2017, 108: 610-626.
[13] Jiang X J, Stockwell B R, Conrad M. Ferroptosis: Mechanisms, biology and role in disease [J]., 2021, 22(4): 266-282.
[14] Cheng I F, Breen K. On the ability of four flavonoids, baicilein, luteolin, naringenin, and quercetin, to suppress the Fenton reaction of the iron-ATP complex [J]., 2000, 13(1): 77-83.
[15] Wei W Q, Zeng H M, Zheng R S,. Cancer registration in China and its role in cancer prevention and control [J]., 2020, 21(7): e342-e349.
[16] Jia L J, Huang S, Yin X R,. Quercetin suppresses the mobility of breast cancer by suppressing glycolysis through Akt-mTOR pathway mediated autophagy induction [J]., 2018, 208: 123-130.
[17] Pang B, Xu X G, Lu Y,. Prediction of new targets and mechanisms for quercetin in the treatment of pancreatic cancer, colon cancer, and rectal cancer [J]., 2019, 10(9): 5339-5349.
[18] 徐浩, 高艺璇, 王向涛. 槲皮素磺酸化衍生物合成及其体内外抗肿瘤研究[J]. 药物评价研究, 2018, 41(11): 1945-1950.
[19] Yang W S, SriRamaratnam R, Welsch M E,. Regulation of ferroptotic cancer cell death by GPX4 [J]., 2014, 156(1/2): 317-331.
[20] Jiang L, Kon N, Li T Y,. Ferroptosis as a p53-mediated activity during tumour suppression [J]., 2015, 520(7545): 57-62.
[21] Chang L C, Chiang S K, Chen S E,. Heme oxygenase-1 mediates BAY 11-7085 induced ferroptosis [J]., 2018, 416: 124-137.
[22] Seibt T M, Proneth B, Conrad M. Role of GPX4 in ferroptosis and its pharmacological implication [J]., 2019, 133: 144-152.
[23] Chen K C, Hsu W H, Ho J Y,. Flavonoids luteolin and quercetin inhibit RPS19 and contributes to metastasis of cancer cells through c-Myc reduction [J]., 2018, 26(3): 1180-1191.
[24] 李艳纯, 周怡, 王鑫, 等. 二氢青蒿素通过诱导铁死亡抑制肝癌细胞生长 [J]. 中国生物化学与分子生物学报, 2019, 35(12): 1361-1366.
[25] Zheng S Y, Li Y, Jiang D,. Anticancer effect and apoptosis induction by quercetin in the human lung cancer cell line A-549 [J]., 2012, 5(3): 822-826.
[26] Lv R, Xu X, Luo Z,. Pyrrolidine dithiocarbamate (PDTC) inhibits the overexpression of MCP-1 and attenuates microglial activation in the hippocampus of a pilocarpine-induced status epilepticus rat model [J]., 2014, 7(1): 39-45.
Effect and mechanism of quercetin on inhibiting proliferation of A549 cells via induction of ferroptosis
LI Chang1, WANG Hao2, HE Qian-yu1, GUO Xiang-yu1, JIANG Tong-wei1, GUO Yan1
1. School of Clinical Medicine, Changchun University of Chinese Medicine, Changchun 130117, China 2. Ji’an Hospital, Ji’an 134200, China
To explore the effect and mechanism of quercetin on proliferation of human non-small cell lung cancer A549 cells based on ferroptosis signaling pathway.CCK-8 method was used to screen the experimental concentration of quercetin on A549 cells; The effect of quercetin on colony forming ability of A549 cells was detected by plate cloning method; The effect of quercetin on glutathione (GSH) level in A549 cells was detected by kit; Western blotting was used to detect the effect of quercetin on the expressions of ferroptosis related protein and mitochondrial apoptosis protein in A549 cells; The effects of quercetin on mitochondrial reactive oxygen species (mtROS), lipid peroxide level and apoptosis in A549 cells were detected by flow cytometry. Combined with ferroptosis inhibitor (Ferrostatin-1) or ROS scavenger-acetylcysteine (NAC), the effects of quercetin on GSH level and expressions of ferroptosis related proteins in A549 cells were detected.Compared with control group, quercetin significantly inhibited the survival rate of A549 cells, with a time-dose correlation (< 0.01). Quercetin inhibited the colony formation of A549 cells in a dose-dependent manner (< 0.01), significantly decreased GSH level in A549 cells (< 0.01), up-regulated mtROS and lipid peroxide levels in A549 cells (< 0.05, 0.01), and induced apoptosis (< 0.01); Quercetin significantly promoted the expression of ferroptosis related protein p53 (< 0.05, 0.01), and inhibited the expressions of glutathione peroxidase 4 (GPX4) and soluble carrier family 7 member 11 (SLC7A11) (< 0.01); Quercetin significantly promoted expressions of mitochondrial apoptosis related proteins such as cysteine-aspartate protease-3 (Caspase-3), Caspase-9, cytochrome c (Cyt C) and B cell lymphoma-2 (Bcl-2) related X protein (Bax) (< 0.05, 0.01), and inhibited the protein expression of anti-apoptotic factor Bcl-2 (< 0.01). Compared with quercetin group, quercetin + NAC group and quercetin + Ferrostatin-1 group recovered the decrease of cell survival rate caused by quercetin to varying degrees (< 0.05, 0.001), and ferrostatin-1 could significantly up-regulated GPX4 and SLC7A11 protein expressions (< 0.05), and regulated the level of GSH (< 0.05).Quercetin can inhibit the proliferation of A549 cells and induce ferroptosis, and then lead to cell apoptosis, which has the biological effect of inducing ferroptosis in A549 cells.
non-small cell lung; quercetin; ferroptosis; cell proliferation; mitochondrial reactive oxygen species; lipid peroxides
R285.5
A
0253 - 2670(2022)22 - 7112 - 09
10.7501/j.issn.0253-2670.2022.22.014
2022-08-14
吉林省自然科学基金资助项目(YDZJ202201ZYTS151);国家自然科学基金国际合作项目(3191101705);吉林省科学技术厅(20210204029YY)
李 畅,女,硕士研究生,主要从事中药药理学相关研究。E-mail: lichang970330@163.com
姜彤伟,男,博士,教授,主要从事中西医结合研究。E-mail: tw2008.ok@163.com
郭 焱,女,博士,教授,主要从事中西医结合研究。E-mail: ccguoyan@163.com
[责任编辑 李亚楠]

