中药基于外泌体影响肿瘤治疗的研究进展
任文静,李朝霞,仇 峰
中药基于外泌体影响肿瘤治疗的研究进展
任文静,李朝霞,仇 峰*
首都医科大学中医药学院,北京 100069
传统中药作为肿瘤现代疗法的主流补充和替代疗法已被广泛接受。然而,目前很多有确切抗肿瘤疗效的中药却无法用对抗医学的思维明确其药效物质基础与作用机制。外泌体作为一种内源性物质,可参与肿瘤微环境以及其他组织、器官的相互通讯,也可作为中间媒介物质影响肿瘤治疗。系统综述了中药通过外泌体间接抗肿瘤的作用机制以及外泌体用作中药载体拓展抗肿瘤中药的临床疗效与应用,旨在基于外泌体发掘更多的抗肿瘤中药药效成分,进一步阐释中药抗肿瘤的复杂机制,推动中医药在肿瘤治疗领域的发展与应用。
中药;活性成分;肿瘤治疗;肿瘤微环境;外泌体;载体
《2022年度癌症统计报告》预计:到2022年,美国将发生1 918 030例新发癌症病例和609 360例癌症死亡病例[1]。Xia等[2]预计,中国到2022年将发生大约482万例新发癌症病例和321万例癌症死亡病例。临床实践证明手术、放疗、化疗等任一单一疗法治疗肿瘤均难以取得最佳疗效,且常带来明显的损伤和不良反应,所以目前肿瘤治疗多以综合治疗为主。临床数据显示,我国2/3以上的肿瘤患者采用中西医联合疗法。事实上,以中医手段治疗肿瘤的应用由来已久,国医大师周岱翰将“虚、瘀、痰、毒”高度概括为恶性肿瘤的4大类病机,并创造性提出“带瘤生存”的肿瘤辨治观。中药因其多成分、多靶点的特点可以多途径发挥抗肿瘤作用。然而,很多有确切抗肿瘤疗效的中药却在很长时间内无法用对抗医学的思维明确其药效物质基础,这种现象提示中药除了直接作用于肿瘤病灶外,可能还存在其他途径发挥抗肿瘤作用。
1 肿瘤与其微环境存在复杂的相互作用
肿瘤微环境指肿瘤细胞存在的周围微环境,包含免疫T细胞、肿瘤相关巨噬细胞、癌症相关成纤维细胞、细胞外基质、分泌因子、血液和淋巴血管网等多种细胞和组分[3-7],非常复杂。肿瘤微环境的形成有免疫抑制和慢性炎性2个主要特征。免疫细胞、基质细胞和恶性细胞产生的肿瘤微环境给癌细胞带来压力升高、氧化应激、营养剥夺和竞争、缺氧和免疫监视等诸多挑战[8]。
研究表明,肿瘤微环境以及其他组织、器官相互通讯的方式之一是外泌体。外泌体通常是指直径为30~150 nm的胞外囊泡,存在于几乎所有体液中,且是近年来的研究热点。据ExoCarta数据库(http://www.exocarta.org/)统计,已有超过286个外泌体研究的41 860个蛋白质和超过7540个RNA记录在库可供查询借鉴。
2 肿瘤源性外泌体(tumor derived exosomes,TDEs)具有促癌作用
肿瘤的发生与发展离不开肿瘤微环境,外泌体包含蛋白质、DNA、微小RNA(microRNA,miRNA)、长链非编码RNA、信使RNA、肿瘤基因和转录因子等多种生物活性物质,而这些生物活性物质的水平与肿瘤的侵袭和肿瘤微环境有一定关系。TDEs具有促癌特性,可通过重塑肿瘤微环境促进血管生成,促进癌细胞的迁移、侵袭、转移与耐药促进癌症发展。
2.1 外泌体的生物发生与功能
外泌体的生物发生有质膜和内体2种说法,后者的相关研究较多。外泌体的生物发生过程如图1所示,它起源于细胞的内吞作用,先由质膜向内出芽形成早期内体,然后早期内体萌发腔内囊泡发育为晚期内体,进一步形成多泡体,最终多泡体与自噬体、溶酶体融合而被降解或与质膜融合,与质膜融合的多泡体所释放的腔内囊泡即为最终形成的外泌体。外泌体可由各种细胞分泌,其功能取决于来源细胞。TDEs可以与特定的受体结合,通过释放囊泡内容物的方式进行信息传递,其携带的各种细胞因子和蛋白质在细胞与微环境之间的通讯中起关键作用,为肿瘤细胞的生存和生长提供合适的环境[9]。

图1 外泌体的生物发生过程
2.2 TDEs的促癌作用
大量证据表明,TDEs介导的因子可以通过肿瘤微环境内的细胞-细胞通信,促进肿瘤的起始、转移和耐药,包括促进肿瘤微环境重塑、肿瘤血管生成及肿瘤细胞的迁移、侵袭、转移和耐药性。
2.2.1 TDEs调节肿瘤微环境重塑 TDEs可通过刺激细胞外受体信号通路和破坏细胞黏附形成来调节肿瘤微环境和细胞外基质[10-13]。在乳腺癌细胞中,外泌体介导的从转移性乳腺癌细胞中转移,通过下调和靶向紧密连接蛋白-1,破坏内皮单层的屏障功能[14],增强血管通透性。外泌体还运输癌蛋白和免疫抑制分子,以破坏宿主免疫系统并有利于肿瘤的微环境,帮助肿瘤细胞免疫逃逸[15]。
2.2.2 TDEs促进肿瘤血管生成 外泌体通过运输包含血管内皮生长因子、基质金属蛋白酶和miRNA等多种促血管生成的生物分子,参与癌症进展中的血管生成。外泌体通过下调抑制因子的缺氧诱导因子-1的表达来促进血管生成[16]。正常内皮细胞摄取肿瘤来源的外泌体,可激活内皮细胞中的血管生成信号通路,并刺激新血管的形成。
2.2.3 TDEs促进肿瘤细胞的迁移、侵袭、转移与耐药 乳腺癌细胞来源的外泌体可以促进乳腺癌细胞增殖、运动和转移的能力,从而产生增强的致癌表型[17]。Piao等[18]报道,乳腺癌细胞来源的外泌体刺激巨噬细胞极化,为三阴性乳腺癌的淋巴结转移过程建立了有利条件。在卵巢癌中,携带的外泌体可以通过诱导细胞衰老来促进紫杉醇的耐药性[19]。
3 抗肿瘤中药通过外泌体间接发挥抗肿瘤作用
传统中药作为肿瘤现代疗法的主流补充和替代疗法已被广泛接受。目前证明有抗肿瘤作用的中药已超过300种,分布十分广泛,包含数千种抗肿瘤活性成分。然而许多中药虽有良好的抗肿瘤作用,但其作用机制却不甚明确。且越来越多的研究发现直接作用机制难以解释一些中药的作用机制,基于此,越来越多的学者将目光转移到间接调控作用。外泌体作为内源性物质,是一种中间媒介物质,亦可用于解释一些中药的抗肿瘤作用机制。外泌体不仅具有促癌特性,还可利用其免疫调节、肿瘤微循环重塑等特性使其成为抗肿瘤治疗的有效方式。随着外泌体相关研究的兴起,已有越来越多的文献报道通过外泌体阐释中药治疗肿瘤的作用机制。
3.1 中药活性单体成分的间接抗肿瘤作用机制
中药活性单体成分可以通过多种途径发挥抗肿瘤作用,如通过影响外泌体的细胞间通讯作用、肿瘤微环境调节作用、抑制TDEs的分泌和增强耐药细胞的药物敏感性抑制肿瘤的发生和发展,通过多个信号通路在一定程度上降低肿瘤细胞的化疗耐药性和减轻其他疗法的不良反应,而且能以外泌体为载体转移到靶细胞发挥抗肿瘤作用。但不同种类的中药活性成分抗肿瘤作用机制存在差别。
苷类是由糖或糖衍生物的端基碳原子与另一类非糖物质连接形成的化合物。据文献报道,中药苷类活性成分可通过影响外泌体的细胞间通讯作用和肿瘤微环境调节作用抑制肿瘤细胞的发展,也可通过抑制TDEs的分泌抑制肿瘤的形成和转移。毛蕊花苷是一种糖基化苯丙烷化合物,可促进胶质母细胞瘤(glioblastoma,GBM)中表达,并且促进通过外泌体传递到受体GBM细胞。通过抑制表皮生长因子受体(epidermal growth factor receptor,EGFR)/磷脂酰肌醇3-激酶(phosphatidylinositol-3-kinase,PI3K)/蛋白激酶B(protein kinase B,PKB/Akt)信号通路抑制GBM细胞增殖、迁移、侵袭和微管形成,并可在体内抑制GBM的肿瘤发生和转移[20],其作用机制见图2。在肿瘤微环境中,细胞内源性和细胞外源性线索重新编程胆固醇代谢,从而促进肿瘤发生。临床前和临床研究表明,可通过控制胆固醇代谢的途径来抑制肿瘤生长、重塑免疫景观、重振抗肿瘤免疫[21]。白英Thunb.中的白英总甾体生物碱苷类是一类具有重要抗肿瘤活性的甾体生物碱苷类化合物,可通过凝集肿瘤细胞膜脂质胆固醇,从而直接影响肿瘤外泌体的形成,导致其功能的改变,进而抑制肿瘤血管生成,抑制肺癌A549细胞的发展[22]。此外,茄胺还能显著抑制乙酰胆碱诱导的人肝癌HepG2细胞外泌体处理的A549细胞的增殖[23]。-鼠李糖β常春藤苷是一种从扬子铁线莲(Lévl. et Vant.) Tamura中分离出来的新型齐墩果型三萜皂苷,已被证明对多种肿瘤有效。鼠李糖β-常春藤能够抑制外泌体分泌,且外泌体水平与靶乳腺癌细胞吸收和内化后的细胞生长呈正相关[24]。
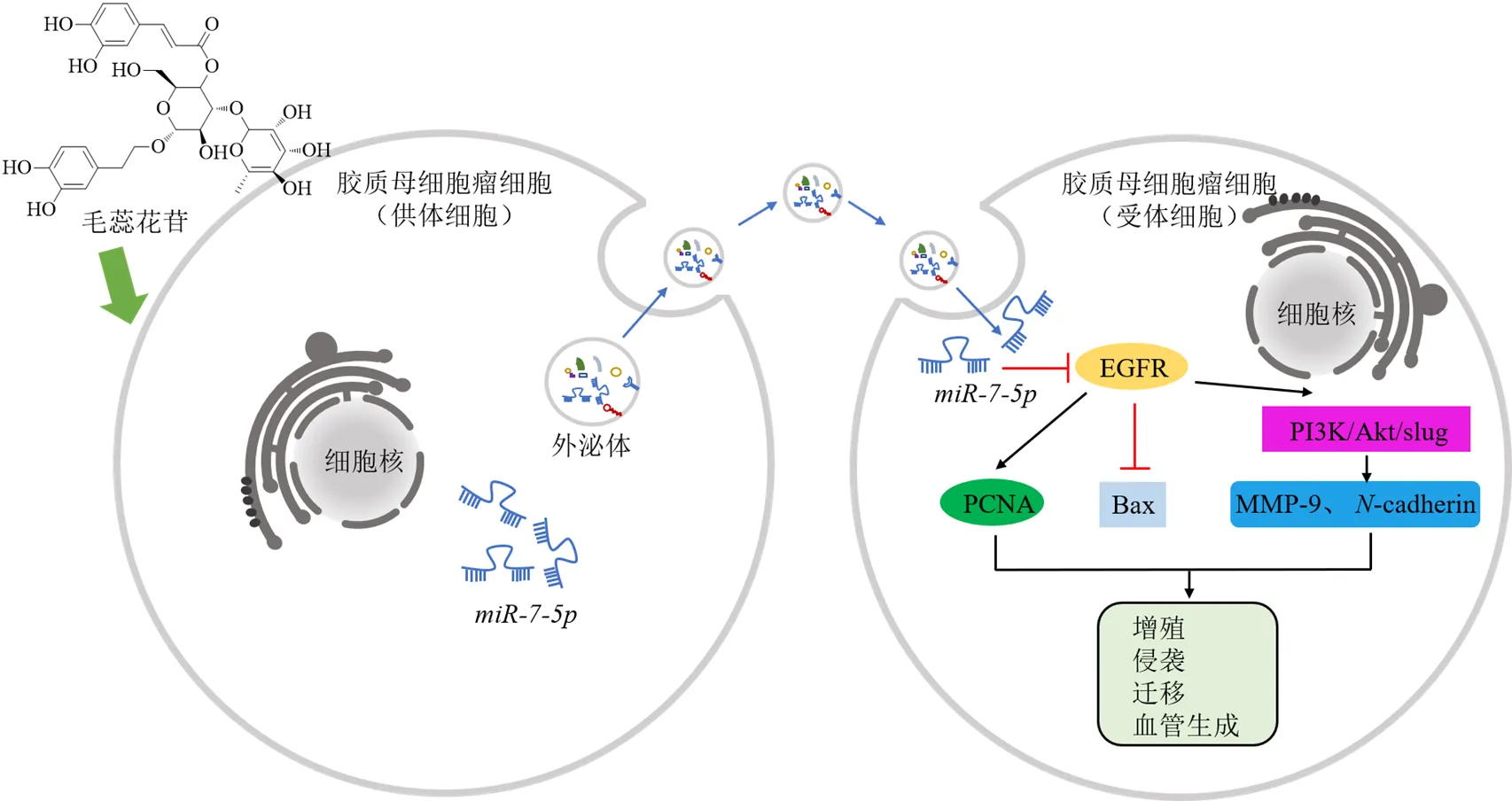
PCNA-增殖细胞核抗原 Bax-B淋巴细胞瘤-2相关X蛋白 MMP-9-基质金属蛋白酶-9 N-cadherin-神经性钙黏蛋白
多酚通常是指相对分子质量在600以上并且包含多个酚羟基结构的化合物,如茶多酚等。多酚主要来源于植物,在自然界中的含量仅次于糖类,与蛋白质、脂肪、核酸、糖类等天然化合物一样,是一类极其重要的化合物。与苷类成分类似,多酚成分亦可通过影响外泌体的细胞间通讯作用发挥抗肿瘤作用,除此之外,多酚成分还能以外泌体为载体转移到靶细胞发挥抗肿瘤作用。表没食子儿茶素没食子酸酯(epigallocatechin gallate,EGCG)是绿茶(L.) O. Ktze干叶中最丰富的多酚成分,占绿茶中总儿茶素的60%~70%。EGCG上调肿瘤细胞中的,该基因再通过外泌体转移到肿瘤相关巨噬细胞,通过抑制肿瘤相关巨噬细胞浸润和M2极化来抑制肿瘤生长[25]。姜黄素是一种从姜Rosc.的新鲜根茎中提取的天然多酚,具有抗炎、抗氧化和抗肿瘤的特性。已知姜黄素可以抑制多种致癌基因驱动的细胞信号通路,从而减轻或预防结肠直肠癌、胰腺癌、乳腺癌、前列腺癌和肺癌等多种不同类型的癌症。姜黄素还可通过外泌体被递送到受体胰腺癌细胞,促进细胞毒性[26]。白藜芦醇是天然的多酚化合物,具有抗血小板、抗肿瘤、神经保护和抗炎特性。药物治疗前对白藜芦醇敏感的人胶质瘤U251细胞释放的外泌体可以提高抗白藜芦醇人胶质瘤LN428细胞对白藜芦醇的敏感性,U251细胞可能通过传递药物增敏信号使LN428细胞对白藜芦醇敏感[27]。
其他中药活性抗肿瘤成分也是通过影响外泌体的细胞间通讯作用和肿瘤微环境调节作用抑制肿瘤细胞的发展。紫草素是从紫草科植物新疆紫草(Royle) Johnst.或内蒙紫草Bunge的干燥根中分离出来的萘醌,通过下调肿瘤来源的外泌体miR-128来抑制人乳腺癌MCF-7细胞的增殖,通过抑制外泌体的释放来抑制MCF-7细胞的生长[28]。紫杉醇是二萜生物碱类化合物中非常具有代表性的抗癌活性成分,但长久使用会使细胞产生耐药性,原因可能是TDEs或基质源性外泌体调节miRNA而赋予肿瘤细胞耐药性[29-31]。
中药活性成分通过外泌体间接发挥抗肿瘤作用机制见表1。
3.2 中药复方制剂的间接抗肿瘤作用机制
中药复方的临床应用历史悠久,目前已有超过10万首复方用于临床。中药化学研究证明,1味中药有若干种化学成分,包含多味中药的复方化学成分更加复杂,可以说中药复方是天然组合化学库,且具有多成分、多作用、多层次、多途径、多靶点的特点,故而中药复方药效研究是近年来中药现代研究的难点和热点。研究发现相较于中药活性单体成分,中药复方通过外泌体阐述抗肿瘤的作用机制更为复杂化、多元化。
中药复方通过多途径同时影响外泌体细胞间的通讯作用、调节肿瘤微环境和抗肿瘤血管生成而直接或间接地抑制肿瘤的发生和发展。中药复方的抗肿瘤作用应是各味中药物质基础相互作用的结果,但目前研究尚未深入至中药复方中单味药的抗肿瘤作用机制,仅有部分团队初步探索了一些中药方剂的抗肿瘤机制。Chen等[32]研究发现大黄䗪虫丸通过外泌体抑制了上调的CC趋化因子配体2(CC chemokine ligand 2,CCL2),显著降低了肝脏中CCL2及其受体(CC chemokineligand-2 receptor,CCR2)的表达。CCL2有激活巨噬细胞招募并将M1/M2范式转移到M2表型的功能。抗纤维化和抑制CCR2可抑制结直肠癌的生长和转移,说明大黄䗪虫丸通过抑制CCL2介导的M2倾斜模式和改善前纤维化微环境来抑制结直肠癌的肝转移。李晶晶等[33]实验证明滋阴化痰方可通过调控肿瘤细胞外泌体而抑制胃癌血管新生,进而抑制胃癌细胞的侵袭和迁移。流行病学研究证实肿瘤的发生与炎症具有明显的相关性,因此炎症的治疗对于肿瘤的发展至关重要。Wang等[34]分析比较高尿酸血症患者葛根芩连汤治疗前后外周血单核细胞中核苷酸结合寡聚化结构域样受体家族pyrin结构域蛋白3(nucleotide-binding and oligomerization domain-like receptors family pyrin-domain-containing 3,NLRP3)和尿外泌体蛋白的表达,发现葛根芩连汤下调了尿酸血症患者中NLRP3的表达,为支持葛根芩连汤通过线粒体凋亡信号通路保护尿酸介导的肾小管上皮细胞炎症的观点提供证据。此外,Zha等[35]研究发现实验性自身免疫性脑脊髓炎小鼠血清外泌体和的表达与脑和脊髓组织相似;前者下调,后者上调。而补肾益髓方的治疗逆转了这一趋势,也和各组小鼠中枢神经系统组织的差异相一致,进一步证实了补肾益髓方在中枢和外周神经系统水平上调节miRNA的作用。而miR-124和均与小胶质细胞极化相关,推测补肾益髓方对多发性硬化症及其实验性自身免疫性脑脊髓炎动物模型的神经保护作用与促进小胶质细胞向M2极化有关。

表1 中药活性成分通过外泌体间接发挥抗肿瘤作用机制
4 外泌体用作中药载体
外泌体是具有生物相容性、生物安全性、组织特异性和长半衰期等优点的纳米级小分子,与目前的人工药物递送载体相比,其具有能够穿透血脑屏障、细胞靶向特性和循环稳定性等显著优势,可用作癌症治疗的天然药物传递载体,使中药更充分地发挥抗肿瘤疗效。He等[36]研究发现,相较于游离雷公藤甲素,一种装载雷公藤甲素的外泌体传递系统(triptolide-loaded exosomes delivery system,TP-exos)显著增强了抗卵巢癌作用,并降低了其对重要器官的毒性。以外泌体为载体还有效解决了雷公藤甲素的不良反应问题,为扩大其临床应用提供可能。
4.1 作为中药载体的外泌体的细胞来源
尽管外泌体来源于几乎所有细胞,但并不是所有细胞分泌的外泌体都适合作为药物载体。人们已研究树突状细胞、间充质干细胞、巨噬细胞、肿瘤细胞、红细胞、T细胞、自然杀伤细胞等多种细胞来源的外泌体作为药物传递载体的潜在应用。判断该来源外泌体是否适合搭载药物应该有严格的考量标准,如大小、表面蛋白、腔内组成和产量等因素。树突状细胞、间充质干细胞和巨噬细胞均被证明可参与机体的免疫调节[37],此外,树突状细胞的组成和主要组织相容性复合体的含量容易检测以及间充质干细胞来源丰富是以上来源外泌体具有载药潜力的重要原因。
如上所述,TDEs在调节肿瘤发生发展方面发挥双重作用,既可促进肿瘤发展,又可协同中药抑制肿瘤发展。因此,以TDEs为中心的治疗方法,在进入临床领域之前,需要克服其对肿瘤的促进作用,并扩大其抗肿瘤潜能。牛奶来源的外泌体由于成本低、生物相容性好、稳定性高、肿瘤靶标能力好和毒性低可能是一种理想的药物载体[38]。González-Sarrías等[39]研究发现牛奶来源的外泌体可以有效保护姜黄素和白藜芦醇等多酚类中药活性成分免受新陈代谢的影响,并且可增强其对乳腺癌的抗癌活性。
4.2 外泌体的载药方式
外泌体负载外源性分子的策略可分为主动装载和被动装载2大类。主动装载包括超声、挤压、冻融、电穿孔、皂苷孵育、点击化学和抗体结合等手段,被动装载包括外泌体与游离药物孵育和供体细胞与游离药物孵育。相对于主动装载,被动装载的操作简单,不破坏膜的完整性。主动装载中超声和挤压损坏膜的完整性。载药外泌体的包封率与载药率和药物种类、药物溶剂种类、外泌体来源、载药方式、处理温度与时间等因素有关。Munagala等[40]将花青素、姜黄素和化疗药物紫杉醇、多西他赛溶液[溶剂为乙醇-乙腈(1∶1)]与牛乳来源外泌体溶液(以PBS为溶剂)以1∶9的比例在室温(22 ℃)下共孵育,结果表明,化疗药物和化学预防药物的载药量随受试药物的不同而变化,其范围介于10%~40%。
综上,外泌体不仅可以作为中药间接抗肿瘤的中间媒介物质,还可作为抗肿瘤中药的载体,在中药发挥抗肿瘤作用的过程中具有不容忽视的重要作用,见图3。
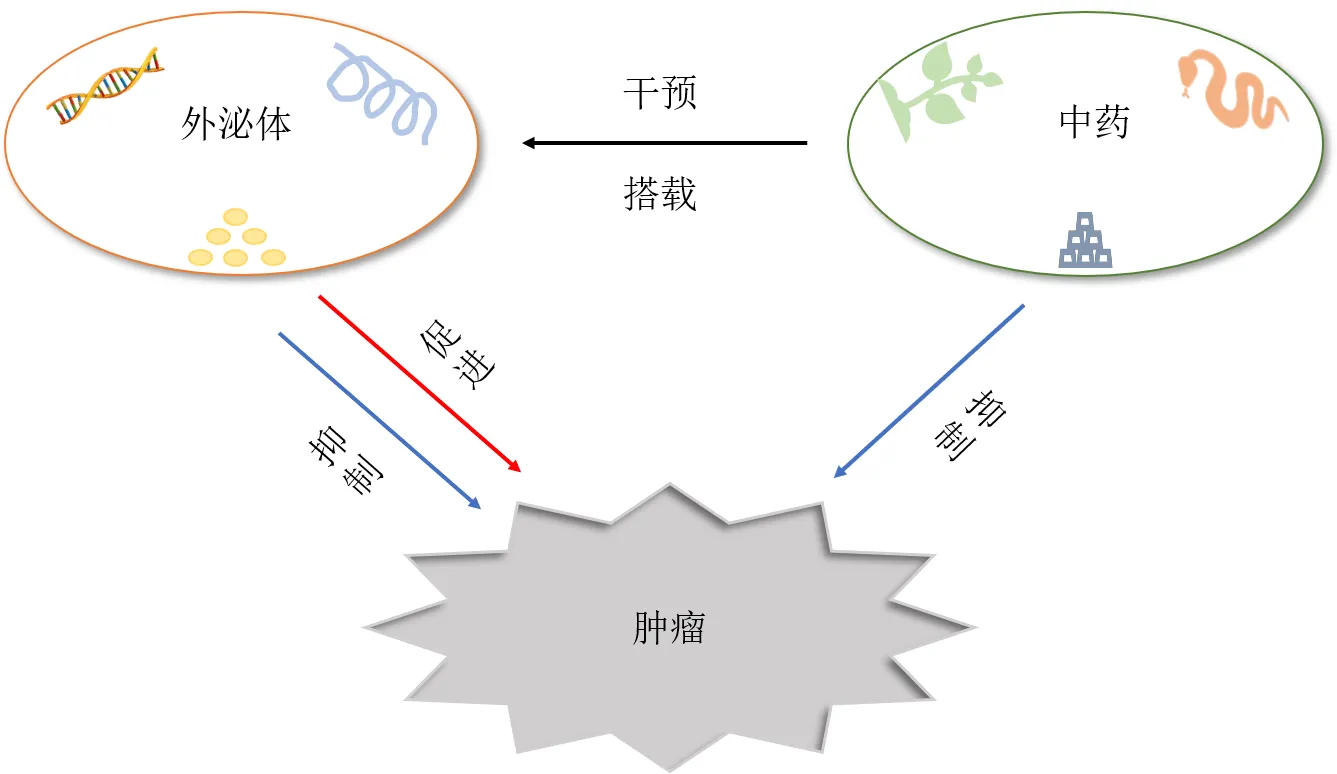
图3 外泌体在中药抗肿瘤过程中扮演的多重角色
5 结语与展望
我国中药资源丰富,中药抗肿瘤的临床应用历史悠久。然而,中药的物质基础较为复杂,不同来源中药的多种药效物质基础通过复杂的机制发挥抗肿瘤作用,作用机制不明的问题很大程度上阻碍了中药的应用与发展。中药除直接作用于肿瘤相关靶部位外,还可通过外泌体等媒介间接发挥抗肿瘤作用。外泌体作为细胞间通讯的重要媒介在中药抗肿瘤过程中发挥重要作用,不仅有利于阐释中药抗肿瘤的机制,还可作为中药的载体提高中药的生物利用度、增强抗肿瘤活性和生物安全性。然而,更多的抗肿瘤活性中药有待发掘,中药复方抗肿瘤的复杂机制相关研究较少,尚不能科学解释复方中各味中药的配伍作用,且中药是否同时通过直接与间接作用抑制肿瘤的发生发展犹未可知,中药在肿瘤治疗领域仍有非常大的研究空间,当然,由于中药的成分复杂、体内外次生成分监控存在困难和当前技术所限等,上述问题的解决任重而道远。
外泌体不仅可以作为一种媒介,在一定程度上证实中药抗肿瘤的作用机制,而且可作为一种天然载体解决中药溶解性差、生物利用度低等问题,在中药治疗肿瘤领域具有独特的不可取代的地位,有望为人类的生命健康事业做出更大的贡献。
利益冲突 所有作者均声明不存在利益冲突
[1] Siegel R L, Miller K D, Fuchs H E,. Cancer statistics, 2022 [J]., 2022, 72(1): 7-33.
[2] Xia C F, Dong X S, Li H,. Cancer statistics in China and United States, 2022: Profiles, trends, and determinants [J]., 2022, 135(5): 584-590.
[3] Kaymak I, Williams K S, Cantor J R,. Immunometabolic interplay in the tumor microenvironment [J]., 2021, 39(1): 28-37.
[4] Guerrero P A, McCarty J H. Integrins in vascular development and pathology [J]., 2018, 81: 129-153.
[5] Duffau H. Mapping the connectome in awake surgery for gliomas: An update [J]., 2017, 61(6): 612-630.
[6] Mota R C, Teller S, Muckenhuber A,. Neoadjuvant therapy remodels the pancreatic cancer microenvironment via depletion of protumorigenic immune cells [J]., 2020, 26(1): 220-231.
[7] Lin R J, Green D L, Shah G L. Therapeutic anticoagulation in patients with primary brain tumors or secondary brain metastasis [J]., 2018, 23(4): 468-473.
[8] Kaplanov I, Carmi Y, Kornetsky R,. Blocking IL-1β reverses the immunosuppression in mouse breast cancer and synergizes with anti-PD-1 for tumor abrogation [J]., 2019,116(4): 1361-1369.
[9] Deng L, Zhang H M, Zhang Y,. An exosome-mimicking membrane hybrid nanoplatform for targeted treatment toward Kras-mutant pancreatic carcinoma [J]., 2021, 9(16): 5599-5611.
[10] Dioufa N, Clark A M, Ma B,. Bi-directional exosome-driven intercommunication between the hepatic niche and cancer cells [J]., 2017, 16(1): 172.
[11] Koumangoye R B, Sakwe A M, Goodwin J S,. Detachment of breast tumor cells induces rapid secretion of exosomes which subsequently mediate cellular adhesion and spreading [J]., 2011, 6(9): e24234.
[12] Mu W, Rana S, Zöller M. Host matrix modulation by tumor exosomes promotes motility and invasiveness [J]., 2013, 15(8): 875-887.
[13] Luga V, Zhang L, Viloria-Petit A M,. Exosomes mediate stromal mobilization of autocrine Wnt-PCP signaling in breast cancer cell migration [J]., 2012, 151(7): 1542-1556.
[14] Zhou W Y, Fong M Y, Min Y F,. Cancer-secreted miR-105 destroys vascular endothelial barriers to promote metastasis [J]., 2014, 25(4): 501-515.
[15] Yang S J, Che S P Y, Kurywchak P,. Detection of mutant KRAS and TP53 DNA in circulating exosomes from healthy individuals and patients with pancreatic cancer [J]., 2017, 18(3): 158-165.
[16] Daßler-Plenker J, Küttner V, Egeblad M. Communication in tiny packages: Exosomes as means of tumor-stroma communication [J]., 2020, 1873(2): 188340.
[17] Beeraka N M, Doreswamy S H, Sadhu S P,. The role of exosomes in stemness and neurodegenerative diseases-chemoresistant-cancer therapeutics and phytochemicals [J]., 2020, 21(18): 6818.
[18] Piao Y J, Kim H S, Hwang E H,. Breast cancer cell-derived exosomes and macrophage polarization are associated with lymph node metastasis [J]., 2017, 9(7): 7398-7410.
[19] Weiner-Gorzel K, Dempsey E, Milewska M,. Overexpression of the microRNA miR-433 promotes resistance to paclitaxel through the induction of cellular senescence in ovarian cancer cells [J]., 2015, 4(5): 745-758.
[20] Wang H, Feng J G, Ao F,. Tumor-derived exosomal microRNA-7-5p enhanced by verbascoside inhibits biological behaviors of glioblastomaand[J]., 2020, 20: 569-582.
[21] Huang B L, Song B L, Xu C Q. Cholesterol metabolism in cancer: Mechanisms and therapeutic opportunities [J]., 2020, 2(2): 132-141.
[22] Du X, Wang J N, Sun J,. Steroidal glycoalkaloids frominhibit the pro-angiogenic activity of A549-derived exosomes [J]., 2020, 141: 104481.
[23] Shen K H, Liao A C, Hung J H,. α-Solanine inhibits invasion of human prostate cancer cell by suppressing epithelial-mesenchymal transition and MMPs expression [J]., 2014, 19(8): 11896-11914.
[24] Chen W X, Cheng L, Pan M,.-Rhamnose β-hederin against human breast cancer by reducing tumor-derived exosomes [J]., 2018, 16(4): 5172-5178.
[25] Jang J Y, Lee J K, Jeon Y K,. Exosome derived from epigallocatechin gallate treated breast cancer cells suppresses tumor growth by inhibiting tumor-associated macrophage infiltration and M2 polarization [J]., 2013, 13: 421.
[26] Osterman C J, Lynch J C, Leaf P,. Curcumin modulates pancreatic adenocarcinoma cell-derived exosomal function [J]., 2015, 10(7): e0132845.
[27] Nie J H, Li H, Wu M L,. Differential exosomic proteomic patterns and their influence in resveratrol sensitivities of glioblastoma cells [J]., 2019, 20(1): 191.
[28] Wei Y, Li M Z, Cui S F,. Shikonin inhibits the proliferation of human breast cancer cells by reducing tumor-derived exosomes [J]., 2016, 21(6): 777.
[29] Wang M, Qiu R, Yu S R,. Paclitaxel‑resistant gastric cancer MGC‑803 cells promote epithelial‑to‑mesenchymal transition and chemoresistance in paclitaxel‑sensitive cells via exosomal delivery of miR‑155‑5p [J]., 2019, 54(1): 326-338.
[30] Au Yeung C L, Co N N, Tsuruga T,. Exosomal transfer of stroma-derived miR21 confers paclitaxel resistance in ovarian cancer cells through targeting APAF1 [J]., 2016, 7: 11150.
[31] Guo Z H, Guo A Y, Zhou C. Breast cancer stem cell-derived ANXA6-containing exosomes sustain paclitaxel resistance and cancer aggressiveness in breast cancer [J]., 2021, 9: 718721.
[32] Chen C H, Yao X Q, Xu Y H,. Dahuang Zhechong Pill suppresses colorectal cancer liver metastasis via ameliorating exosomal CCL2 primed pre-metastatic niche [J]., 2019, 238: 111878.
[33] 李晶晶, 季青, 刘煊, 等. 滋阴化痰方调控肿瘤细胞来源外泌体对HUVECs管样分化的影响 [J]. 中医学报, 2021, 36(1): 118-125.
[34] Wang X J, Qi Y D, Guan H C,. Gegen Qinlian Decoction ameliorates hyperuricemia-induced renal tubular injury via blocking the inflammatory signaling pathway [J]., 2021, 12: 665398.
[35] Zha Z, Gao Y F, Ji J,. Bu Shen Yi Sui capsule alleviates neuroinflammation and demyelination by promoting microglia toward M2 polarization, which correlates with changes in miR-124 and miR-155 in experimental autoimmune encephalomyelitis [J]., 2021, 2021: 5521503.
[36] He D, Xu X Y, Li L X,. Functional exosome-mediated delivery of triptolide endowed with targeting properties as chemotherapy carriers for ovarian carcinoma [J]., 2021, 17(3): 426-438.
[37] Yao Y, Fu C M, Zhou L,. DC-derived exosomes for cancer immunotherapy [J]., 2021, 13(15): 3667.
[38] Melnik B C, John S M, Schmitz G. Milk: An exosomal microRNA transmitter promoting thymic regulatory T cell maturation preventing the development of atopy? [J]., 2014, 12: 43.
[39] González-Sarrías A, Iglesias-Aguirre C E, Cortés-Martín A,. Milk-derived exosomes as nanocarriers to deliver curcumin and resveratrol in breast tissue and enhance their anticancer activity [J]., 2022, 23(5): 2860.
[40] Munagala R, Aqil F, Jeyabalan J,. Bovine milk-derived exosomes for drug delivery [J]., 2016, 371(1): 48-61.
Research progress on traditional Chinese medicine affecting tumor therapy based on exosomes
REN Wen-jing, LI Zhao-xia, QIU Feng
School of Traditional Chinese Medicine, Capital Medical University, Beijing 100069, China
Traditional Chinese medicine (TCM) has been widely accepted as the mainstream complementary and alternative therapy of modern cancer therapy. However, the material bases and action mechanisms of many TCM with exact anti-tumor efficacy could not be clearly clarified by using the antagonistic medical thinking till now. As endogenous substances, exosomes not only participate in the communication between tumor microenvironment and other tissues and organs, but also act as an intermediary substance to affect tumor therapy. Mechanisms on indirect anti-tumor action of TCM via exosomes and usage of exosomes as the carriers of TCM to expand the clinical efficacy and application of anti-tumor TCM were mainly reviewed in this paper, in order to explore more effective components and clarify the complex mechanisms of anti-tumor TCM to promote the development of TCM in the field of tumor therapy.
traditional Chinese medicine; active ingredient; tumor therapy; tumor microenvironment; exosome; carrier
R282.710.5
A
0253 - 2670(2022)22 - 7234 - 08
10.7501/j.issn.0253-2670.2022.22.028
2022-06-20
国家自然科学基金面上项目(82174062);国家自然科学基金面上项目(81573682)
任文静(1997—),硕士研究生,研究方向为中药药动学。Tel: (010)83911635 E-mail: 122021010565@mail.ccmu.edu.cn
仇 峰,副教授,硕士生导师,博士,研究方向为中药药动学。Tel: (010)83911635 E-mail: qiufeng@ccmu.edu.cn
[责任编辑 崔艳丽]
——外泌体与老年慢性疾病相关性的研究进展

