基于特征图谱与5种成分含量的经典名方桃红四物汤量值传递分析
杜克群,成颜芬,李敏敏,江华娟,马 川,黄成武,张羽斌,王团结,何 瑶*,傅超美*
基于特征图谱与5种成分含量的经典名方桃红四物汤量值传递分析
杜克群1,成颜芬1,李敏敏1,江华娟1,马 川1,黄成武2,张羽斌2,王团结3, 4,何 瑶1*,傅超美1*
1. 成都中医药大学药学院 西南特色中药资源国家重点实验室,四川 成都 611137 2. 贵州益佰制药股份有限公司,贵州 贵阳 550008 3. 江苏康缘药业股份有限公司,江苏 连云港 222001 4. 中药制剂过程新技术国家重点实验室,江苏 连云港 222001
探索桃红四物汤(Taohong Siwu Decoction,TSD)药材-饮片-水煎液-基准样品的全过程质量传递规律,为其经典名方制剂质量控制研究提供基础。制备15批TSD水煎液、基准样品,建立水煎液、基准样品超高效液相色谱(ultra performance liquid chromatography,UPLC)特征图谱,并采用高效液相色谱(high performance liquid chromatography,HPLC)法测定5种指标性成分的含量,计算各成分在药材-饮片-水煎液-基准样品传递过程中的转移率。15批TSD水煎液和基准样品的特征图谱,相似度均>0.9,共归属20个共有峰,经与对照品比对指认出11个色谱峰,分别为没食子酸、地黄苷D、苦杏仁苷、绿原酸、芍药苷、羟基红花黄色素A、阿魏酸、毛蕊花糖苷、槲皮素、苯甲酰芍药苷、藁本内酯。5种成分在水煎液、基准样品中的质量分数分别为地黄苷D 0.26~0.46、0.11~0.30 mg/g,阿魏酸0.33~0.51、0.09~0.18 mg/g,芍药苷1.07~2.43、0.48~1.49 mg/g,苦杏仁苷1.66~2.31、0.60~1.58 mg/g,羟基红花黄色素A 0.98、0.26~0.44 mg/g。药材至饮片、饮片至水煎液、水煎液至基准样品的平均转移率分别为地黄苷D 101.50%、55.44%、64.11%;阿魏酸94.31%(当归药材至饮片)、93.91%(川芎药材至饮片)、37.24%、35.61%;芍药苷111.55%、72.80%、63.48%;苦杏仁苷117.34%、91.78%、64.60%;羟基红花黄色素A 93.64%、60.23%、34.19%。采用UPLC特征图谱结合5种成分的HPLC含量测定,分析TSD药材-饮片-水煎液-基准样品的量值传递规律,为TSD经典名方制剂开发和质量控制提供科学基础。
经典名方;桃红四物汤;基准样品;特征图谱;含量测定;量值传递;没食子酸;地黄苷D;苦杏仁苷;绿原酸;芍药苷;羟基红花黄色素A;阿魏酸;毛蕊花糖苷;槲皮素;苯甲酰芍药苷;藁本内酯;UPLC;HPLC;质量控制
桃红四物汤(Taohong Siwu Decoction,TSD)是《古代经典名方目录(第一批)》第97号方剂,也是首批公布关键信息的7首经典名方之一[1]。该方出自清·柴得华所著《妇科冰鉴》,由酒地黄、酒当归、酒白芍、燀桃仁、川芎及酒红花组成,功效为养血、活血、逐瘀,主治血虚血瘀证[2]。方中生地滋阴生血、活血祛瘀,酒炙后可增强其活血作用;当归养血活血,此方中以活血为主,二者共为君药;其余四味均为臣药:白芍敛阴养血;川芎活血行滞;加入活血祛瘀的红花、桃仁,增强全方活血化瘀的作用。基于其传统功效,TSD在临床上用于治疗月经不调、骨折、深静脉血栓、黄褐斑、冠心病心绞痛等妇科、骨科、内科疾病,应用广泛且具有显著疗效[3]。
经典名方复方制剂研发是近年来中药新药研究的热点,国家药品监督管理局药品审评中心发布的《按古代经典名方目录管理的中药复方制剂药学研究技术指导原则(试行)》[4],提出要重视“基准样品研究”,并对药材、饮片、中间体、基准样品、制剂开展相关性研究。以基准样品承载古代经典名方的有效性、安全性,制剂研究应以制剂质量与基准样品质量基本一致为目标。基准样品量值传递研究是目前实现制剂质量相关性研究的重要基础,为全面控制经典名方制剂质量提供依据。国内研究者采用特征图谱和多成分含量测定对枳实薤白桂枝汤[5]、桃核承气汤[6]、当归四逆汤[7]、竹叶石膏汤[8]等经典名方开展了量值传递研究,以特征峰和指标性成分的含量对样品中成分进行表征。本课题组进行TSD经典名方制剂研究,前期系统开展了TSD古籍文献考证、饮片炮制工艺研究[9]、质量标志物预测[10-11]、煎煮工艺优化[12]等研究。本实验在此基础上,制备15批TSD水煎液、基准样品,建立其UPLC特征图谱,并以HPLC法测定5个指标性成分地黄苷D、阿魏酸、芍药苷、苦杏仁苷、羟基红花黄色素A的含量,全面分析TSD药材-饮片-水煎液-基准样品传递过程中的量值传递规律,为经典名方TSD复方制剂的后续质量控制和研究开发奠定基础。
1 仪器与材料
1.1 仪器
Thermo Ultimate 3000型高效液相色谱仪(8321033DAD检测器,7120988四元泵,8738269自动进样器,6280773柱温箱)、Thermo Ultimate 3000型超高效液相色谱仪(6092427DAD检测器,8175463四元泵,8163902自动进样器,8527201柱温箱),美国Thermo Fisher公司;FTS-10A型陶瓷煎药锅,潮州市一壶百饮电器实业有限公司;N-1100型旋转蒸发仪,上海泉杰仪器有限公司;KQ5200DE型数控超声波清洗器,昆山市超声仪器有限公司;DZF6020型真空干燥机,宁波新芝生物科技股份有限公司,LC-LX-H185C型台式高速离心机,上海力辰科技有限公司。
1.2 试剂与试药
对照品地黄苷D(批号wkq21043009)、羟基红花黄色素A(批号wkq21070209)、芍药苷(批号wkq21040203)、阿魏酸(批号wkq21010504)、苦杏仁苷(批号wkq21032412)、没食子酸(批号wkq20101503)、绿原酸(批号wkq21040904)、毛蕊花糖苷(批号wkq21040708)、槲皮素(批号wkq20061112)、苯甲酰芍药苷(批号wkq20022409)、藁本内酯(批号wkq20012006),各对照品均购自四川省维克奇生物科技有限公司,质量分数均≥98%,符合要求。水为纯化水或Milli-Q超纯水;甲醇和磷酸为HPLC级,其他试剂均为分析纯,购于成都市科隆化学品有限公司。
药材信息:生地黄购自河南省焦作市武陟县(批号20073101~20073115),当归购自青海省西宁市大通县(批号20091501~20091515),白芍购自四川省德阳市中江县(批号20100101~20100115),川芎购自四川省都江堰市(批号20073101~20073115),桃仁购自陕西省宝鸡市千阳县(批号20120501~20120515),红花购自新疆省伊犁州霍城县(批号20091601~20091615),经成都中医药大学裴瑾教授鉴定,各药材均符合《中国药典》2020年版一部相关项下的性状规定,鉴定结果地黄为玄参科地黄属植物地黄Libosch.的干燥块根,当归为伞形科当归属植物当归(Oliv.) Diels的干燥根,白芍为毛茛科芍药属植物芍药Pall.的干燥根,川芎为伞形科藁本属植物川芎Hort.的干燥根茎,桃仁为蔷薇科桃属植物桃(L.) Batsch.的干燥成熟种子,红花为菊科红花属植物红花L.的干燥花。饮片规格:按照国家发布的“TSD关键信息”,经课题组前期研究确定6味饮片炮制工艺[9],制备出酒地黄、酒当归、酒白芍、川芎生品、燀桃仁、酒红花六味饮片,批次同上。
2 方法与结果
2.1 15批TSD水煎液、基准样品的制备
2.1.1 水煎液的制备 根据随机数字表法对6味饮片进行随机组合及排序,15批TSD水煎液对应饮片批次如表1所示。按照关键信息公布的处方剂量及课题组前期研究得到的煎煮方法[11]制备:称取饮片3倍量,即酒地黄33.57 g、酒当归44.76 g、酒白芍16.8 g、川芎11.19 g、燀桃仁11.34 g、酒红花11.19 g,置陶瓷锅中,加10倍量水,放置浸泡30 min,充分润湿,武火煮沸后,转文火保持微沸60 min,待药液冷却至80 ℃时,采用200目过滤纱布进行滤过,煎煮2次,3层纱布滤过,合并2次滤液,调整滤液体积至2000 mL,得TSD水煎液(S1~S15)。
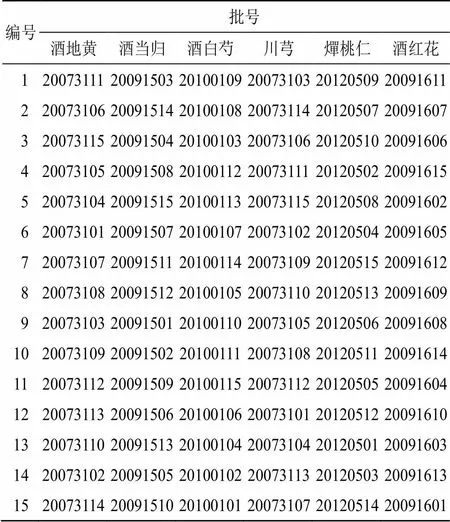
表1 15批TSD饮片随机组合信息
2.1.2 基准样品的制备 分别取“2.1.1”项水煎液1800 mL,−0.1 MPa,50 ℃旋转蒸发浓缩至相对密度约为1.17(50 ℃)的浸膏,再在−0.09 MPa,50 ℃条件下减压干燥3 d,得TSD基准样品(J1~J15)。
2.2 TSD水煎液及基准样品特征图谱的建立
2.2.1 色谱条件 Thermo Hypersil Gold C18色谱柱(100 mm×2.1 mm,1.9 μm);流动相为甲醇-0.1%磷酸水溶液,梯度洗脱:0~5 min,3%甲醇;5~35 min,3%~33%甲醇;35~40 min,33%~37%甲醇;40~45 min,37%~46%甲醇;45~65 min,46%~90%甲醇;柱温30 ℃;体积流量0.3 mL/min;进样量10 μL;检测波长为210 nm。
2.2.2 对照品溶液的制备 精密称取地黄苷D、阿魏酸、芍药苷、苦杏仁苷、羟基红花黄色素A、没食子酸、绿原酸、毛蕊花糖苷、槲皮素、苯甲酰芍药苷、藁本内酯对照品,以甲醇为溶剂,充分溶解后定容至10 mL,配成质量浓度分别为555.0、130.0、545.0、477.5、1370.0、675.0、390.0、480.0、650.0、475.0、575.0 μg/mL的各对照品溶液。
2.2.3 供试品溶液的制备
(1)TSD水煎液供试品溶液:吸取2 mL水煎液,0.22 μm微孔滤膜滤过,即得。
(2)TSD基准样品供试品溶液:称取5 g基准样品于锥形瓶中,精密加入纯水50 mL,密封后超声30 min。超声后,补足减失的质量,全部转移至50 mL离心管内,10 000 r/min离心(离心半径为16 cm)10 min,取上清液过0.22 μm微孔滤膜,即得。
(3)单味药材、饮片供试品溶液[13]:分别称取各单味药材、饮片10 g,置于圆底烧瓶中,加入100 mL去离子水,放置浸泡30 min,充分润湿,武火煮沸后转文火加热回流60 min,待药液冷却至80 ℃时,趁热用3层200目尼龙纱布滤过,加热回流2次,合并2次提取液,冷却后加去离子水定容体积至200 mL,取2 mL过0.22 μm微孔滤膜,即得。
(4)阴性供试品溶液:按照“2.1.1”项下方法分别制备缺酒地黄、缺酒当归、缺川芎、缺酒当归和川芎、缺酒白芍、缺燀桃仁、缺酒红花的TSD阴性样品溶液,取2 mL过0.22 μm微孔滤膜,即得。
2.2.4 精密度考察 取TSD基准样品(J1)供试品溶液,按照“2.2.1”项下色谱条件,连续进样6次,记录各色谱峰的保留时间和峰面积,以峰面积较大且传递稳定的13号峰(阿魏酸)为参照峰,计算各共有峰相对保留时间及相对峰面积,结果各共有峰相对保留时间的RSD均小于0.14%,相对峰面积的RSD均小于2.89%,表明仪器的精密度良好。
2.2.5 稳定性考察 取TSD基准样品(J1)供试品溶液,按照“2.2.1”项下色谱条件,分别在制备后0、2、4、8、12、24 h进样,记录各色谱峰的保留时间和峰面积,以13号峰(阿魏酸)为参照峰,计算各共有峰相对保留时间及相对峰面积,结果各共有峰相对保留时间的RSD均小于0.42%,相对峰面积的RSD均小于2.60%,表明TSD基准样品供试品溶液在24 h内保持稳定。
2.2.6 重复性考察 取TSD基准样品(J1),采用“2.2.3(2)”项下方法平行制备供试品溶液6份,按照“2.2.1”项下色谱条件进样,记录各色谱峰的保留时间和峰面积,以13号峰(阿魏酸)为参照峰,计算各共有峰相对保留时间及相对峰面积,结果各共有峰相对保留时间的RSD均小于0.65%,相对峰面积的RSD均小于3.28%,表明该测定方法重复性良好。
2.2.7 指纹图谱的建立及相似度分析 将15批TSD水煎液(S1~S15)及基准样品(J1~J15)的特征图谱以cdf格式分别导入《中药色谱指纹图谱相似度评价系统》(2012A版),以S1或J1特征图谱为对照,采用中位数法,时间窗宽度为0.2 min,多点校正后,进行全峰匹配,生成TSD水煎液和基准样品特征图谱共有模式(R),结果见图1、2。水煎液与基准样品均标定到前19个特征峰,第20号峰(藁本内酯)未从水煎液传递到基准样品。通过与对照品比对,指认了其中11个成分,结果见图3。对15批TSD水煎液及基准样品特征图谱进行相似度分析,结果表明,TSD水煎液样品(S1~S15)特征图谱与其对照特征图谱的相似度分别为0.929、0.939、0.966、0.978、0.982、0.963、0.974、0.980、0.987、0.989、0.988、0.977、0.981、0.992、0.960,均>0.9;15批TSD基准样品(J1~J15)特征图谱与其对照特征图谱的相似度分别为0.942、0.946、0.925、0.959、0.916、0.968、0.979、0.921、0.969、0.970、0.971、0.949、0.972、0.951、0.971,均>0.9。

图1 15批TSD水煎液(S1~S15)的UPLC特征图谱及对照特征图谱(R)

图2 15批TSD基准样品(J1~J15)的UPLC特征图谱及对照特征图谱(R)

3-没食子酸 4-地黄苷D 7-苦杏仁苷 9-绿原酸 10-芍药苷 12-羟基红花黄色素A 13-阿魏酸 15-毛蕊花糖苷 17-槲皮素 18-苯甲酰芍药苷 20-藁本内酯
2.2.8 特征图谱量值传递关系分析 将水煎液、基准样品与阴性样品、单味药材和单味饮片的特征图谱进行比对,对标定的20个特征峰进行归属,见图4、5。结果表明,1、4(地黄苷D)、11、15(毛蕊花糖苷)号峰来源于地黄,2、13(阿魏酸)、20(藁本内酯)号峰来源于当归和川芎,3(没食子酸)号峰为白芍和红花共有,6号峰为当归和白芍共有,7(苦杏仁苷)号峰来源于桃仁,9(绿原酸)号峰为当归、川芎和红花共有,8、12(羟基红花黄色素A)、14、16、17(槲皮素)号峰来源于红花,10(芍药苷)、18(苯甲酰芍药苷)号峰来源于白芍,19号峰来源于川芎。5号峰在除白芍外的5味中药中均有出现,推测可能为极性相似的一类化合物,有待进一步研究。

图4 TSD基准样品(J1)、水煎液(S1)与单味药材、单味饮片的UPLC图谱
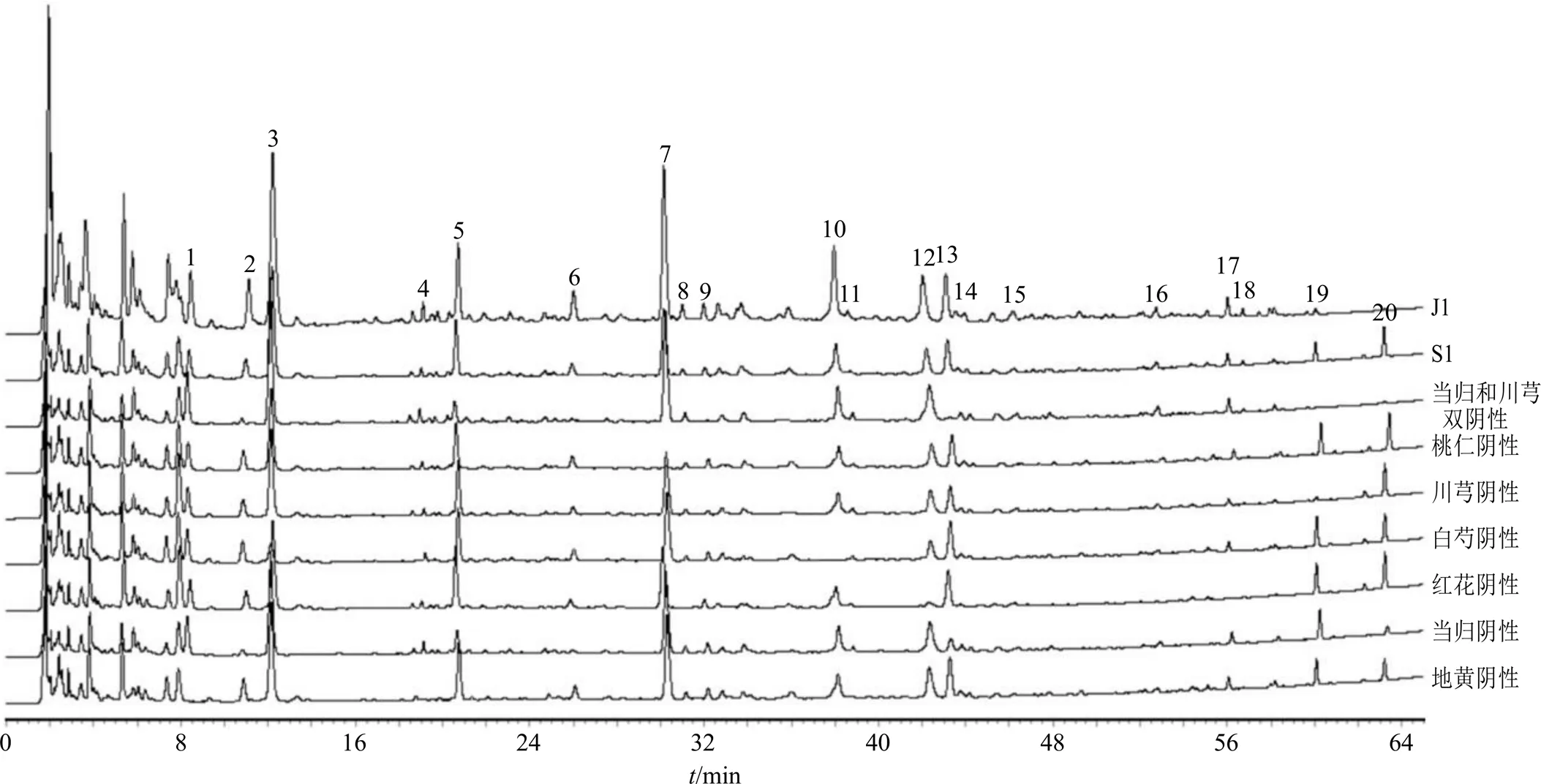
图5 TSD基准样品(J1)、水煎液(S1)与阴性样品的UPLC图谱
水煎液与基准样品是重要的制剂中间体,为了更加明确水煎液到基准样品的特征图谱传递规律,比较了水煎液、基准样品已指认特征峰相对峰面积的差异,相对峰面积可以反映成分含量在药物中的比例。以峰面积较大且传递稳定的阿魏酸(S峰)为参照,计算15批TSD水煎液、基准样品中另10个已指认特征峰的相对峰面积,结果见表2。结果表明,TSD中大部分已指认特征峰可以以稳定的比例从水煎液传递到基准样品。

表2 TSD水煎液(S)-基准样品(J)中已指认特征峰相对峰面积的传递
某批次某特征峰的相对峰面积=某批次某特征峰的峰面积/同一批次S峰的峰面积
2.3 TSD中5种成分的含量测定
2.3.1 色谱条件[14]Thermo Hypersil Gold C18色谱柱(250 mm×4.6 mm,5 μm);流动相为甲醇-0.1%磷酸水溶液,梯度洗脱:0~10 min,5%~13%甲醇;10~15 min,13%~22%甲醇;15~20 min,22%甲醇;20~40 min,22%~34%甲醇;40~55 min,34%~46%甲醇;柱温25 ℃;体积流量1 mL/min;进样量10 μL;检测波长为210 nm。
2.3.2 供试品溶液的制备 分别称取3倍处方量的各单味药材及饮片,按照“2.2.3(1)”项下水煎液的制备方法制备各单味药材、饮片供试品溶液,水煎液、基准样品供试品溶液的制备方法与“2.2.3”项下供试品溶液的制备方法一致。
2.3.3 对照品溶液的制备 精密称取地黄苷D、阿魏酸、芍药苷、苦杏仁苷、羟基红花黄色素A对照品,分别用甲醇充分溶解后转移至5 mL量瓶中,定容至刻度,配成质量浓度分别为1.270、1.054、4.020、3.822、5.200 mg/mL的对照品母液,用甲醇将母液分别稀释成所需质量浓度,对照品与样品的色谱图见图6。
2.3.4 线性关系考察 按照二倍稀释法将指标性成分对照品母液分别稀释2、4、8、16、32、64倍,制得系列质量浓度的对照品溶液,按照“2.3.1”项下色谱条件进样,以质量浓度为横坐标(),峰面积为纵坐标(),绘制标准曲线并计算回归方程,结果见表3。
2.3.5 精密度考察 取TSD基准样品(J1)供试品溶液1份,按照“2.3.1”项下色谱条件,连续进样6次,计算各指标性成分峰面积的RSD值,结果见表3,表明仪器精密度良好。
2.3.6 稳定性考察 取TSD基准样品(J1)供试品溶液1份,按照“2.3.1”项下色谱条件,分别于制备后0、2、4、8、12、24 h进样,计算各指标性成分峰面积的RSD值,结果见表3,表明供试品溶液在24 h内稳定性良好。
2.3.7 重复性考察 取TSD基准样品(J1),采用“2.2.3(2)”项下方法平行制备供试品溶液6份,按照“2.3.1”项下色谱条件分别进样,计算各指标性成分质量分数的RSD值,结果见表3,表明该方法重复性良好。

1-地黄苷D 2-苦杏仁苷 3-羟基红花黄色素A 4-芍药苷 5-阿魏酸
2.3.8 加样回收率考察 精密称取已知指标成分含量的TSD基准样品(J1,含地黄苷D 4.90 mg、阿魏酸3.95 mg、芍药苷20.17 mg、苦杏仁苷23.90 mg、羟基红花黄色素A 3.21 mg)约5 g,置锥形瓶中,分别按样品中各成分含量的100%水平加入地黄苷D、阿魏酸、羟基红花黄色素A、芍药苷、苦杏仁苷5种对照品溶液,按“2.2.3(2)”项下方法平行制备6份供试品溶液,采用“2.3.1”项下色谱条件分别进样,进行含量测定,计算5种指标成分的加样回收率及RSD值,结果见表3,表明该方法加样回收率良好。
2.3.9 样品含量测定及量值传递关系分析 按照“2.3.1”项下色谱条件将TSD 15批药材、饮片、水煎液、基准样品分别进样。测定出各样品的指标性成分含量(换算为生药中的含量,便于比较、计算转移率),并按以下公式计算药材-饮片-水煎液-基准样品中指标成分的转移率。结果见表4~6。其中水煎液中阿魏酸的转移率为水煎液中阿魏酸的质量分数与对应批次当归、川芎饮片中阿魏酸质量分数之和的比值。

表3 含量测定方法学考察结果
转移率(药材-饮片)=饮片中指标成分含量/对应批次药材中指标成分含量
转移率(饮片-水煎液)=水煎液中指标成分含量×全方饮片量/(对应批次饮片中指标成分含量×单味饮片量)
转移率(水煎液-基准样品)=基准样品中指标成分含量/对应批次水煎液中指标成分含量
(1)5种成分在药材-饮片的量值传递分析:酒地黄中地黄苷D平均转移率为101.50%,酒当归中阿魏酸平均转移率为94.31%,酒白芍中芍药苷转移率平均转移率为111.55%,川芎饮片中阿魏酸平均转移率为93.91%,燀桃仁中苦杏仁苷的平均转移率为117.34%,酒红花中羟基红花黄色素A平均转移率为93.64%。
结果发现,3个批次的酒白芍饮片中芍药苷和4个批次的燀桃仁饮片中苦杏仁苷转移率未在平均值的70%~130%,说明芍药苷和苦杏仁苷在炮制过程中可能受白芍炒制温度、炒制时间或者桃仁浸泡时间的影响较大。6味药材与其对应炮制饮片的成分转移率结果表明,课题组研究确定的炮制工艺较稳定,5种成分含量波动基本在合理范围内。
(2)5种成分在饮片-水煎液的量值传递分析:TSD水煎液中地黄苷D的质量分数为0.26~0.46 mg/g,饮片-水煎液平均转移率为55.44%;阿魏酸的质量分数为0.33~0.51 mg/g,饮片-水煎液平均转移率为37.24%;芍药苷的质量分数为1.07~2.43 mg/g,饮片-水煎液平均转移率为72.80%;苦杏仁苷的质量分数为1.66~2.31 mg/g,饮片-水煎液平均转移率为91.78%;羟基红花黄色素A的质量分数为0.98 mg/g,饮片-水煎液平均转移率为60.23%。结果发现,5种成分含量在饮片-水煎液传递过程中未出现离散值,表明煎煮过程成分能稳定传递。

表4 TSD药材、饮片中指标成分含量及转移率

表5 TSD饮片、水煎液中指标成分含量及转移率
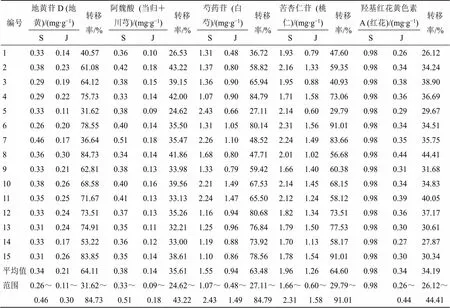
表6 TSD水煎液(S)、基准样品(J)中指标成分含量及转移率
(3)5种成分在水煎液-基准样品的量值传递分析:TSD基准样品中地黄苷D的质量分数为0.11~0.30 mg/g,水煎液-基准样品平均转移率为64.11%;阿魏酸的质量分数为0.09~0.18 mg/g,水煎液到基准样品的平均转移率为35.61%;芍药苷的质量分数为0.48~1.49 mg/g,水煎液到基准样品的平均转移率为63.48%;苦杏仁苷的质量分数为0.60~1.58 mg/g,水煎液到基准样品的平均转移率为64.60%;羟基红花黄色素A的质量分数为0.26~0.44 mg/g,水煎液到基准样品的平均转移率为34.19%。
结果发现,各成分从水煎液转移到基准样品时,地黄苷D有3个批次、芍药苷有2个批次、苦杏仁苷有4个批次的转移率超出均值的70%~130%。提示水煎液至基准样品的制备过程对基准样品的质量影响较大,制剂生产时需重点关注。
3 讨论
经典名方制剂研发是促进中医药传承创新发展的重要举措,是近年来中药新药研发的热点[15]。从2008年《中药注册管理补充规定》首次提出经典名方以来,国家相继发布了多个政策支持经典名方制剂研究,经典名方复方制剂的研究要求日渐清晰。经典名方基准样品与药材、饮片、水煎液的相关性研究,是有效控制其质量波动范围,确保基准样品与制剂质量一致性的重要途径[16]。本研究通过TSD药材-饮片-水煎液-基准样品的量值传递研究,开展了相关性分析并初步确定了水煎液、基准样品的质量波动范围,为后续TSD制剂生产奠定了基础。
在药材产地选择方面,2020年11月,国家药品审评中心发布《按古代经典名方目录管理的中药复方制剂药学研究技术指导原则(试行)》,指出“应对药材进行资源评估”“确定优质药材的产地、生长年限、采收期、产地加工等信息”“鼓励使用优质药材为原料进行研究和生产”。课题组前期已针对TSD 6味药的产地等信息进行了考证,并对3个产地(药材的产地在道地产区和/或主产区中选择)共18个批次药材的质量进行研究分析,确定了优质药材的产地等信息。最后选取购买了15批次确定产地等信息的优质药材,开展此次TSD基准样品量值传递研究。
本实验通过特征图谱量值传递研究发现,大部分特征峰在药材、饮片、水煎液与基准样品间可以较为完整地传递。水煎液至基准样品的传递过程中除藁本内酯外,各成分相对峰面积的比例关系相似,说明特征图谱能够在水煎液-基准样品过程中较为稳定传递。藁本内酯是当归、川芎挥发油中的主要药效成分,具有扩张血管、抑制血小板聚集和血栓形成、镇痛等药理作用[17]。本研究中,在基准样品中未检测到藁本内酯,说明从水煎液–基准样品制备过程中,藁本内酯大量损失,且高效液相色谱仪有一定的检测限,故未能检测出藁本内酯。经典名方制剂研发,要求“遵古”,《妇科冰鉴》中记载其制备方法为“水煎温服”,与大多数“水煎”的经典名方一样,本研究采用了水煎煮的制备方法,未进行挥发油或蒸馏液的收集,藁本内酯在浓缩和干燥过程中损失较大[18]。因而,后续研究中,需重点关注藁本内酯等挥发性成分的传递特征,必要情况下对制剂工艺进行合理优化和调整。
关于含量测定指标成分的选择,本文基于课题组前期质量标志物的筛选[12]确定地黄苷D、阿魏酸、苦杏仁苷、芍药苷、羟基红花黄色素A 5个成分作为含量测定指标成分探索TSD量值传递规律。同时这5个成分也是《中国药典》2020年版中规定的含测指标成分[19]。地黄苷D作为《中国药典》2020年版首次收载的含测指标成分,在地黄的炮制加工过程中较梓醇稳定,且含量较高,特征明显,更适宜作为质量控制标准物质[20],现代药理学研究也表明其具有补血和降血糖等药理作用,是地黄的药效成分[21];阿魏酸是当归和川芎的有效成分,具有抗氧化和抗血小板凝聚等作用[22];芍药苷作为白芍的主要成分,具有补血、调节人体免疫功能等作用[23];桃仁主要药效成分苦杏仁苷具有抗凝血及镇痛等作用[24];羟基红花黄色素A是红花功效成分且含量较高,具有抗血小板聚集等药理作用[25]。
5个成分的量值传递研究发现,部分批次药材至饮片的成分转移率超过100%,可能是从药材到饮片的炮制过程中存在杂质、药材碎屑、水分的减少,计算时未考虑到炮制过程饮片的得率。同时,炮制过程中部分批次药材至饮片芍药苷和苦杏仁苷的转移率出现离散值,提示芍药苷和苦杏仁苷是炮制过程中应重点关注的成分。芍药苷、苦杏仁苷均易溶于水,有研究表明浸泡过程对白芍中芍药苷、桃仁中苦杏仁苷的含量影响较大[26-27],故2种药材均不宜久泡。针对本研究购买的15批白芍药材的性状情况,不同批次的白芍软硬程度不一,桃仁种皮剥落难易程度不一,故在相同的浸泡时间下,成分浸出损失的程度不一。此前该炮制工艺已经过企业验证,炮制出的饮片也经过质检部门检验合格,此次量值传递研究提示在饮片炮制环节还应重视浸泡时间、药材性状对饮片质量的影响,考虑是否根据实际情况调整浸泡时间,或将不同批次的药材勾兑后投料,确保后续饮片和制剂质量的均一和稳定。
饮片至水煎液的传递过程中,成分的转移率未出现离散值,说明煎煮过程成分的含量转移较稳定,煎煮过程对成分的影响较小。水煎液–基准样品指标性成分转移率结果中,除阿魏酸、羟基红花黄色素A外,另3个成分均有少量批次的转移率不在均值的70%~130%,说明其他成分受浓缩、干燥过程有一定影响。一方面可能是TSD君药地黄含有大量多糖,在水煎液制备成基准样品的过程中,由于溶液的不断浓缩,溶液黏度增大,成分分布可能不均匀;另一方面干燥后的浸膏中会析出大量的糖晶,经粉碎后仍有细小糖晶微粒,可能也是造成成分分布不均的主要原因。在基准样品的干燥方法选择时,课题组考虑到与企业工业生产的衔接,采用低温减压干燥方法,出现个别批次离散度超出规定范围,表明减压干燥方法能够基本确保基准样品质量稳定性,但是制剂工艺过程中需要严格控制相关参数,并动态监控成分含量。
利益冲突 所有作者均声明不存在利益冲突
[1] 国家中医药管理局. 关于发布《古代经典名方关键信息考证原则》《古代经典名方关键信息表(7首方剂)》的通知[EB/OL]. (2020-10-15) [2020-11-10]. http://kjs. satcm.gov.cn/zhengcewenjian/2020-11-10/18132.html.
[2] 清·柴得华. 妇科冰鉴 [M]. 于峥, 魏民, 杨威校注. 北京: 人民军医出版社, 2012: 5.
[3] 杜克群, 江华娟, 李敏敏, 等. 基于文献计量学的桃红四物汤临床应用研究现状分析 [J]. 中药与临床, 2020, 11(6): 87-91.
[4] 国家药品监督管理局药品审评中心. 国家药监局药审中心关于发布《按古代经典名方目录管理的中药复方制剂药学研究技术指导原则(试行)》的通告 (2021年第36号) [EB/OL]. [2021-8-27]. https://www.cde.org.cn/ main/news/viewInfoCommon/1c18dd163e7c9221786e5469889367d0.
[5] 徐瑞杰, 薛蓉, 梅茜, 等. 经典名方枳实薤白桂枝汤物质基准的量值传递研究 [J]. 中草药, 2022, 53(9): 2650-2658.
[6] 刘雨涵, 关雅戈, 韩晨, 等. 经典名方桃核承气汤物质基准关键质量属性传递规律分析 [J]. 中草药, 2022, 53(7): 2011-2021.
[7] 许金国, 梅茜, 夏金鑫, 等. 经典名方当归四逆汤物质基准量值传递分析 [J]. 中草药, 2021, 52(21): 6501-6509.
[8] 葛威, 刘小康, 王康宇, 等. 经典名方竹叶石膏汤的物质基准量值传递分析 [J]. 中草药, 2021, 52(11): 3239-3248.
[9] 王升菊, 郑雨, 段赟, 等. 基于组方药味古今炮制工艺的经典名方桃红四物汤质量差异性研究 [J]. 中草药, 2021, 52(14): 4201-4209.
[10] 聂欣, 成颜芬, 王琳, 等. 桃红四物汤化学成分、药理作用、临床应用的研究进展及质量标志物的预测分析 [J]. 中国实验方剂学杂志, 2020, 26(4): 226-234.
[11] 江华娟, 李敏敏, 何瑶, 等. 基于HPLC指纹图谱和化学模式识别的经典名方桃红四物汤制备过程质量评价研究 [J]. 中草药, 2021, 52(4): 1000-1010.
[12] 何瑶, 江华娟, 成颜芬, 等. 基于Box-Behnken设计-响应面法与质量综合评价优化经典名方桃红四物汤煎煮工艺 [J]. 中草药, 2021, 52(22): 6845-6855.
[13] 齐琪, 赵玥瑛, 张晴, 等. 经典名方小承气汤的物质基准量值传递研究 [J]. 中草药, 2021, 52(10): 2927-2937.
[14] 成颜芬, 江华娟, 王琳, 等. 经典名方桃红四物汤化学指纹图谱及9种成分含量测定研究 [J]. 中草药, 2020, 51(3): 653-661.
[15] 张鹏, 刘安, 邬兰, 等. 经典名方概述与开发探讨 [J]. 中国实验方剂学杂志, 2020, 26(15): 183-194.
[16] 黄仕文, 颜媛媛, 嵇晶, 等. 经典名方质量研究及其量值传递关键技术 [J]. 南京中医药大学学报, 2021, 37(3): 446-449.
[17] 姚楠, 王志旺, 付晓艳, 等. 当归挥发油及其苯酞类成分对平滑肌作用的研究进展 [J]. 中国现代应用药学, 2019, 36(21): 2738-2742.
[18] 陈健, 张越, 崔小兵, 等. 基于多成分质量控制的温经汤制备工艺研究 [J]. 中草药, 2021, 52(2): 404-412.
[19] 中国药典 [S]. 一部. 2020: 91-339.
[20] 付国辉, 杜鑫. 地黄化学成分及药理作用研究进展 [J]. 中国医药科学, 2015, 5(15): 39-41.
[21] 李更生, 刘明, 王慧森, 等. 生地黄与熟地黄中地黄苷A、D的比较分析 [J]. 中成药, 2008, 30(1): 93-96.
[22] 邹全飞, 马坤, 陆榕. 阿魏酸药动学研究进展 [J]. 药物评价研究, 2013, 36(4): 297-301.
[23] 王成龙. 基于白芍养血柔肝功效的芍药苷、芍药内酯苷药理作用研究 [D]. 北京: 北京中医药大学, 2017.
[24] 许筱凰, 李婷, 王一涛, 等. 桃仁的研究进展 [J]. 中草药, 2015, 46(17): 2649-2655.
[25] 牛芬溪, 刘悦, 刘雅楠, 等. 羟基红花黄色素A的药理作用及研究进展 [J]. 中国药学杂志, 2021, 56(17): 1372-1377.
[26] 于定荣, 邓志灏, 翁小刚, 等. 炮制加工对白芍中9个成分含量的影响 [J]. 中药材, 2020, 43(12): 2909-2913.
[27] 张晓男, 魏惠珍, 吕尚, 等. 多指标综合评分法优化桃仁“燀”炮制工艺 [J]. 中华中医药杂志, 2020, 35(1): 403-407.
[28] 王慧. 羟基红花黄色素A提取、精制及稳定性研究 [D]. 太原: 山西大学, 2007.
Analysis on quality and value transmitting of classical formula Taohong Siwu Decoction based on feature chromatogram and content of five components
DU Ke-qun1, CHENG Yan-fen1, LI Min-min1, JIANG Hua-juan1, MA Chuan1, HUANG Cheng-wu2, ZHANG Yu-bin2, WANG Tuan-jie3, 4, HE Yao1, FU Chao-mei1
1. College of Pharmacy, Chengdu University of Traditional Chinese Medicine, Key Laboratory of Traditional Chinese Medicine Standardization of the Ministry of Education, Chengdu 611137, China 2. Guizhou Yibai Pharmaceutical Co., Ltd., Guiyang 550008, China 3. Jiangsu Kanion Pharmaceutical Co., Ltd., Lianyungang 222001, China 4. State Key Laboratory of New-Tech of Traditional Chinese Medicine Preparation Process, Lianyungang 222001, China
Exploring the whole process quality transmission rule of herb-herbal pieces-water decoction-benchmark sample of Taohong Siwu Decoction (TSD, 桃红四物汤), so as to provide a basis for the quality control of classic formula preparations.A total of 15 batches of TSD water decoction and benchmark sample were prepared, UPLC characteristic chromatograms were established, and the contents of five components were determined by HPLC method, and the transfer rates of each component during the transmission of herb-herbal pieces-water decoction-benchmark samples were calculated.The similarity of 15 batches of water decoction and benchmark sample > 0.9, 20 common peaks were assigned, and 11 peaks were identified by comparison with reference substances, including gallic acid, rehmannioside D, amygdalin, chlorogenic acid, paeoniflorin, hydroxysafflor yellow A, ferulic acid, verbascoside, quercetin, benzoylpaeoniflorin, ligustilide. The mass fraction of the five components in the water decoction and benchmark samples were respectively: rehmannioside D were 0.26—0.46, 0.11—0.30 mg/g, ferulic acid were 0.33—0.51, 0.09—0.18 mg/g, paeoniflorin were 1.07—2.43, 0.48—1.49 mg/g, amygdalin were 1.66—2.31, 0.60—1.58 mg/g, hydroxysafflor yellow A were 0.98, 0.26—0.44 mg/g. The average transfer rates of herb to herbal pieces, herbal pieces to water decoction and water decoction to benchmark sample were respectively: rehmannioside D were 101.50%, 55.44%, 64.11%; ferulic acid were 94.31% [Danggui () to herbal pieces], 93.91% [Chuanxiong () to herbal pieces), 37.24% and 35.61%; paeoniflorin were 111.55%, 72.80% and 63.48%, amygdalin were 117.34%, 91.78% and 64.60%, and hydroxysafflor yellow A were 93.64%, 60.23% and 34.19%.Using UPLC characteristic chromatogram and content determination of five components, to analyze the value transmission rule of TSD herb-herbal pieces-water decoction-benchmark sample, providing scientific basis for the development and quality control of classic formula.
classic formula; Taohong Siwu Decoction; benchmark sample; characteristic chromatogram; content determination; quantity and value transfer; gallic acid; rehmannioside D; amygdalin; chlorogenic acid; paeoniflorin; hydroxysafflor yellow A; ferulic acid; verbascoside; quercetin; benzoylpaeoniflorin; ligustilide; UPLC; HPLC; quality control
R283.6
A
0253 - 2670(2022)22 - 7058 - 12
10.7501/j.issn.0253-2670.2022.22.009
2022-06-08
四川省科技计划项目(2021YFS0256);四川省科技计划项目(2020YFS0567);中药制剂过程新技术国家重点实验室开放基金资助项目(SKL2020Z0305)
杜克群,硕士研究生,主要从事新制剂、新剂型、新工艺研究。E-mail: 751250966@qq.com
何 瑶,副教授,主要从事新制剂、新剂型、新工艺研究。E-mail: 20660306@qq.com
傅超美,教授,主要从事新制剂、新剂型和中药炮制工艺与机制研究。E-mail: chaomeifu@126.com
[责任编辑 郑礼胜]

