以标准汤剂为基准建立丹参的质量评价方法
董青+於化桃+代云桃+赵嵘+范自全+王丹丹+朱超+陈士林
[摘要]市售的丹参配方颗粒质量差异大,主要原因是丹参原料饮片质量的不均一性、缺乏统一规范的生产工艺和系统的质量评价方法。配方颗粒和“标准汤剂”具有质量一致性。该文将从“标准汤剂”角度,建立评价丹参水煎液质量的系统评价方法,探索影响丹参配方颗粒质量均一性差的主要因素。制备丹参标准汤剂,建立指纹图谱并测定丹酚酸B含量,采用UPLC-QTOF-MS对主要色谱峰进行结构确认;计算出膏率、指标成分转移率和pH等参数,评价工艺的稳定性。结果显示丹参标准煎液的主要成分为酚酸类成分,丹参煎液的出膏率、丹酚酸B的转移率和pH变化不大,且所得标准汤剂的指纹图谱相似度高,表明制备工艺的稳定性良好;标准煎液中丹酚酸B含量范围波动大,主要源于丹参药材中丹酚酸B含量的差异性。
[关键词] 丹参; 标准煎液/汤剂; 质量评价; 出膏率; 转移率
[Abstract] The quality of Danshen extract granules on market is largely different from each other mainly due to the heterogeneous quality of raw materials of Salvia miltiorrhiza, various producing procedures and lack of good quality evaluation method. Formula granule and "standard decoction" have the same quality. In this paper, a systematic evaluation method for the quality of Danshen decoction was established from the perspective of "standard decoction", in order to explore the main factors affecting the quality uniformity of Danshen extract granules. Danshen standard decoction was prepared; then the fingerprint method was developed to determine the content of salvianolic acid B; and the main peaks in the fingerprint were identified with UPLC-QTOF/MS to clarify the chemical compositions of Danshen decoction. Three indexes were calculated to evaluate the stability of whole process, including the extraction ratio; transfer rate of index components and pH value. The results showed that the main components of Danshen decoction were phenolic acids, while the extraction rate, the transfer rate of salvianolic acid B and pH value were in a relatively stable level, and the similarity in the fingerprint of standard decoction was high, indicating that the preparation procedure was stable. The level of salvianolic acid B in the standard decoction was in a large range, which was mainly due to the difference in the quality of Salviae Miltiorrhizae Radix et Rhizoma.
[Key words] Salviae Miltiorrhizae Radix et Rhizoma; standard decoction; quality evaluation; extraction ratio; transfer rate
丹參年需求量较大,为大宗药材品种之一,其配方颗粒的质量是众多学者讨论的焦点。丹参为唇形科鼠尾草植物丹参Salvia miltiorrhiza Bunge的干燥根及根茎,是最常用的活血化瘀中药之一。其主要化学成分为水溶性的酚酸类化合物和脂溶性的二萜醌类化合物[1]。已有学者对市场上丹参配方颗粒的质量进行了分析总结[2-4],主要问题如下:①成分组成差异大,丹参水提液的主要成分是酚酸类,有的厂家丹参配方颗粒中含有丹参酮ⅡA等脂溶性成分,暗示该配方颗粒的生产中可能采用了乙醇提取工艺,表明已有的丹参配方颗粒生产工艺不统一;②指标成分含量不均一,丹酚酸B含量差异很大。造成上述问题的主要原因是由于原料饮片的质量不一致和缺乏统一规范的生产工艺造成的。
中药“标准汤剂”,又称中药“标准煎液”,是按照临床汤剂煎煮方法、经标准化工艺制备而成的单味中药饮片水煎液[5]。中药配方颗粒除了成型工艺外,其余的过程与传统的汤剂基本一致。所以,配方颗粒的药效物质组成和汤剂的基本保持一致,即二者的质量具有一致性。因此,可以以标准汤剂为“基准”,评价配方颗粒主要生产工艺和质量控制方法的合理性。2016年,陈士林研究员提出以中药饮片标准煎液为标准,标化不同用药形式,提高临床用药的准确性和疗效的一致性[5]。中药标准煎液质量标准的制定将为所有源于饮片水煎液的制剂的质量标准的制定提供参考。
本文的主要研究目标:①从丹参标准煎液角度,探索影响丹参配方颗粒质量均一性的主要因素;②厘清丹参水煎液的成分组成,制定合理评价丹参水煎液质量的系统评价方法。对丹参的标准煎液的质量控制主要从三方面进行:①药材选择包括了丹参的主产区(山东和四川中江)和主要的药材市场,符合2015年版《中国药典》各项规定的药材为12个批次,对药材鉴定精确到物种;②标准煎液的制备过程,有统一的标准化操作,完全按照《中药饮片标准煎液研究策略》中推荐的制法[5];③标准汤剂的质量控制,采用化学指标成分含量测定和指纹图谱相结合的模式,且对主要共有峰进行成分鉴定,从整体定性和指标成分定量的角度对所得汤剂进行质量分析。从而实现对标准汤剂、配方颗粒等失去中药外表特征的中药制剂的有效质量控制。本文展示了对丹参标准煎液从源头药材质量控制、中间过程参数标定和标准煎液的化学指纹标定的整个质量控制过程,从而为实现丹参配方颗粒的稳定均一性提供思路。
1 材料
1260型高效液相色谱仪(美国安捷伦公司),ACQUITY UPLC-Class型超高效液相系统和Xevo G2-XS型Q-TOF高分辨质谱仪(美国Waters公司)。丹参药材共12批丹参药材,见表1,购于山东、河南、河北、四川中江、安徽亳州市场等地,包括了丹参的主产区,道地产区和国内的主要的药材市场;DNA测序与数据库比对鉴定为唇形科鼠尾草植物丹参S. miltiorrhiza的干燥根及根茎。丹酚酸B,购于北京世纪奥科生物技术有限公司,纯度为99.02%。水为娃哈哈纯净水,乙腈为色谱纯,其余试剂均为分析纯。
2 方法与结果
2.1 供试品溶液的制备
2.1.1 丹参标准汤剂的制备方法
称取丹参饮片100 g,至于圆底烧瓶中,加8倍水,充分润湿,放置浸泡30 min,加热煮沸后回流提取30 min,趁热3层纱布过滤,滤渣再加入6倍水回流提取20 min,滤过,合并滤液,并浓缩至500 mL即得。
2.1.2 供试品溶液的制备
取2.1.1项下所得的丹参标准汤剂置于2 mL离心管中,稀释10倍,12 000 r·min-1离心5 min,取上清液即得。
2.1.3 对照品溶液的制备
取丹酚酸B对照品适量,精密称定,置棕色量瓶中,加80%甲醇制成丹酚酸B质量浓度为0.1 g·L-1的溶液[3],摇匀,作为对照品溶液。
2.2 HPLC含量测定
2.2.1 HPLC色谱条件
采用SilGreen HPLC C18柱(4.6 mm×150 mm,5 μm);柱温为30 ℃,体积流量为1 mL·min-1;进样量为10 μL;流动相为0.1%磷酸(A)-乙腈(B),等度洗脱,两相比例为A-B 78∶22;检测波长286 nm[6]。
2.2.2 HPLC分析方法学考察
2.2.2.1 线性关系考察 将对照品储备液,分别用80%甲醇稀释2,4,8,16,32,64倍,按2.2.1项下的色谱条件测定,进样10 μL,以进样量10 μL 中对照品质量(μg)为横坐标,286 nm波长下的峰面积为纵坐标,绘制标准曲线。丹酚酸B的线性方程为y=9 057.4x-96.596,r=0.999 1。
2.2.2.2 精密度试验 取供试品溶液按HPLC色谱条件连续进样6次,每次进样量为10 μL,丹酚酸B峰面积RSD为1.4%,符合含量测定要求。
2.2.2.3 稳定性试验 取供试品溶液放置0,1,4,6,12,24 h后按HPLC色谱条件进样10 μL进行測定,记录所有共有峰的峰面积,24 h内丹酚酸B峰面积RSD为2.2%,符合含量测定要求,说明丹参供试液在24 h内稳定。
2.2.2.4 重复性试验 取同一批样品,按供试品备样方法平行制备6份供试品溶液,分别按HPLC色谱条件进样10 μL进行测定。丹酚酸B峰面积RSD为2.5%,说明本实验采用的方法重复性良好。
2.2.2.5 回收率试验 平行精密量取已知丹酚酸B含量的供试品溶液6份,分别加入丹酚酸B对照品0.1 mg,混匀,按照供试品制备方法备样,进样10 μL,记录丹酚酸B峰面积,结果显示其平均回收率为101.6%,RSD为2.7%,表明该方法可以用于丹酚酸B含量的准确测定。
2.2.3 HPLC含量测定
分别精密吸取12批供试品溶液10 μL,注入液相色谱仪,按2.2.1项下的色谱条件测定,记录286 nm波长下丹酚酸B的色谱峰面积,带入标准曲线进行计算,结果见表2。结果显示12批丹参(DS1~DS12)的标准汤剂中,按照投入药材量计算,丹酚酸B的提取率为2.0%~4.7%,平均提取率为(3.1±0.9)%;根据各批药材不同的出膏率,浸膏粉中丹酚酸B的质量分数为4.9%~11.6%,平均值为(6.8±2.0)%。
2.3 UPLC指纹图谱测定
2.3.1 UPLC色谱条件
采用 Acquity UPLC HSST3 C18柱(2.1 mm×100 mm,1.8 μm,Waters 公司);柱温为30 ℃,体积流量为0.3 mL·min-1;进样量为1 μL;流动相为乙腈(A)-0.1%甲酸水(B)[7],梯度洗脱(0~5.5 min,8%~19% B;5.5~11.5 min,19%~22% B;11.5~18.5 min,22%~30% B;18.5~22 min,30%~70% B;22~27 min,70%~90% B;27~29 min,90% B;29~32 min,90%~8% B);检测波长286 nm。
2.3.2 UPLC指紋图谱采集与分析
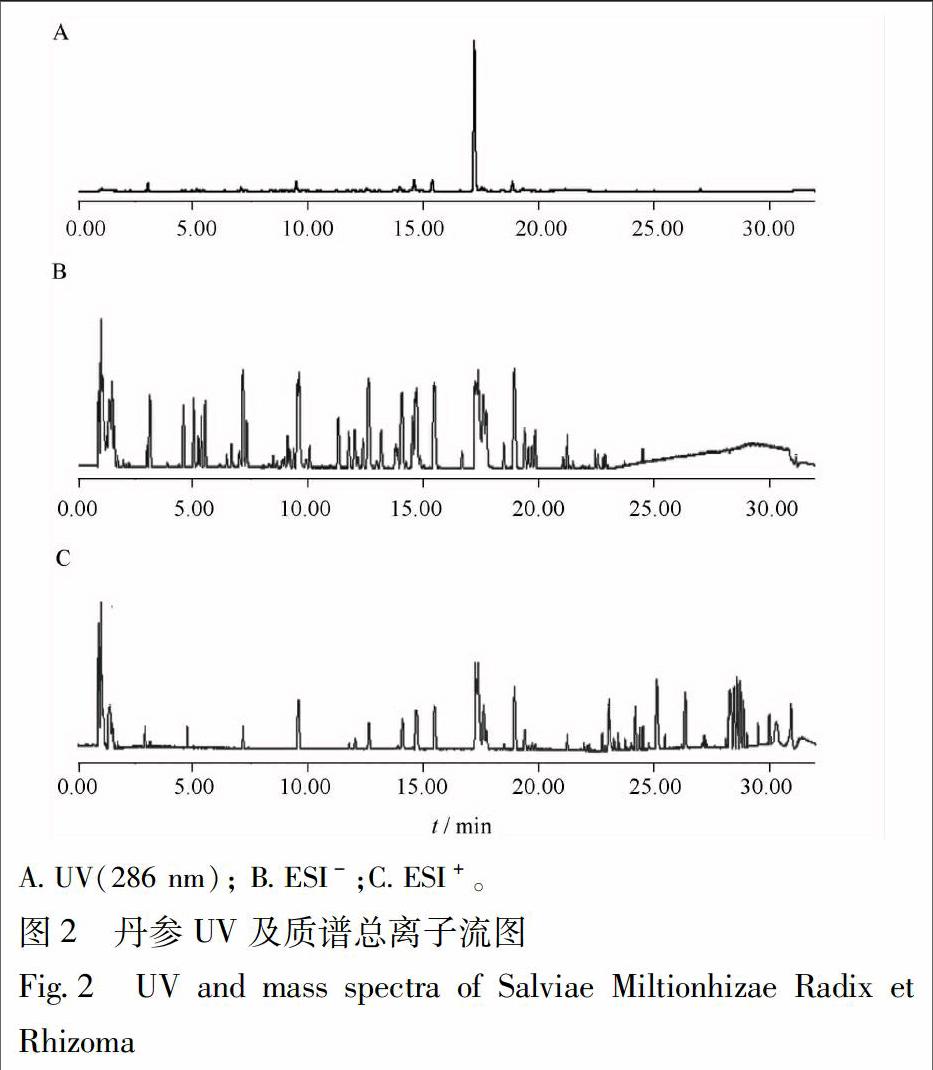
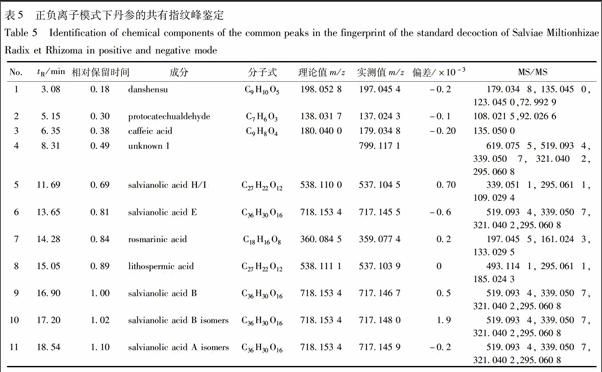
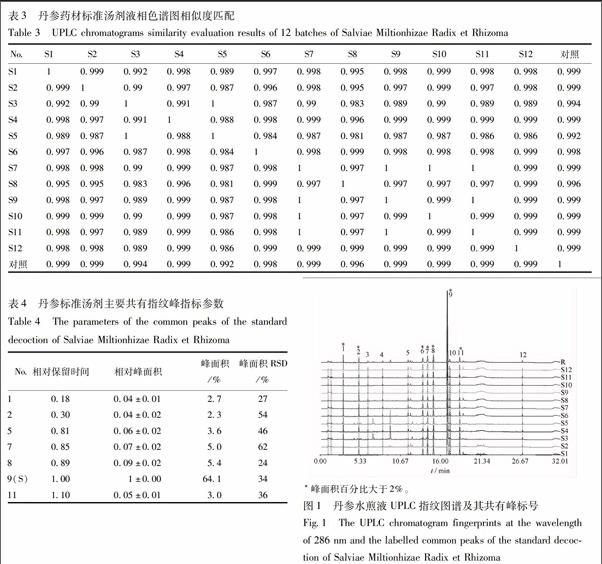
分别精密吸取12批供试品溶液1 μL,注入超高效液相色谱仪,按2.3.1项下的色谱条件测定,得12批丹参提取物286 nm下的UPLC指纹图谱,见图1。图谱采用药典委推荐的“中药色谱指纹图谱相似度评价系统(2012)”软件进行色谱峰匹配,计算谱图的相似度。所有药材的相似度位于0.992~0.999,见表3。共有峰匹配结果显示,丹参标准汤剂的共有峰有12个,其中峰面积百分比大于2%、峰形好的有共有峰有7个。以9号丹酚酸B作参照,计算7个共有峰的相对保留时间、相对峰面积、峰面积百分比、峰面积RSD,见表4。
2.4 质谱指认
2.4.1 质谱条件
采用Xevo G2-XS QTOF质谱仪,电喷雾电离离子源 (ESI),离子化模式为正、负离子,离子源温度为150 ℃,脱溶剂气体为高纯度氮气,温度为550 ℃,流速为800 L·h-1,毛细管电压为1.0 kV,锥孔电压为30 V,扫描范围m/z 50~1 200。亮氨酸-脑啡肽(m/z 554.261 5)作为外标(Lock SprayTM)进行质量实时校正。
2.4.2 色谱峰的指认
吸取2.1.1供试品溶液1 μL,注入UPLC-QTOF/MS系统,按2.3.1项下的色谱条件运行,记录质谱信号,各成分在负离子模式条件下有较高的响应。采用MassLynx 4.1 对正负离子模式总离子流图进行处理,采用UNIFI 1.8 数据处理系统,通过比对精确相对分子质量、特征碎片峰,并结合MassFragmentTM确定化合物的相对分子质量、分子组成和可能分子式;比对已建立的目标数据库和丹参已知化合物的文献报道[7-8],对286 nm波长下主要共有峰进行了鉴定,相关离子推断见表5,共鉴定出10个共有峰,UV及质谱总离子流图见图2。
2.5 丹参标准汤剂过程稳定性评价指标参数的测定
2.5.1 出膏率
分别取2.1.1项下的供试品溶液50 mL,干燥,称取浸膏质量(m),根据如下公式计算标准汤剂的出膏率,出膏率=干膏量(E)/饮片量(m)×100%=m×10/100×100%。结果见表2,13批煎液出膏率为37%~55%,平均值为(44.2±5.3)%,不同批次的出膏率相差不大。
2.5.2 转移率
分别将丹酚酸B带入如下公式计算标准汤剂的转移率,转移率=汤剂中指标成分量/饮片中指标成分量×100%。结果见表2,转移率以丹酚酸B计算为35.5%~57.5%,平均转移率为(43.3±6.4)%,相对稳定。
2.5.3 pH
将pH精密试纸浸入丹参溶液中,0.5 s后取出与标准色版比较,即得pH。平行测定3次,取平均值,结果见表2,pH为5.0,不同批次之间没有差异。
3 讨论
药材标准汤剂的组成成分有别于药材饮片本身,质量评价方法不能盲目套用《中国药典》规定的药材饮片的质量标准。对所得丹参指纹图谱共有峰鉴定结果显示,丹参标准汤剂的主要成分包括丹参素、原儿茶醛、咖啡酸、丹酚酸H/I、丹酚酸E、迷迭香酸、紫草酸、丹酚酸B和异丹酚酸B[2,8]。指纹图谱结果显示,丹参标准汤剂指纹图谱与丹参总酚酸提取物的指纹图谱组成相似[6]。因此,丹参标准汤剂的主要成分为丹酚酸类成分,而脂溶性成分如丹参酮ⅡA基本检测不到。所以,丹参标准汤剂质量标准中仅对丹酚酸B进行了含量测定,所用指标成分不同于药典中药材的水溶性和脂溶性成分的双重指标。该结果提示丹参生产工艺评估和产品的质量控制方法的选择,要考虑到配方颗粒产品所含化学成分与传统饮片的差异,不要完全参考《中国药典》或其他文献中的药材或饮片的方法。
丹参标准汤剂中的丹酚酸B的浓度变化大主要源于药材本身,而生产工艺的规范化保证了工艺的稳定性。煎液中丹酚酸B的提取率为2.0%~4.7%,位于均值的67%~158%。大多推论认为该现象与丹酚酸B的热不稳定性有关,在煎煮、浓缩过程中丹酚酸B会部分水解为原儿茶醛、丹参素和丹酚酸A[2,9],且转化率随着加热时间的延长而提高。但是,制备标准汤剂的合格丹参药材中丹酚酸B的质量分数变化范围为5.1%~11.4%,位于均值的74%~165%,因此,丹参标准汤剂中的丹酚酸B的浓度变化幅度与丹参药材本身基本一致。而且,标准汤剂的工艺参数(丹酚酸B)转移率位于37.3%~57.5%,位于均值的82%~133%,转移率基本稳定,表明丹酚酸B虽然热不稳定,但是规范化的工艺操做仍能保证丹酚酸B的稳定转化,从而保证其转移率的稳定性,保证所得丹参煎液指纹图谱的高度相似性。
本文所得12批丹参标准煎液的相似度值均大于0.99,相似度良好,表明所得丹参标准汤剂化学轮廓相似度高。丹参标准煎液的平均出膏率为(44.2±5.3)%,出膏率为37%~55%,位于均值的75%~125%;丹酚酸B的平均转移率为(43.3±6.4)%,位于均值的82%~133%;pH均为4.0。这些数据表明,本文所用标准汤剂制备工艺稳定,只要保证药材质量的稳定性,即可获得质量均一稳定的丹参煎液。
采用本文建立的方法,所得丹参标准煎液中丹酚酸B提取率为2.0%~4.7%,平均值为(3.1±0.9)%,位于均值的67%~158%,浸膏粉中丹酚酸B平均质量分数为(6.8±2.0)%,均位于均值的72%~170%。这些数据表明丹参标准煎液的中丹酚酸B的含量范围波动大。因此,①建议制定丹参标准汤剂的质量标准时,应放宽丹酚酸B的浓度范围;②对于生产厂家,为了生产出质量均一稳定的丹参配方颗粒,生产工艺的规范化是基础,保证药材质量的均一性稳定是关键。
[參考文献]
[1] 张乙川. 对丹参化学成分及临床药理的研究进展[J].中国医药指南, 2015(11): 214.
[2] Song J Z, Li S L, Zhou Y, et al. A novel approach to rapidly explore analytical markers for quality control of Radix Salviae Miltiorrhizae extract granules by robust principal component analysis with ultra-high performance liquid chromatography-ultraviolet-quadrupole time-of-flight mass spectrometry[J]. J Pharm Biomed Anal, 2010,53(3):279.
[3] Song J Z, Qiao C F, Li S L,et al. quality assessment of granule of danshen extract by high performance liquid chromatography[J]. Chin J Nat Med, 2009, 7(5):368.
[4] 张红梅, 宋景政, 谭红胜, 等. 从煎液到颗粒剂:中药配方颗粒20年回顾与展望[J].世界科学技术——中医药现代化, 2012(4): 1740.
[5] 陈士林,刘安,朱广伟, 等. 中药饮片标准汤剂研究策略[J].中国中药杂志,2016, 41(8):1367.
[6] 中国药典.一部[S]. 2015:221.
[7] 赵洪芝, 王静, 姜民, 等.丹参总酚酸提取物UPLC指纹图谱及成分定性研究[J]. 药物分析杂志, 2012, 32(4): 620.
[8] Liu A H, Lin Y H, Yang M, et al. Development of the fingerprints for the quality of the roots of Salviae Miltionhizae Radix et Rhizoma and its related preparations by HPLC-DAD and LC-MS(n) [J]. J Chromatogr B Analyt Technol Biomed Life Sci, 2007,846(1/2): 32.
[9] 高丽娜, 崔元璐, 延阔, 等. 丹参红花配伍研究进展[J].中草药, 2016(4): 671.
[责任编辑 孔晶晶]

