基于转录组学研究毛冬青三萜皂苷对脂多糖诱导小鼠肠损伤的保护作用及其机制
王 莹,陈冰莹,伍钰蓉,张颖茵,王 倩,李 瑜,张 蕾*
基于转录组学研究毛冬青三萜皂苷对脂多糖诱导小鼠肠损伤的保护作用及其机制
王 莹1,陈冰莹1,伍钰蓉1,张颖茵1,王 倩1,李 瑜2,张 蕾1*
1. 广州中医药大学中药学院,广东 广州 510006 2. 广州中医药大学护理学院,广东 广州 510006
探讨毛冬青三萜皂苷(triterpenoid saponin,IPTS)对脂多糖(lipopolysaccharide,LPS)诱导的小鼠肠损伤的作用及潜在机制。C57BL/6小鼠随机分为对照组、模型组和IPTS低、中、高剂量(88、176、264 mg/kg)组,给予药物干预7 d,ip LPS诱导小鼠小肠损伤,造模7 h后,采用苏木素-伊红(HE)染色法观察小鼠回肠组织病理变化;检测小鼠血清中丙二醛(malondialdehyde,MDA)水平和超氧化物歧化酶(superoxide dismutase,SOD)活性;采用qRT-PCR和Western blotting法检测回肠组织炎症因子白细胞介素-1β(interleukin-1β,)、肿瘤坏死因子-α(tumor necrosis factor-α,)mRNA和肠屏障紧密连接蛋白、mRNA及蛋白表达。通过转录组学测序挖掘IPTS作用于回肠的潜在机制。与模型组比较,IPTS组小鼠回肠组织完整,氧化应激损伤改善(<0.001),回肠炎症因子水平降低(<0.01),肠屏障恢复(<0.05、0.01、0.001)。RNA-seq测序结果显示,与对照组比较,模型组共筛选出2584个差异表达基因;与模型组比较,IPTS高剂量组共筛选出259个差异表达基因;这些差异表达基因主要富集在免疫球蛋白A(immunoglobulin A,IgA)相关的肠道免疫、花生四烯酸代谢、B细胞受体、瞬时受体电位(transient receptor potential,TRP)通道炎症调控、亚油酸代谢等信号通路。IPTS可以改善LPS诱导的小鼠小肠损伤,可能与花生四烯酸代谢、IgA相关的肠道免疫代谢以及TRP通道炎症调控通路密切相关。
毛冬青三萜皂苷;肠损伤;转录组学;氧化应激;炎症;肠屏障
毛冬青Hook. et Am.是冬青科冬青属植物,是我国南方常用中药,其主要功效为清热解毒、活血通络。中医通过辨证论治,广泛应用毛冬青治疗心脑血管疾病,其在降低不良反应等方面明显优于化学药,且疗效稳定,无耐药性和成瘾性,患者容易接受[1]。植物化学和药效学研究结果表明,毛冬青的主要活性成分为三萜皂苷[2]。然而,当将毛冬青三萜皂苷(triterpenoid saponin,IPTS)的体内过程纳入药理机制的阐释中时,却有系列问题亟待解决:毛冬青主要药效物质三萜皂苷类成分口服给药血药浓度低,即便相对吸收特性较好的苷元如毛冬青甲素,单体口服给药的绝对生物利用度<3%[3-4]。本课题组前期组织分布研究结果发现,大鼠ig毛冬青提取液后,IPTS主要分布于胃肠道,仅有少量分布于心脏,脑中更是痕量的分布,因此现有的基于非口服给药途径的药理学研究结果尚无法诠释其口服用药抗心脑血管性疾病的作用机制。
本课题组在研究IPTS抗动脉粥样硬化作用机制时发现,IPTS不但可以调控肠道菌群结构改善动脉粥样硬化,还能显著降低动脉粥样硬化小鼠血清中脂多糖(lipopolysaccharide,LPS)水平[5]。文献报道,动脉粥样硬化疾病常伴随肠黏膜屏障功能障碍,使其通透性增大,从而导致肠道菌群产生的LPS透过肠屏障进入血液循环中。当LPS从肠道转移到循环中时,与LPS结合蛋白形成复合体,可以与单核细胞上的CD14结合进而导致促炎细胞因子的产生[6]。基于“肠-心”轴理论、毛冬青在民间的抗炎用途和其组织分布特点,推测毛冬青具有抗小肠炎性损伤,维持肠黏膜屏障紧密连接和完整性,进而发挥其抗心脑血管疾病的作用。由于通过高脂饮食制备的动脉粥样硬化模型伴肠道损伤周期长、成模率低,本研究通过ip LPS建立小鼠小肠损伤的炎症模型,探讨IPTS保护小肠黏膜屏障的作用,并结合转录组学测序分析,探索其潜在机制和作用靶点。
1 材料
1.1 动物
SPF级雄性C57BL/6小鼠,体质量18~22 g,购自珠海百试通生物科技有限公司,动物合格证号SCXK(粤)2020-0051。动物于广州中医药大学中药学院动物房SPF级环境中适应性饲养1周,温度(24±2)℃、12 h光昼交替,自由进食饮水。实验单位使用许可证编号为SYXK(粤)2019-0202,动物实验经广州中医药大学中药学院实验动物伦理审查委员会批准(批准号ZYD-2021-223)。
1.2 药材
毛冬青购自广州白云山中药饮片有限公司,经广州中医药大学张丹雁教授鉴定为冬青科冬青属植物毛冬青Hook. et Am.的干燥根。
1.3 药品与试剂
毛冬青皂苷B1对照品(质量分数>98%)由广州中医药大学赵钟祥教授课题组提供;4%多聚甲醛固定液(批号21211717)购自北京Biosharp公司; PBS缓冲液(批号GA21120122694)购自武汉赛维尔生物科技有限公司;LPS(批号12190801)购自美国Sigma公司;生理盐水(批号0506A22)购自雷根生物公司;超氧化物歧化酶(superoxide dismutase,SOD)检测试剂盒(批号20211119)、丙二醛(malondialdehyde,MDA)检测试剂盒(批号20211120)购自南京建成生物工程研究所;TRIzol试剂(批号03877118721)、HiFiScript gDNA Removal RT Master Mix试剂盒(批号02322)、Magic SYBR Mixture试剂盒(批号09321)购自康为世纪公司;小鼠甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)引物(批号I620KA5091)购自生工生物工程公司;DEPC水(批号051821210702)购自北京索莱宝公司;GAPDH抗体(批号AC21110131A)购自武汉塞维尔生物科技有限公司;ZO-1抗体(批号GR3398704-6)、Occludin抗体(批号GR3383643-14)购自英国Abcam公司;山羊抗兔IgG抗体(批号S0001)购自Affinity公司;Marker(批号91226047)购自美国Thermo Fisher Scientific公司。
1.4 仪器
LC-LX-HR165A型冷冻离心机(上海力辰公司);Eclipse E100型正置光学显微镜(日本尼康公司);THM51 119300型全波长酶标仪、NC2000型Nanodrop紫外定量仪、ABI 7500型荧光定量PCR仪(美国Thermo Fisher Scientific公司);SDS-PAGE垂直电泳槽、垂直转印槽(美国Bio-Rad公司);Illumina Misseq测序仪(美国Illumina公司)。
2 方法
2.1 IPTS的制备
毛冬青根茎饮片打成粗粉,用10倍量的蒸馏水浸泡24 h,浸泡2次,并定时搅拌,滤过,弃去滤液,滤过后的粗粉按料液比1∶10加入85%乙醇加热回流提取2次,每次1 h,收集全部滤液,浓缩,干燥后得到毛冬青提取粉末。以毛冬青皂苷B1为对照品,采用比色法测定总三萜皂苷的质量分数,以对照品浓度为横坐标(),吸光度为纵坐标(),得标准曲线=369.95-0.052 9(2=1.000),计算得三萜皂苷的质量分数为81.6%。
2.2 造模、分组及给药
C57BL/6小鼠随机分为对照组、模型组和IPTS低、中、高剂量(88、176、264 mg/kg)组,每组12只。IPTS溶于0.5%羧甲基纤维素钠(CMC-Na)配制成质量浓度为8.8、17.6、26.4 mg/mL的混悬液,各给药组ig相应药物(10 mL/kg),对照组和模型组ig等体积的0.5% CMC-Na,1次/d,连续7 d。末次给药后,模型组和各给药组ip LPS(10 mg/kg),造模7 h后,记录小鼠造模前后体质量及状态变化,计算小鼠ip LPS前后体质量差值。
2.3 IPTS对肠损伤小鼠血清中MDA水平及SOD活性的影响
造模7 h后,对小鼠进行麻醉,摘眼球取血,室温静置1 h后,4 ℃、3800 r/min离心10 min,收集上清液,于−80 ℃保存。按照试剂盒说明书测定血清中MDA水平及SOD活性。
2.4 IPTS对肠损伤小鼠回肠组织病理变化的影响
小鼠脱颈椎处死后,在冰上取回肠,用PBS溶于小心冲洗,取0.5 cm置于4%多聚甲醛溶液中固定,经石蜡包埋后切片,进行苏木素-伊红(HE)染色,于光学显微镜下观察小肠组织病理变化。
2.5 IPTS对肠损伤小鼠回肠组织炎症因子白细胞介素-1β(interleukin-1β,IL-1β)、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)和肠屏障蛋白ZO-1、Occludin mRNA表达的影响
取各组小鼠回肠组织20 mg,按照试剂盒说明书提取总RNA并合成cDNA,进行qRT-PCR分析。引物序列:上游引物5’-CACTACAGGCTCCG- AGATGAACAAC-3’、下游引物5’-TGTCGTTGCTT- GGTTCTCCTTGTAC-3’;上游引物5’-AGAGGTTGGCTATGGAGGCTGTG-3’、下游引物5’-CCTGCATCGTTGACGGTCTTCC-3’;上游引物5’-AACCCGAAACTGATGCTGTGGATAG-3’、下游引物5’-CGCCCTTGGAATGTATGTGGAGAG-3’;上游引物5’-TTGGCTACGGAGGTG- GCTATGG、下游引物5’-CCTTTGGCTGCTCTTG-GGTCTG-3’;上游引物5’-GGTTGTCTCCT- GCGACTTCA-3’、下游引物5’-TGGTCCAGGGTT- TCTTACTCC-3’。
2.6 IPTS对肠损伤小鼠回肠组织ZO-1和Occludin蛋白表达的影响
取各组小鼠回肠组织30 mg,加入RIPA裂解液和蛋白酶抑制剂,使用冷冻组织研磨仪进行匀浆(60 Hz、60 s),匀浆后放于碎冰上静置20 min,4 ℃、1200 r/min离心5 min,取上清液。采用BCA蛋白定量试剂盒测定蛋白浓度,加入Loading buffer后混匀,沸水煮15 min使蛋白变性。蛋白样品经十二烷基硫酸钠-聚丙烯酰胺凝胶电泳,转至PVDF膜,加入5%脱脂牛奶,室温封闭2.5 h;分别加入相应抗体,4 ℃孵育过夜;加入二抗,室温孵育1 h,加入ECL工作液发光显色,采用Image J软件分析条带灰度值。
2.7 RNA-Seq测序分析
2.7.1 RNA提取和RNA-Seq测序 分别取对照组、模型组、IPTS高剂量组回肠组织100 mg,置于RNase-Free冻存管内,于液氮中冷冻,委托(上海)美吉生物公司进行RNA提取和RNA-Seq测序,并使用该公司在线分析平台进行分析。转录测序具体流程如下:采用TruSeqTMRNA sample preparation Kit试剂盒建立RNA文库。首先利用带有Oligo(dT)的磁珠从1 μg总RNA中富集有poly-A尾的mRNA,再加入fragmentation buffer,将mRNA随机断裂成300 bp左右的小片段,接着采用SuperScript double-stranded cDNA synthesis kit试剂盒,加入六碱基随机引物,以mRNA为模板反转合成一链cDNA,随后进行二链合成,形成稳定的双链结构。双链的cDNA结构为黏性末端,加入End Repair Mix将其补成平末端,随后在3’末端加上一个A碱基,用于连接Y字形的接头。cDNA经过PCR富集后,beads(DNA clean beads)筛选200~300 bp的条带。经TBS380定量后,使用Ilumina HiSeq xten/NovaSeq 6000测序平台进行高通量测序,测序读长为PE150。
2.7.2 测序滤过原始数据质控对比 对原始测序数据进行滤过,去除reads中的接头序列,去除序列末端质量值小于20的碱基,去除含N比率超过10%的reads,舍弃去adapter及质量修剪后长度小于20 bp的序列,对滤过的数据与参考基因组比对分析。
2.7.3 基因差异表达分析 在RNA-Seq分析中,通过定位到基因组区域的序列数来计算基因的表达水平。使用RSEM软件对基因的表达水平进行定量分析,获得基因的序列数后,使用基于负二项分布的DESeq2软件对Raw数进行分析,基于一定的标准化处理和筛选条件获得比较组间表达差异的基因,最后按照表达量倍数差异和表达差异显著性进行筛选,校正的值(adjust)<0.05且|log2FC|≥2。
2.7.4 基因本体(gene ontology,GO)功能和京都基因与基因组百科全书(Kyoto encyclopedia of genes and genomes,KEGG)通路富集分析 利用GO数据库,使用Goatools软件,进行Fisher精确检验,对差异基因进行GO功能显著性富集分析。采用BH方法对值进行校正,当adjust<0.05时,认为此功能存在显著富集情况。使用KOBAS进行KEGG通路富集分析,计算原理同GO功能富集分析,满足adjust<0.05的KEGG通路定义为在差异表达基因中显著富集的KEGG通路。
2.7.5 IPTS对LPS诱导的肠损伤小鼠回肠组织关键基因表达的影响 通过qRT-PCR验证关键差异基因肌醇-1,4,5-三磷酸受体2(inositol-1,4,5-trisphosphate receptor type 2,)、嘌呤能受体P2Y2(purinergic receptor P2Y2,)、整合素亚基α4(integrin subunit α4,)、、趋化因子受体4(C-X-C motif chemokine receptor 4,)、细胞色素P450家族2亚家族C成员55(cytochrome P450 family 2 subfamily C member 55,)、、、、Ⅴ组磷脂酶A2(phospholipase A2 group V,)的表达。取小鼠回肠组织20 mg,按“2.5”项下方法进行qRT-PCR分析,引物序列见表1。

表1 引物序列
2.8 统计学分析
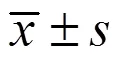
3 结果
3.1 IPTS对肠损伤小鼠体质量的影响
如图1所示,与对照组比较,模型组小鼠体质量丢失明显升高(<0.01);与模型组比较,各给药组小鼠体质量丢失均明显降低(<0.01)。表明小鼠ip LPS会造成体质量下降,IPTS可以缓解LPS造成的小鼠体质量下降。
3.2 IPTS对肠损伤小鼠血清中MDA水平及SOD活性的影响
如图2所示,与对照组比较,模型组小鼠血清中MDA水平显著升高(<0.001),SOD活性显著降低(<0.001);与模型组比较,IPTS高剂量组小鼠血清中MDA水平显著降低(<0.001),各给药组SOD活性均显著升高(<0.001)。表明小鼠ip LPS后,体内发生氧化应激损伤,IPTS能够缓解氧化应激损伤。
与对照组比较:#P<0.05 ##P<0.01 ###P<0.001;与模型组比较:*P<0.05 **P<0.01 ***P<0.01,下图同
3.3 IPTS对肠损伤小鼠回肠组织病理变化的影响
如图3所示,对照组小鼠回肠组织结构正常,绒毛排列紧密,细胞形态正常,无组织学病变。模型组小鼠回肠绒毛断裂,肠黏膜上皮细胞脱落。与模型组比较,IPTS低、中剂量组小鼠回肠绒毛恢复,仅有小部分脱落;IPTS高剂量组小鼠回肠损伤较轻,肠黏膜结构基本完整,肠绒毛大部分排列整齐。
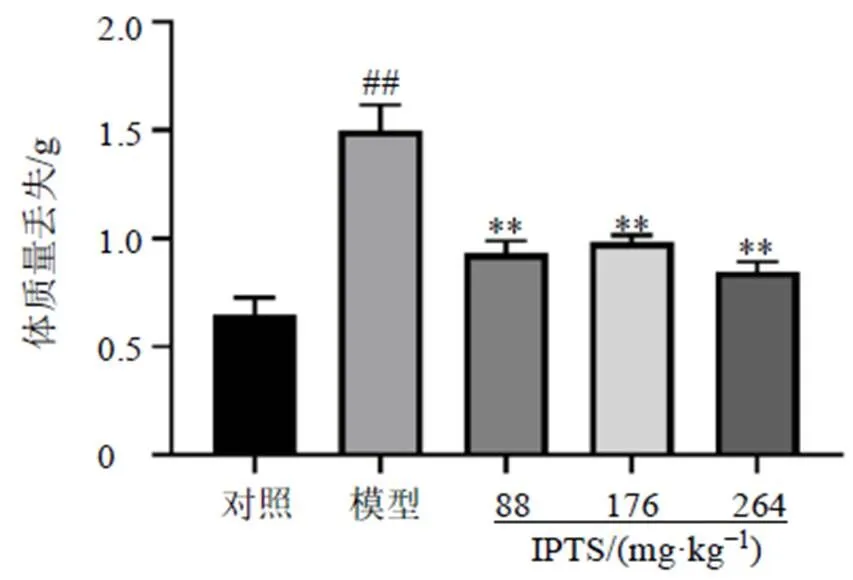
3.4 IPTS对肠损伤小鼠回肠组织炎症因子IL-1β和TNF-αmRNA表达的影响
如图4所示,与对照组比较,模型组小鼠回肠组织中和的mRNA表达水平均显著升高(<0.01);与模型组比较,各给药组小鼠回肠组织中mRNA表达水平显著降低(<0.01),IPTS中、高剂量组回肠组织中mRNA表达水平显著降低(<0.01)。表明IPTS能够显著降低LPS诱导的肠损伤小鼠回肠组织中炎症因子表达。

图2 IPTS对肠损伤小鼠血清中MDA水平及SOD活性的影响(, n = 6)

箭头表示小肠绒毛受损
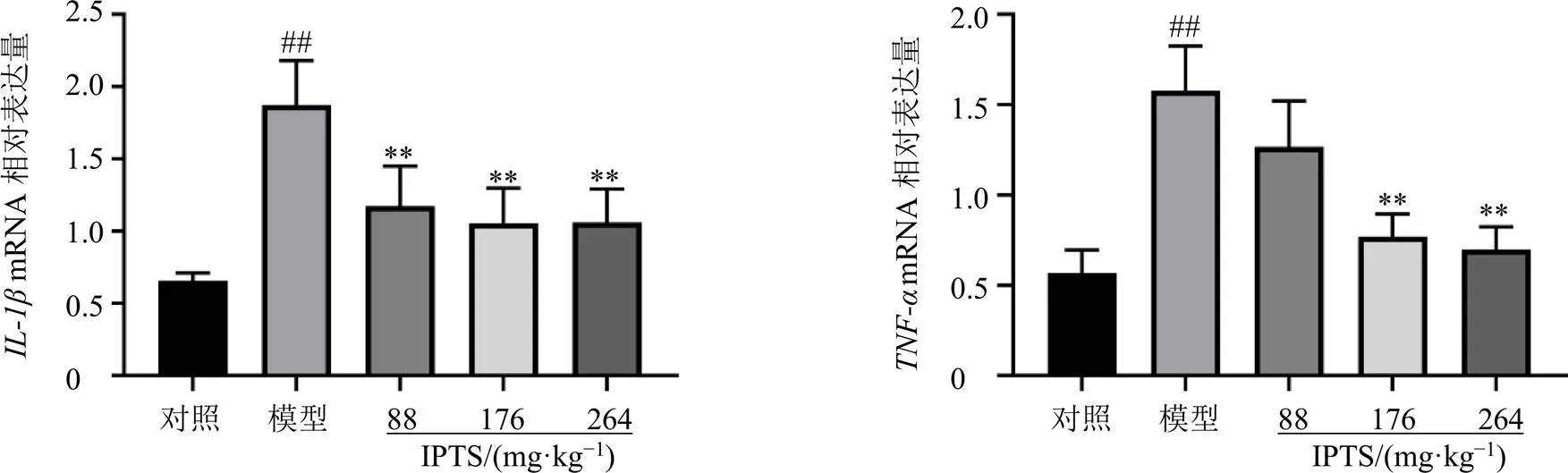
图4 IPTS对肠损伤小鼠回肠组织IL-1β和TNF-αmRNA表达的影响(, n = 6)
3.5 IPTS对肠损伤小鼠回肠组织肠屏障蛋白ZO-1、OccludinmRNA和蛋白表达的影响
如图5所示,与对照组比较,模型组小鼠回肠组织中屏障蛋白、的mRNA表达水平均显著降低(<0.001);与模型组比较,IPTS高剂量组回肠组织中的mRNA表达水平显著升高(<0.001),IPTS中、高剂量组回肠组织中的mRNA表达水平明显升高(<0.05、0.001)。
如图6所示,与对照组比较,模型组小鼠回肠组织中ZO-1和Occludin蛋白表达水平均显著降低(<0.001);与模型组比较,IPTS中、高剂量组回肠组织中ZO-1和Occludin蛋白表达水平均显著升高(<0.01、0.001)。
以上结果表明,小鼠ip LPS后,回肠组织中肠屏障蛋白和的mRNA及蛋白表达均显著降低,造成回肠肠屏障损伤;IPTS能够显著恢复其表达,保护回肠肠屏障。
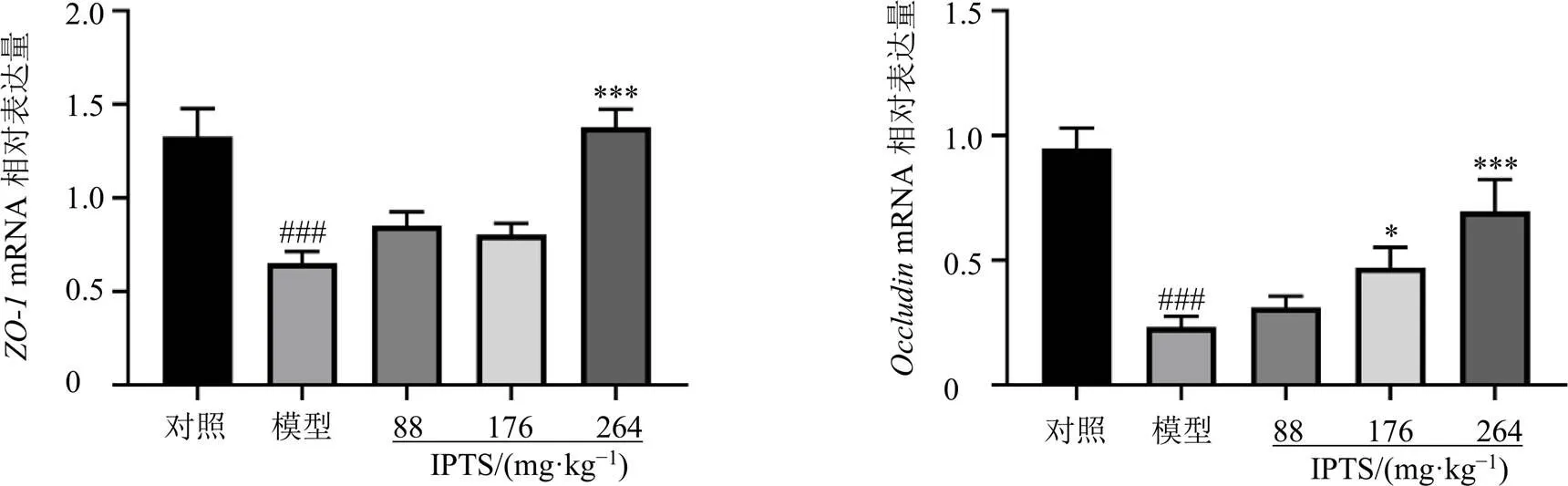
图5 IPTS对肠损伤小鼠回肠组织ZO-1和OccludinmRNA表达的影响(, n = 6)
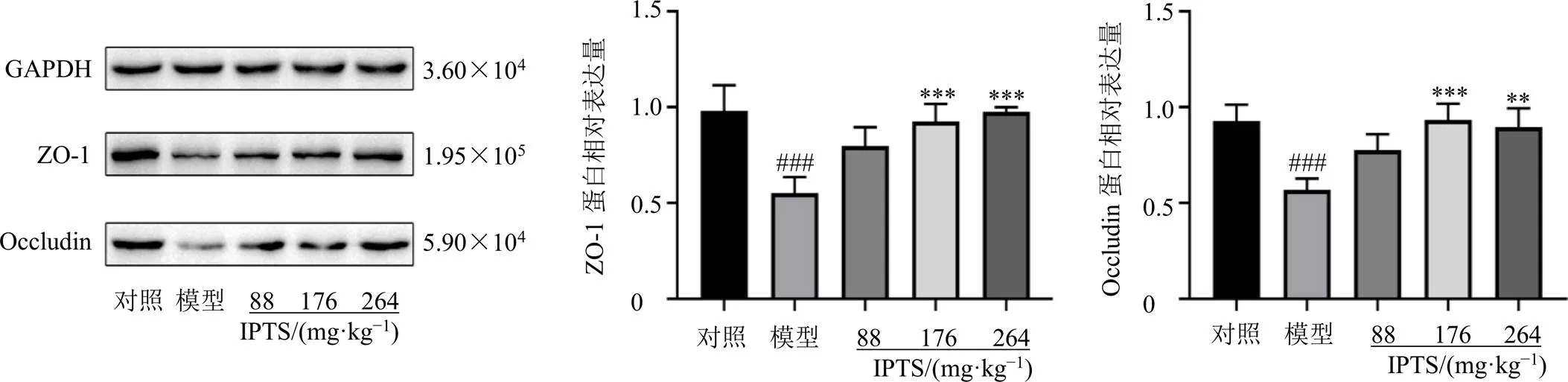
图6 IPTS对肠损伤小鼠回肠组织ZO-1和Occludin蛋白表达的影响(, n = 6)
3.6 转录组学测序数据的质量评估
本研究共完成14个样品(对照组4个、模型组5个、IPTS高剂量组5个)的转录组测序分析。经质量控制所有样品的误差率小于0.025 3%,所有样品的20均大于97.85%,30均大于93.94%。根据饱和度曲线可知,所有样品测序数据量已满足定量要求。覆盖度分布图说明测序无偏向性,测序所得序列在基因上均匀分布。
3.7 基因差异表达分析结果
模型组和对照组之间有2584个差异表达基因(differentially expressed genes,DEGs),与对照组比较,模型组上调DEGs 1119个,下调DEGs 1465个;IPTS高剂量组和模型组之间有259个DEGs,与模型组比较,IPTS高剂量组上调DEGs 208个,下调DEGs 51个。由差异表达基因聚类分析图(图7)可知,IPTS在一定程度上回调了小鼠ip LPS后回肠组织DEGs。
3.8 DEGs富集分析
将筛选出的DEGs进行GO和KEGG富集分析。GO富集结果见图8,模型组与对照组相比,与分子功能相关的差异基因主要富集在连接、催化活性;与细胞成分相关的主要富集于细胞部分、细胞器、细胞膜;与生物过程相关的主要富集在细胞过程、生物调控。KEGG通路主要富集在IgA生成相关肠道免疫网络、甾体激素生物合成、磷脂酰肌醇3-激酶(phosphatidylinositol-3-kinase,PI3K)-蛋白激酶B(protein kinase B,Akt)信号通路、TNF信号通路、NOD样受体信号通路、核因子-κB(nuclear factor-κB,NF-κB)信号通路等。
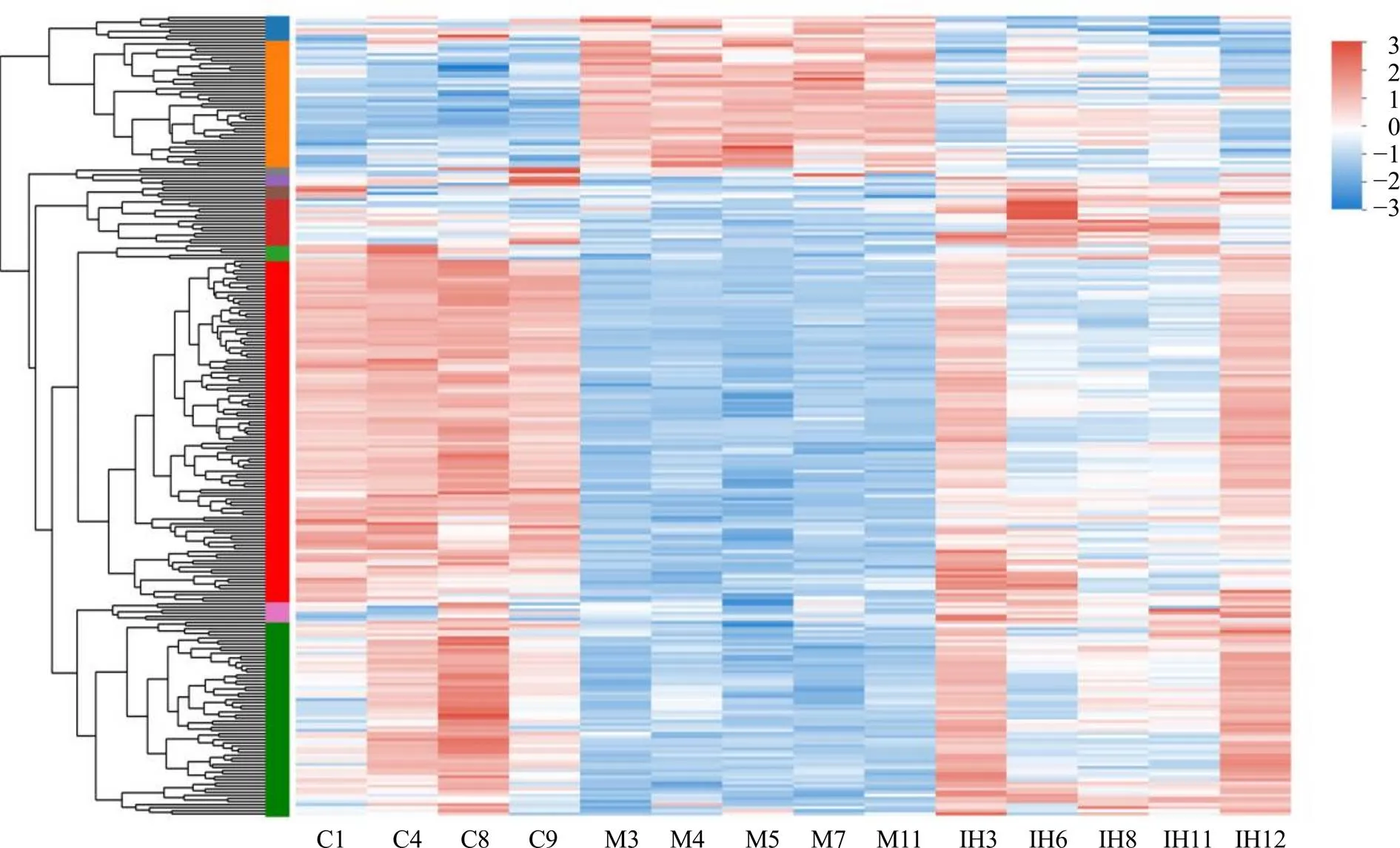
C-模型组 M-模型组 IH-IPTS高剂量组

图8 对照组与模型组DEGs的GO功能 (A)和KEGG通路 (B)富集分析
如图9所示,IPTS高剂量组与模型组相比,与分子功能相关的差异基因主要富集在连接、催化活性;与细胞成分相关的主要富集于细胞部分、细胞器、细胞膜;与生物过程相关的主要富集在细胞过程、生物调控、代谢过程。KEGG通路主要富集在免疫球蛋白A(immunoglobulin A,IgA)生成相关肠道免疫网络、亚油酸代谢、色氨酸代谢、花生四烯酸代谢、药物代谢-细胞色素P450、B细胞受体信号通路、瞬时受体电位(transient receptor potential,TRP)通道炎症调控通路等。
3.9 IPTS对肠损伤小鼠回肠组织关键基因表达的影响
以为内参基因,通过qRT-PCR对RNA-Seq分析结果中TRP通道炎症调控、花生四烯酸代谢、IgA相关的肠道免疫相关通路的10个关键基因、、、、、、、、、进行mRNA表达水平的验证。如图10所示,与对照组比较,模型组小鼠回肠组织中、、、、、、、、mRNA表达水平均显著降低(<0.05、0.01、0.001),mRNA表达水平显著升高(<0.001);与模型组比较,IPTS高剂量组回肠组织中、、、、、、、、mRNA表达水平均显著升高(<0.05、0.01),mRNA表达水平显著降低(<0.01)。

图9 模型组与IPTS高剂量组DEGs的GO功能 (A)和KEGG通路 (B)富集分析

图10 IPTS对肠损伤小鼠回肠组织中关键基因表达的影响(, n = 6)
4 讨论
LPS是革兰阴性菌细胞壁的一种成分,在肠屏障功能障碍中有着重要作用,LPS诱导的模型被广泛认为是评价肠道损伤的代表性实验模型[7]。在LPS刺激下,NF-κB信号通路被激活,释放大量炎症因子如TNF-α、IL-1β、IL-6等。肠道炎症与肠屏障破坏有关,肠上皮炎症可通过炎症信号转导下调紧密连接蛋白的表达[8]。肠道机械屏障是肠屏障中重要的组成部分,由单层的肠上皮细胞及细胞间的连接组成。其中,细胞间的连接方式包括紧密连接、黏附连接等,紧密连接是细胞间主要的连接方式。与紧密连接相关的蛋白有ZO蛋白家族、Occludin、Claudins蛋白家族等,这些蛋白的表达有助于肠屏障功能[9]。本研究结果显示,IPTS可以下调肠损伤小鼠回肠组织中炎症因子TNF-α、IL-1β的水平,上调回肠组织中紧密连接蛋白ZO-1、Occludin表达。
MDA是脂质过氧化的产物,被认为是过度氧化应激的指标。SOD可以催化O2−歧化为H2O2和O2,参与抗氧化系统。小肠过度氧化应激反应可以破坏脂质和蛋白质等重要细胞成分,进而导致肠屏障损伤[7]。本研究发现,IPTS降低肠损伤小鼠血清中MDA水平,升高SOD活性,表明IPTS可以抑制机体过度氧化应激反应,保护肠屏障。
本研究对对照组、模型组、IPTS高剂量组进行转录组学测序。KEGG通路富集分析结果显示,DEGs主要富集在IgA相关的肠道免疫、花生四烯酸代谢、B细胞受体、TRP通道炎症调控、亚油酸代谢等信号通路。IgA是黏膜免疫系统中含量最丰富的抗体亚型,分泌型免疫球蛋白A是由二聚体IgA、J链和分泌成分组成的聚合物免疫球蛋白,是机体黏膜局部抗感染免疫的主要抗体[10]。肠上皮中的分泌型免疫球蛋白A可以拦截入侵的病原体,防止病原体对肠道屏障的渗透,并将病原体从组织中排泄出来[11]。本研究选取IgA相关的肠道免疫通路上的、基因进行验证。其中,IL-15是一种T细胞生长因子,可诱导生发中心B细胞增殖、分化和Ig合成[12]。趋化因子受体CXCR4是趋化因子基质细胞衍生因子12(C-X-C motif chemokine ligand 12,CXCL12)的特异受体。CXCL12对淋巴细胞有强烈的趋化作用[13]。因此,IPTS可能是通过调节其表达进而调节小肠免疫系统,维持肠屏障功能。
花生四烯酸是一种ω-6多不饱和脂肪酸。花生四烯酸代谢通路上的关键基因,具有将细胞膜内表面酯化的花生四烯酸水解成游离形式的作用,再由然后由环氧合酶、脂氧合酶和细胞色素P450酶进一步代谢成一系列生物活性介质,包括前列腺素、白三烯、二十碳四烯酸等,有助于细胞炎症信号的传递,被认为是炎症性疾病和心血管疾病的预防和治疗靶点[14-15]。本研究结果显示,IPTS可能是通过下调PLA2G5的表达,上调细胞色素P450家族(CYP2C55、CYP2C65、CYP2C66、CYP2C68)的表达,抑制小肠炎症的发生。
此外,TRP通道是一种阳离子选择性通道,广泛存在于胃肠道,作为各种刺激的检测器和G蛋白偶联受体的二级转导。TRP通道的激活可以引发相关神经肽的炎症并启动免疫反应,在控制单核细胞和巨噬细胞的吞噬、产生趋化因子和细胞因子等方面发挥重要作用[16],是炎症通路中的重要信号成分[17]。该通路的关键基因属于嘌呤能受体家族,能被三磷酸腺苷(adenosine triphosphate,ATP)或其他核苷酸激活。其中,P2Y受体主要为G蛋白偶联受体,可以调节TRP通道。该通路另一关键基因是一种内质网钙释放通道,该基因编码的蛋白家族成员是细胞内第2信使钙释放通道。因此,IPTS可能是通过调节P2RY2和ITPR2的表达,影响TRP通道,进一步抑制小肠炎症反应。
综上所述,本研究通过LPS诱导建立小鼠小肠损伤模型,通过检测炎症因子水平、肠屏障蛋白的表达等方法证明IPTS具有保护小肠肠屏障的作用。利用转录组学测序的手段,深入探究潜在机制,结果显示IPTS通过介导IgA相关的肠道免疫信号通路、花生四烯酸代谢的信号通路、TRP通道炎症调控通路和B细胞受体信号通路等多种途径发挥保护作用。
利益冲突 所有作者均声明不存在利益冲突
[1] 乔宛虹. 毛冬青的药理作用及临床应用研究概况 [J]. 中国现代药物应用, 2008, 2(5): 104-106.
[2] 范星岳, 余继英. 毛冬青活性成分及检测方法的研究进展 [J]. 华西药学杂志, 2019, 34(5): 512-518.
[3] 柳文媛, 李萍, 冯锋, 等. 大鼠血浆中冬青素A的LC-MS测定法及其药动学研究 [J]. 中国药学, 2010,19(1): 38-42.
[4] 李美芬, 赵钟祥, 林朝展, 等. 毛冬青皂苷元ilexgenin A在大鼠体内的药动学研究 [J]. 华西药学杂志, 2012, 27(3): 296-297.
[5] 白荣钰, 易欢, 陈丰连, 等. 毛冬青三萜皂苷对动脉粥样硬化大鼠肠道菌群的影响 [J]. 中草药, 2021, 52(20): 6245-6253.
[6] Verhaar B J H, Prodan A, Nieuwdorp M,. Gut microbiota in hypertension and atherosclerosis: A review [J]., 2020, 12(10): E2982.
[7] Zhuang S, Zhong J, Bian Y F,. Rhein ameliorates lipopolysaccharide-induced intestinal barrier injury via modulation of Nrf2 and MAPKs [J]., 2019, 216: 168-175.
[8] Wu W C, Wang S S, Liu Q,. Metformin protects against LPS-induced intestinal barrier dysfunction by activating AMPK pathway [J]., 2018, 15(8): 3272-3284.
[9] Sánchez de Medina F, Romero-Calvo I, Mascaraque C,. Intestinal inflammation and mucosal barrier function [J]., 2014, 20(12): 2394-2404.
[10] Hand T W, Reboldi A. Production and function of immunoglobulin A [J]., 2021, 39: 695-718.
[11] Pietrzak B, Tomela K, Olejnik-Schmidt A,. Secretory IgA in intestinal mucosal secretions as an adaptive barrier against microbial cells [J]., 2020, 21(23): E9254.
[12] Patidar M, Yadav N, Dalai S K. Interleukin 15: A key cytokine for immunotherapy [J]., 2016, 31: 49-59.
[13] Mousavi A. CXCL12/CXCR4 signal transduction in diseases and its molecular approaches in targeted-therapy [J]., 2020, 217: 91-115.
[14] Wang B, Wu L J, Chen J,. Metabolism pathways of arachidonic acids: Mechanisms and potential therapeutic targets [J]., 2021, 6(1): 94.
[15] Sztolsztener K, Chabowski A, Harasim-Symbor E,. Arachidonic acid as an early indicator of inflammation during non-alcoholic fatty liver disease development [J]., 2020, 10(8): 1133.
[16] Santoni G, Morelli M B, Amantini C,. “Immuno-transient receptor potential ion channels”: The role in monocyte-and macrophage-mediated inflammatory responses [J]., 2018, 9: 1273.
[17] Rajasekhar P, Poole D P, Veldhuis N A. Role of nonneuronal TRPV4 signaling in inflammatory processes [J]., 2017, 79: 117-139.
Effect and mechanism oftriterpenoid saponins on lipopolysaccharide-induced intestinal barrier injury in mice based on transcriptome
WANG Ying1, CHEN Bing-ying1, WU Yu-rong1, ZHANG Ying-yin1, WANG Qian1, LI Yu2, ZHANG Lei1
1. School of Pharmaceutical Science, Guangzhou University of Chinese Medicine, Guangzhou 510006, China 2. School of Nursing, Guangzhou University of Chinese Medicine, Guangzhou 510006, China
To investigate the effect and potential mechanism oftriterpenoid saponins (IPTS) on lipopolysaccharide (LPS)-induced small intestinal injury in mice.C57BL/6 mice were randomly divided into control group, model group and IPTS low-, medium-and high-dose (88, 176, 264 mg/kg) groups. After 7 d of drug intervention, mice were ip LPS to induce small intestine injury. After 7 h of modeling, hematoxylin eosin (HE) staining was used to observe pathology of ileum in mice; Level of malondialdehyde (MDA) and activity of superoxide dismutase (SOD) in serum of mice were detected; qRT-PCR and Western blotting were used to detect inflammatory factor interleukin-1β (), tumor necrosis factor-α () mRNA and intestinal barrier tight junction protein,mRNA and protein expressions in ileum. The potential mechanism of IPTS on ileum was explored by transcriptome sequencing.Compared with model group, ileum in IPTS group was intact, oxidative stress injury was improved (< 0.001), level of ileitis factor was decreased (< 0.01), and intestinal barrier was restored (< 0.05, 0.01, 0.001). RNA-seq sequencing results showed that 2584 differentially expressed genes were screened from model group compared with control group; Compared with model group, 259 differentially expressed genes were screened out in IPTS high-dose group; These differentially expressed genes were mainly enriched in signaling pathway such as immunoglobulin A (IgA) related intestinal immunity, arachidonic acid metabolism, B cell receptor, transient receptor potential (TRP) channel inflammation regulation, linoleic acid metabolism, etc.IPTS can improve LPS induced intestinal injury in mice, which may be closely related to arachidonic acid metabolism, IgA related intestinal immune metabolism and TRP channel inflammatory regulation pathway.
triterpene saponins; intestinal barrier injury; transcriptome; oxidative stress; inflammation; intestinal barrier
R285.5
A
0253 - 2670(2022)22 - 7102 - 10
10.7501/j.issn.0253-2670.2022.22.013
2022-08-16
广东省科技计划项目(2016A020226031);广东省自然科学基金资助项目(2018A030313328);广东省教育厅创新强校工程项目(2016KTSCX019)
王 莹(1998—),女,硕士研究生,研究方向为中药药效物质基础及其作用机制。Tel: 13128253065 E-mail: 839072446@qq.com
张 蕾,女,硕士生导师,教授,研究方向为中药药效物质基础及其作用机制。Tel: 15622182155 E-mail: zhangleic431@163.com
[责任编辑 李亚楠]

