基于Box-Behnken设计-响应面法与质量综合评价优化葛根芩连汤煎煮工艺
徐蓓蕾,韩晓宇,刘晶晶,张文君,孙志伟,胡 扬,綦 峥,杨雪晶,孙文斌,杨娜娜,李文兰*
基于Box-Behnken设计-响应面法与质量综合评价优化葛根芩连汤煎煮工艺
徐蓓蕾1, 2, 3,韩晓宇1,刘晶晶4,张文君1, 2, 3,孙志伟1, 2, 3,胡 扬1, 2, 3,綦 峥1, 2, 3,杨雪晶1, 2, 3,孙文斌1,杨娜娜1,李文兰1, 2, 3*
1. 哈尔滨商业大学药学院,黑龙江 哈尔滨 150076 2. 抗肿瘤天然药物教育部工程研究中心,黑龙江 哈尔滨 150076 3. 黑龙江省预防与治疗老年性疾病药物研究重点实验室,黑龙江 哈尔滨 150076 4. 中国食品药品检定研究院,北京 100050
优化和科学评价葛根芩连汤(Gegen Qinlian Decoction,GQD)的煎煮工艺,为其经典方剂中药复方制剂的研究与开发奠定基础以及提供参考。以指纹图谱概貌结合多指标定量为综合评价,采用Box-Behnken设计-响应面法对加水量、浸泡时间、煎煮时间、煎煮次数进行优化。指纹图谱研究采用Waters Acquity UPLC BEH C18色谱柱(100 mm×2.1 mm,1.7 μm),流动相为乙腈-0.1%甲酸水溶液(梯度洗脱),体积流量为0.3 mL/min,柱温为35 ℃,进样量为1 µL;采用电喷雾离子源,以正、负离子模式检测,在质荷比(/)50~1200进行扫描,建立29批GQD指纹图谱并对共有峰进行指认。对图谱信息进行主成分分析,建立UPLC多波长检测方法测定木兰花碱、葛根素、药根碱、巴马汀、黄芩苷、大豆苷元、黄芩素、甘草苷8个成分含量,计算各样品综合得分,优化煎煮工艺。建立了29个试验号GQD样品的UPLC-Q-TOF-MS正、负离子模式下指纹图谱。正、负离子模式下分别有共有峰23、19个,并对其进行指认,指认出葛根素、大豆苷元、黄芩素、黄芩苷、巴马汀、药根碱、木兰花碱、甘草苷、甘草次酸、大豆苷、异甘草苷、汉黄芩苷、汉黄芩素、甘草酸、glyasperins D、甘草醇、绿原酸、韧黄芩素II。对共有峰中8个指标成分进行含量测定,以计算综合得分,综合得分结果显示,26号工艺为最佳工艺。最终确定GQD最佳煎煮工艺为加10倍量水,浸泡0.5 h,煎煮3次,每次0.5 h。所得出的GQD最佳煎煮工艺主要成分溶出率高,稳定可行,可为经典方剂GQD复方制剂的进一步研究和开发提供一定的依据。
葛根芩连汤;指纹图谱;Box-Behnken设计-响应面法;煎煮工艺;UPLC-Q-TOF-MS;葛根素;大豆苷元;黄芩素;黄芩苷;巴马汀;药根碱;木兰花碱;甘草苷;甘草次酸;大豆苷;异甘草苷;汉黄芩苷;汉黄芩素;甘草酸;glyasperins D;甘草醇;绿原酸;韧黄芩素II
葛根芩连汤(Gegen Qinlian Decoction,GQD)始载于张仲景《伤寒论》,由葛根、黄芩、黄连、甘草4味中药组成,葛根为君药,归脾胃经,解表退热散邪、养阴生津;黄芩、黄连为臣药,入大肠经,清泄胃肠里热、解毒燥湿;炙甘草甘缓和中,调佐诸药。本方以清热坚阴止利为主,兼以透表,为解表清里之剂,用于治疗太阳表邪内陷所致热下利证,是表里双解的经典方剂[1-2]。临床常用来治疗急性肠炎、细菌性痢疾、阿米巴痢疾、小儿轮状病毒性肠炎等,现代药理学研究表明GQD具有抗炎、抗氧化、增强机体免疫功能等药理作用[3-6]。课题组前期针对其治疗溃疡性结肠炎、相关结肠癌的作用机制以及药效物质进行了大量研究[7-10]。在经典名方研究的大背景下,有必要对该方的煎煮工艺进行进一步深入探究。历代本草及文献报道中对于GQD煎煮工艺有过记述,葛根半斤,黄芩3两,黄连3两,炙甘草2两,以上4味,以水8升,先煎煮葛根,减2升,内诸药,煮取2升,去滓,分温再服。古方记述基本确定了该方现代提取工艺的部分参数,经典方剂应遵循古方原则,而在实际生产过程中,提取容器、火力大小、提取、浓缩、干燥等因素皆会影响提取工艺,从而导致质量差异,因此,如何保证现代生产工艺与古方传统工艺产品质量的一致性,是经典名方研究成功的重点和难点问题,对于临床复方制剂质量具有重要意义[11]。
Box-Behnken设计-响应面法(Box-Behnken design-response surface methodology,BBD-RSM)是近年来广泛应用的多实验条件优化的方法,通过建立多元回归方程拟合因素和效应值之间的函数关系,以寻求最佳提取工艺参数[12-13]。中药复方是复杂的混合物体系,UPLC-Q-TOF-MS技术将UPLC对多组分样品的高分离能力与质谱高分辨率、高灵敏度的优势相结合,且能提供化合物的元素组成及离子碎片信息等特点,能够全面反映中药成分[14-15],结合现代数理分析技术可更加全面地优化中药复方提取工艺。因此,本研究在BBD-RSM设计基础上,结合UPLC-Q-TOF-MS技术,以指纹图谱概貌、共有峰指认及含量测定结果为评价指标,对GQD煎煮工艺进行参数优化,可为后续中药经典方剂GQD研究提供实验基础。
1 仪器与材料
1.1 仪器
G7116B 6546 LC/Q-TOF型安捷伦液相色谱,安捷伦科技(中国)有限公司;SK3310HP型超声波清洗器,上海科导超声仪器有限公司;JM型电子分析天平,诸暨市超泽衡器设备有限公司;001- 00S型电热恒温鼓风干燥箱,湖南兰思仪器有限公司;TopPette型手动单道可调移液器,大龙兴创实验仪器(北京)股份公司;HI1210型水浴锅,德国Leica公司。
1.2 饮片
葛根(批号1901002,产地陕西)、黄芩(批号19030405,产地安徽)、黄连(批号19031603,产地四川)、甘草(批号20211222,产地甘肃)中药饮片均购买于哈尔滨三棵树药材市场,经哈尔滨商业大学药学院中药学专业金哲雄教授鉴定,葛根为豆科葛属植物野葛(Willd.) Ohwi的干燥根,黄芩为唇形科黄芩属植物黄芩Georgi的干燥根,黄连为毛茛科黄连属植物黄连Franch.的干燥根茎,炙甘草为豆科甘草属植物甘草Fisch.的干燥根及根茎经蜜炙的炮制加工品,以上饮片均符合《中国药典》2020年版要求。
1.3 对照品及试剂
对照品葛根素(批号111025)、大豆苷元(批号wkq16080304)、黄芩素(批号wkq16011504)、黄芩苷(批号wkq16070503)、巴马汀(批号wkq19042309)、药根碱(批号wkq19022113)、木兰花碱(批号140525)、甘草苷(批号wkq16071504)均来自中国食品药品检定研究院;屈臣氏蒸馏水,广州屈臣氏食品饮料有限公司;甲醇(批号20220831)、乙腈(批号20220731),色谱级,德国默克公司;甲酸,批号202674,质谱级,美国Fisher公司;娃哈哈纯净水,杭州娃哈哈集团有限公司。
2 方法与结果
2.1 对照品溶液制备
分别精密称定适量的葛根素、大豆苷元、黄芩苷、黄芩素、巴马汀、药根碱、木兰花碱、甘草苷对照品,加入甲醇定容到10 mL,溶解制成质量浓度分别为1.8、2.5、1.5、1.5、1.8、0.8、1.0、0.3 mg/mL的混合对照品储备母液。0.22 μm微孔滤膜滤过,4 ℃避光保存,备用。
2.2 供试品溶液制备
遵循古方《伤寒论》中GQD的用法用量,参照《中国药典》2020年版一部葛根芩连片、葛根芩连丸的药物组成及比例,确定GQD中葛根、黄芩、黄连、炙甘草的药味比例为8∶3∶3∶2。分别称取符合药典标准的葛根8 g、黄芩3 g、黄连3 g、炙甘草2 g,各试验号样品按表1因素水平进行煎煮,滤过药渣,合并滤液,浓缩至浸膏状,用甲醇复溶定容到20 mL,4000 r/min离心(离心半径为6.21 cm)15 min,取上清液过0.22 μm微孔滤膜,即得供试品溶液。
2.3 BBD-RSM因素和水平设计
课题组前期以总黄酮及总生物碱的提取率为测定指标,分别对加水量、浸泡时间、煎煮时间、提取次数进行单因素实验,结果见表1~4。在此基础上,选取加水量(1)、浸泡时间(2)、煎煮时间(3)、煎煮次数(4)为考察因素,采用Box-Behnken设计-响应面法进行试验优化设计,所得因素水平见表5,共得到29个试验样品。

表1 加水量对GQD煎煮工艺的影响
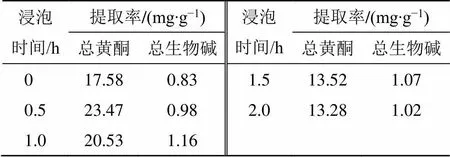
表2 浸泡时间对GQD煎煮工艺的影响
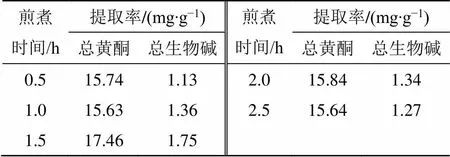
表3 煎煮时间对GQD煎煮工艺的影响
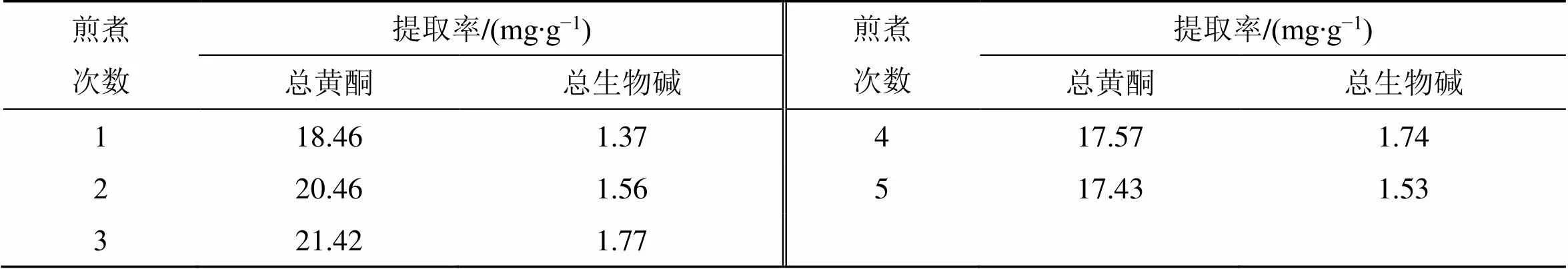
表4 煎煮次数对GQD煎煮工艺的影响
2.4 UPLC-Q-TOF-MS指纹图谱的建立
2.4.1 色谱条件 采用Waters Acquity UPLC®BEH C18色谱柱(100 mm×2.1 mm,1.7 μm);保护柱Waters Acquity UPLC®BEH C18(50 mm×2.1 mm,1.7 μm);流动相为0.1%甲酸水溶液-乙腈,梯度洗脱:0 min,5%乙腈;0~5 min,5%~10%乙腈;5~10 min,10%~12%乙腈;10~17 min,12%~22%乙腈;17~20 min,22%~29%乙腈;20~25 min,29%~80%乙腈;25~27 min,80%~95%乙腈;27~28 min,95%乙腈;体积流量0.3 mL/min;柱温35 ℃;进样量1 μL。
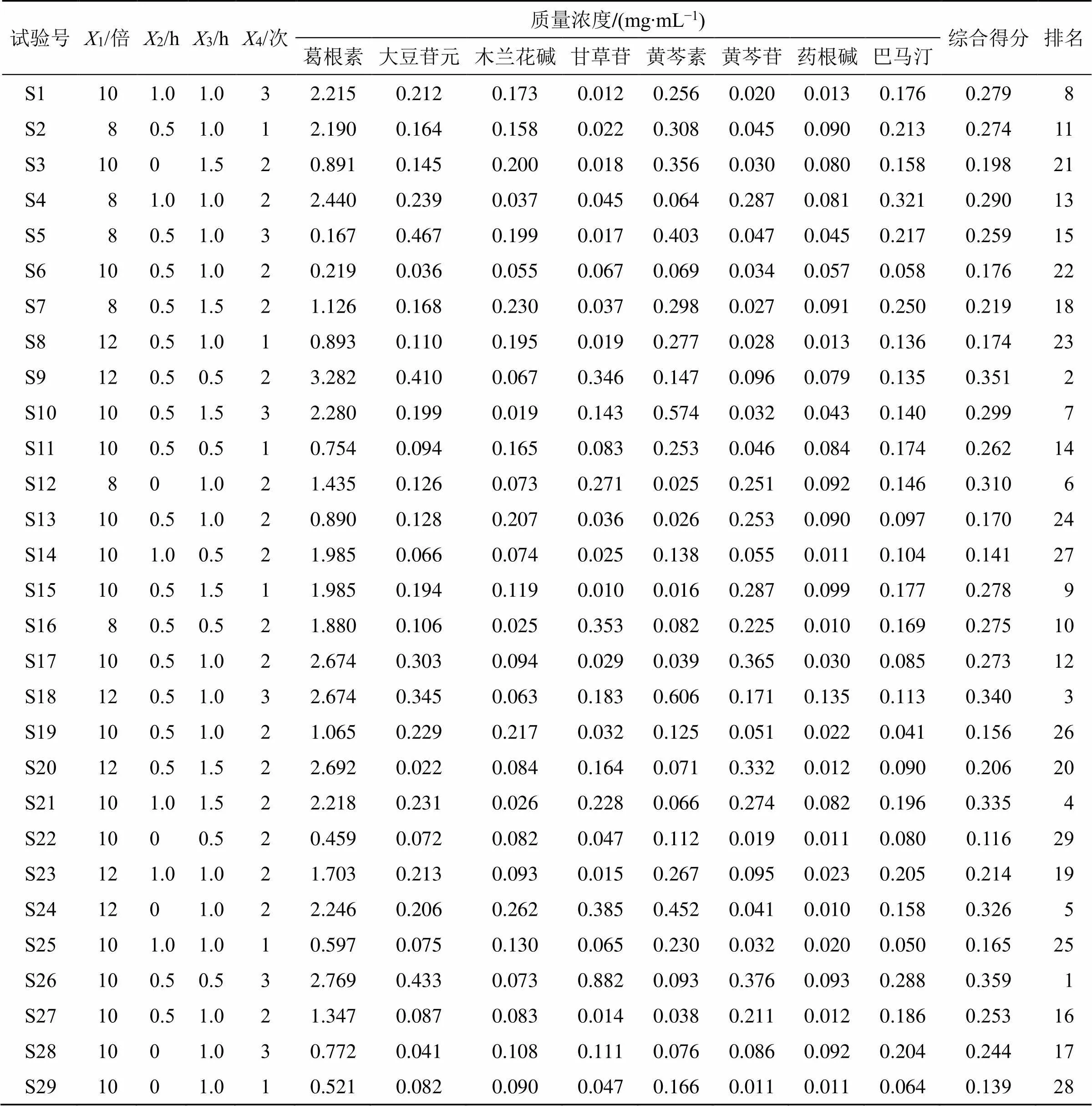
表5 GQD煎煮工艺响应面试验优化设计
2.4.2 质谱条件 离子源为电喷雾离子源(ESI);采用正、负离子采集模式;毛细管电压3 kV,雾化器气体650 kPa(6.5 bar),锥形电压35 kV,锥形气体积流量50 L/h,去溶剂气温度350 ℃,去溶剂气体积流量700 L/h,源温度180 ℃。
2.4.3 精密度试验 称取试验号17样品,按照“2.2”项下方法制得供试品溶液,按照“2.4.1”项下色谱条件进行检测,连续进样6次,记录谱图,选择出峰较稳定、响应值较高、峰面积较大的药根碱为参照峰,各共有峰相对保留时间和相对峰面积的RSD分别小于2.00%、2.17%,表明本方法精密度良好。
2.4.4 稳定性试验 称取试验号17样品,按照“2.2”项下方法制得供试品溶液,按照“2.4.1”项下色谱条件进行检测,分别于0、4、8、12、16、20、24 h进样,记录谱图。选择出峰较稳定、响应值较高、峰面积较大的药根碱为参照峰,各共有峰相对保留时间和相对峰面积的RSD分别小于1.97%、2.00%,表明供试品溶液在24 h内稳定性良好。
2.4.5 重复性试验 平行制备试验号17样品6份,按照“2.2”项下方法制得供试品溶液,分别按照“2.4.1”项下色谱条件进行检测,记录谱图。选择出峰较稳定、响应值较高、峰面积较大的药根碱为参照峰,各共有峰相对保留时间和相对峰面积的RSD分别小于2.26%、2.83%,表明本方法重复性良好。
2.4.6 指纹图谱分析 分别称取29个试验号样品,按照“2.2”项下方法制得供试品溶液,分别按照“2.4.1”“2.4.2”项下色谱条件和质谱条件进行检测,得到29个试验号样品UPLC-Q-TOF-MS正、负离子模式下总离子流图(total ion chromatogram,TIC),见图1、2。将谱图导入“中药色谱指纹图谱相似度评价系统2004A版”进行分析。分别确定了正、负离子模式下出峰明显、重复性良好、保留时间稳定的共有峰23、19个(R为对照图谱),依据相对分子质量、主要离子碎片等信息对共有峰进行指认,指认结果如表6所示。
2.4.7 主成分分析(principal component analysis,PCA) 将GQD样品正、负离子模式下指纹图谱的共有峰峰面积分别导入SPSS 20.0软件,进行PCA,正离子模式下PCA结果见表7和图3-A;负离子模式下PCA结果见表8和图3-B。主成分特征值、累积方差贡献率以特征值>1为提取标准,正离子模式下共提取出8个主成分,得到主成分的累积方差贡献率78.57%;负离子模式下共提取出5个主成分,得到主成分的累积方差贡献率为72.611%;能够代表样品中成分的大部分信息。
从表9中可以看出根据因子载荷矩阵,在主成分1中,除了1~3、8号色谱峰以外,其余19个成分的因子载荷非常接近,均是主成分1的重要贡献成分,说明正离子模式下主成分1很好地表达了GQD多成分物质群。
从表10中可以看出根据因子载荷矩阵,在主成分1中,除了9、19号色谱峰以外,其余17个成分的因子载荷非常接近,均是主成分1的重要贡献成分,说明负离子模式下主成分1很好地表达了GQD多成分物质群。
2.5 GQD多成分含量测定研究
2.5.1 样品测定 在共有峰指认和PCA的基础上对29个试验号样品中8个共有成分指认并进行含量测定。如图4所示,分别在254 nm(葛根素、大豆苷元)、270 nm(黄芩苷、黄芩素、木兰花碱、甘草苷)、345 nm(巴马汀、药根碱)波长下对相应成分进行测定。色谱条件同“2.4.1”项下。

图2 29批GQD样品叠加图谱(负离子模式)

表6 GQD共有峰指认结果
2.5.2 线性关系考察 精密量取“2.1”项下制备的对照品储备液,用甲醇通过2倍稀释法分别稀释2、4、8、16、32倍,制得各质量浓度的混合对照品溶液,分别按照“2.5.1”项下条件进行测定,记录峰面积。以质量浓度为横坐标(),峰面积为纵坐标()进行线性回归,得各成分的回归方程分别为木兰花碱=32 917+765.76,=0.999 0,线性范围0.071~1.510 mg/mL;葛根素=18 077+246.57,=0.999 3,线性范围0.020~2.240 mg/mL;药根碱=93 737+1646.8,=0.999 7,线性范围0.010~0.150 mg/mL;巴马汀=20 535-387.09,=0.999 5,线性范围0.040~1.370 mg/mL;黄芩苷=46 102+2299,=0.999 3,线性范围0.020~1.720 mg/mL;大豆苷元=87 047+58.59,=0.999 6,线性范围0.006~0.600 mg/mL;黄芩素=50 810+294.76,=0.999 3,线性范围0.004~0.500 mg/mL;甘草苷=23 347+2 042.6,=0.999 2,线性范围0.060~0.180 mg/mL。
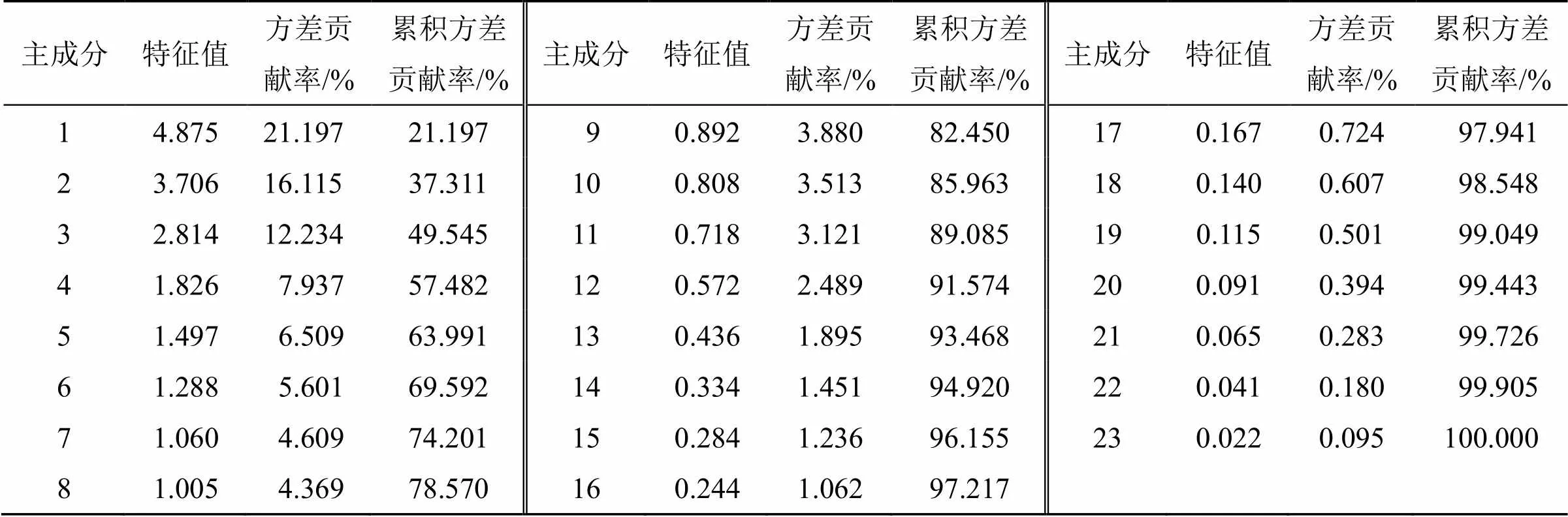
表7 主成分初始特征值和累积方差贡献率(正离子模式)
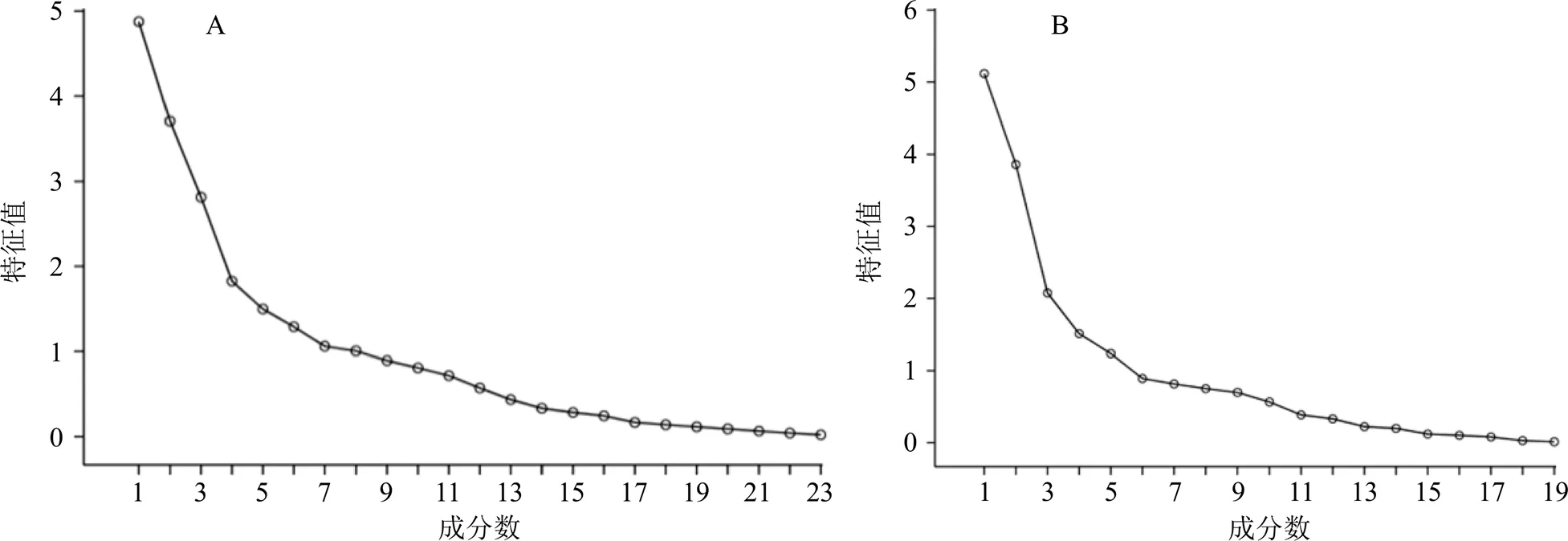
图3 正离子模式(A)和负离子模式(B)下PCA碎石图

表8 主成分初始特征值和累积方差贡献率(负离子模式)
2.5.3 精密度试验 按试验号17的制备方法制备供试品溶液,按照“2.5.1”项下色谱条件,连续进样6次,记录各成分色谱峰峰面积,计算其RSD。结果木兰花碱、葛根素、药根碱、巴马汀、黄芩苷、大豆苷元、黄芩素、甘草苷峰面积的RSD分别为1.97%、0.95%、1.64%、1.75%、1.56%、2.15%、1.46%、1.55%,表明仪器精密度良好。
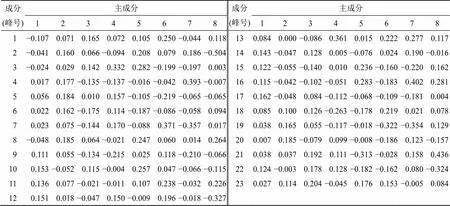
表9 成分得分系数矩阵(正离子模式)
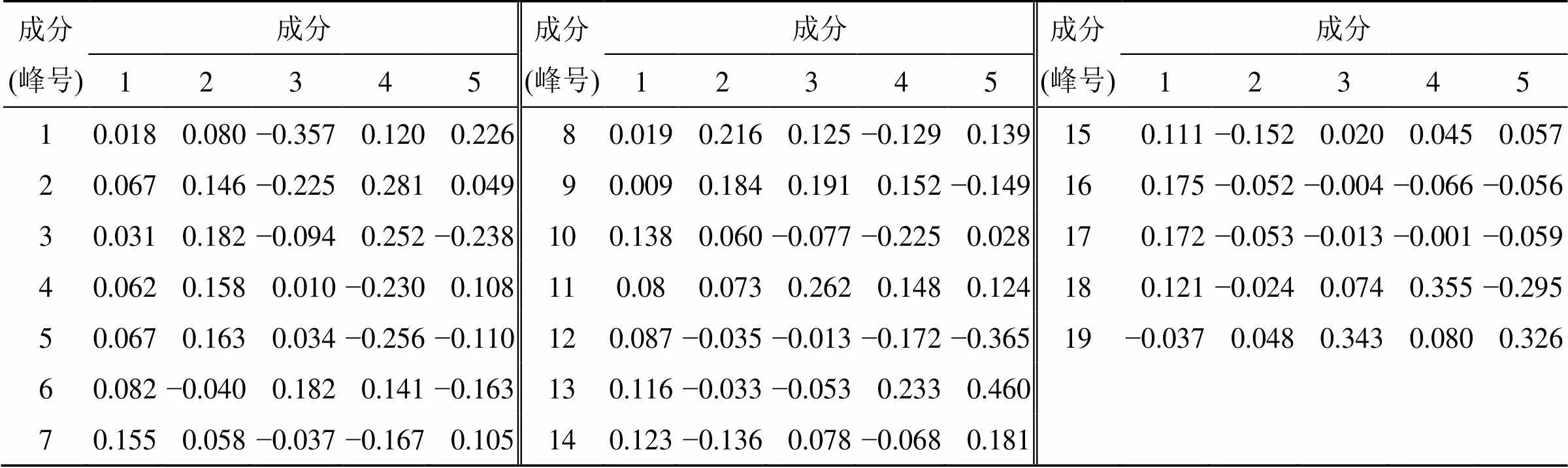
表10 成分得分系数矩阵(负离子模式)
2.5.4 稳定性试验 按试验号17的制备方法制备供试品溶液,室温放置,分别在制备后0、4、8、12、16、20、24 h时,按照“2.5.1”项下色谱条件测定,记录各成分色谱峰峰面积,计算其峰面积的RSD。结果木兰花碱、葛根素、药根碱、巴马汀、黄芩苷、大豆苷元、黄芩素、甘草苷峰面积的RSD分别为1.65%、1.86%、2.41%、2.18%、1.74%、2.55%、1.86%、1.39%,表明供试品溶液在室温放置24 h内稳定性良好。
2.5.5 重复性试验 按试验号17的制备方法平行制备6份供试品溶液,按照“2.5.1”项下色谱条件测定,记录各成分色谱峰峰面积,计算各组分峰面积的RSD。结果木兰花碱、葛根素、药根碱、巴马汀、黄芩苷、大豆苷元、黄芩素、甘草苷的峰面积RSD分别为1.45%、1.23%、1.72%、1.63%、1.64%、1.53%、1.28%、1.46%,表明该方法重复性良好。
2.5.6 加样回收率试验 按试验号17的制备方法制备6份供试品溶液,每份称取1 mL,分别精密加入8种对照品适量,按照“2.5.1”项下色谱条件测定,记录各组分色谱峰峰面积,计算各成分加样回收率及其峰面积的RSD。结果木兰花碱、葛根素、药根碱、巴马汀、黄芩苷、大豆苷元、黄芩素、甘草苷的平均加样回收率分别为99.2%、99.0%、98.7%、98.6%、99.3%、99.5%、98.5%、99.4%,峰面积RSD分别为1.37%、1.33%、1.47%、1.38%、1.14%、1.5%、1.33%、1.27%。
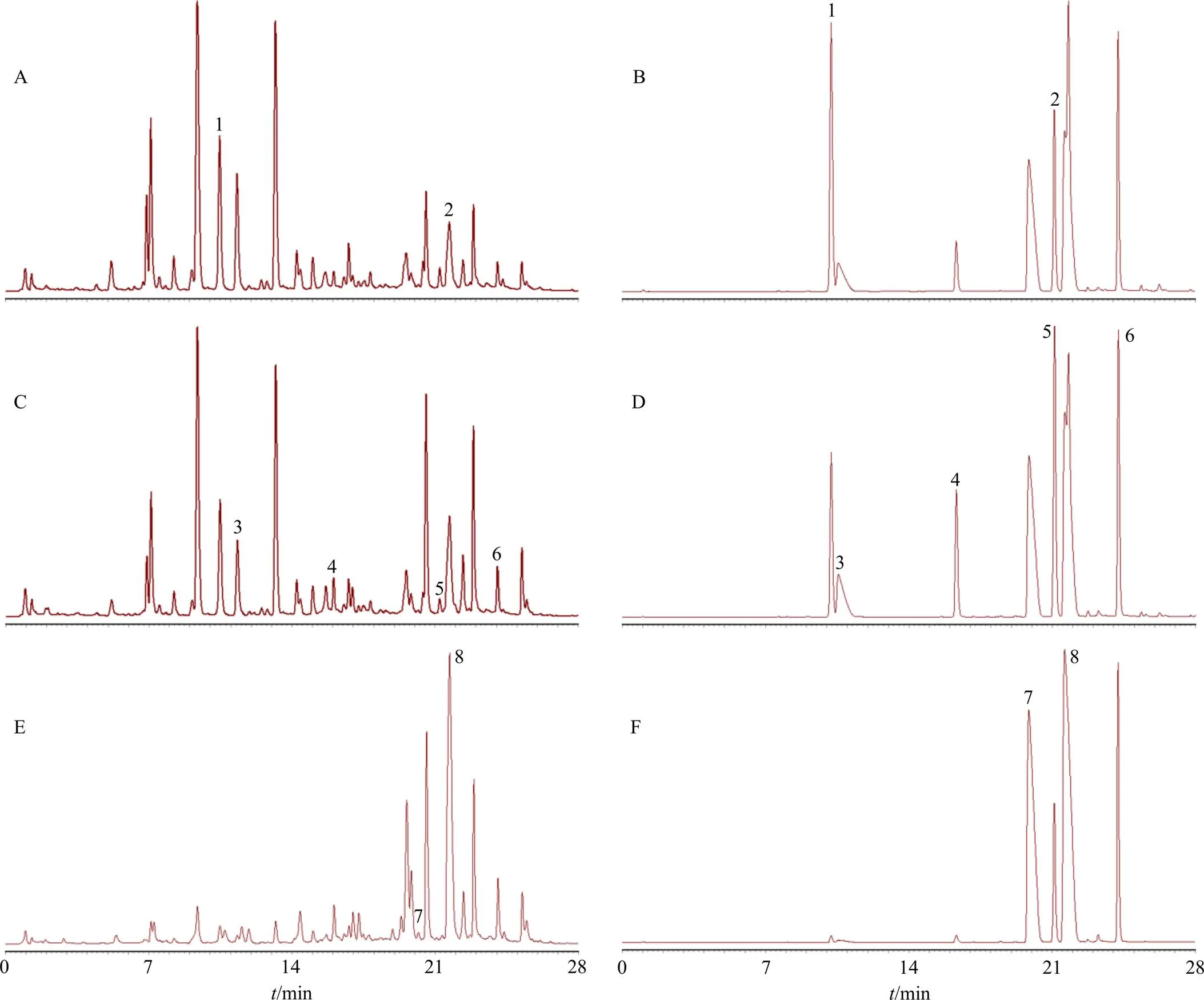
1-葛根素 2-大豆苷元 3-木兰花碱 4-甘草苷 5-黄芩素 6-黄芩苷 7-药根碱 8-巴马汀 A、C、E分别为254、270、345 nm波长下GQD样品图谱 B、D、F分别为254、270、345 nm波长下混合对照品图谱
2.5.7 多指标含量测定评价结果 计算各成分含量测定结果,并赋予8成分相同权重(8成分分别为4味药的核心代表性成分,赋予相同权重),以综合评分进行评价[13],综合评分=(1/max+2/max+3/max+4/max+5/max+6/max+7/max+8/max)/8,如表5所示。综合得分结果显示26号工艺为最佳工艺。
2.6 BBD-RSM回归模型的建立及分析
采用Design Expert 10软件,通过响应面法进行工艺优化。分别对各因素水平进行多元线性和非线性回归,建立各指标综合评分()对4个因素(1、2、3、4)的回归方程模型Y=8.42-1.351-0.282-0.263-1.424-0.0912-0.1013+0.1114+0.7123+0.1024-0.2434+0.0612+0.2822+0.6332+0.1642,相关系数=0.886 5,校正系数0.870 4,说明该模型拟合度良好,试验误差小,可用此模型对综合评分进行分析和预测。根据软件拟合得到回归方程等高线及响应面图,评价试验因素之间的交互强度,来确定最佳煎煮工艺参数。通过等高线的形状反映交互效应的强弱,椭圆表示交互作用强,圆形则交互作用较弱,结果见图5。根据模型拟合结果,加水量8.9倍、浸泡时间0.57 h、煎煮时间0.81 h、煎煮次数2.75次。
因此,以本实验中BBD-RSM设计为依据,整合指纹图谱、化学模式识别以及多指标含量测定结果,从煎煮及后续生产工艺实际情况出发,并参考GQD经典名方制备工艺,本着成本节约及最大限度提取有效成分的原则,最终确定GQD最佳工艺为10倍量水、浸泡0.5 h、煎煮0.5 h、煎煮3次。
2.7 工艺验证实验
选择最佳煎煮工艺条件(加10倍量水,浸泡0.5 h,煎煮3次,每次0.5 h)进行3次验证试验,按上述方法进行指纹图谱和含量测定,计算得到指纹图谱相似度分别为0.983、0.992、0.987,3次验证样品含量测定的综合得分如表11所示,与最佳工艺所得样品综合评分基本吻合,说明优化得到的提取工艺条件较为稳定可行。
3 讨论
提取工艺是中药复方药效物质与质量控制领域的核心环节,优化中药复方提取工艺参数,是高效充分提取药效物质,保障临床有效性的前提,也是影响中药制剂质量的关键因素。古方记载GQD用法为葛根、黄芩、黄连、炙甘草,上四味,以水八升,先煮葛根,减两升,内诸药,煮取二升,去滓,分温再服。因现代煎煮工具、条件、技术手段与古代相去甚远,导致现代煎煮工艺与古法记载存在一定差异[11,16]。遵循古方优化现代煎煮工艺参数成为经典名方研究的重中之重环节。本研究依据刘昌孝院士提出的“传承不泥古,创新不离宗,论证以求真”的基本科研精神,参照古籍记载,综合考虑现代提取工艺的实际情况,最终优化GQD煎煮工艺。模型拟合结果得到的最佳工艺为加水量8.9倍、浸泡时间0.57 h、煎煮时间0.81 h、煎煮次数2.75次。结合煎煮工艺的实际情况以及研究过程中指纹图谱和化学模式识别多指标含量测定结果得到并确定GQD最佳工艺。

图5 4因素对综合评分的响应面图
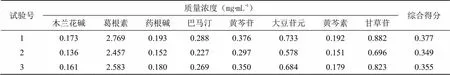
表11 验证实验结果
课题组前期预实验研究发现,加水量、浸泡时间、煎煮时间、煎煮次数对GQD的提取工艺有较大影响,其中煎煮次数是对复方提取质量影响最大的因素。在此基础上,本研究采用BBD-RSM设计对GQD提取工艺的加水量、浸泡时间、煎煮时间、煎煮次数进行优化,结合UPLC-Q-TOF-MS指纹图谱概貌分析与多指标成分综合评价分析,确定了GQD最佳煎煮工艺。
BBD-RSM设计法近年来广泛应用于经典中药复方提取工艺研究[17-19],是一种通过建立多元回归方程拟合因素和效应值之间的函数关系寻求最佳提取工艺参数的设计方法[20],将响应面设计法应用于古方提取工艺研究相比于正交试验更简化,相对于均匀设计更全面[21],能够有效减少试验次数,操作起来更高效同时更节约试验成本。运用现代分析技术UPLC-Q-TOF-MS构建中药复方GQD的指纹图谱,方法精密度、稳定性良好,并依据分子量和离子碎片信息等对正、负离子模式下的共有峰分别进行指认,可以更加精准更加全面地反映GQD全成分及主要成分的信息[22-23]。《中国药典》2020年版要求葛根芩连方中只对葛根素、盐酸小檗碱、黄芩苷3个成分进行定量分析,本实验建立了GQD不同煎煮工艺指纹图谱,结合主成分分析,选择分离良好,峰形稳定,峰面积较大、易于定量的共有峰所对应的8个成分作为指标成分定量分析[24-25],设计质量综合评分。
相较于传统提取工艺在中药生产过程中的局限性,基于现代设计手段的提取工艺研究优势逐渐突显,在遵古而不泥古的原则下,明显提高了提取效率,节约资源,节省时间[26-27],本实验首次基于BBD-RSM设计,结合UPLC-Q-TOF-MS指纹图谱概貌分析与多指标成分质量综合评价优化GQD最佳现代煎煮工艺,UPLC-Q-TOF-MS能更加准确全面地从定性角度反映GQD全成分信息,通过共有峰指认、主成分分析以及在此基础上所展开的关键指标成分含量测定,做到从“定性”和“定量”2个角度综合优化GQD煎煮工艺。所得提取工艺缩短了煎煮时间,简化操作,有利于药效物质的提取,是GQD更为高效的提取工艺,避免了不必要的中药资源浪费,为经典方剂GQD的进一步研究与开发提供物质基础参考和依据,为保障临床药效奠定基础[28]。
利益冲突 所有作者均声明不存在利益冲突
[1] 任伟光, 郭丽丽, 张翠英. 葛根芩连汤的研究进展及质量标志物的预测分析 [J]. 中国新药杂志, 2021, 30(18): 1675-1679.
[2] 陈丽红, 唐于平, 王强. 葛根芩连汤的现代研究进展 [J]. 中草药, 2010, 41(4): 676-680.
[3] 滕健樣. 葛根芩连汤方证研究 [D]. 北京: 北京中医药大学, 2012.
[4] 刘莲萱, 吴威, 庞琳琳, 等. 葛根芩连汤化学成分、药理作用及临床应用研究进展 [J]. 中华中医药学刊, 2022, 40(3): 147-154.
[5] 曾瀞仪. 基于数据挖掘的葛根芩连汤方证研究 [D]. 北京: 北京中医药大学, 2017.
[6] 孙婷, 李新民, 孙丹, 等. 基于整合药理学平台研究葛根芩连汤治疗小儿肺炎的作用机制 [J]. 药物评价研究, 2019, 42(1): 78-83.
[7] 徐蓓蕾, 张贵君, 崔向微, 等. 葛根芩连汤药效组分抑菌生物效价测定 [J]. 中华中医药杂志, 2013, 28(1): 230-233.
[8] Xu B L, Zhang G J, Ji Y B. Active components alignment of Gegenqinlian Decoction protects ulcerative colitis by attenuating inflammatory and oxidative stress [J]., 2015, 162: 253-260.
[9] 徐蓓蕾, 吴迪, 杨娜娜, 等. 基于“通路-疾病”交互网络的葛根芩连汤及其指标成分组合物干预小鼠溃疡性结肠炎相关结肠癌的作用 [J]. 中草药, 2020, 51(19): 4991-4998.
[10] Xu B L, Li P Y, Zhang G J. Comparative pharmacokinetics of puerarin, daidzin, baicalin, glycyrrhizic acid, liquiritin, berberine, palmatine and jateorhizine by liquid chromatography-mass spectrometry after oral administration of Gegenqinlian Decoction and active components alignment (ACA) to rats [J]., 2015, 988: 33-44.
[11] 代珊, 李帅, 张爱军, 等. 基于基准关联度和AHP-熵权法综合评价经典名方小续命汤古今提取工艺 [J]. 中草药, 2022, 53(3): 726-734.
[12] 栗焕焕, 毛营营, 张国琴, 等. 响应面分析法优化吴茱萸提取工艺及多指标定量指纹图谱研究 [J]. 中华中医药杂志, 2020, 35(11): 5716-5720.
[13] 何瑶, 江华娟, 成颜芬, 等. 基于Box-Behnken设计-响应面法与质量综合评价优化经典名方桃红四物汤煎煮工艺 [J]. 中草药, 2021, 52(22): 6845-6855.
[14] 陈明曦, 李艳梅, 孙婷, 等. 液相色谱-质谱联用技术在中药质量研究中的应用 [J]. 中国药剂学杂志, 2021, 19(1): 12-17.
[15] Yu Y, Yao C L, Guo D A. Insight into chemical basis of traditional Chinese medicine based on the state-of-the-art techniques of liquid chromatography-mass spectrometry [J]., 2021, 11(6): 1469-1492.
[16] 文谨, 刘起华, 章军, 等. 葛根芩连汤煮散煎煮工艺优化 [J]. 中成药, 2016, 38(9): 2070-2073.
[17] 王蕊娇, 张育龙, 董培良, 等. 基于Box-Behnken设计和主成分分析法研究当归-苦参药对的提取工艺及不同比例配伍对急性心肌缺血大鼠的影响 [J]. 中草药, 2022, 53(12): 3632-3642.
[18] 曾海蓉, 李婷娜, 冉倩, 等. 基于熵权法结合Box- Behnken响应面法优化桂枝芍药知母颗粒复方提取工艺 [J]. 中草药, 2020, 51(1): 84-90.
[19] 吴振起, 高畅, 杨璐, 等. 基于层次分析法结合Box- Behnken设计-响应面法优选养阴清肺汤加味提取工艺 [J]. 中草药, 2019, 50(12): 2862-2867.
[20] 宋佳, 黄飞龙, 段树卿, 等. Plackett-Burnman设计联合Box-Behnken设计-效应面法优化心神宁片的提取工艺 [J]. 中草药, 2016, 47(3): 430-435.
[21] 王萍, 王宇鹤, 许刚, 等. 大叶秦艽总环烯醚萜苷3种提取工艺优化及其抗氧化活性研究 [J]. 中成药, 2022, 44(8): 2435-2443.
[22] 程斌, 童静玲, 周爱珍, 等. 基于UPLC-Q-TOF-MS谱-效分析的浙贝母化痰质量标志物的初步筛选及含量差异研究 [J]. 中国药学杂志, 2021, 56(6): 462-471.
[23] 程斌, 周爱珍, 彭昕, 等. 浙贝母UPLC-Q-TOF-MS/ MS指纹图谱的建立及其抗炎质量标志物的分析 [J]. 中国药房, 2020, 31(17): 2129-2135.
[24] 王钰乐, 刘文, 杨道斌, 等. 葛根芩连汤的UPLC-MS/ MS指纹图谱研究 [J]. 中药新药与临床药理, 2017, 28(2): 206-211.
[25] 吴亿晗, 王迪, 杨晓琴, 等. 葛根芩连丸UPLC指纹图谱建立及7种成分测定 [J]. 中成药, 2018, 40(5): 1083-1087.
[26] 李丹, 石沁, 张李, 等. 基于逆流动态提取技术的红丹通络颗粒提取工艺优化研究 [J]. 中药材, 2022, 45(2): 419-421.
[27] 代珊, 李帅, 张爱军, 等. 基于基准关联度和AHP-熵权法综合评价经典名方小续命汤古今提取工艺 [J]. 中草药, 2022, 53(3): 726-734.
[28] 丰茂秀, 杨颖, 温柔, 等. 经方百合知母汤提取工艺优化 [J]. 中华中医药学刊, 2021, 39(7): 127-130.
Decocting process of Gegen Qinlian Decoction was optimized based on Box-Behnken design-response surface methodology and comprehensive quality evaluation
XU Bei-lei1, 2, 3, HAN Xiao-yu1, LIU Jing-jing4, ZHANG Wen-jun1, 2, 3, SUN Zhi-wei1, 2, 3, HU Yang1, 2, 3, QI Zheng1, 2, 3, YANG Xue-jing1, 2, 3, SUN Wen-bin1, YANG Na-na1, LI Wen-lan1, 2, 3
1. School of Pharmacy, Harbin University of Commerce, Harbin 150076, China 2. Engineering Research Center of Natural Anti-cancer Drugs, Ministry of Education, Harbin 150076, China 3. Heilongjiang Key Laboratory of Preventive and Therapeutic Drug Research of Senile Diseases, Harbin 150076, China 4. National Institutes for Food and Drug Control, Beijing 100050, China
To optimize and scientifically evaluate the decoction process of Gegen Qinlian Decoction (GQD, 葛根芩连汤) based on Box-Behnken design-response surface methodology in order to lay the foundation and provide reference for the research and development of traditional Chinese medicine compound preparations.Taking fingerprint profile combined with multi-index quantification as the comprehensive evaluation, the amount of water, soaking time, decocting time and decocting times were optimized by Box-Behnken design response surface method. The fingerprint analysis was performed on a Waters Acquity UPLC BEH C18column (100 mm × 2.1 mm, 1.7 μm) with mobile phase consisted of acetonitrile-0.1% formic acid aqueous solution (gradient elution) at the volume flow of 0.3 mL/min. The column temperature was 35 ℃, and the injection volume was 1 µL. The fingerprints of 29 batches of GQD were established by scanning in the range of mass charge ratio (/) of 50—1200 with ESI source and detected in positive and negative ion modes, and common peaks were identified. The principal components were analyzed, and contents of 8 main components, including magnoflorine, puerarin, jatrorrhizine, palmatine, baicalin, daidzein, baicalein and liquiritin were determined by UPLC multi-wavelength detection method. And the comprehensive score of each sample was calculated to optimize the decoction process..The UPLC-Q-TOF-MS fingerprints of 29 test number of GQD samples were established in positive and negative ion mode. There were 23 and 19 common peaks in positive and negative ion mode respectively, and 18 components of them were identified, including puerarin, daidzein, baicalein, baicalin, palmatine, jatrorrhizine, magnoflorine, liquiritin, glycyrrhetinic acid, daidzin, isoliquiritin, wogonoside, wogonin, glycyrrhizic acid, glyasperins D, glycyrol, chlorogenic acid and tenaxin II. The content of eight index components of the common peaks was determined to calculate the comprehensive score, and the comprehensive score results showed that test number 26 was the optimal preparation process condition. Finally, the best decoction process for GQD was determined as follows, 10 times amount of water, soaking for 0.5 h, decocting for 3 times, and each time for 0.5 h.The optimal decoction technology with high dissolution rate of main components obtained by this experiment was stable and feasible, which could provide a certain basis for further research and development of the classical prescription compound preparation of GQD.
Gegen Qinlian Decoction; fingerprints; Box-Behnken design-response surface methodology; decoction technology; UPLC-Q-TOF-MS; puerarin; daidzein; baicalein; baicalin; palmatine; jatrorrhizine; magnoflorine; liquiritin; glycyrrhetinic acid; daidzin; isoliquiritin; wogonoside; wogonin; glycyrrhizic acid; glyasperins D; glycyrol; chlorogenic acid; tenaxin II
R283.6
A
0253 - 2670(2022)22 - 7070 - 12
10.7501/j.issn.0253-2670.2022.22.010
2022-06-15
黑龙江省自然科学基金联合指导计划(LH2020H069);哈尔滨商业大学青年学术骨干支持计划(2020CX12)
徐蓓蕾(1983—),女,博士,副教授,主要研究方向为中药药效物质与质量评价研究。Tel: 15124515866 E-mail: xubeilei2006@163.com
李文兰(1967—),女,博士,教授/院长,主要研究方向为中药药效物质与质量评价研究。Tel: 13936169153 E-mail: lwldzd@163.com
[责任编辑 郑礼胜]

