人参固本口服液对椎间盘退变小鼠肠道菌群的影响
李艺璇,姜艳玲,廖 镒,王 伟,欧儒珍,唐树杰*,孙国栋*
人参固本口服液对椎间盘退变小鼠肠道菌群的影响
李艺璇1,姜艳玲2#,廖 镒1,王 伟2,欧儒珍3,唐树杰1*,孙国栋3*
1. 暨南大学中医学院,广东 广州 510630 2. 鲁南制药集团股份有限公司,中药制药共性技术国家重点实验室,山东 临沂 276006 3. 暨南大学附属第一医院,广东 广州 510630
研究人参固本口服液对椎间盘退变小鼠肠道菌群的影响。28只小鼠随机分为假手术组、模型组、布洛芬(90 mg/kg)组和人参固本口服液(3 mL/kg),每组7只。采用尾部全层穿刺法制备椎间盘退变模型,给予相应药物干预28 d,拍摄尾部核磁共振;采用苏木素-伊红(HE)、番红固绿染色观察小鼠肝、肾、椎间盘的病理变化;采用16S rRNA高通量测序检测小鼠结肠内肠道菌群组成和结构。与假手术组比较,模型组椎间盘结构明显破坏;肠道菌群α多样性分析Chao指数、Shannon指数无明显差异,β多样性PC1、PC2水平均有明显偏移;疣微菌门(Verrucomicrobiota)、巴氏杆菌门(Patescibacteria)、杜氏杆菌属、阿克曼氏菌属的相对丰度显著降低(<0.05、0.01),粪杆菌属相对丰度显著升高(<0.001)。与模型组比较,人参固本口服液组失序的椎间盘结构得到修复;肠道菌群α多样性Chao指数、Shannon指数显著升高(<0.05),β多样性在PC1水平更趋向于假手术组;疣微菌门、Lachnospiraceae_NK4A136_group、阿克曼氏菌属、回肠杆菌属相对丰度显著升高(<0.05、0.01、0.001),粪杆菌属相对丰度显著降低(<0.001)。人参固本口服液能够修复髓核、纤维环的结构,减轻炎性细胞浸润,延缓椎间盘退变的病理过程,其机制可能与调控肠道菌群微环境有关。
人参固本口服液;椎间盘退变;肠道菌群;髓核;纤维环
全球约5.4亿人受到腰背痛的困扰[1],承受着巨大的身体负担和经济压力[2]。椎间盘退变(intervertebral disc degeneration,IVDD)导致椎间盘机械稳定性以及力的传导功能下降,与腰背痛有着密不可分的联系[3]。目前的治疗方式主要包括非甾体类抗炎药、康复锻炼、心理辅导、介入及手术治疗等[4],但是均无法恢复甚至逆转IVDD的病理改变。此外,长期服用非甾体类抗炎药具有消化道出血及肝肾损伤的风险。为缓解病人痛苦、提高患者的生活质量,寻找有效和不良反应小的治疗药物十分必要。
传统医学在治疗腰痛方面具有很好的疗效。传统医学认为,腰为肾之府,故IVDD的治疗应从肾论治。人参固本口服液[5]是在六味地黄丸的基础上,添加人参、天冬及麦冬,具有固本培元、补肾填精的功效。研究发现,骨相关疾病与肠道菌群失调有密切关系[6-7]。考虑到肠道菌群在关节稳态中起重要作用[8],因此本研究从肠道菌群角度探究人参固本口服液治疗IVDD的作用及其机制。
1 材料
1.1 动物
SPF级雄性C57BL/6J小鼠,4~6周龄,体质量20~25 g,购自浙江维通利华实验动物技术有限公司,许可证号SYXK(粤)2017-0174。动物饲养于暨南大学动物实验中心,室温20~24 ℃,相对湿度52%~64%,光照周期10~14 h,自由进食饮水,实验前适应性饲养10 d。动物实验经暨南大学动物实验中心伦理委员会批准(批准号IACUC-20220221-07)。
1.2 药品与试剂
人参固本口服液(批号29190332,10 mL/支)购自鲁南厚普制药有限公司;布洛芬缓释胶囊(批号H20066822,0.3 mg/粒)购自珠海润都制药股份有限公司;DNA抽提试剂盒购自MP Biomedicals公司;琼脂糖购自Biowest公司;Fast Pfu DNA聚合酶购自北京全式金生物技术有限公司;DNA凝胶回收试剂盒购自Axygen公司;建库试剂盒购自Bioo Scientific公司;测序试剂盒购自美国Illumina公司;4%多聚甲醛(批号043368)购自ALFA公司;1.25%三溴乙醇(批号T48402)购自美国Sigma公司;无水乙醇(批号10009218)购自上海国药集团化学试剂有限公司;二甲苯(批号X820585)购自广州丛源仪器有限公司;中性树胶(批号yk-3313)购自广州市佳研生物有限公司;苏木素-伊红(HE)染液套装(批号GP1031)、番红固绿染液套装(批号G1031)、环保型脱蜡透明液(批号G1128)、分化液(批号G1039)购自Servicebio公司。
1.3 仪器
DYY-6C型核酸电泳仪、ND2000型光度计、94/30型小动物磁共振成像系统(BioSpec公司);Donatello脱水机、Giotto染色机(Diapath公司);JB-P5型包埋机、JB-L5型冻台(武汉俊杰电子有限公司);RM2016型病理切片机(上海徕卡仪器有限公司);KD-P型组织摊片机(浙江省金华市科迪仪器设备有限公司);Eclipse E100型正置荧光显微镜(日本Olympus公司);9700型PCR仪(美国ABI公司);Quantus™高灵敏荧光计(Promega公司);Miseq PE300型测序平台(上海美吉生物公司)。
2 方法
2.1 动物分组、造模及给药
28只C57BL/6J小鼠随机分为假手术组、模型组、布洛芬(90 mg/kg)组和人参固本口服液(3 mL/kg,相当于临床等效剂量)组,每组7只。除假手术组外,其余各组均采用尾部全层穿刺法制备IVDD模型[9]:小鼠ip 1.25%三溴乙醇麻醉(0.3 mL/只),沿矢状面切开尾部Co3~5节段皮肤,暴露Co3~4、Co4~5椎间盘,31G注射器针头沿平行软骨终板的方向刺入1.5 mm,进入纤维环、髓核后,轴向旋转180°,保持10 s,缝合,青霉素钠涂抹伤口防止感染。假手术组仅切开尾部皮肤,不予椎间盘穿刺。各给药组ig相应药物,假手术组和模型组ig生理盐水(3 mL/kg),1次/d,连续28 d。
2.2 椎间盘核磁共振成像检测
末次给药后禁食12 h,使用小动物呼吸麻醉机用异氟烷麻醉小鼠,对小鼠Co3~5椎间盘进行核磁共振成像检测。
2.3 肝、肾、椎间盘的HE与番红固绿染色观察
小鼠于无菌环境中脱颈椎处死,取肝、肾、椎间盘,于4%多聚甲醛中固定,石蜡包埋后切片,肝、肾组织切片进行常规HE染色,椎间盘组织切片脱钙后进行HE和番红固绿染色,于显微镜下观察肝、肾、椎间盘组织病理变化。
2.4 16S rRNA测序分析
2.4.1 DNA抽提及PCR扩增 取各组小鼠结肠组织,收集结肠内粪便样本至无菌Ep管中,于−80 ℃保存。参照DNA提取试剂盒说明书抽提基因组DNA后,用1%琼脂糖凝胶电泳检测,扩增16S rDNA的V3~4可变区。引物序列:338F为5’-ACTCCTACGGGAGGCAGCAG-3’,806R为5’-GGACTACHVGGGTWTCTAAT-3’。
2.4.2 Illumina Miseq测序分析 用2%琼脂糖凝胶回收PCR产物,用DNA凝胶回收试剂盒纯化,Tris-HCl洗脱,2%琼脂糖电泳检测,用高灵敏荧光计检测定量,在Illumina MiSeq平台将纯化后的扩增片段构建文库与测序。
2.5 统计学分析
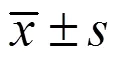
3 结果
3.1 椎间盘核磁共振成像检测
如图1所示,假手术组小鼠椎间盘形态完整,T2W1呈均匀高信号;终板形态完整,与椎间盘有明显的分界,T2W1呈均匀低信号。模型组小鼠椎间盘形态被破坏,T2W1呈低信号;终板表面毛糙,T2W1呈点状高信号。布洛芬组小鼠椎间盘形态差,T2W1呈低信号;终板破裂,T2W1点状高信号融合成片。人参固本口服液组小鼠椎间盘形态欠佳,T2W1部分高信号;终板表面欠平整,与椎间盘分界尚可,T2W1呈点状高信号。
3.2 组织学病理观察
3.2.1 肝、肾组织HE染色观察 如图2所示,各组小鼠肝组织结构清楚,肝细胞排列致密有序,细胞膜及核膜完整,胞质均匀,中央静脉形态正常。各组小鼠肾组织结构清晰完整,皮髓分界清晰,肾小球、肾小管形态正常。
3.2.2 椎间盘HE与番红固绿染色观察 如图3所示,假手术组小鼠髓核结构形态完整,细胞排列正常,纤维环有序层状排列,未见炎性细胞浸润。模型组小鼠髓核结构丢失,细胞明显减少,分布散乱,空泡样明显,部分区域被纤维环组织填充侵占,纤维环失去有序层状排列,伴有明显的炎性细胞浸润。布洛芬组损坏的髓核结构有所修复,细胞排列欠佳,纤维环排列欠有序,可见炎性细胞浸润。人参固本口服液组小鼠损坏的髓核结构尚可,髓核细胞趋于整齐,纤维环结构相对完整,可见少量的炎性细胞浸润。
3.3 肠道微生物测序质量评价
各组小鼠各随机抽取4个结肠内粪便样本,进行16S rRNA测序,优化后序列数目为4 013 568,碱基数目为1 699 712 622,平均长度为423 bp。经过聚类分析,得到12个门、18个纲、46个目、77个科、148个属、225个种和610个OTU。
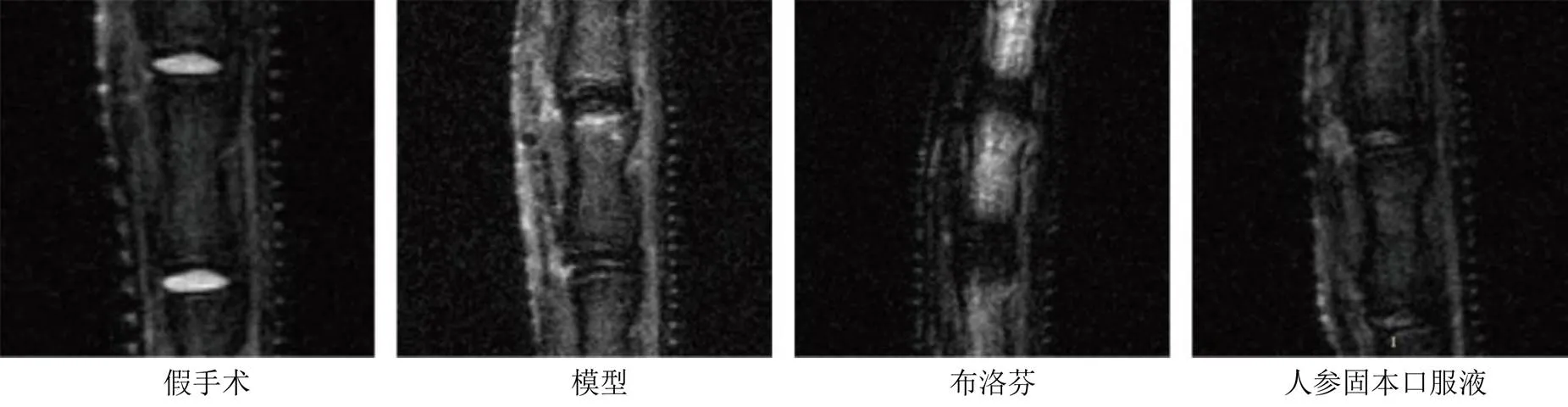
图1 各组小鼠椎间盘的核磁共振成像检测

图2 各组小鼠肝、肾组织HE染色

图3 各组小鼠椎间盘的HE (A) 与番红固绿(B) 染色
Shannon指数稀释曲线直接或间接反映测序数据量的合理性及物种的丰富程度,等级聚类曲线的曲线宽度和平缓度分别代表了物种丰富度及均匀度。如图4-A、B所示,稀释曲线达到平台期,等级聚类曲线趋于平缓,表明数据量渐进合理,物种分布较均匀,丰富度较高。与假手术组比较,模型组丰富度、均匀度无明显变化;与模型组比较,各给药组丰富度、均匀度上升,其中人参固本口服液组有明显差异。Venn图可反映各组之间共有和独有的OTU数目及样本群落组成的相似度。如图4-C所示,4组样本有127个重叠OTU,假手术组、模型组、布洛芬组和人参固本口服液组分别独有22、23、24、78个OTU。
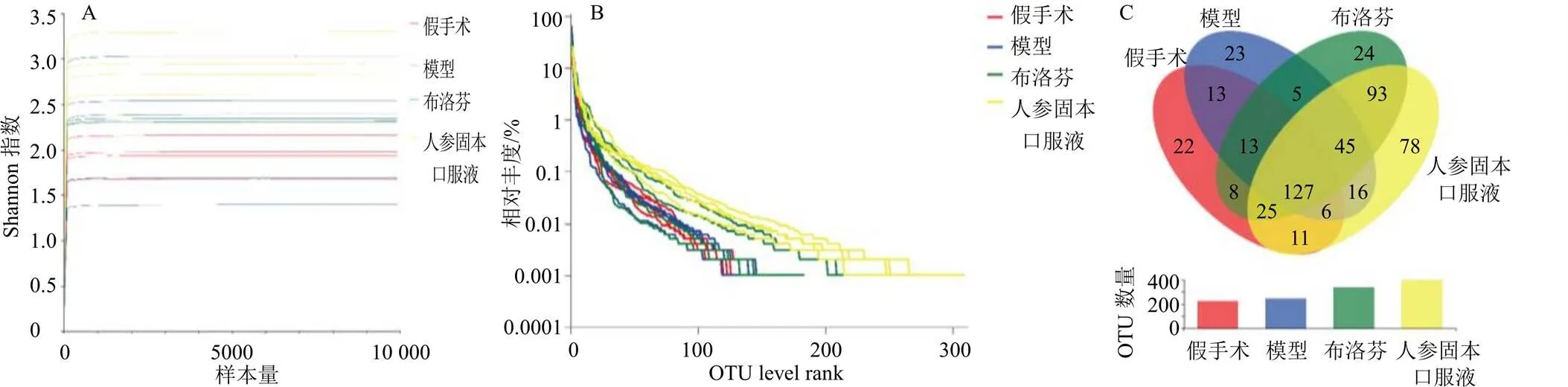
A-稀释曲线 B-等级聚类曲线 C-各组OTU数量的Venn图
3.4 α多样性分析
α多样性是指通过对单个样品的多样性分析,来评估肠道群落物种的丰度及多样性,其中Chao指数、Shannon指数分别表示物种丰度、多样性。如图5-A、B所示,与假手术组比较,模型组Chao指数和Shannon指数无明显差异;与模型组比较,人参固本口服液组Chao指数和Shannon指数均显著升高(<0.05)。如图5-C所示,在种水平上,与模型组比较,各给药组_valens的相对丰度明显升高,uncultured__g_的相对丰度明显降低。
3.5 β多样性分析
β多样性用于进一步评估组别间的微生物组成。主坐标分析(principal co-ordinates analysis,PCoA)、非度量多维尺度法(non-metric multidimensional scaling analysis,NMDS)是研究Beta多样性的可视化方法,样本间的距离与菌群组成结构的相似值呈负相关,即样本点越接近,其物种组成越相似。如图6所示,与假手术组比较,模型组在PC1、PC2水平均有明显偏移,表明模型组小鼠肠道菌群结构与组成明显改变;与模型组比较,各给药组在PC1水平更趋向于假手术组,提示给药后肠道菌群的整体结构发生了实质性的变化。NMDS分析结果与PCoA分析趋势一致。
3.6 菌群结构组成分析
如图7-A所示,在门水平上,厚壁菌门(Firmicutes)和拟杆菌门(Bacteroidota)为优势菌种,与假手术组比较,模型组放线菌门(Actinobacteriota)和疣微菌门(Verrucomicrobiota)的相对丰度明显降低;与模型组比较,人参固本口服液组菌群组成及丰度明显逆转。如图7-B所示,在属水平上,假手术组优势菌种为杜氏杆菌属,模型组的优势菌种为粪杆菌属。与模型组比较,各给药组回肠杆菌属相对丰度明显升高,粪杆菌属相对丰度明显降低。
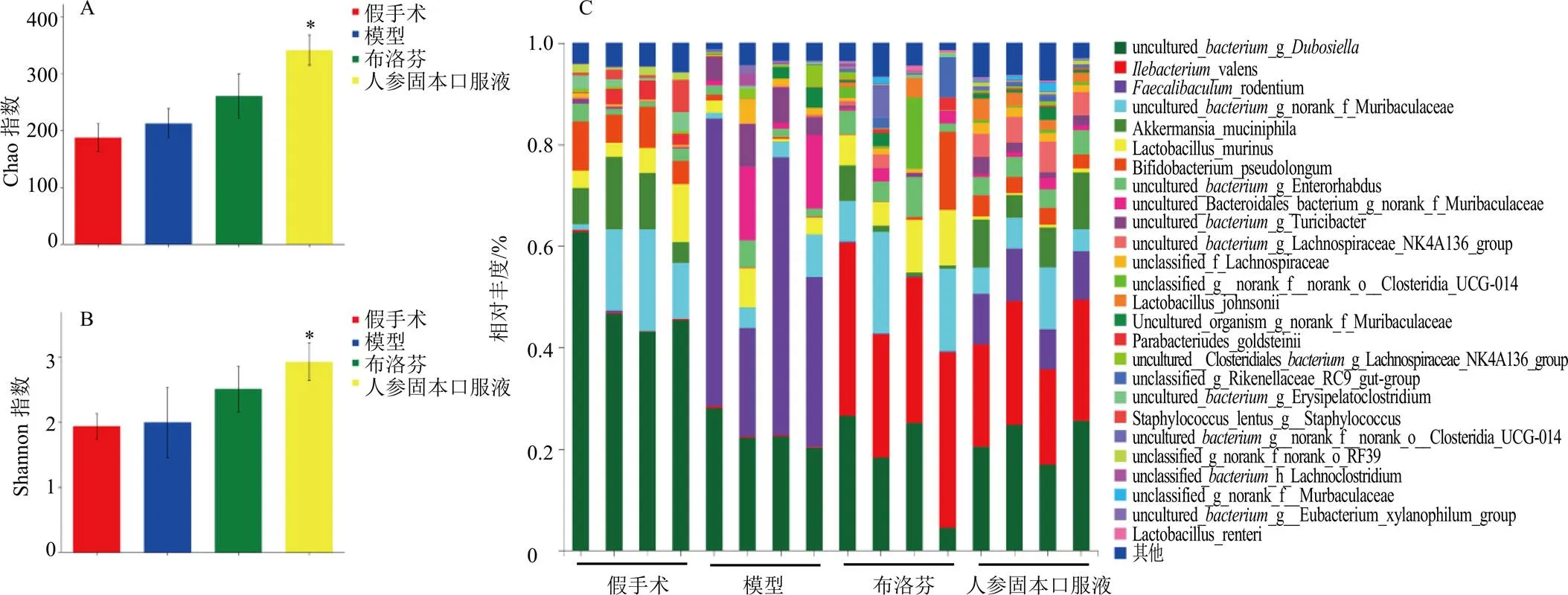
A-Chao指数 B-Shannon指数 C-种水平各组肠道菌群组成分布 与模型组比较:*P<0.05
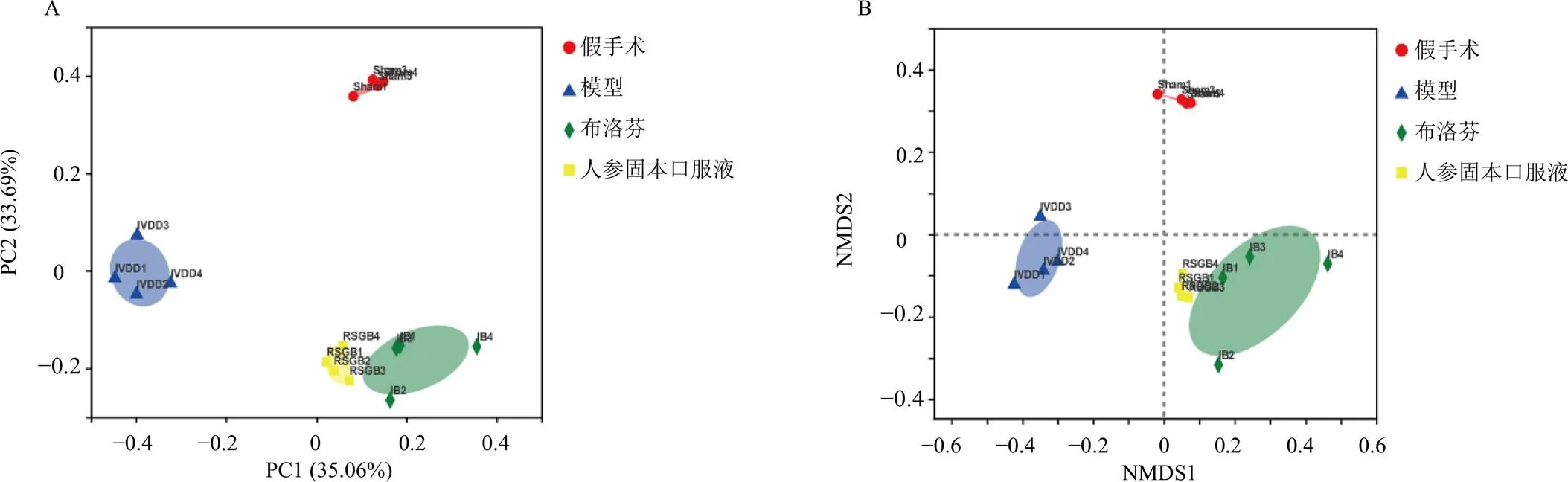
A-PCoA分析 B-NMDS分析
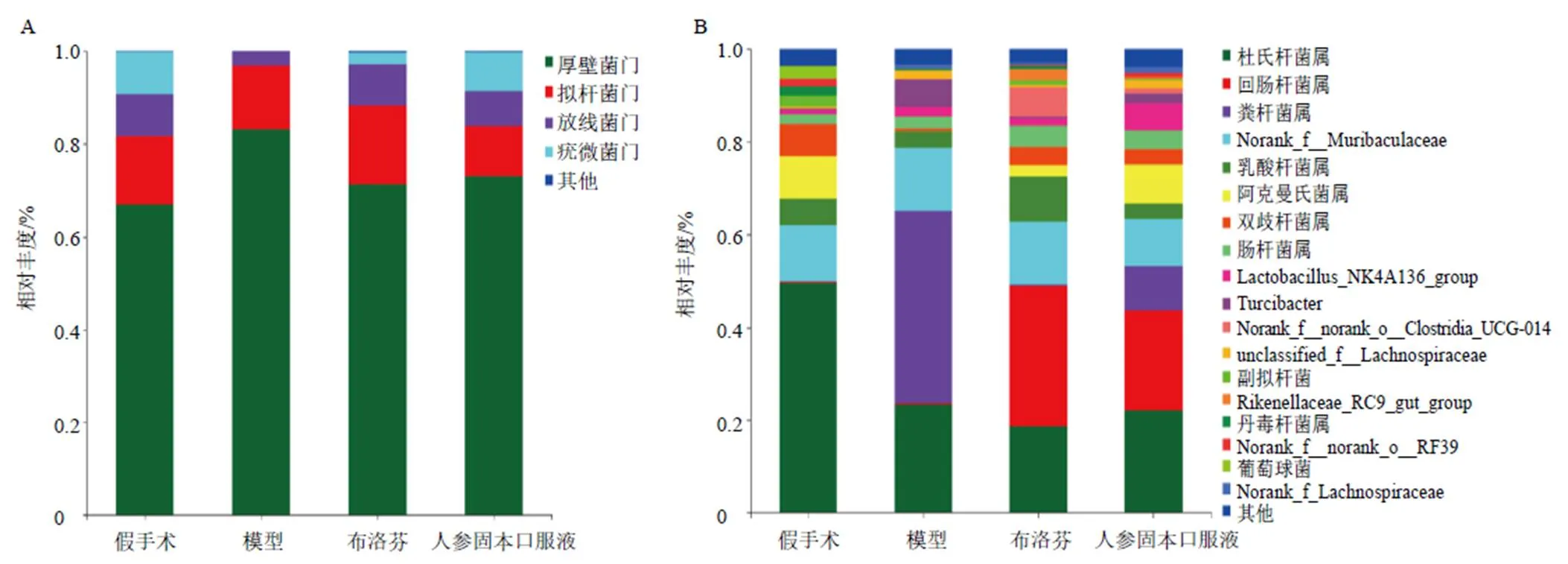
图7 门水平(A) 和属水平 (B) 各组肠道菌群结构组成
组间差异显著性检验是利用样本检验得到的群落丰度数据,通过统计学方法对不同群落微生物丰度差异种进行假设检验,评价样本间差异的显著性。如图8所示,门水平上,与假手术组比较,模型组菌群中的疣微菌门和巴氏杆菌门(Patescibacteria)相对丰度显著降低(<0.05、0.01);与模型组比较,人参固本口服液组疣微菌门相对丰度显著升高(<0.05)。在属水平上,与假手术组比较,模型组粪杆菌属相对丰度显著升高(<0.001),为优势物种,杜氏杆菌属和阿克曼氏菌属相对丰度显著降低(<0.01);与模型组比较,布洛芬组回肠杆菌属相对丰度显著升高(<0.001),人参固本口服液组Lachnospiraceae_NK4A136_group、阿克曼氏菌属和回肠杆菌属相对丰度显著升高(<0.05、0.001),粪杆菌属相对丰度显著降低(<0.001)。
4 讨论
椎间盘是软骨结构,包含与上下椎体连接的终板、纤维环及髓核。正常情况下,纤维环、髓核承担不同轴向的压力载荷,维持脊柱多方向的运动。而椎间盘内组织细胞和生物化学改变,导致结构失衡,该过程即IVDD。目前临床常用补益肝肾的药物治疗腰痛。人参固本口服液由人参、麦冬、天冬加六味地黄丸组成,方中人参、熟地、山茱萸、山药为君,填精益髓、补气养血;茯苓健脾益气;麦冬、天冬养阴益气;泽泻、牡丹皮补泻相宜,泻肾浊。椎间盘核磁共振成像及病理结果表明,人参固本口服液能够修复髓核、纤维环的结构,减轻炎性细胞浸润,从而延缓IVDD的病理过程。表明人参固本口服液能够有效改善IVDD。
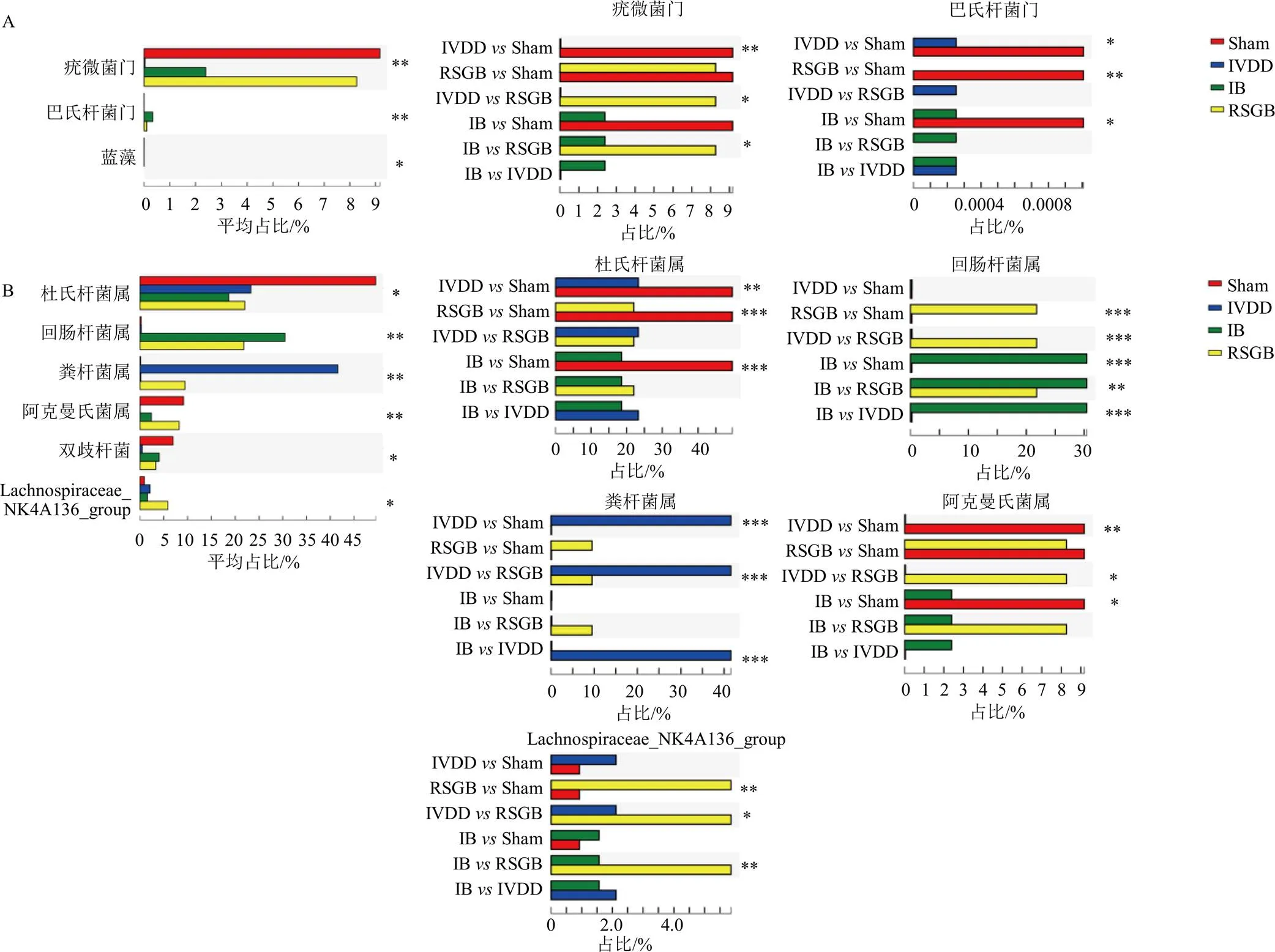
Sham-对照组 IVDD-模型组 IB-布洛芬组 RSGB-人参固本口服液组 *P<0.05 **P<0.01 ***P<0.001
胃肠道微生物是人体内最丰富的微生物群,通常处于动态平衡状态。研究发现,肠道菌群在关节稳态中发挥重要作用。随着年龄增长,膝骨关节炎发病率的升高与肠道通透性的增加呈正相关[8,10]。肠道菌群通过调节自身代谢产物,调节免疫应答系统,从而影响骨代谢如骨质疏松、股骨头坏死等[11-12]。本研究基于16S rRNA技术发现模型组与假手术组小鼠肠道菌群Alpha多样性无明显差异,而Beta多样性存在差异,疣微菌门、巴氏杆菌门、杜氏杆菌属、阿克曼氏菌属的相对丰度降低,粪杆菌属相对丰度升高。与模型组比较,人参固本口服液组肠道菌群的丰度和均匀度增加,疣微菌门、阿克曼氏菌属、Lachnospiraceae_NK4A136_group和回肠杆菌属相对丰度升高,粪杆菌属相对丰度下降。
研究表明,杜氏杆菌属减少后,能够激活:核苷酸结合寡聚化结构域样受体蛋白3(nucleotide-binding oligomerization domain-like receptor protein 3,NLRP3)炎症小体,从而引起肠道及神经炎症[13],提示IVDD后,小鼠肠道内与炎症相关肠道微生物群增加,肠道菌群稳态遭到破坏。疣微菌门及该门中的阿克曼氏菌属在增强免疫力、抗肿瘤、抗衰老、维持肠道稳态和抗炎方面有重要作用[14]。IVDD小鼠给予人参固本口服液后,肠道内疣微菌门、阿克曼氏菌属为优势物种,其相对丰度显著升高。表明人参固本口服液可以调控IVDD小鼠肠道菌群微生态,改善菌群多样性及丰度,影响菌群代谢。
综上,人参固本口服液能够通过调控肠道菌群微环境,有效延缓IVDD。人参固本口服液补肾机制可能是通过调节肠道微生态实现的,符合“养后天以滋先天”的中医理论。
利益冲突 所有作者均声明不存在利益冲突
[1] Hartvigsen J, Hancock M J, Kongsted A,. What low back pain is and why we need to pay attention [J]., 2018, 391(10137): 2356-2367.
[2] Kadow T, Sowa G, Vo N,. Molecular basis of intervertebral disc degeneration and herniations: What are the important translational questions? [J]., 2015, 473(6): 1903-1912.
[3] Lo W C, Chen Y T, Chen C C. The effects of elgucare on degenerated intervertebral disc-induced low back pain and disc regeneration: A clinical trial [J]., 2021, 2021: 5824956.
[4] Zhao L, Manchikanti L, Kaye A D,. Treatment of discogenic low back pain: Current treatment strategies and future options-a literature review [J]., 2019, 23(11): 86.
[5] 钟诚, 杨东亮, 姚景春, 等. UHPLC-ESI-QE-Orbitrap-MS技术的人参固本口服液干预食蟹猴颈椎间盘置换术术后的血清代谢组学研究[J]. 中草药, 2022, 53(6): 1776-1782.
[6] Biver E, Berenbaum F, Valdes A M,. Gut microbiota and osteoarthritis management: An expert consensus of the European society for clinical and economic aspects of osteoporosis, osteoarthritis and musculoskeletal diseases (ESCEO) [J]., 2019, 55: 100946.
[7] Wei J, Zhang C H, Zhang Y Q,. Association between gut microbiota and symptomatic hand osteoarthritis: Data from the Xiangya osteoarthritis study [J]., 2021, 73(9): 1656-1662.
[8] Li W T, Lai K T, Chopra N,. Gut-disc axis: A cause of intervertebral disc degeneration and low back pain? [J]., 2022, 31(4): 917-925.
[9] Wang S Z, Sun G D, Fan P,. Distinctive roles of tumor necrosis factor receptor type 1 and type 2 in a mouse disc degeneration model [J]., 2021, 31: 62-72.
[10] Thevaranjan N, Puchta A, Schulz C,. Age-associated microbial dysbiosis promotes intestinal permeability, systemic inflammation, and macrophage dysfunction [J]., 2018, 23(4): 570.
[11] 何剑全, 林小梅, 林正坤, 等. 绝经后骨质疏松症患者中医证型与肠道菌群结构的相关性研究[J]. 中医药临床杂志, 2022, 34(3): 539-545.
[12] de Sire A, de Sire R, Petito V,. Gut-joint axis: The role of physical exercise on gut microbiota modulation in older people with osteoarthritis [J]., 2020, 12(2): E574.
[13] Xiao L L, Zheng H P, Li J,. Targeting NLRP3 inflammasome modulates gut microbiota, attenuates corticospinal tract injury and ameliorates neurobehavioral deficits after intracerebral hemorrhage in mice [J]., 2022, 149: 112797.
[14] Everard A, Belzer C, Geurts L,. Cross-talk betweenand intestinal epithelium controls diet-induced obesity [J]., 2013, 110(22): 9066-9071.
Effect of Ginseng Guben Oral Liquid on intestinal flora in mice with intervertebral disc degeneration
LI Yi-xuan1, JIANG Yan-ling2, LIAO Yi1, WANG Wei2, OU Ru-zhen3, TANG Shu-jie1, SUN Guo-dong3
1. School of Traditional Chinese Medicine, Jinan University, Guangzhou 510630, China 2. State Key Laboratory of Generic Manufacture Technology of Chinese Traditional Medicine, Lunan Pharmaceutical Group Co., Ltd., Linyi 276006, China 3. The First Affiliated Hospital of Jinan University, Guangzhou 510630, China
To study the effect of Ginseng Guben Oral Liquid (人参固本口服液) on intestinal flora of mice with intervertebral disc degeneration (IVDD).Twenty-eight mice were randomly divided into sham operation group, model group, ibuprofen (90 mg/kg) group and Ginseng Guben Oral Liquid (3 mL/kg), with seven mice in each group. The model of IVDD was made by tail full-thickness puncture, and corresponding drugs were given for 28 d, tail nuclear magnetic resonance was taken; HE and saffron fast green staining were used to observe the pathological changes of liver, kidney and intervertebral disc in mice; 16S rRNA high-throughput sequencing was used to detect the composition and structure of intestinal flora in colon of mice.Compared with sham operation group, intervertebral disc structure in model group was obviously destroyed; There was no significant difference in Chao index and Shannon index of α diversity analysis in intestinal flora, but PC1 and PC2 levels of β diversity were obviously deviated; Relative abundance of Verrucomicrobiota, Patescibacteria,andwere significantly decreased (< 0.05, 0.01), whilerelative abundance was significantly increased (< 0.001). Compared with model group, disordered intervertebral disc structure in Ginseng Guben Oral Liquid group was repaired; Chao index and Shannon index of α diversity analysis in intestinal flora were significantly increased (< 0.05), β diversity tended to sham-operation group at PC1 level; Relative abundance of Verrucomicrobiota, Lachnospiraceae_NK4A136_group,andwere significantly increased (< 0.05, 0.01, 0.001), while relative abundance ofwas significantly decreased (< 0.001).Ginseng Guben Oral Liquid can repair the structure of nucleus pulposus and annulus fibrosus, reduce the infiltration of inflammatory cells and delay the pathological process of IVDD, and its mechanism may be related to the regulation of intestinal flora microenvironment.
Ginseng Guben Oral Liquid; intervertebral disc degeneration; intestinal flora; nucleus pulposus; annulus fibrosus
R285.5
A
0253 - 2670(2022)22 - 7121 - 08
10.7501/j.issn.0253-2670.2022.22.015
2022-07-28
中药制药共性技术国家重点实验室开放基金资助项目(202009)
李艺璇(1996—),女,硕士,研究方向为脊柱骨关节病。Tel: 15521321703 E-mail: liyixuanhenan@163.com
唐树杰,男,博士,研究方向为脊柱骨关节病。Tel: (020)85226289 E-mail: tsj697@163.com
孙国栋,男,博士,研究方向为脊柱骨科。Tel: 15521382902 E-mail: sgd96@jnu.edu.cn
#共同第一作者:姜艳玲(1990—),女,硕士,研究方向为中药及天然药物有效成分及质量控制。Tel: 15098860396 E-mail: m15098860396@163.com
[责任编辑 李亚楠]

