芍药苷通过调控肠道菌群改善α-异硫氰酸酯诱导胆汁淤积大鼠的作用机制研究
吴和霏,章方玲,邓昕雨,李煜兵,陈 沅,胡启超,马 骁*,赵艳玲
• 药理与临床 •
芍药苷通过调控肠道菌群改善α-异硫氰酸酯诱导胆汁淤积大鼠的作用机制研究
吴和霏1,章方玲1,邓昕雨1,李煜兵1,陈 沅1,胡启超1,马 骁1*,赵艳玲2*
1. 成都中医药大学药学院,西南特色中药资源国家重点实验室,四川 成都 611137 2. 解放军总医院医疗保障中心 药剂科,北京 100037
确证芍药苷对α-异硫氰酸酯(α-isothiocyanate,ANIT)诱导胆汁淤积大鼠的药效作用,通过16S rRNA技术探究芍药苷对肠道菌群的调节作用机制。SD大鼠随机分为对照组、模型组及芍药苷高、中、低剂量(200、100、50 mg/kg)组和熊去氧胆酸(60 mg/kg)组,每组10只。给予药物干预7 d,第4天ig ANIT(60 mg/kg)诱导胆汁淤积模型。测定胆汁体积流量;检测血清中血清中天冬氨酸氨基转移酶(aspartate aminotransferase,AST)、丙氨酸氨基转移酶(alanine aminotransferase,ALT)、γ-谷氨酰转肽酶(γ-glutamyl transpeptidase,γ-GT)活性及总胆红素(total bilirubin,TBIL)、直接胆红素(direct bilirubin,DBIL)、总胆汁酸(total bile acid,TBA)水平;采用苏木素-伊红(HE)染色观察肝脏组织病理变化;收集大鼠肠内容物进行肠道菌群测序,探索芍药苷对肠道菌群的影响。与模型组比较,芍药苷有效改善胆汁体积流量(<0.05),显著下调大鼠血清中肝功能指标AST、ALT、γ-GT活性及胆汁淤积指标TBIL、DBIL、TBA水平(<0.01),改善肝细胞损伤。肠道菌群测序结果可知,芍药苷显著上调厚壁菌门与拟杆菌门比值及异杆菌属、布劳特氏菌属丰度(<0.05),降低颤螺菌属、瘤胃球菌属丰度(<0.05、0.01)。芍药苷可能通过改善ANIT诱导的胆汁淤积大鼠肠道菌群失调,从而发挥对胆汁淤积肝损伤的改善作用。
芍药苷;α-异硫氰酸酯;胆汁淤积;药效;16S rRNA;肠道菌群
胆汁淤积肝脏疾病是一种因各种内外原因,导致有毒胆汁酸过度积累或胆汁流量改变,胆管和肝细胞受损的肝脏疾病,胆汁淤积本身也会进一步加重肝脏的损害[1]。据统计,我国慢性肝病住院患者胆汁淤积肝脏疾病的发生率高达10.26%,在原发硬化性胆管炎患者中发生率高达75%,肝硬化中可达47.76%[2]。在胆汁淤积疾病过程中,胆汁酸是胆汁的重要成分,约占胆汁固体成分的85%,胆汁酸在肝脏合成后,进入胆管分泌到胆囊,后进入小肠参与食物消化,最后大部分胆汁酸在回肠末端重新吸收,通过门静脉返回肝脏,另有5%的胆汁酸通过粪便排出[3],这个过程为胆汁酸的肝肠循环。因此,任何造成胆汁酸平衡失调的因素都能导致胆汁淤积的形成。胆汁酸通过肝肠循环将肠道与肝脏连接起来,肠道菌群可调节经肝脏合成排入肠道的胆汁酸,同时肠道菌群的结构和分布又受胆汁酸的影响。
肠道菌群失调与胆汁淤积性肝病密切相关[4],由于肝脏和肠道经胆管、门静脉和体循环进行双向交流[5],因此肠道菌群失调可能通过肠-肝轴引起肝脏的炎症性疾病[6]。研究表明,肠道菌群失调,肠内代谢产物包括肠源性毒素和微生物代谢物通过门静脉进入肝脏,引起肝细胞炎症损伤,激活肝脏免疫应答机制,从而导致肝功能改变[7]。此外,肠道微生物在肝脏病理生理过程中发挥重要作用,能够通过改变肠道通透性、调节胆碱代谢、调节胆汁酸代谢等来改善肝脏炎症和(或)纤维化[8]。
传统中医药理论将胆汁淤积归属于“黄疸”范畴,处方数据挖掘研究表明,治疗淤胆型肝炎的中药复方汤剂中最常用的中药之一为赤芍,使用频率高达82.61%[9]。赤芍为毛茛科芍药属植物芍药的干燥根,性凉能泻肝胆之热,味苦可入胆而益胆汁,《神农本草经》中述其“主邪气腹痛,除血痹,破坚积,寒热疝瘕,止痛,利小便”[10]。“瘀”贯穿淤胆型肝炎始终,使用赤芍可清利肝胆热毒、改善脉道瘀阻的状态;现代药理学研究也证实,大剂量赤芍可通过调节转运蛋白的表达,并调节胆汁酸组成和含量,从而改善胆汁淤积[11]。其主要活性成分芍药苷于1963年作为一种单萜苷首次从芍药中分离得到[12],芍药苷可以改善大鼠肝组织淤胆型炎症、坏死和胆管增生[13-14]。表明赤芍中的主要效应成分芍药苷具有显著的保肝利胆作用,能够通过抗氧化、抗凋亡、抗炎等具体的通路发挥效应,然而对芍药苷与肠道菌群的调节关联却少有研究。因此,本研究采用α-异硫氰酸酯(α-isothiocyanate,ANIT)致大鼠急性肝内胆汁淤积模型对芍药苷进行药效学评价,进而通过考察芍药苷对大鼠肠道菌群的影响来研究其作用机制,为芍药苷通过调节肠道菌群从而改善胆汁淤积提供科学依据。
1 材料
1.1 动物
SPF级雄性SD大鼠,体质量200~220 g,购自斯贝福(北京)生物技术有限公司,许可证号SCXK(京)2019-0010,动物合格证号No.110324220102750123。动物于成都中医药大学动物实验中心动物房饲养,自由进食饮水,适应性喂养3 d后进行实验。动物实验经成都中医药大学实验动物伦理委员会批准(批准号2020-0312)。
1.2 药品与试剂
ANIT(批号L2104215,质量分数≥98.0%)购自上海阿拉丁生化科技股份有限公司;芍药苷(批号CHB-S-068,质量分数≥95.0%)购自成都生物克洛玛生物科技有限公司;熊去氧胆酸(ursodeoxycholic acid,UDCA,批号L21056A,质量分数≥98.5%)购自德国Losan Pharma Gmbh;天冬氨酸氨基转移酶(aspartate aminotransferase,AST)试剂盒(批号20220210)、丙氨酸氨基转移酶(alanine aminotransferase,ALT)试剂盒(批号20220304)、γ-谷氨酰转肽酶(γ-glutamyl transpeptidase,γ-GT)试剂盒(批号20220323)、总胆红素(total bilirubin,TBIL)试剂盒(批号20220407)、直接胆红素(direct bilirubin,DBIL)试剂盒(批号20220311)、总胆汁酸(total bile acid,TBA)试剂盒(批号20220209)购自南京建成生物工程研究所。
1.3 仪器
1600R型低温离心机(上海力申科学仪器有限公司);DG5032型酶标仪(南京华东电子集团);JA5003型电子分析天平(上海舜宇平科学仪器有限公司);CI-S型倒置显微镜(日本Nikon公司);THZ-92A型气浴恒温振荡器(上海博迅医疗生物仪器股份有限公司);KQ-500DE型超声波清洗器(昆山超声仪器有限公司)。
2 方法
2.1 分组、给药及造模
SD大鼠适应性饲养3 d后,采用随机数字表法随机分为对照组、模型组、芍药苷高、中、低剂量(200、100、50 mg/kg)组和UDCA(60 mg/kg)组,每组10只。各给药组ig相应药物(10 mL/kg),对照组和模型组ig等体积生理盐水,1次/d,连续7 d。实验第4天,模型组和各给药组ig ANIT(60 mg/kg)诱导胆汁淤积模型,对照组ig等体积橄榄油,记录给药前及给药7 d后大鼠的体质量变化。
2.2 芍药苷对胆汁淤积大鼠胆汁体积流量的影响
大鼠ip乌拉坦麻醉后,仰卧位固定,剑突下开腹,进行胆总管插管手术留取胆汁,为了确保准确测量,插管5 min后对胆汁收集取样20~30 min,于−80 ℃保存直至分析,胆汁收集量与流出时间的比值为胆汁体积流量。
2.3 芍药苷对胆汁淤积大鼠血清中AST、ALT、γ-GT活性及DBIL、TBIL、TBA水平的影响
大鼠麻醉后,腹主动脉取血,于室温下静置4 h后,4 ℃、3000 r/min离心10 min,分离血清,于0 ℃保存,按试剂盒说明书测定血清中AST、ALT、γ-GT活性及DBIL、TBIL、TBA水平。
2.4 芍药苷对胆汁淤积大鼠肝脏组织病理变化的影响
取各组大鼠肝脏,于4%多聚甲醛中固定24 h后,脱水,石蜡包埋,常规切片,进行苏木素-伊红(HE)染色,于显微镜下观察肝脏病理变化。
2.5 肠内容物标本采集
于无菌状态下取出各组大鼠整个肠道,吸取无菌PBS溶液,冲洗消化道外壁后,切取所需结肠段,轻柔挤出内容物或剖开肠道用无菌手术刀挖取内容物1~3 g置于无菌EP管,立刻放入−80 ℃液氮冻存,1 d内转存至−80 ℃低温冰箱保存。
2.6 大鼠肠道菌群16S rRNA检测
提取对照组、模型组、芍药苷高剂量组样本的基因组DNA,检测DNA的纯度和浓度合格后,取适量的基因组DNA为模板,根据测序区域的选择,添加样本特异性Barcode序列,与Pfu高保真DNA聚合酶进行PCR,确保扩增效率和提取DNA样品的准确性、样品检测、纯化、建库、并采用Illumina Miseq平台进行高通量测序。下机数据按照QIIME2 DaDa2分析流程或Vsearch软件的分析流程进行序列去噪或操作分类单位(operational taxonomic units,OTU)聚类,进行ASV/OTU物种注释,并与大鼠微生物数据库进一步比对,得到样本的物种分类信息,进行聚类分析及多样性分析,后通过京都基因与基因组百科全书(Kyoto encyclopedia of genes and genomes,KEGG)通路富集分析预测样本的菌群代谢功能。
2.7 统计学分析

3 结果
3.1 芍药苷对胆汁淤积大鼠体质量的影响
如图1所示,自第4天造模后,与对照组比较,各组大鼠体质量均降低;第7天,与对照组比较,模型组大鼠体质量显著降低(<0.01);与模型组比较,芍药苷高、中剂量组和UDCA组大鼠体质量均明显升高(<0.05、0.01)。
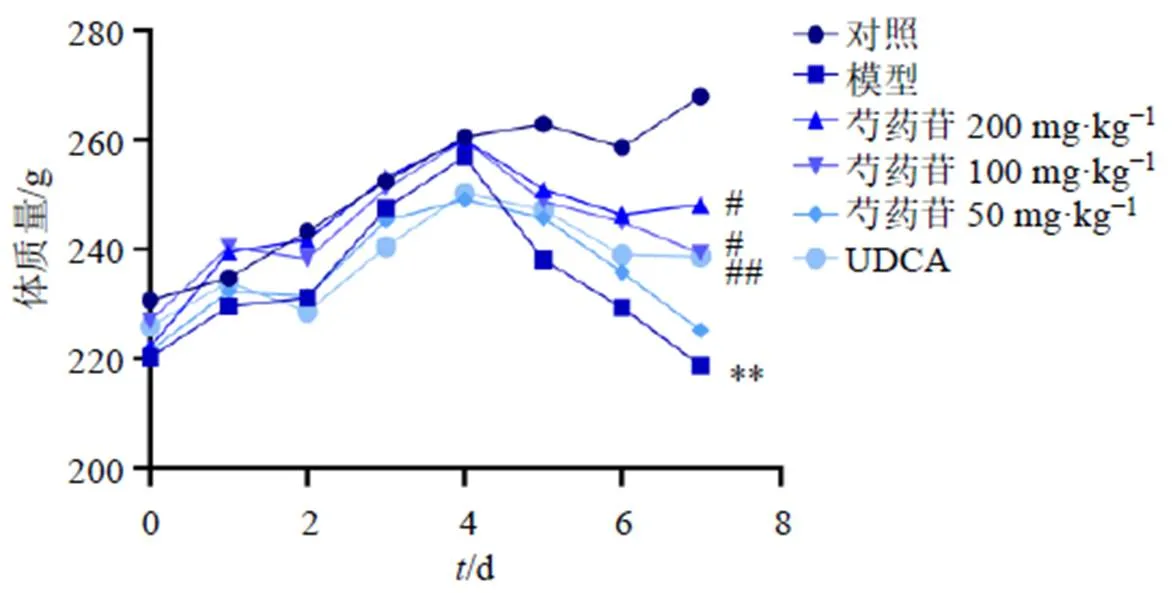
与对照组比较:**P<0.01;与模型组比较:#P<0.05 ##P<0.01
3.2 芍药苷对胆汁淤积大鼠胆汁体积流量的影响
对照组大鼠胆汁体积流量为(21.44±0.66)μL/min;模型组大鼠胆汁体积流量为(7.11±0.36)μL/min,与对照组比较具有统计学差异(<0.05);芍药苷高剂量组胆汁体积流量为(17.15±0.19)μL/min,与模型组比较具有统计学差异(<0.05)。表明芍药苷高剂量可以有效改善胆汁淤积大鼠胆汁体积流量。
3.3 芍药苷对胆汁淤积大鼠血清中AST、ALT、γ-GT活性及DBIL、TBIL、TBA水平的影响
如表1所示,与对照组比较,模型组大鼠血清中肝功能指标ALT、AST、γ-GT活性与胆汁淤积指标DBIL、TBIL、TBA水平均明显升高(<0.01);与模型组比较,各给药组大鼠血清中肝功能指标ALT、AST、γ-GT活性与胆汁淤积指标DBIL、TBIL、TBA水平均明显降低(<0.01),且呈剂量相关性。
通过地下水系统脆弱性评价分析,可以掌握不同等级脆弱性的地下水分布,特别是了解地下水水质脆弱性高,即易于污染地区的状况。这样,地下水水质保护就能做到更有针对性。地下水系统的脆弱性,除了地下水系统固有的对污染物的敏感性外,还与天然或人为造成的污染源的位置和类型以及污染物距离含水层的相对位置和污染物的运移情况等因素有关。因此,应了解和掌握受水区地下水系统对污染物的固有敏感性,研究评价受水区地下水系统的脆弱性。
3.4 芍药苷对胆汁淤积大鼠肝脏组织病理变化的影响
如图2所示,对照组大鼠肝脏组织结构正常,肝细胞索状排列整齐,肝细胞间肝窦明显,未见明显组织病理损伤改变;模型组大鼠肝细胞萎缩呈严重长梭状形态,肝窦和汇管区见炎性细胞浸润,汇管区见胆管上皮细胞及纤维细胞增生;芍药苷高剂量组大鼠肝脏组织可见炎性细胞浸润;芍药苷中剂量组大鼠肝细胞萎缩,纤维细胞增生,见有肝窦和汇管区见炎性细胞浸润;芍药苷低剂量组大鼠肝细胞空泡变性可见,肝窦和汇管区见炎性细胞浸润,汇管区见胆管上皮细胞及纤维细胞增生;UDCA组大鼠肝组织汇管区可见少量炎性细胞浸润,肝窦内可见数个灶性炎性细胞浸润区。
3.5 大鼠肠道菌群测序变化与物种注释
对对照组、模型组、芍药苷高剂量组样本进行16S rRNA检测,3组大鼠肠道菌群测序结果中,高质量序列数目为2 377 872,碱基数目为1 005 993 655,平均长度为418 bp,序列长度分布在400~440 bp(图3-A),符合16S rRNA V3~4要求,可知后续分析较为可靠,测序结果能够反映样本的真实情况。物种分类注释图表明肠道菌群各分类单元门、纲、目、科、属、种水平的ASV/OTU数(图3-B)。统计后得,对照组、芍药苷高剂量组、模型组门水平及以下ASV/OTU数分别为2204、2223、2413,属水平ASV/OTU数分别为623、632、659。
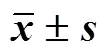
表1 芍药苷对胆汁淤积大鼠血清中AST、ALT、γ-GT活性及DBIL、TBIL、TBA水平的影响(, n = 10)
与对照组比较:**<0.01;与模型组比较:##<0.01
**< 0.01control group;##< 0.01model group
“↑↑”表示细胞增生或者细胞纤维化;“↑”表示细胞空泡萎缩形态变性;“◯”表示炎性浸润

A-高质量序列长度分布统计图 B-物种分类注释图 C-对照组 M-模型组 HP-芍药苷高剂量组,下图同
3.6 大鼠肠道菌群α多样性分析
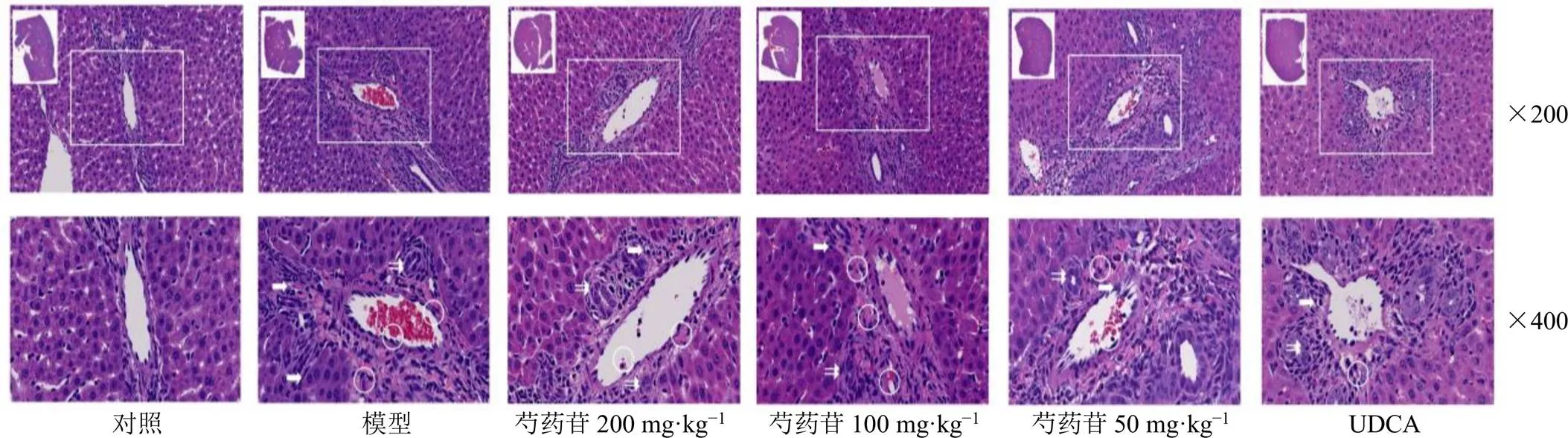
如图4-a所示,Shannon和Simpson指数表征多样性,与对照组比较,模型组Shannon和Simpson指数均升高;与模型组比较,芍药苷高剂量组Shannon和Simpson指数均降低,群落多样性降低,表明芍药苷能够降低胆汁淤积大鼠肠道菌群多样性。Pielou’s evenness指数表征均匀度,与对照组比较,模型组Pielou’s evenness指数升高;与模型组比较,芍药苷高剂量组Pielou’s evenness指数降低,表明芍药苷能够降低胆汁淤积大鼠肠道菌群均匀度。丰度等级曲线反映各样本中ASV/OTU丰度的分布规律,各组在横轴上的范围较大且平缓下降,表明各组大鼠肠道菌群物种丰富度高和物种分布均匀(图4-b)。物种累积曲线随样本量的增加,曲线始终保持上升趋势,表明样本量还须补充(图4-c)。
3.7 大鼠肠道菌群β多样性分析
β多样性分析可比较不同样本肠道菌群的物种多样性,探索各组菌群组成的差异性。Adonis显示组间差异大于组内差异(2=0.201、=0.001),提示各组肠道菌群结构具有显著差异性。主坐标分析(principal coordinates analysis,PCoA)与非量度多维尺度分析(non-metric multidimensional scaling,NMDS)如图5所示,各组内样本点相对聚集,说明各组组内样本点之间的变异度较小;组间较为离散,说明各组组间样本具有物种差异,NMDS结果的stress值=0.156<0.2,表明NMDS分析的结果可靠。提示芍药苷高剂量一定程度上可以调节ANIT诱导的胆汁淤积大鼠肠道菌群组成变化。
3.8 大鼠肠道菌群物种组成分析
3.8.1 门水平下各组肠道菌群组成及物种丰度分析 如图6-a、b所示,各组大鼠菌群优势种类差异不大,主要由厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidetes)、放线菌门(Actinobacteria)、变形菌门(Proteobacteria)等构成,其中厚壁菌门与拟杆菌门比例最高,占80%以上。与对照组比较,模型组拟杆菌门、变形菌门相对丰度显著升高(<0.01),厚壁菌门相对丰度显著降低(<0.05);与模型组比较,芍药苷高剂量组拟杆菌门相对丰度显著降低(<0.01),厚壁菌门、放线菌门相对丰度显著升高(<0.05、0.01),厚壁菌门与拟杆菌门比值(F/B)升高。表明芍药苷能够调控ANIT诱导的胆汁淤积大鼠肠道菌群优势物种厚壁菌门、拟杆菌门、放线菌门的群落丰度。
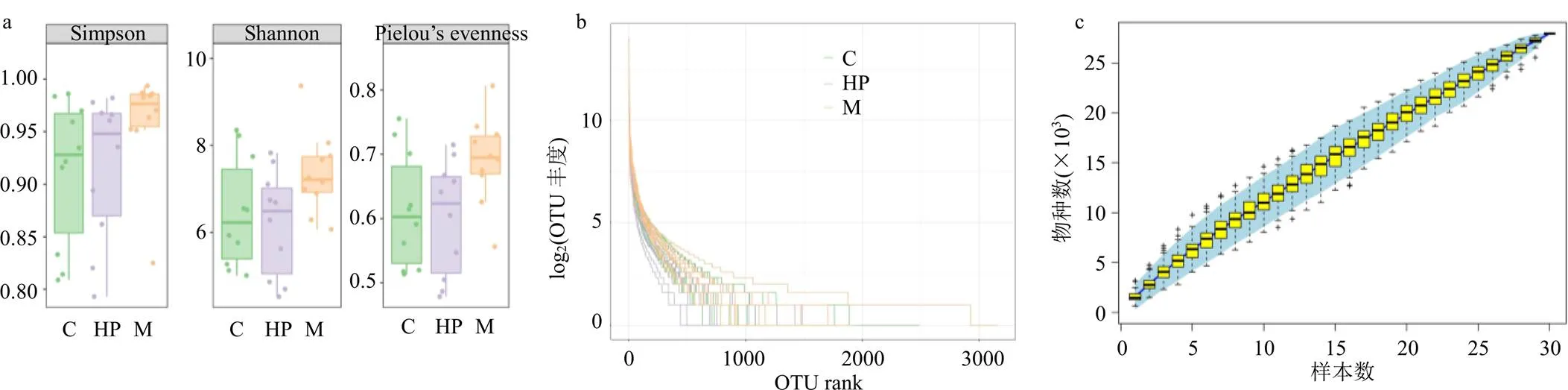
a-Simpson、Shannon和Pielou’s evenness指数 b-丰度等级曲线 c-物种累积曲线
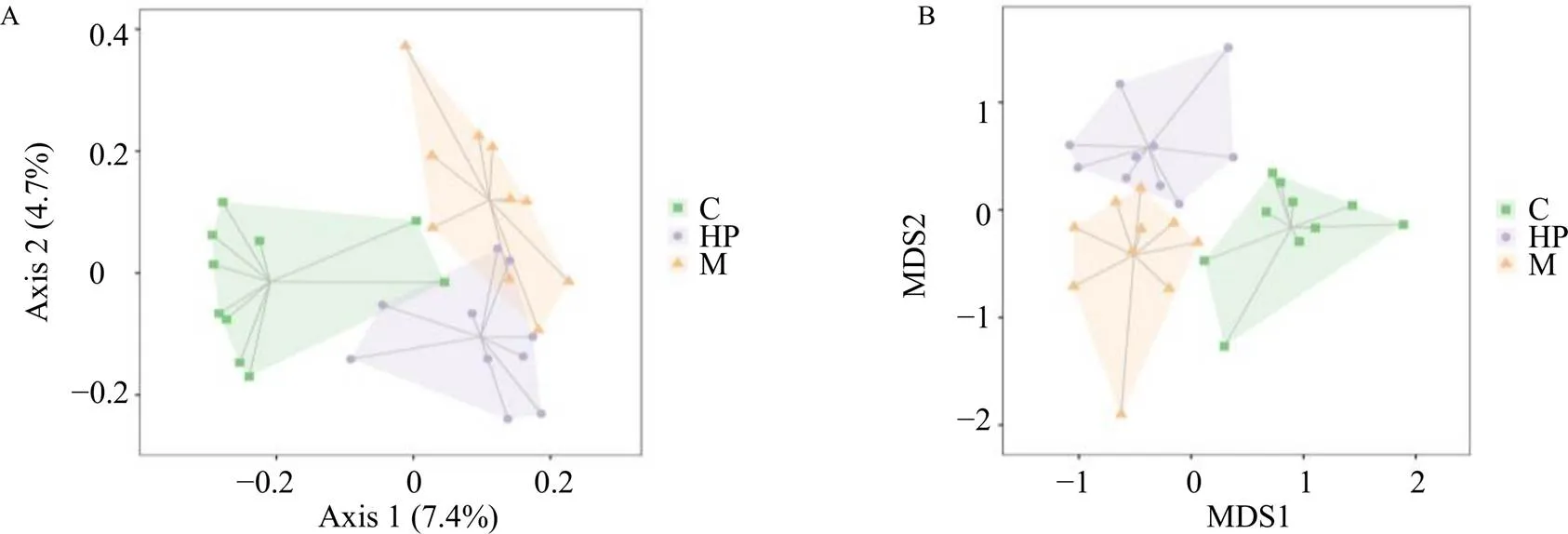
A-PCoA分析 B-NMDS分析
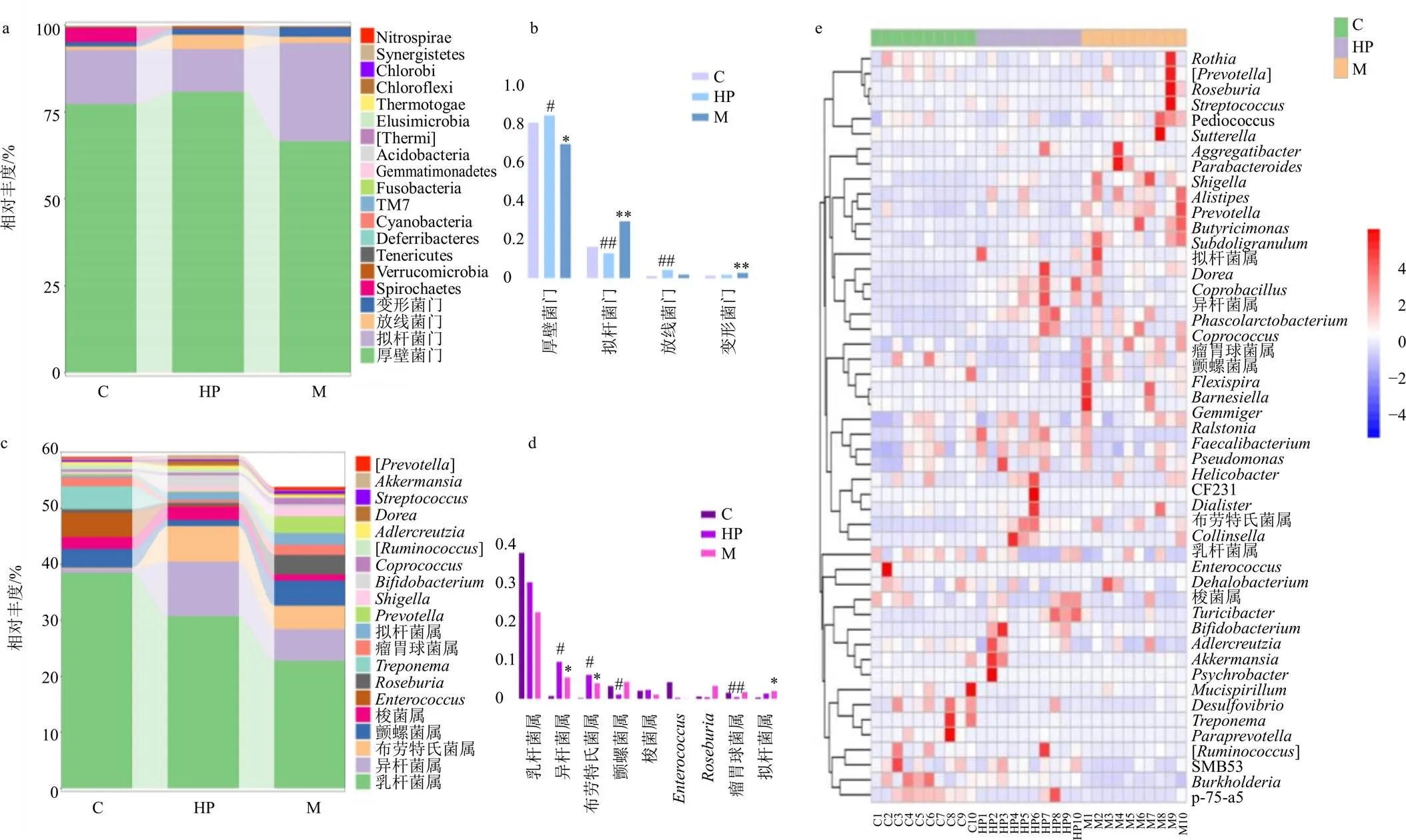
a-门水平下各组肠道菌群组成及物种丰度柱状图 b-门水平下优势种类 c-属水平下各组肠道菌群组成及物种丰度柱状图 d-属水平下优势种类 e-物种组成热图 与对照组比较:*P<0.05 **P<0.01;与模型组比较:#P<0.05 ##P<0.01
3.8.2 属水平下各组肠道菌群组成及物种丰度分析 如图6-c、d所示,各组大鼠菌群优势种类分布列有前20种,菌属组成所占百分比不同,其中乳杆菌属、异杆菌属、布劳特氏菌属、颤螺菌属、梭菌属是相对丰度前5位的菌属。与对照组比较,模型组异杆菌属、布劳特氏菌属、拟杆菌属相对丰度显著升高(<0.05);与模型组比较,芍药苷高剂量组异杆菌属、布劳特氏菌属相对丰度显著升高(<0.05),颤螺菌属、瘤胃球菌属相对丰度显著降低(<0.05、0.01)。表明芍药苷能够调控ANIT诱导的胆汁淤积大鼠肠道菌群优势物种异杆菌属、布劳特氏菌属、颤螺菌属的群落丰度。
3.9 大鼠肠道菌群标志物种差异分析
为直观展示菌群物种的重要性,排序绘制带柱状图的热图,将重要性前100的物种从上到下,在影响分组的重要性上依次递减,重要性靠前的物种可认为是组间差异的标志物种(图7-I)。通过标志物种差异分析(LDA effect size,LEfSe),LEfSe分析结果包括3部分:一是显著差异物种LDA值分布柱状图(图7-II),展示各个组内显著富集的标志物种及其重要性程度,LDA效应量>2以及<0.05具有显著统计学意义,可见对照组具有丰度差异的物种为螺旋体门(p-Spirochaetes)、螺旋体目(o-Spirochaetales)、螺旋体科(f-Spirochaetaceae)、螺旋体纲(c-Spirochaetes)、密螺旋体属(g-)、副帕拉普氏菌属(g-);芍药苷高剂量组具有丰度差异的物种为红蝽菌目(o-Coriobacteriales)、红蝽菌科(f-Coriobacteriaceae)、红蝽菌纲(c-Coriobacteriia)、多尔氏菌属(g-)、罗尔斯顿菌属(g-);模型组具有丰度差异的物种为粪热杆菌属(g-)、热脱硫杆菌科(f-Thermodesulfobiaceae)、热袍菌纲(c-Thermotogae)、热袍菌目(o-Thermotogales)、热袍菌科(f-Thermotogaceae)、热袍菌(p-Thermotogae)、热袍菌科(g-S1)、副拟杆菌属(g-)、紫胞菌科(f-Porphyromonadaceae)、嗜热厌氧菌目(o-Thermoanaerobacterales)、梭状芽孢杆菌MBA08(Bacteria-MBA08)。二是物种分类学分枝图,将LDA值图中各组样品中标志物种进一步按照分类学层次进行分布,由内至外辐射的圆圈代表了由门至属(或种)的分类级别(图7-III)。三是组间丰度柱状图,将不同分组样品中的标志物种进一步组间比较,如图8所示,与对照组比较,模型组红蝽菌纲、梭状芽孢杆菌MBA08、多尔氏菌属、紫胞菌科、热袍菌纲相对丰度上升,罗尔斯顿菌属、副帕拉普氏菌属、螺旋体纲相对丰度下降;与模型组比较,芍药苷高剂量组红蝽菌纲、多尔氏菌属、罗尔斯顿菌属相对丰度上升,梭状芽孢杆菌MBA08、紫胞菌科、热袍菌纲相对丰度下降。此外,对照组与芍药苷高剂量组HP组梭状芽孢杆菌MBA08、紫胞菌科、热袍菌纲相对丰度极低,其中梭状芽孢杆菌MBA08、热袍菌纲相对丰度在对照组中并无体现,为胆汁淤积大鼠肠道菌群显著标志物种。
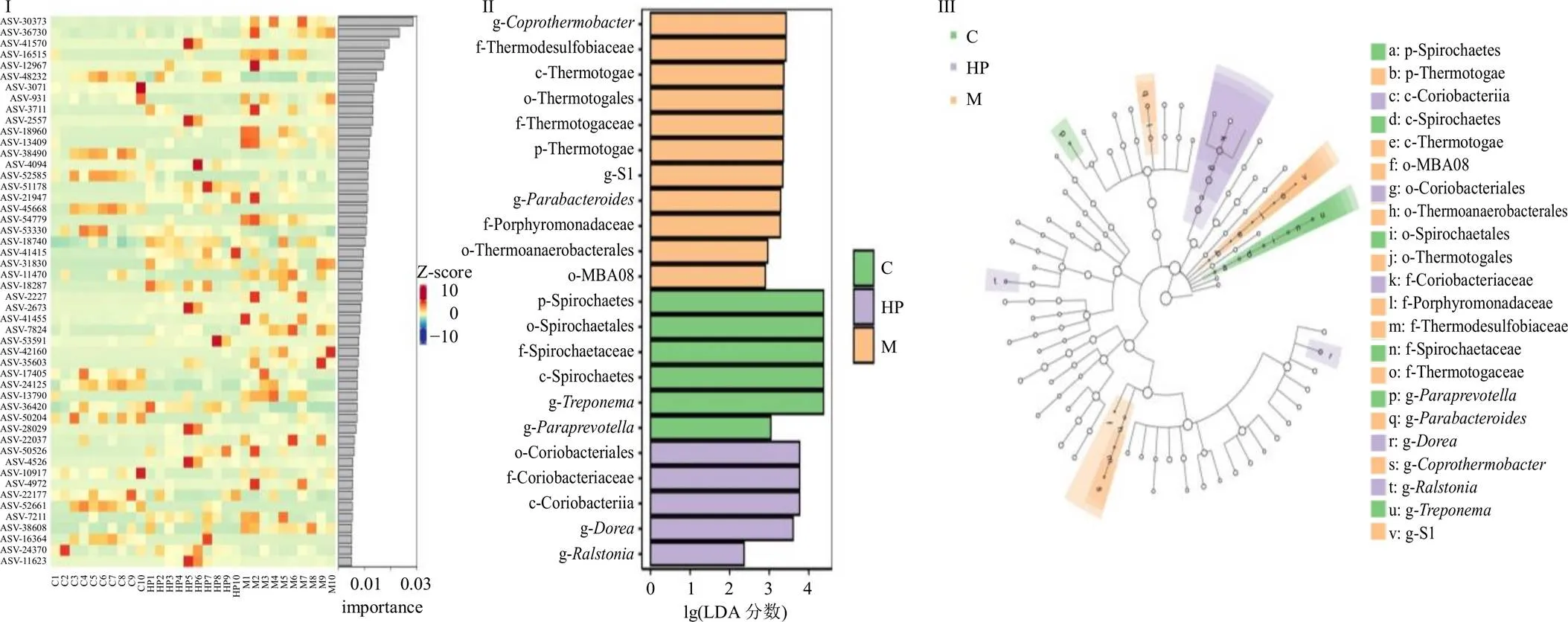
I-组间差异的标志物热图 II-物种LDA值分布柱状图 III-基于分类等级树的组间差异分类单元展示图(以0.01%为阈值)
3.10 大鼠肠道菌群通路富集差异分析
KEGG数据库的核心为生物代谢通路分析数据库,如图9所示,3组大鼠肠道菌群KEGG通路主要富集在代谢、遗传信息处理2大代谢通路方面,功能类别主要富集在碳水化合物代谢、氨基酸代谢、辅酶因子和维生素代谢、萜类多酮类代谢、脂质代谢等。
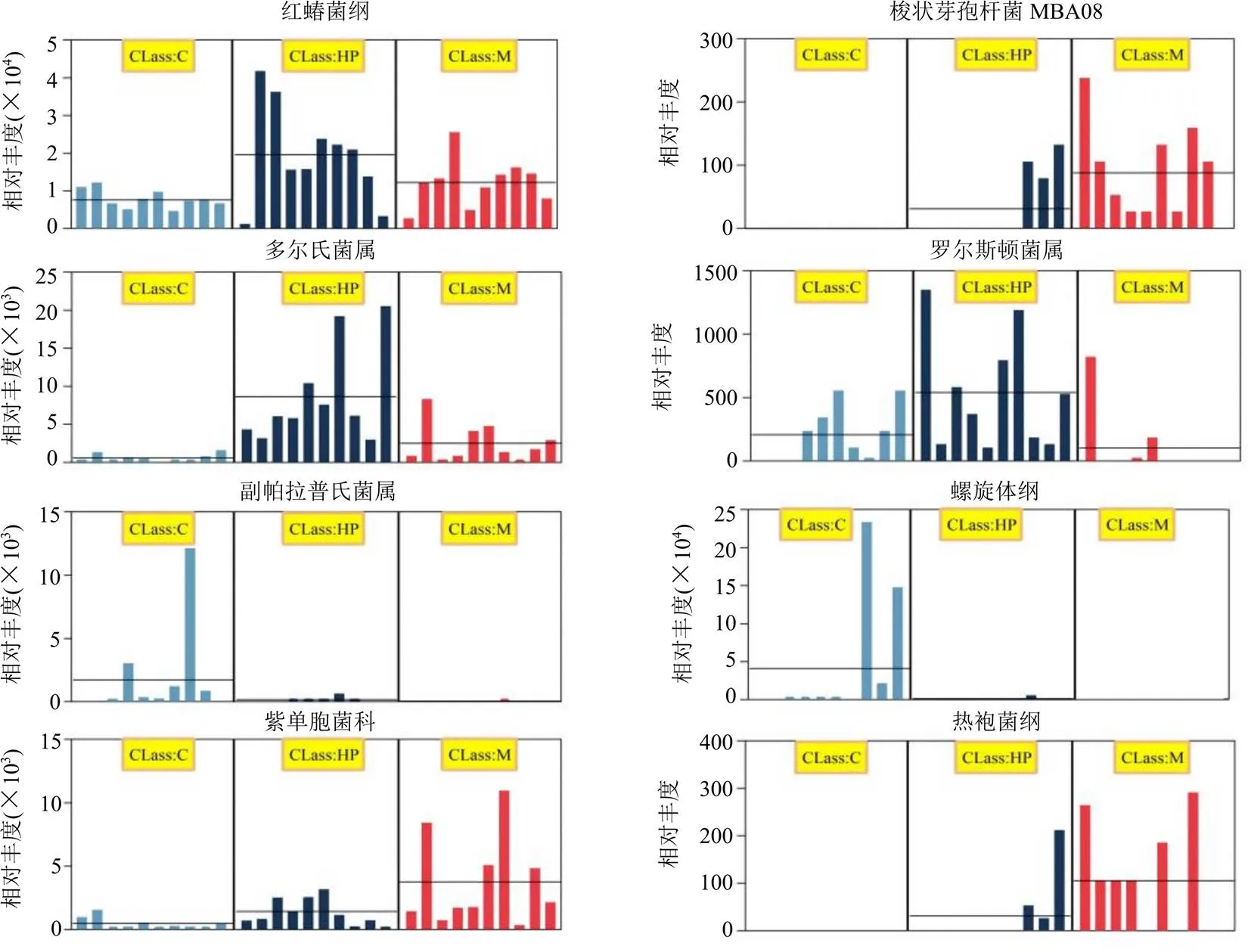
图8 大鼠肠道菌群物种LEfSe分析组间丰度柱状图
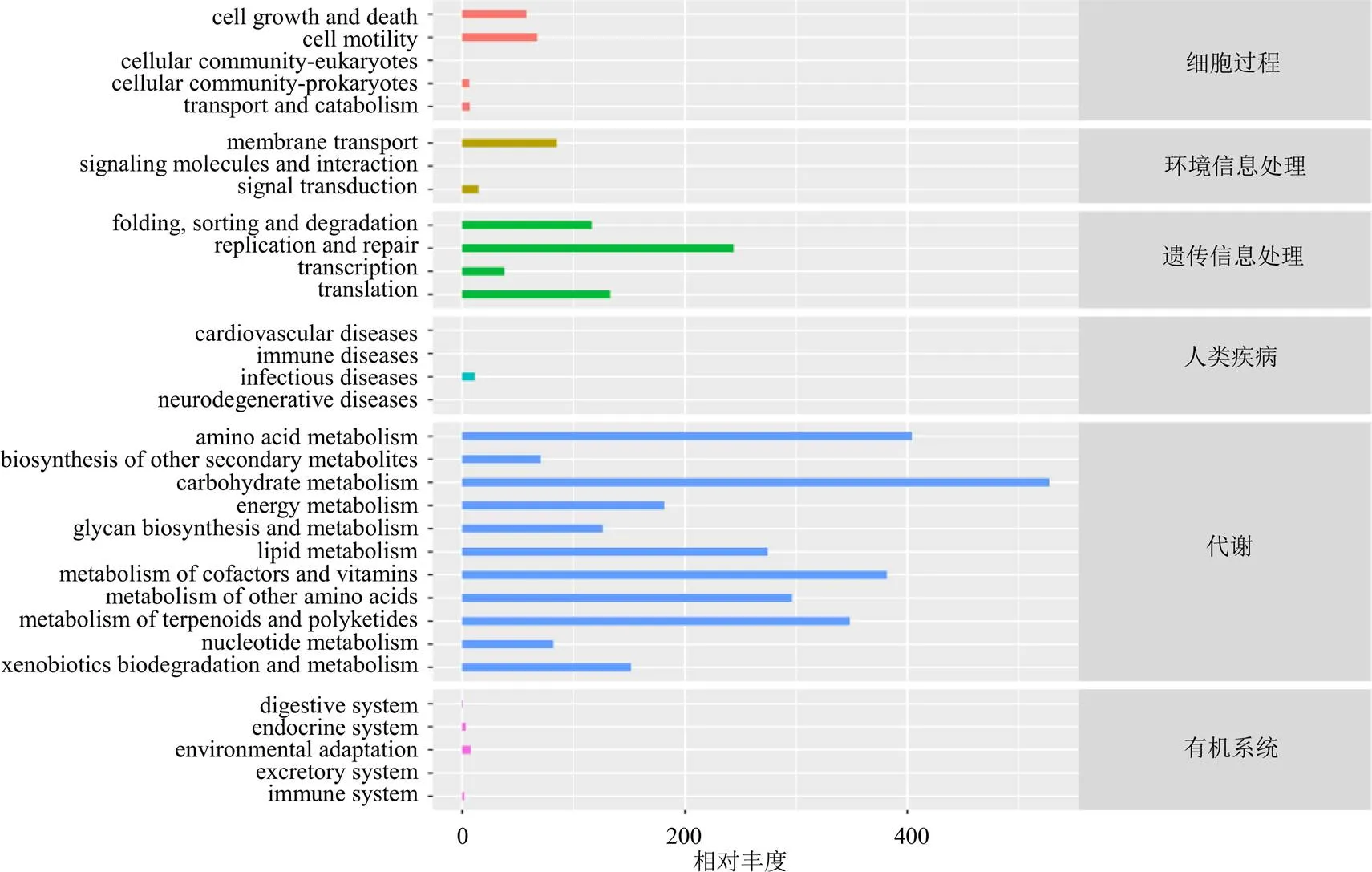
图9 肠道菌群KEGG通路富集差异分析
4 讨论
在基础研究中,ANIT引起动物的肝脏中出现各种生物化学和组织病理学变化,包括胆管上皮和胆管上皮细胞坏死,因此被广泛用于诱发胆汁淤积。早期有关ANIT诱导胆汁淤积模型的研究中,ANIT可能通过消耗肝细胞或胆管上皮细胞的还原型谷胱甘肽或其他硫醇而引起毒性,进而引起动物的肝脏中出现各种生物化学和组织病理学变化,包括胆管上皮和胆管上皮细胞坏死,从而造成肝功能损伤[15]。AST、ALT、γ-GT、TBIL、DBIL、TBA是临床诊断肝功能的重要指标,反映了肝脏生理病理状况,肝脏受损时,以上指标会明显升高。本研究结果显示,模型组大鼠血清中肝功能相关指标明显升高,肝脏病理切片观察到肝细胞萎缩呈严重长梭状形态,肝窦和汇管区见炎性细胞浸润,汇管区见胆管上皮细胞及纤维细胞增生,胆汁体积流量明显降低,表明本研究中ANIT诱导的胆汁淤积明显。
芍药在中医中广泛用于脑血管疾病、心血管疾病、神经系统疾病和肝脏疾病的治疗[16],其味酸,故能入肝以生肝血,味苦故能入胆而益胆汁,味酸而兼苦,且又性凉,又善泄肝胆之热。同时现代药理学研究证实芍药活性成分不仅有保肝作用,还能减轻胆汁淤积症状[17]。芍药中提取的主要生物活性成分芍药苷因其对肝脏具有强大的疗效,深有药用研究价值而深受关注[18],但芍药苷抗胆汁淤积的具体作用机制尚不清楚。本研究结果显示,给予不同剂量的芍药苷干预1周后,大鼠血清中肝功能指标AST、ALT、γ-GT活性与胆汁淤积指标TBIL、DBIL、TBA水平呈剂量相关性降低,肝脏组织病理损伤明显减轻,肝小叶内肝细胞肿胀变性得到缓解,肝窦内炎性细胞浸润、汇管区炎性细胞浸润和纤维组织增生均减少。胆汁淤积是由各种复杂原因导致有毒胆汁酸积聚,造成胆汁体积流量改变。芍药苷高剂量组胆汁体积流量较模型组明显升高,表明芍药苷能够改善胆汁淤积状况,这也体现了芍药能够疏肝利胆退黄的功效。上述结果说明芍药苷在治疗胆汁淤积症状时有一定疗效。
本研究成功建立了ANIT诱导的胆汁淤积大鼠模型,并基于16S rRNA技术评价芍药苷对胆汁淤积大鼠肠道菌群的调节作用,从肠道菌群角度初步探讨芍药苷改善胆汁淤积的作用机制。多样性分析表明胆汁淤积疾病进展过程会伴随肠道菌群失调,高剂量的芍药苷一定程度上可以调节ANIT诱导的胆汁淤积大鼠肠道菌群组成及结构变化。进一步对各组肠道菌群组成及物种丰度进行分析,门水平上,相较于对照组,模型组拟杆菌门、变形菌门丰度显著升高;相较于模型组,芍药苷高剂量组拟杆菌门丰度显著降低,厚壁菌门、放线菌门丰度显著升高。属水平上,相较于对照组,模型组异杆菌属、布劳特氏菌属、拟杆菌属丰度显著升高;相较于模型组,芍药苷高剂量组异杆菌属、布劳特氏菌属丰度显著升高,颤螺菌属、瘤胃球菌属丰度显著降低。LEfSe组间标志物种差异分析结果显示,与对照组比较,模型组红蝽菌纲、梭状芽孢杆菌MBA08、多尔氏菌属、紫胞菌科、热袍菌纲相对丰度升高,罗尔斯顿菌属、副帕拉普氏菌属、螺旋体纲相对丰度下降;与模型组比较,芍药苷高剂量组红蝽菌纲、多尔氏菌属、罗尔斯顿菌属相对丰度升高,梭状芽孢杆菌MBA08、紫胞菌科、热袍菌纲相对丰度下降,并发现梭状芽孢杆菌MBA08、紫胞菌科、热袍菌纲为胆汁淤积大鼠肠道菌群显著标志物种。大鼠肠道菌群KEGG功能富集差异分析表明,菌群功能类别主要富集在碳水化合物代谢、氨基酸代谢、辅酶因子和维生素代谢、萜类多酮类代谢、脂质代谢等。
肠道微生态紊乱引起肠道内潜在有害物质如病原菌、内毒素、炎症因子等增加,导致肠道上皮细胞间紧密连接破坏,肠道渗透性增加以及肠黏膜结构改变,继而通过门静脉作用于肝脏,促进肝脏炎症[19]。近年研究强调了微生物组和肠道屏障在肝脏疾病中的作用,导致将肠-肝轴概念作为一种常见的致病原理和潜在的治疗靶点[20],通过抗生素、益生菌等调节肠道微生态减少有害菌和有害物质产生,或通过改善肠道屏障减少肠道细菌及有害物质进入肝脏,或调节肝脏免疫功能增加其抗菌反应[21]。人体和大鼠肠道内细菌多半属于厚壁菌门和拟杆菌门,显著影响机体生理功能,F/B变化作为一种生物失调标志与多种疾病进展相关[22-][23],如在间充质干细胞移植治疗四氯化碳诱导的急性肝损伤实验中,治疗组F/B值升高[24],在本研究中,芍药苷高剂量组主要表现为厚壁菌门相关菌群增加,拟杆菌门相关菌群减少,F/B值升高。变形菌门属于对宿主有害的内毒素产生菌,在本研究中,胆汁淤积大鼠肠道菌群丰度较高。乳杆菌属是最主要的益生菌类群之一,研究表明,在胆总管结扎诱导的胆汁淤积小鼠中,乳杆菌通过作用于法尼醇X受体-成纤维细胞生长因子15信号通路抑制胆汁酸合成,从而减少胆汁酸分泌,并增强胆汁酸排泄,从而防止胆汁酸诱导的小鼠过度肝损伤和纤维化[25],更有报道突出了乳酸杆菌对胆汁淤积小鼠肠道和肝脏稳态的潜在治疗效果[26]。布劳特氏菌属、异杆菌属广泛分布于哺乳动物的粪便和肠道,并显示出潜在的益生菌特性[27],在缓解炎症疾病和代谢紊乱方面发挥着有利作用,对特定微生物具有抗菌活性[28]。研究发现,布劳特氏菌属能够产生短链式脂肪酸以维持肠道黏膜屏障的完整性,且通过相关性分析,布劳特氏菌与血清中ALT、γ-GT活性呈负相关[29]。颤螺菌属、布劳特氏菌属、瘤胃球菌属、罗氏菌属等肠道微生物通过产生短链脂肪酸为肠上皮细胞提供能量和营养,能够恢复肠道黏膜[30]。梭菌属通过7α-脱羟基化将未结合的初级胆汁酸转化为次级胆汁酸,临床研究表明胆汁淤积患者梭菌属丰度低于正常组[31],本研究发现,相较于对照组和芍药苷高剂量组,ANIT诱导的胆汁淤积大鼠肠道菌群梭菌属丰度低。罗氏菌属丰度与葡萄糖和脂质代谢之间存在关联,且具有预防免疫性肝损伤和改善保护性修复肠道屏障的功能[32]。拟杆菌属抑制肠道微生物群衍生的7α-脱羟基酶对胆酸向脱氧胆酸的转化[33]。胆汁淤积大鼠肠道菌群显著标志物种紫胞菌科丰度的增加、血浆内毒素水平的升高和肝脏炎症与慢性肝病的并发症密切相关[34]。另外,布劳特氏菌属丰度与胰岛素敏感性和脂质代谢的负面影响显著正相关,瘤胃球菌属可以降解抗性淀粉,从而增加肠道能量吸收[35],本研究中3组大鼠肠道菌群KEGG功能富集主要在代谢通路方面,因此芍药苷可能通过调节肠道菌群丰度影响碳水化合物、氨基酸及脂质等的代谢,从而减轻胆汁淤积性肝损伤。
本研究通过大鼠体质量变化、血清肝功能与胆汁淤积指标、胆汁酸体积流量测定及肝脏病理切片等一系列综合评定芍药苷对ANIT诱导的胆汁淤积大鼠药效学研究,结果均表明芍药苷可以有效缓解由于胆汁淤积导致的肝损伤,减少肝内胆汁淤积带来的危害。此外,通过肠内容物菌群测序分析,胆汁淤积疾病进展过程会伴随肠道菌群的失调,且高剂量的芍药苷一定程度上可以调节ANIT诱导的胆汁淤积大鼠肠道菌群组成及结构变化,F/B值升高,降低肠道有害菌拟杆菌门及胆汁淤积大鼠肠道菌群显著标志物种梭状芽孢杆菌MBA08、紫胞菌科、热袍菌纲丰度,提升肠道有益菌厚壁菌门、布劳特氏菌属、异杆菌属丰度,促进胆汁淤积大鼠肠道菌群向正常水平恢复。综上,芍药苷对胆汁淤积的治疗作用与其对胆汁淤积大鼠肠道菌群失调的改善作用具有相关性。
利益冲突 所有作者均声明不存在利益冲突
[1] Wu H H, Chen C B, Ziani S,. Fibrotic events in the progression of cholestatic liver disease [J]., 2021, 10(5): 1107.
[2] 中华医学会肝病学分会, 中华医学会消化病学分会, 中华医学会感染病学分会. 胆汁淤积性肝病诊断和治疗共识 (2015) [J]. 实用肝脏病杂志, 2016, 19(6): 2-12.
[3] Martinot E, Sedes L, Baptissart M,. Bile acids and their receptors [J]., 2017, 56: 2-9.
[4] Isaacs-Ten A, Echeandia M, Moreno-Gonzalez M,. Intestinal microbiome-macrophage crosstalk contributes to cholestatic liver disease by promoting intestinal permeability in mice [J]., 2020, 72(6): 2090-2108.
[5] Li X V, Leonardi I, Iliev I D. Gut mycobiota in immunity and inflammatory disease [J]., 2019, 50(6): 1365-1379.
[6] Schneider K M, Candels L S, Hov J R,. Gut microbiota depletion exacerbates cholestatic liver injury via loss of FXR signalling [J]., 2021, 3(9): 1228-1241.
[7] 黄倩, 张海博, 李京涛, 等. 肠道微生态在肝内胆汁淤积中的作用机制 [J]. 临床肝胆病杂志, 2019, 35(10): 2355-2359.
[8] Floch M H, Walker W A, Sanders M E,. Recommendations for probiotic use: 2015 update: Proceedings and consensus opinion [J]., 2015, 49(Suppl 1): S69-S73.
[9] 李晨冰. 中药复方汤剂治疗淤胆型肝炎的荟萃分析及临床用药规律探讨 [D]. 武汉: 湖北中医药大学, 2021.
[10] 清·莫枚士辑注. 郭君双, 米鹏, 周扬校注. 神农本经校注 [M]. 北京: 中国中医药出版社, 2015: 41, 90.
[11] Xie T J, Li K, Gong X,. Paeoniflorin protects against liver ischemia/reperfusion injury in mice via inhibiting HMGB1-TLR4 signaling pathway [J]., 2018, 32(11): 2247-2255.
[12] Zhang H Y, Wang H L, Zhong G Y,. Molecular mechanism and research progress on pharmacology of traditional Chinese medicine in liver injury [J]., 2018, 56(1): 594-611.
[13] Chen L S, Zhao X, Wei S Z,. Mechanism of paeoniflorin on ANIT-induced cholestatic liver injury using integrated metabolomics and network pharmacology [J]., 2021, 12: 737630.
[14] Chen L S, Wei S Z, Liu H H,. Paeoniflorin protects against ANIT-induced cholestatic liver injury in rats via the activation of SIRT1-FXR signaling pathway [J]., 2021, 2021: 8479868.
[15] Carpenter-Deyo L, Marchand D H, Jean P A,. Involvement of glutathione in 1-naphthylisothiocyanate (ANIT) metabolism and toxicity to isolated hepatocytes [J]., 1991, 42(11): 2171-2180.
[16] Zhao D D, Jiang L L, Li H Y,. Chemical components and pharmacological activities of terpene natural products from the genus[J]., 2016, 21(10): 1362.
[17] Zhang H Y, Wang H L, Zhong G Y,. Molecular mechanism and research progress on pharmacology of traditional Chinese medicine in liver injury [J]., 2018, 56(1): 594-611.
[18] Zhou H Q, Liu W, Wang J,. Paeoniflorin attenuates ANIT-induced cholestasis by inhibiting apoptosisvia mitochondria-dependent pathway [J]., 2017, 89: 696-704.
[19] Juanola O, Hassan M, Kumar P,. Intestinal microbiota drives cholestasis-induced specific hepatic gene expression patterns [J]., 2021, 13(1): 1-20.
[20] Kummen M, Hov J R. The gut microbial influence on cholestatic liver disease [J]., 2019, 39(7): 1186-1196.
[21] Jasirwan C O M, Muradi A, Hasan I,. Correlation of gut Firmicutes/Bacteroidetes ratio with fibrosis and steatosis stratified by body mass index in patients with non-alcoholic fatty liver disease [J]., 2021, 40(1): 50-58.
[22] Ahlawat S, Asha, Sharma K K. Gut-organ axis: A microbial outreach and networking [J]., 2021, 72(6): 636-668.
[23] Zhang W W, Zhang X L, Zhang Y Y,. Analysis of changes of intestinal flora in elderly patients with Alzheimer’s disease and liver cancer and its correlation with abnormal gastrointestinal motility [J]., 2021, 2021: 7517379.
[24] Dong X T, Feng X D, Liu J Q,. Characteristics of intestinal microecology during mesenchymal stem cell-based therapy for mouse acute liver injury [J]., 2019, 2019: 2403793.
[25] Liu Y H, Chen K F, Li F Y,. ProbioticGG prevents liver fibrosis through inhibiting hepatic bile acid synthesis and enhancing bile acid excretion in mice [J]., 2020, 71(6): 2050-2066.
[26] Santos A A, Afonso M B, Ramiro R S,. Host miRNA-21 promotes liver dysfunction by targeting small intestinalin mice [J]., 2020, 12(1): 1840766.
[27] Chen T Y, Ding R R, Chen X R,. Firmicutes andin gut microbiota lessened in chronic liver diseases and hepatocellular carcinoma patients: A pilot study [J]., 2021, 12(1): 8233-8246.
[28] Liu X M, Mao B Y, Gu J Y,.-a new functional genus with potential probiotic properties? [J]., 2021, 13(1): 1-21.
[29] Shi L T, Pan R L, Lin G P,. Lactic acid bacteria alleviate liver damage caused by perfluorooctanoic acid exposure via antioxidant capacity, biosorption capacity and gut microbiota regulation [J]., 2021, 222: 112515.
[30] Song W, Sun L Y, Zhu Z J,. Characteristics of gut microbiota in children with biliary atresia after liver transplantation [J]., 2021, 12: 704313.
[31] Xiao Y T, Zhou K J, Lu Y,. Administration of antibiotics contributes to cholestasis in pediatric patients with intestinal failure via the alteration of FXR signaling [J]., 2018, 50(12): 1-14.
[32] Pan X F, Kaminga A C, Liu A Z,. Gut microbiota, glucose, lipid, and water-electrolyte metabolism in children with nonalcoholic fatty liver disease [J]., 2021, 11: 683743.
[33] Hegade V S, Pechlivanis A, McDonald J A K,. Autotaxin, bile acid profile and effect of ileal bile acid transporter inhibition in primary biliary cholangitis patients with pruritus [J]., 2019, 39(5): 967-975.
[34] Huang H P, Lin Z H, Zeng Y L,. Probiotic and glutamine treatments attenuate alcoholic liver disease in a rat model [J]., 2019, 18(6): 4733-4739.
[35] Zhao T, Zhan L B, Zhou W,. The effects of Erchen Decoction on gut microbiota and lipid metabolism disorders in Zucker diabetic fatty rats [J]., 2021, 12: 647529.
Mechanism of paeoniflorin in improving α-isothiocyanate induced cholestasis by regulating intestinal flora in rats
WU He-fei1, ZHANG Fang-ling1, DENG Xin-yu1, LI Yu-bing1, CHEN Yuan1, HU Qi-chao1, MA Xiao1, ZHAO Yan-ling2
1. State Key Laboratory of Southwest Characteristic Chinese Medicine Resources, College of Pharmacy, Chengdu University of Chinese Medicine, State Key Laboratory of Southwest Characteristic Chinese Medicine Resources, Chengdu 611137, China 2. Department of Pharmacy, Chinese PLA General Hospital, Beijing 100037, China
To verify the pharmacodynamic effect of paeoniflorin on α-isothiocyanate (ANIT)-induced cholestasis in rats, and explore the regulatory mechanism of paeoniflorin on intestinal flora by 16S rRNA technology.SD rats were randomly divided into control group, model group, paeoniflorin high-, medium-and low-dose (200, 100, 50 mg/kg) groups and ursodeoxycholic acid (60 mg/kg) group, with 10 rats in each group. After 7 d of drug intervention, model of cholestasis was induced by ig ANIT (60 mg/kg) on 4th day. Bile volume flow was measured; Activities of aspartate aminotransferase (AST), alanine aminotransferase (ALT), γ-glutamyl transpeptidase (γ-GT) and levels of total bilirubin (TBIL), direct bilirubin (DBIL), total bile acid (TBA) in serum were detected; Hematoxylin eosin (HE) staining was used to observe the pathological changes of liver tissue; Intestinal contents of rats was collected for intestinal flora sequencing to explore the effect of paeoniflorin on intestinal flora.Compared with model group, paeoniflorin effectively improved bile volume flow (< 0.05), significantly down-regulated liver function index AST, ALT, γ-GT activities and cholestatic index TBIL, DBIL and TBA levels (< 0.01), improved the damage of liver cells. The sequencing results of intestinal flora showed that paeoniflorin significantly increased the ratio of Firmicutes/Bacteroides and abundance ofand(< 0.05), and decreased the abundance ofand(< 0.05, 0.01).Paeoniflorin may improve the liver injury of cholestasis by improving the imbalance of intestinal flora in ANIT-induced cholestasis rats.
paeoniflorin; α-isothiocyanate; cholestasis; pharmacodynamic effect; 16S rRNA; intestinal flora
R285.5
A
0253 - 2670(2022)22 - 7091 - 11
10.7501/j.issn.0253-2670.2022.22.012
2022-08-24
国家自然科学基金资助项目(82274187);四川省科技厅应用基础项目(2019YJ0492)
吴和霏(1998—),女,硕士研究生,研究方向为临床中药学。E-mail: hefei5725737@163.com
马 骁(1987—),男,副教授,研究方向为临床中药学。E-mail: tobymaxiao@163.com
赵艳玲(1965—),女,研究员,博士生导师,研究方向为临床中药学。E-mail: zhaoyl2855@126.com
[责任编辑 李亚楠]

