红小米黄酒心肌保护作用及活性成分研究
李 爽,陈林玉,王东浩,李英梅,刘藤藤,娄舒奇,毕跃峰
红小米黄酒心肌保护作用及活性成分研究
李 爽,陈林玉,王东浩,李英梅,刘藤藤,娄舒奇,毕跃峰*
郑州大学药学院,河南 郑州 450001
选用2种河南南阳红小米黄酒和1种糯米黄酒,对比研究其心肌保护作用及红小米黄酒活性成分。采用过氧化氢作用于心肌细胞,建立氧化应激损伤模型,CCK-8法测定细胞活力;比色法测定细胞乳酸脱氢酶、超氧化物歧化酶和丙二醛的含量。利用普鲁士蓝显色法和亚硝酸钠-硝酸铝-氢氧化钠显色法测定了总酚酸、总黄酮含量以及相关营养成分含量。并采用硅胶、ODS等柱色谱方法,结合各种波谱分析技术,对红小米黄酒中的化学成分进行了系统研究。3种黄酒对过氧化氢氧化损伤心肌细胞均有一定程度的保护作用,特别是红小米黄酒作用显著;从红小米黄酒中分离得到了17个化合物,主要为酚酸类和黄酮类化合物,含量测定结果表明红小米黄酒中总酚酸、总黄酮及γ-氨基丁酸含量均最高。红小米黄酒对氧化损伤细胞具有良好的保护作用,其主要活性成分为总酚酸、总黄酮及γ-氨基丁酸。
红小米黄酒;心肌保护;含量测定;总酚酸;总黄酮;γ-氨基丁酸
黄酒是世界上最古老的酒种之一,与葡萄酒、啤酒合称为“世界三大古酒”。研究表明,黄酒含有酚酸、氨基酸、醇和酯类等成分[1],因其营养丰富,素有“液体蛋糕”的美誉。黄酒性温,具有活气血、通经脉、保护心血管等作用,也常作为中药炮制辅料用于改善药性。但目前研究较多的是南方黄酒,主要包括浙江绍兴黄酒、福州红曲黄酒等,大多以糯米为原料[2]。北方黄酒多以小米为原料,其中南阳黄酒以红小米为原料,风味独特,具有很高的营养价值,为河南南阳特色产业,但关于红小米黄酒心肌保护作用及活性成分系统研究尚未见报道。通过文献查询,γ-氨基丁酸(γ-aminobutyric acid,GABA)是目前研究较为深入的一种重要的抑制性神经递质,它参与多种代谢活动,能对抗多种实验性心律失常[3],具有较好的生理活性;磷(P)参与机体多种生理活动,是使心脏有规律地跳动、维持肾脏正常机能和传达神经刺激的重要物质,提示二者可能为红小米黄酒中与心肌保护相关的营养成分。
本实验利用H9c2细胞的过氧化氢(H2O2)损伤模型,通过测定细胞活力、乳酸脱氢酶(lactate dehydrogenase,LDH)、丙二醛(malondialdehyde,MDA)、超氧化物歧化酶(superoxide dismutase,SOD)和还原型谷胱甘肽(glutathione,GSH)含量等指标,从细胞水平上探讨红小米红曲黄酒[CRW-XY(RK)]、红小米黄酒(CRW-XY)和绍兴糯米麦曲黄酒(CRW-SX)对氧化损伤细胞的保护作用,发现CRW-XY对心肌细胞的保护作用最好。并对3种黄酒主要成分总酚酸、总黄酮、相关营养成分γ-氨基丁酸和磷进行了含量测定及比较分析。再采用硅胶、ODS等柱色谱方法,结合各种波谱分析技术,对CRW-XY中的化学成分进行了系统研究,以期为CRW-XY质量标准体系的建立提供参考。
1 仪器与材料
1.1 仪器
UV-2550紫外-分光光度计(日本岛津公司);SW-CJ-2D超净工作台(苏州名牌之星仪器有限公司);CO2恒温培养箱(美国Thermo Fisher公司);37XB倒置显微镜(上海光学仪器五厂);Research plus多功能酶标仪(美国Bio Tek公司)。
1.2 样品与试剂
CRW-XY(RK)(批号20200805)、CRW-XY(批号20200807)均购自河南省南阳市新野县,古越龙山沈永和陈年黄酒CRW-SX(批号20200822)购自浙江省绍兴市;样品目前保存于郑州大学药学院实验室。所用试剂均为国产分析纯。
H9c2心肌细胞系(CRL-1446TM)购自美国典型培养物保藏中心。
对照品没食子酸(批号110831-201906)、芦丁(批号100080-201811)质量分数均为94.2%,购自于中国食品药品检定研究院;阳性药白藜芦醇(resveratrol,北京索莱宝科技有限公司,货号R8350);LDH测定试剂盒(碧云天生物技术有限公司);总蛋白定量试剂盒(BCA法)、MDA测定试剂盒、SOD测定试剂盒、GSH测定试剂盒(南京建成生物公司);CCK-8试剂盒(郑州德雅有限公司)。
2 方法
2.1 3种黄酒心肌保护作用研究
2.1.1 H9c2心肌细胞培养、分组与模型建立 将H9c2细胞置于CO2培养箱中(37 ℃、5% CO2)进行培养,当细胞数量达到80%以上时,使用血球计数板对细胞计数,调整细胞浓度,以5×103个/孔接种于96孔板。将培养好的H9c2心肌细胞分为对照组、H2O2组、阳性药组、给药组(55 ℃减压浓缩下所得黄酒浸膏)。对照组不给予任何处理正常培养H9c2心肌细胞;H2O2组给予300 μmol/L处理正常培养的H9c2心肌细胞;阳性药组加入200 μL的10 μmol/L的白藜芦醇溶液;给药组分别加入200 μL不同质量浓度(0.1、0.5、1.0 mg/mL)黄酒溶液。每组每个质量浓度均设6个复孔。加样作用24 h后,除对照组,弃去原培养基,加入200 μL 300 μmol/L H2O2溶液,培养2 h,可观察到细胞形态出现皱缩,折光率减小以及细胞空泡化,即为H2O2氧化应激模型[4]。
2.1.2 CCK-8法测定细胞活力 弃去原培养基,每孔中加入200 μL配好的CCK-8溶液,摇匀后CO2培养箱(37 ℃、5% CO2)孵育4 h,450 nm下检测各孔吸光度()值。
2.1.3 抗氧化指标的测定 将H9c2细胞接种于6孔板内,细胞密度为30×104个/孔,分组及药物处理同“2.1.1”项。2 mL 500 µmol/L的H2O2作用心肌细胞2 h后,收集细胞培养基,标记好组别,用于LDH活力检测(胞外)。细胞用PBS清洗2次,400 μL胰蛋白酶进行消化,4 ℃、3500 r/min离心5 min,收集细胞沉淀。加入500 μL 4 ℃预冷的PBS,冰浴条件下超声破碎细胞,4 ℃、3500 r/min离心5 min,取上清检测LDH活力(胞内)。MDA、SOD、GSH含量的计算均以蛋白含量为基础,蛋白含量测定采用BCA法,以上抗氧化指标的测定均使用试剂盒检测,所有操作严格按说明书进行。
2.2 总酚酸及总黄酮含量测定
测定CRW-XY(RK)、CRW-XY中总酚酸和总黄酮含量,同时对比CRW-SX,采用普鲁士蓝显色法[5-6]测定总酚酸含量,亚硝酸钠-硝酸铝-氢氧化钠显色法[7]测定总黄酮含量。
2.2.1 对照品溶液的制备 精密称取没食子酸和芦丁对照品适量,分别用甲醇和70%乙醇溶解后转移至量瓶,配制成质量浓度为0.1 mg/mL的对照品溶液。
2.2.2 供试品溶液的制备 3种黄酒各精密量取适量体积,55 ℃减压浓缩至恒定质量,得总浸膏,精密称取3种黄酒总浸膏各100 mg,用70%乙醇溶解后转移至10 mL量瓶,配制成质量浓度为10 mg/mL的供试品溶液。
2.2.3 总酚酸测定的方法学考察
(1)线性关系考察:采用普鲁士蓝显色法[5-6]测定总酚酸含量,精密移取没食子酸对照品溶液0、0.05、0.10、0.15、0.20、0.25、0.30 mL于25 mL量瓶,加入5 mL甲醇、2 mL SDS溶液及1 mL FeCl3-K3[Fe(CN)6] 混合溶液,暗处静置5 min;盐酸溶液定容,摇匀,静置20 min,在743 nm处测定吸光度()。以对照品质量浓度为横坐标(),值为纵坐标(),进行线性分析,得线性方程=0.035 4+0.009 1,2=0.999 5,结果表明没食子酸在5~30 μg线性关系良好。
(2)精密度试验:吸取0.10 mL供试品溶液,测定值,重复操作6次,结果3个样品RSD均小于2%,说明此试验精密度良好。
(3)稳定性试验:吸取0.10 mL供试品溶液,分别于0、2、4、6、8、12 h测定值,结果3个样品RSD均小于2%,说明供试品溶液在12 h内稳定性良好。
(4)重复性试验:精密称取6份样品按“2.2.2”项下方法制备供试品溶液。精密吸取0.10 mL,测定值,结果3个样品RSD均小于2%,说明此方法重复性良好。
(5)加样回收率试验:分别吸取6份0.05 mL供试品溶液及0.10 mL对照品溶液,于25 mL量瓶中,显色后测定值。计算加样回收率,CRW-XY(RK)、CRW-XY和CRW-SX的平均加样回收率分别为99.84%、99.39%、99.55%,3个样品RSD值均小于3.0%,说明此方法的回收率良好。
2.2.4 总黄酮测定的方法学考察
(1)线性关系考察:亚硝酸钠-硝酸铝-氢氧化钠显色法[7]测定总黄酮含量,精密移取芦丁对照品溶液0、0.2、0.4、0.8、1.0、1.2 mL于25 mL量瓶中,依次加入5 mL乙醇,1 mL NaNO2溶液,摇匀,暗处静置6 min。加入1 mL Al(NO3)3溶液,暗处静置6 min。加入10 mL NaOH溶液,乙醇定容,摇匀,暗处静置15 min,在356 nm处测定值。以对照品质量浓度为横坐标(),为纵坐标(),进行线性分析,得线性方程=0.008 5-0.003 7,2=0.999 6,结果表明芦丁在20~120 μg线性关系良好。
(2)精密度试验:分别吸取3种供试品溶液0.10 mL,测定值,重复操作6次,结果3个样品RSD均小于2%,说明此试验精密度良好。
(3)稳定性试验:吸取0.10 mL供试品溶液,分别于0、2、4、6、8、12 h测定值,结果3个样品RSD均小于2%,说明供试品溶液在12 h内稳定性良好。
(4)重复性试验:精密称取6份样品按“2.2.2”项下方法制备供试品溶液。精密吸取0.10 mL,测定值,结果3个样品RSD均小于2%,说明此方法重复性良好。
(5)加样回收率试验:分别吸取6份0.05 mL供试品溶液及0.40 mL对照品溶液于25 mL量瓶,显色后测定吸光度。计算加样回收率,CRW-XY(RK)、CRW-XY和CRW-SX的平均加样回收率分别为99.72%、99.68%、99.79%,3个样品RSD值均小于2.0%,说明此方法回收率良好。
2.3 相关营养成分测定
测定CRW-XY(RK)、CRW-XY中相关营养成分含量,同时对比CRW-SX。氨基酸含量测定参考《食品中氨基酸的测定(GB 5009.124-2016)》进行[8];微量元素磷的含量测定参考GB 5009.87-2016进行。
2.4 CRW-XY分离与结构鉴定
量取2 L CRW-XY,55 ℃减压浓缩,得总浸膏(62.3 g)。取35.0 g总浸膏,6倍量甲醇重复萃取7次,得CRW-XY甲醇部位浸膏(CRW-A,29.6 g),得膏率为84.57%。CRW-A采用硅胶柱色谱(200~300目,110 cm×20 cm),二氯甲烷-醋酸乙酯(2∶1)、醋酸乙酯-95%乙醇-水(10∶2∶1、8∶2∶1)及醋酸乙酯-甲醇-30%甲酸水溶液(6∶2∶1.5)梯度洗脱,TLC分析合并得到10个组分Fr. 1~10。
Fr. 1(8.26 g)经硅胶柱色谱二氯甲烷-丙酮(4∶1)洗脱,TLC分析合并得5个组分Fr. 1a~1e。Fr. 1c反复经硅胶柱二氯甲烷-甲醇(5∶1)及石油醚、甲醇重结晶,得到化合物1(10.14 mg)、2(9.28 mg)、3(16.78 mg)。Fr. 1b经硅胶柱色谱石油醚-醋酸乙酯(12∶1),乙醇重结晶得化合物5(37.76 mg),此组分再经硅胶柱色谱石油醚-二氯甲烷(1∶1),得到化合物7(12.97 mg)。Fr. 1d经硅胶柱色谱二氯甲烷-醋酸乙酯-甲酸(5∶3∶1),甲醇重结晶得到化合物6(12.42 mg)、13(15.33 mg)。
Fr. 3(1.26 g)经硅胶柱色谱,二氯甲烷-甲醇(10∶1、5∶1)梯度洗脱,TLC分析合并得2个组分Fr. 3a~3b。Fr. 3a经Sephadex LH-20凝胶柱色谱[甲醇-水(2∶8、3∶7)]洗脱,得到化合物12(11.24 mg)、14(8.99 mg)。
Fr. 4(2.30 g)经ODS柱色谱[甲醇-水(100∶1→1∶100)]梯度洗脱,得7个组分Fr. 4a~4g。Fr. 4b(582.17 mg)经硅胶柱色谱二氯甲烷-甲醇(3∶1)洗脱,得到化合物4(96.11 mg)、17(10.01 mg)。Fr. 4f(575.57 mg)反复Sephadex LH-20凝胶柱色谱[甲醇-水(2∶8)]、硅胶柱色谱二氯甲烷-甲醇(1∶1)洗脱,得到化合物8(36.95 mg)、9(27.33 mg)。
Fr. 7(369.75 mg)经硅胶柱色谱醋酸乙酯-95%乙醇-水(6∶2∶1)洗脱,TLC分析合并得3个组分Fr. 7a~7c。Fr. 7c经硅胶柱色谱,石油醚-醋酸乙酯(3∶1、1∶1)梯度洗脱,得到化合物10(11.52 mg)。
Fr. 9(3.10 g)经硅胶柱色谱醋酸乙酯-水-甲酸(8∶1∶1),反复用乙醇重结晶及沉淀法,得到化合物11(47.86 mg)、16(20.72 mg)。
Fr. 10(3.10 g)经硅胶柱色谱,醋酸乙酯-水-甲酸(8∶1∶1、6∶1∶1)梯度洗脱,得到化合物15(17.53 mg)。
3 结果
3.1 心肌保护作用
3.1.1 细胞活力检测 3种黄酒分别给药0.1、0.5、1.0 mg/mL,CCK-8法检测细胞活力结果见图1。与对照组比较,H2O2组细胞生存率显著降低(<0.05),说明模型建立成功。与H2O2组相比,RES(10 µmol/L)及3种黄酒(1.0 mg/mL)对细胞预处理后,细胞生存率显著升高(<0.05),说明其均有一定预防H2O2氧化应激作用。其中CRW-XY在1.0 mg/mL时效果最佳,接近于阳性药白藜芦醇。
3.1.2 抗氧化指标的测定结果 按试剂盒说明书检测LDH漏出率,结果见图2。与对照组比较,H2O2组细胞LDH漏出率显著升高,但在给RES(10 µmol/L)及3种黄酒(1.0 mg/mL)对细胞预保护之后,漏出率有所降低(<0.05),具有统计学意义,说明RES及3种黄酒对H2O2氧化应激反应可以起到一定预防作用,其中CRW-XY预防效果最好。
按试剂盒说明书检测MDA、SOD及GSH含量,结果见图3。与对照组比较,H2O2组细胞MDA含量显著升高(<0.001),说明模型建立成功;与H2O2组相比,RES(10 μmol/L)及各给药组(1.0 mg/mL)MDA含量均有一定降低,特别是CRW-XY在1.0 mg/mL质量浓度下,MDA降低至3.22 nmol/mg,接近于RES。与对照组相比,H2O2组细胞SOD及GSH含量显著降低(<0.01),说明模型建立成功;与H2O2组相比,RES(10 μmol/L)及各给药组(1.0 mg/mL)SOD及GSH含量升高,说明3种黄酒均有一定预防H2O2氧化应激作用,特别是CRW-XY在1.0 mg/mL质量浓度下,预防效果接近于RES。
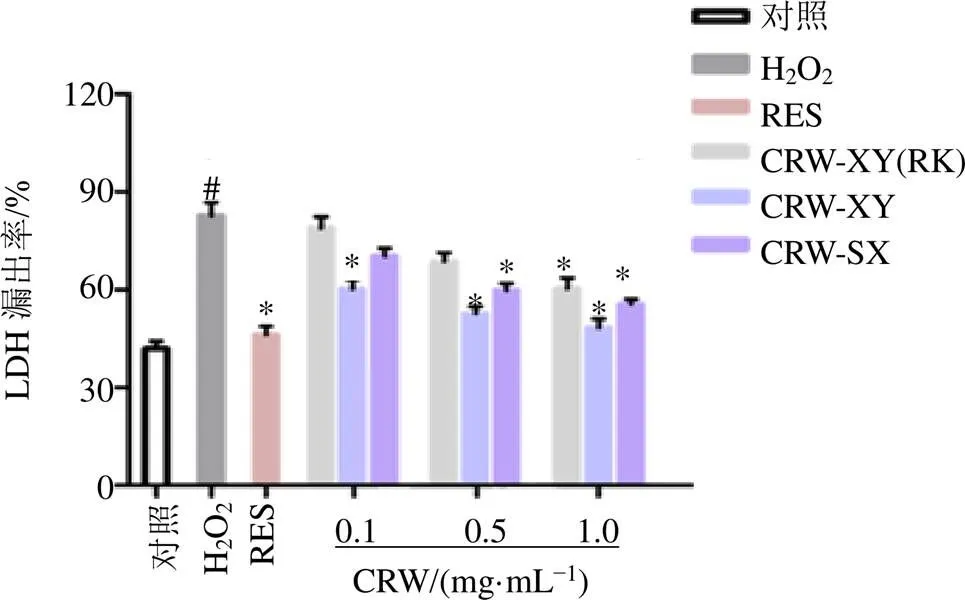
图2 不同浓度黄酒对H2O2致H9c2心肌细胞氧化应激细胞LDH漏出率影响
3.2 总酚酸测定结果
分别吸取0.10 mL的供试品溶液,测定值,根据线性方程计算样品含量,结果见表1,表明CRW-XY总酚酸含量最高。
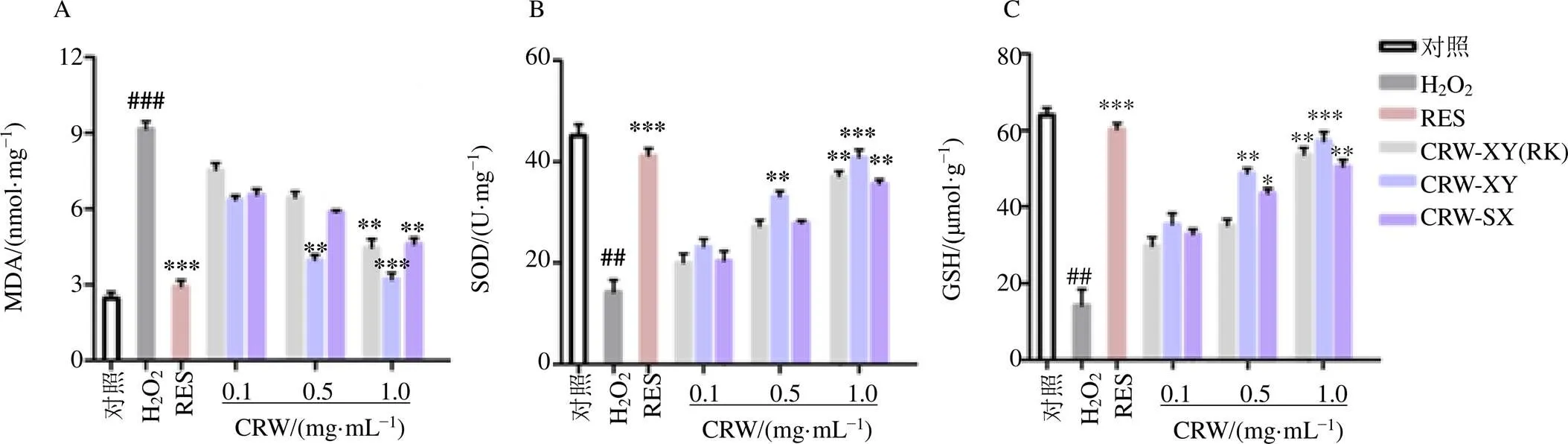
图3 黄酒对H2O2损伤H9c2心肌细胞内MDA (A)、SOD (B) 及GSH (C) 含量的影响
3.3 总黄酮测定结果
分别吸取0.10 mL的供试品溶液,测定值,根据线性方程计算样品含量,结果见表2。3个样品RSD值均小于2.0%,结果表明CRW-XY总黄酮含量最高。

表1 样品总酚酸含量测定结果()

表2 样品总黄酮含量测定结果()
3.4 相关营养成分结果分析
γ-氨基丁酸和P都具有保护心脏作用,可对抗多种心律失常。本实验对3种黄酒中与心肌保护作用相关的营养成分γ-氨基丁酸和P进行含量测定,结果见表3。表明CRW-XY中的γ-氨基丁酸含量最高,P含量相对较高,提示二者也为CRW-XY心肌保护作用的物质基础。
3.5 化合物结构鉴定
从CRW-XY中共分离得到17个化合物,分别进行结构确证。
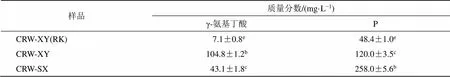
表3 3种黄酒中相关营养成分含量测定结果
同行上标字母不同表示差异显著(<0.05)
significant differences are indicated by different superscript letters of the counterparts(< 0.05)
化合物1:淡黄色粉末,mp 89~92 ℃,硅胶板检识,FeCl3-K3[Fe(CN)6] 显色为蓝色,提示该物质为酚类物质。ESI-MS/137.1 [M-H]−,分子式为C8H10O2。1H-NMR (400 MHz, CDCl3): 8.10 (1H, s, -OH), 7.09 (2H, d,= 8.4 Hz, H-2, 6), 6.78 (2H, d,= 8.4 Hz, H-3, 5), 4.77 (1H, s, 8-OH), 3.82 (2H, d,= 6.5 Hz, H-8), 2.79 (2H, d,= 6.5 Hz, H-7);13C-NMR (100 MHz, CDCl3): 154.3 (C-4), 133.6 (C-1), 130.2 (C-2, 6), 115.5 (C-3, 5), 63.8 (C-8), 38.2 (C-7)。上述数据与文献报道基本一致[9-10],鉴定化合物1为对羟基苯乙醇。
化合物2:白色针晶(石油醚),mp 168~172 ℃,硅胶板检识,FeCl3-K3[Fe(CN)6] 显色为蓝色,溴酚蓝显色为黄色,提示该物质为酚酸类物质。ESI-MS/195.0 [M+H]+,分子式为C10H10O4。1H-NMR (400 MHz, MeOD): 7.56 (1H, d,= 15.9 Hz, H-7), 7.14 (1H, d,= 1.9 Hz, H-2), 7.02 (1H, dd,= 8.2, 1.9 Hz, H-6), 6.77 (1H, d,= 8.2 Hz, H-5), 6.27 (1H, d,= 15.9 Hz, H-8), 3.85 (3H, s, -OCH3)。13C-NMR (100 MHz, MeOD): 171.0 (-COOH), 150.5 (C-4), 149.4 (C-3), 146.9 (C-7), 127.8 (C-1), 124.0 (C-6), 116.5 (C-8), 115.9 (C-2), 111.7 (C-5), 56.4 (-OCH3)。上述数据与文献报道基本一致[11-12],鉴定化合物2为阿魏酸。
化合物3:白色针晶(甲醇),mp 211~213 ℃,硅胶板检识,FeCl3-K3[Fe(CN)6] 显色为蓝色,溴酚蓝显示阳性,提示该物质为酚酸类物质。ESI-MS/181.1 [M+H]+,分子式为C9H8O4。1H-NMR (400 MHz, MeOD): 7.53 (1H, d,= 15.9 Hz, H-7), 7.03 (1H, d,= 2.0 Hz, H-2), 6.93 (1H, dd,= 8.2, 2.0 Hz, H-6), 6.78 (1H, d,= 8.2 Hz, H-5), 6.22 (1H, d,= 15.9 Hz, H-8);13C-NMR (100 MHz, MeOD): 171.2 (-COOH), 149.6 (C-4), 147.2 (C-3), 146.9 (C-7), 127.9 (C-1), 123.0 (C-6), 116.6 (C-5), 115.7 (C-8), 115.2 (C-2)。上述数据与文献报道基本一致[13-14],鉴定化合物3为咖啡酸。
化合物4:无色针晶(甲醇),mp 118~120 ℃,硅胶板检识,乙醇-浓硫酸显色加热呈紫红色。ESI-MS/121.1 [M-H]−,分子式为C4H10O4。1H-NMR (400 MHz, MeOD): 3.70 (2H, dd,= 10.3, 5.0 Hz, H-2, 3), 3.58 (8H, ddd,= 17.5, 11.4, 5.3 Hz, 1, 2, 3, 4-OH, H-1, 4,)。13C-NMR (100 MHz, MeOD): 73.6 (C-2, 3), 64.0 (C-1, 4)。上述数据与文献报道基本一致[15-16],鉴定化合物4为赤藓糖醇。
化合物5:无色片状结晶(乙醇),mp 300 ℃,硅胶板检识,FeCl3-K3[Fe(CN)6] 显色为蓝色,提示该物质为酚类物质。ESI-MS/109.0 [M-H]−,分子式为C6H6O2。1H-NMR (400 MHz, DMSO-6): 8.81 (2H, s, H-1, 2), 6.74 (2H, m, H-3, 6), 6.61 (2H, m, H-4, 5);13C-NMR (100 MHz, DMSO-6): 145.4 (C-1, 2), 119.4 (C-4, 5), 115.8 (C-3, 6)。上述数据与文献报道基本一致[17],鉴定化合物5为儿茶酚。
化合物6:淡黄色粉末,mp 175~176 ℃,硅胶板检识,AlCl3显色后加热,365 nm显黄色荧光,提示该物质为黄酮类物质。ESI-MS/291.2 [M+H]+,分子式为C15H14O6。1H-NMR (400 MHz, MeOD): 6.84 (1H, d,= 1.9 Hz, H-2′ ), 6.76 (1H, d,= 8.1 Hz, H-5′), 6.72 (1H, dd,= 8.2, 1.9 Hz, H-6′), 5.92 (1H, d,= 2.3 Hz, H-6), 5.85 (1H, d,= 2.3 Hz, H-8), 4.56 (1H, d,= 7.5 Hz, H-2), 3.97 (1H, dd,= 13.2, 7.9 Hz, H-3), 2.85 (1H, dd,= 16.1, 5.4 Hz, H-4a), 2.50 (1H, dd,= 16.1, 8.2 Hz, H-4b);13C-NMR (100 MHz, MeOD): 158.0 (C-7), 157.7 (C-5), 157.1 (C-9), 146.3 (C-3′, 4′), 132.4 (C-1′), 120.2 (C-6′), 116.2 (C-5′), 115.4 (C-2′), 101.0 (C-10), 96.4 (C-6), 95.6 (C-8), 82.9 (C-2), 69.0 (C-3), 28.7 (C-4)。上述数据与文献报道基本一致[18-19],鉴定化合物6为儿茶素。
化合物7:白色粉末,mp 205~209 ℃,硅胶板检识,FeCl3-K3[Fe(CN)6] 显色为蓝色,溴酚蓝显阳性,提示该物质为酚酸类物质。ESI-MS/196.9 [M-H]−,分子式为C9H10O5。1H-NMR (400 MHz, MeOD): 7.33 (1H, s, H-2, 6), 3.88 (6H, s, 8, 9-OCH3);13C-NMR (100 MHz, MeOD): 170.0 (C-7), 148.9 (C-3, 5), 120.8 (C-1), 108.3 (C-2, 6), 56.8 (C-8, 9)。上述数据与文献报道基本一致[20-21],鉴定化合物7为丁香酸。
化合物8:黄色粉末,mp 195 ℃,硅胶板检识,AlCl3显色后加热,365 nm显黄色荧光,提示该物质为黄酮类物质。ESI-MS/608.9 [M-H]−,分子式为C27H30O16。1H-NMR (400 MHz, DMSO-6): 12.60 (1H, s, 5-OH), 7.54 (2H, m, H-2′, 6′), 6.84 (1H, d,= 8.4 Hz, H-5′), 6.38 (1H, d,= 2.0 Hz, H-8), 6.19 (1H, d,= 2.0 Hz, H-6), 5.34 (1H, d,= 7.4 Hz, H-1′′), 5.28 (1H, d,= 3.0 Hz, 2′-OH), 4.38 (1H, s, H-1′′′), 0.99 (3H, d,= 6.2 Hz, H-6′′′);13C-NMR (100 MHz, DMSO-6): 177.6 (C-4), 164.3 (C-7), 161.4 (C-5), 156.8 (C-2), 156.6 (C-9), 148.5 (C-4′), 144.9 (C-3′), 133.4 (C-3), 121.8 (C-1′), 121.2 (C-6′), 116.4 (C-5′), 115.3 (C-2′), 104.2 (C-10), 101.2 (C-1′′), 100.8 (C-1′′′), 98.8 (C-6), 93.7 (C-8), 76.6 (C-3′′), 76.1 (C-5′′), 74.2 (C-2′′), 72.0 (C-4′′′), 70.7 (C-3′′′), 70.5 (C-2′′′), 70.1 (C-4′′), 68.4 (C-5′′′), 67.2 (C-5′′), 17.9 (C-6′′′)。上述数据与文献基本一致[22-23],鉴定化合物8为芦丁。
化合物9:黄色粉末,mp 314~317 ℃,硅胶板检识,AlCl3显色后加热,365 nm显黄色荧光,提示该物质为黄酮类物质。ESI-MS/300.9 [M-H]−,分子式为C15H10O7。1H-NMR (400 MHz, MeOD): 7.73 (1H, d,= 2.2 Hz, H-2′), 7.63 (1H, dd,= 8.5, 2.2 Hz, H-6′), 6.88 (1H, d,= 8.5 Hz, H-5′), 6.39 (1H, d,= 2.1 Hz, H-6), 6.18 (1H, d,= 2.1 Hz, H-8);13C-NMR (100 MHz, MeOD): 177.2 (C-4), 165.6 (C-7), 162.5 (C-5), 158.1 (C-9), 148.7 (C-2), 148.0 (C-4′), 146.1 (C-3′), 137.1 (C-3), 124.0 (C-1′), 121.7 (C-6′), 116.2 (C-5′), 116.0 (C-10), 104.5 (C-2′), 99.2 (C-8), 94.4 (C-6)。上述数据与文献基本一致[24-25],鉴定化合物9为槲皮素。
化合物10:白色针晶(甲醇),mp 139~142 ℃,硅胶板检识,乙醇-浓硫酸显色加热呈紫红色。ESI-MS/397.5 [M+H]+,分子式为C29H50O。1H-NMR (400 MHz, CDCl3): 5.35 (1H, s, H-6), 3.52 (1H, m, H-3), 1.01 (3H, s, H-19), 0.92 (3H, d,= 6.6 Hz , H-21), 0.85 (3H, d,= 7.7 Hz, H-29), 0.82 (3H, d,= 1.9 Hz, H-26), 0.80 (3H, d,= 6.9 Hz, H-27), 0.68 (3H, s, H-18);13C-NMR (100 MHz, CDCl3): 140.9 (C-5), 121.9 (C-6), 72.0 (C-3), 56.9 (C-14), 56.2 (C-17), 50.3 (C-9), 46.0 (C-24), 42.5 (C-4, 13), 39.9 (C-12), 37.4 (C-1), 36.7 (C-10), 36.3 (C-20), 34.1 (C-22), 32.1 (C-7), 31.8 (C-7), 31.7 (C-2), 29.3 (C-25), 28.4 (C-23), 26.3 (C-15), 24.5 (C-16), 23.2 (C-28), 21.2 (C-11), 20.0 (C-26), 19.6 (C-27), 19.2 (C-21), 18.9 (C-19), 12.1 (C-29), 12.0 (C-18)。上述数据与文献基本一致[26-27],鉴定化合物10为β-谷甾醇。
化合物11:白色无定形粉末,mp 228 ℃,硅胶板检识,改良碘化铋钾显黄色斑点,提示其含N原子;茚三酮乙醇显色呈阳性,提示该化合物为氨基酸类或肽类化合物。ESI-MS/116.0 [M+H]+,分子式为C5H9NO2。1H-NMR (400 MHz, MeOD): 3.98 (1H, dd,= 8.8, 6.4 Hz, H-2), 3.38 (1H, m, H-3), 3.24 (1H, m, H-3), 2.30 (1H, m, H-5), 2.11 (1H, m,= 13.3, 6.3 Hz, H-5), 1.97 (2H, m, H-4);13C-NMR (100 MHz, MeOD): 174.1 (C-1), 62.6 (C-2), 47.0 (C-3), 30.4 (C-5), 25.1 (C-4)。上述数据与文献报道基本一致[28],鉴定化合物11为脯氨酸。
化合物12:白色针晶(甲醇),mp 197~200 ℃,硅胶板检识,FeCl3-K3[Fe(CN)6]显色为蓝色,溴酚蓝显黄色斑点,提示该化合物为酚酸类物质。ESI-MS/152.9 [M-H]−,分子式为C7H6O4。1H-NMR (400 MHz, MeOD): 7.41 (2H, m, H-2, 6), 6.78 (1H, d,= 7.8 Hz, H-5);13C-NMR (100 MHz, MeOD): 170.4 (C-7), 151.7 (C-4), 146.2 (C-3), 124.0 (C-6), 123.3 (C-1), 117.3 (C-2), 115.7 (C-5)。上述数据与文献报道基本一致[29-30],鉴定化合物12为原儿茶酸。
化合物13:白色结晶(甲醇),mp 240 ℃,硅胶板检识,AlCl3显色加热,365 nm显黄色荧光,提示该物质为黄酮类物质。ESI-MS/:291.1 [M+H]+,分子式为C15H14O6。1H-NMR (400 MHz, MeOD): 6.98 (1H, d,= 1.8 Hz, H-2′), 6.76 (1H, d,= 2.7 Hz, H-6′), 6.65 (1H, dd,= 5.9, 3.5 Hz, H-5′), 5.94 (1H, s, H-8), 5.92 (1H, s, H-6), 4.82 (1H, s, H-2), 4.18 (1H, s, H-3), 2.86 (1H, dd,= 16.7, 4.6 Hz, H-4a), 2.74 (1H, dd,= 16.8, 2.8 Hz, H-4b);13C-NMR (100 MHz, MeOD): 158.2 (C-7), 157.8 (C-5), 157.5 (C-9), 146.1 (C-3′), 145.9 (C-4′), 132.4 (C-1′), 121.1 (C-6′), 116.0 (C-5′), 115.4 (C-2′), 100.2 (C-10), 96.5 (C-6), 96.0 (C-8), 80.0 (C-2), 67.6 (C-3), 29.4 (C-4)。上述数据与文献报道基本一致[31-32],鉴定化合物13为表儿茶素。
化合物14:白色结晶(醋酸乙酯),mp 210 ℃,硅胶板检识,FeCl3-K3[Fe(CN)6] 显色为蓝色,溴酚蓝显示阳性,提示该物质为酚酸类物质。ESI-MS/352.9 [M-H]−,分子式为C16H18O9。1H-NMR (400 MHz, MeOD): 7.56 (1H, d,= 15.9 Hz, H-7), 7.05 (1H, d,= 2.0 Hz, H-2), 6.95 (1H, dd,= 8.2, 2.0 Hz, H-6), 6.78 (1H, d,= 8.2 Hz, H-5), 6.26 (1H, d,= 15.9 Hz, H-8), 5.33 (1H, m, H-5′), 4.17 (1H, dd,= 6.3, 3.3 Hz, H-4′), 3.73 (1H, dd,= 8.5, 3.2 Hz, H-3′), 2.15 (4H, m, H-2′, 6′);13C-NMR (100 MHz, MeOD): 177.2 (C-7′), 168.8 (C-9), 149.7 (C-4), 147.2 (C-7), 147.0 (C-3), 127.9 (C-1), 123.1 (C-6), 116.6 (C-5), 115.4 (C-8), 76.3 (C-1′), 73.6 (C-3′), 72.1 (C-4′), 71.4 (C-5′), 38.9 (C-2′), 38.4 (C-6′)。上述数据与文献基本一致[33-34],鉴定化合物14为绿原酸。
化合物15:白色片状晶体(乙醇),mp 300 ℃,硅胶板检识,改良碘化铋钾显黄色斑点,提示其含N原子;茚三酮乙醇显色呈阳性,提示该化合物为氨基酸类化合物。ESI-MS/132.0 [M-H]−,分子式为C4H7NO4。1H-NMR (400 MHz, D2O): 4.08 (1H, dd,= 6.9, 4.6 Hz, H-2), 3.00 (2H, m, H-3);13C-NMR (100 MHz, D2O): 174.3 (C-1), 172.9 (C-4), 50.7 (C-2), 34.6 (C-3)。上述数据与文献报道基本一致[35],鉴定化合物15为天冬氨酸。
化合物16:白色片状晶体(乙醇),mp 215 ℃,硅胶板检识,改良碘化铋钾显黄色斑点,提示其含N原子;茚三酮乙醇显色呈阳性,提示该化合物为氨基酸类化合物。ESI-MS/147.0 [M+H]+,分子式为C6H14N2O2。1H-NMR (400 MHz, D2O): 3.38 (1H, t,= 6.3 Hz, H-1), 2.95 (2H, m, H-5, 5′), 1.67 (4H, m, H-2, 4, 2′, 4′), 1.40 (2H, m, H-3, 3′);13C-NMR (100 MHz, D2O): 180.7 (-COOH), 55.3 (C-2), 39.3 (C-6), 32.7 (C-5), 27.0 (C-4), 21.8 (C-3)。上述数据与文献报道基本一致[36],鉴定化合物16为赖氨酸。
化合物17:白色结晶粉末,mp 94~98 ℃,硅胶板检识,乙醇-浓硫酸喷雾后加热呈紫红色。ESI-MS/143.0 [M-H]−,分子式为C10H8O。1H-NMR (400 MHz, MeOD): 8.23 (1H, m, H-8), 7.72 (1H, dd,= 6.2, 3.2 Hz, H-5), 7.39 (2H, m, H-6, 7), 7.27 (2H, m, H-3, 4), 6.84 (1H, dd,= 7.3, 1.1 Hz, H-2);13C-NMR (100 MHz, MeOD): 154.5 (C-1), 136.4 (C-10), 128.5 (H-5), 127.2 (C-6), 127.1 (C-3), 126.4 (C-7), 125.6 (C-9), 123.2 (C-8), 120.2 (C-4), 109.0 (C-2)。上述数据与文献基本一致[37],鉴定化合物17为α-萘酚。
4 讨论
本实验研究了3种黄酒的心肌保护作用及CRW-XY活性成分。以细胞生存率、LDH漏出率、MDA、SOD及GSH为指标,发现白藜芦醇及各给药组均能一定程度升高细胞生存率、降低LDH漏出率及MDA含量并升高SOD及GSH含量,说明3种黄酒对H2O2氧化应激损伤细胞有不同程度的保护作用,特别是CRW-XY在1.0 mg/mL下效果最好,均接近于白藜芦醇。对其活性成分进行了进一步研究,从中分离得到了17个化合物,主要为酚酸类和黄酮类物质,鉴于2类物质具有很强的抗氧化性[38],本研究测定了3种黄酒中总酚酸、总黄酮及相关营养成分γ-氨基丁酸含量,结果表明CRW-XY中2类物质含量明显高于其他2种黄酒,与其心肌保护作用最好相印证。
本研究表明CRW-XY对氧化损伤细胞具有良好的保护作用,并与黄酒的酵曲和原料具有一定相关性,研究为黄酒质量标准体系建立、CRW-XY品质进一步提升及黄酒产业健康发展提供了科学依据。
利益冲突 所有作者均声明不存在利益冲突
[1] 倪莉, 吕旭聪, 黄志清, 等. 黄酒的生理功效及其生理活性物质研究进展 [J]. 中国食品学报, 2012, 12(03): 1-7.
[2] 韩惠敏, 李新生, 耿敬章, 等. 黄酒酿造原料及生产工艺研究现状与展望 [J]. 生物资源, 2019, 41(1): 87-93.
[3] Wang Y, Li D X, Shen G S. Inhibitory effects of gamma-aminobutyric acid and diazepam on ventricular arrhythmias induced by hypothalamic electric stimulation [J]., 1989, 10(2): 147-150.
[4] Wei B, Lin Q, Ji Y G,. Luteolin ameliorates rat myocardial ischaemia-reperfusion injury through activation of peroxiredoxin II [J]., 2018, 175(16): 3315-3332.
[5] 罗铝铿, 邹浩元, 杨宇辉, 等. 客家黄酒的抗氧化作用研究 [J]. 中国酿造, 2016, 35(8): 61-65.
[6] 陈林玉, 宋乐园, 王云雨, 等. 红小米化学成分与营养成分分析 [J]. 食品科学, 2021, 42(18): 218-224.
[7] 张桂芳, 张东杰, 鹿保鑫, 等. 不同萌发时间黑豆芽总黄酮含量及DPPH自由基清除能力的测定 [J]. 食品科技, 2020, 45(12): 39-45.
[8] GB 5009.124-2016 食品中氨基酸的测定 [S]. 2016: 1-4.
[9] 董丽巍, 王金兰, 赵明, 等. 紫丁香花蕾化学成分研究 [J]. 天然产物研究与开发, 2011, 23(4): 658-660.
[10] 王亚男, 卢轩, 孙莎, 等.海洋真菌No.Y19-07菌丝体次级代谢产物化学成分的分离与鉴定 [J]. 沈阳药科大学学报, 2009, 26 (9): 704-708.
[11] 杜伟东, 吴蓓, 李志峰, 等. 小花清风藤化学成分的分离与鉴定 (II) [J]. 中草药, 2019, 50(18): 4277-4280.
[12] Park J, Gim S Y, Jeon J Y,. Chemical profiles and antioxidant properties of roasted rice hull extracts in bulk oil and oil-in-water emulsion [J]., 2019, 272: 242-250.
[13] 钱文琪, 吴炜琳, 张勋豪, 等. 满江红全草化学成分研究 [J]. 中草药, 2020, 51(17): 4397-4404.
[14] 周媛, 薛艳红, 刘朝霞. 木榄提取物及单体化合物对SH-SY5Y神经细胞抗氧化研究 [J]. 三峡大学学报: 自然科学版, 2016, 38(2): 88-91.
[15] 米娇, 张龙云, 吴林蔚, 等. 洋河大曲的化学成分 [J]. 应用与环境生物学报, 2016, 22(5): 845-847.
[16] Tanaka E, Honda Y. Teleomorph-anamorph connection ofwithand corresponding erythritol production [J]., 2017, 58(6): 445-451.
[17] 张树军, 常海波, 吕伟强, 等. 旱柳落叶化学成分研究 [J]. 林产化学与工业, 2013, 33(1): 97-101.
[18] 陈玩珊, 胡新华, 原文鹏. 酸模叶的化学成分研究 [J]. 中华中医药杂志, 2019, 34(8): 3769-3771.
[19] Moresco H H, Colla G, Cavalcante I D,. Chemical constituents ofand their antioxidant activity [J]., 2016, 30(22): 2624-2628.
[20] 李余钊, 文琰章, 杨新洲, 等. 紫茎泽兰醋酸乙酯部位化学成分研究 [J]. 中草药, 2020, 51(4): 932-936.
[21] Panyo J, Matsunami K, Panichayupakaranant P. Bioassay-guided isolation and evaluation of antimicrobial compounds fromagainst some oral pathogens [J]., 2016, 54(9): 1522-1527.
[22] 赵明, 徐阳宏, 乌兰托娅, 等. 东北岩高兰醋酸乙酯萃取物化学成分研究 [J]. 中草药, 2020, 51(13): 3399-3405.
[23] Devkota H P, Adhikari B, Watanabe T,. Nonvolatile chemical constituents from the leaves of(DC.) pimenov & kljuykov and their free radical-scavenging activity [J]., 2018, 2018: 1794650.
[24] 彭谷, 黄娟, 周应军, 等. 水葱化学成分研究 [J]. 中草药, 2020, 51(19): 4902-4906.
[25] Lee J S, Kim Y N, Kim N H,. Identification of hepatoprotective constituents inand development of simultaneous analysis method using high-performance liquid chromatography [J]., 2017, 13(52): 535-541.
[26] 肖艳华, 徐卓, 杜治平. 青钱柳化学成分及抗氧化活性研究 [J]. 食品科技, 2019, 44(10): 223-228.
[27] Li D, Fu D W, Zhang Y,. Isolation, purification, and identification of taxol and related taxanes from taxol-producing fungussubsp.[J]., 2017, 27(8): 1379-1385.
[28] McKerrow J D, Al-Rawi J M A, Brooks P. Use of diphenyliodonium bromide in the synthesis of some-phenyl α-amino acids [J]., 2010, 40(8): 1161-1179.
[29] 成蕾, 陈志有, 尚志梅, 等. 重唇石斛化学成分研究 [J]. 中草药, 2020, 51(12): 3126-3130.
[30] Ezzat M I, Ezzat S M, El Deeb K S,.evaluation of cytotoxic activity of the ethanol extract and isolated compounds from the corms of(L.) Willd on HepG2 [J]., 2017, 31(11): 1325-1328.
[31] 董丽华, 朱玉野, 张忠立, 等. 叉分蓼全草化学成分研究 [J]. 中药材, 2019, 42(5): 1059-1061.
[32] Nam J W, Phansalkar R S, Lankin D C,. Absolute configuration of native oligomeric proanthocyanidins with dentin biomodification potency [J]., 2017, 82(3): 1316-1329.
[33] 胡居吾, 吴磊, 涂招秀, 等. 蔓三七叶中分离绿原酸和异绿原酸及其抗氧化活性研究 [J]. 天然产物研究与开发, 2019, 31(1): 38-43.
[34] Kumar A, Agnihotri V K. Phytochemical studies ofroots from Western Himalaya [J]., 2020, 34(3): 421-424.
[35] 胡永美, 汪豪, 叶文才, 等. 繁缕中的水溶性化学成分 [J]. 中国药科大学学报, 2005, 36(6): 523-525.
[36] 陈燕燕, 李晓男, 王跃飞, 等. 应用核磁共振指纹谱考察黄芪不同炮制品化学成分的差异 [J]. 中国科技论文, 2014, 9(12): 1410-1413.
[37] Abdel-Mogib M, Basaif S A. Two new naphthalene and anthraquinone derivatives from[J]., 2002, 57(4): 286-287.
[38] 林亲录, 施兆鹏. 类黄酮与酚酸等天然抗氧化剂的结构与其抗氧化力的关系 [J]. 食品科学, 2001, 22(6): 85-91.
Cardioprotective effects and active components of red millet Huangjiu
LI Shuang, CHEN Lin-yu, WANG Dong-hao, LI Ying-mei, LIU Teng-teng, LOU Shu-qi, BI Yue-feng
Pharmacy College, Zhengzhou University, Zhengzhou 450001, China
In this paper, two kinds of Henan Nanyang red millet Huangjiu and one kind of glutinous Huangjiu were selected to compare and study their myocardial protective effects and active components of red millet Huangjiu.The oxidative stress injury model was established by applying hydrogen peroxide (H2O2) to cardiomyocytes. The cell viability was measured by CCK-8 assay; The levels of cellular lactate dehydrogenase (LDH), superoxide dismutase (SOD) and malondialdehyde (MDA) were measured colorimetrically. The contents of total phenolic acids, total flavonoids, as well as related nutritional components were determined using the Prussian blue chromogenic method and the sodium nitrite aluminum nitrate sodium hydroxide chromogenic method. A systematic study of the chemical constituents in red millet Huangjiu was carried out using column chromatography methods such as silica gel and ODS, combined with various spectroscopic techniques.All 3 kinds of Huangjiu exhibited some degree of protection on cardiomyocytes from oxidative damage by H2O2, especially the red millet Huangjiu exhibited significant protection. A total of 17 compounds, mainly phenolic acids and flavonoids, were isolated from red millet Huangjiu. The results of content determination showed that the red millet Huangjiu had the highest contents of total phenolic acids, total flavonoids as well as γ-aminobutyric acid.Red millet Huangjiu has a good protective effect on the cells damaged by oxidation, and its main active components were total phenolic acid, total flavonoids and γ-aminobutyric acid.
red millet Huangjiu;myocardial protection;content determination; total phenolic acid; total flavonoids; γ-aminobutyric acid
R284.1
A
0253 - 2670(2022)22 - 7010 - 09
10.7501/j.issn.0253-2670.2022.22.004
2022-07-14
李 爽(1998—),女,在读硕士研究生,专业方向为药学。E-mail: lis0801@163.com。
毕跃峰,女,博士后,教授,研究生导师,研究方向为中药作用物质基础、作用机制研究及新药研究开发。Tel: 13939091607 E-mail: 2000byf@sina.com
[责任编辑 王文倩]

