海蒿子多糖提取、纯化及其药理活性研究进展
孔丽,朱月霞,周冰雪,刘志,薛旺迁,石锦峰,郑家勤,李姣姣,吉敬,秦昆明,3,董自波,3,沈金阳,3*
(1.江苏海洋大学 药学院,江苏 连云港 222000;2.连云港贵科药业有限公司,江苏 连云港 222000;3. 江苏省海洋药用资源开发工程研究中心,江苏 连云港 222005)
海蒿子Sargassumpallidum隶属于褐藻门Rhaeophyta马尾藻科Sargassaceae马尾藻属Sargassum。海蒿子植物形态呈皱缩卷曲,长度为30~60 cm;圆柱形主干,两侧发出主枝,主枝叶腋处生出侧枝;单叶互生,初生叶和次生叶呈披针形或线形,固着器呈盘状,黑褐色气囊直径为2~5 mm,呈球形或倒卵形(图1)。海蒿子生长于潮间带的石沼中和大干潮线下1~4 m深处的岩石上,为多年生海藻[1],主产于中国黄海、渤海沿岸海域,其他海域也有少量分布[2]。干燥海蒿子水浸后膨胀,具有黏滑、柔软和味咸等特点[3]。海蒿子具有化痰软坚、消瘿散结和利水消肿等功效,被用于治疗痰饮水肿、瘿瘤、脚气和小便不利等疾病,1963年版《中国药典》将海蒿子同羊栖菜作为中药海藻的主流品种收入正品药材[2,4]。海蒿子为褐藻的典型代表,系统地研究其多糖活性和结构,对褐藻多糖的开发利用具有积极意义[3]。
对海蒿子多糖(SPP)的研究较多,通过传统的水提法、酸提法,以及新颖的超声波、微波辅助、超临界流体萃取技术等提取海蒿子多糖,采用沉淀法、柱色谱法等进行纯化,可分离出不同的多糖组分[4-5]。大量研究发现,海蒿子多糖提取物具有抗氧化、抗肿瘤、降血糖、降血脂和调节免疫功能等药理作用[4-7]。刘斌[5]在不同提取温度和乙醇含量下,用醇沉法获得性质不同的褐藻糖胶,并通过噻唑蓝(MTT)法分析发现,硫酸基含量最高的海蒿子多糖组分对肿瘤细胞的生长抑制活性最强;Cao等[6]研究表明,海蒿子多糖不仅具有良好的1,1-二苯基-2-三硝基苯肼(DPPH)自由基清除能力、羟基自由基清除能力、细胞抗氧化能力和活性氧抑制能力,还具有良好的α淀粉酶和α葡萄糖苷酶抑制活性,能显著提高胰岛素抵抗性肝癌细胞(HepG2)的糖消耗、糖原合成,以及丙酮酸激酶、己糖激酶活性,因此,海蒿子多糖可以作为一种潜在的抗氧化剂和降血糖候选物质,应用于功能性和营养食品等方面;张华峰等[7]研究表明,海蒿子多糖能明显降低高血脂小鼠血清中总胆固醇、甘油三酯的含量;Zhang等[8]发现,海蒿子多糖可以抵抗N-甲基-N-硝基-亚硝基胍(MNNG)引起的免疫损伤,降低肿瘤坏死因子-α的水平,增强胃癌大鼠的免疫力。本研究中,对海蒿子多糖的提取纯化方法及药理作用进行综述,并针对研究应用中存在的问题,提出了海蒿子多糖研究的未来发展建议,以期为海蒿子的进一步开发利用提供参考,使其在医药健康领域发挥更为积极的作用。

图1 海蒿子(2020年4月18采摘于山东威海)Fig.1 Sea weed Sargassum pallidum (collected on April 18, 2020, from Weihai, Shandong Province)
1 海蒿子多糖组成与结构
对海蒿子多糖的研究最早可追溯至1970年Ovodov等[9]对褐藻多糖的研究,褐藻多糖主要包括褐藻糖胶、褐藻胶和褐藻淀粉[5],是中药海藻水提取物的主要部分。李溢真等[1]采用传统水提法测得海蒿子总多糖含量为24.32%;刘斌[5]通过改变提取温度和乙醇含量,用醇沉法获得性质不同的褐藻糖胶,纯化分离后获得的褐藻糖胶分子量均单一。多位学者对海蒿子多糖的单糖组成进行了研究,证实了纯化的海蒿子多糖主要由岩藻糖、半乳糖、木糖、葡萄糖、甘露糖、鼠李糖和阿拉伯糖组成[5-6],也有研究表明,海蒿子单糖组成中还有一定量的糖醛酸[5,10-12]。海蒿子多糖分离组分具体组成见表1。
海蒿子多糖结构具有如下特点:主要以岩藻糖、甘露糖和半乳糖的多糖骨架组成,硫酸基和糖链分支连接于该骨架上,其相对分子质量约为280 000,不被高碘酸氧化;多糖链主要由1→4连接的岩藻糖,1→2,3,4和1→3,4,6连接的甘露糖,以及1→3,6连接的半乳糖构成;多糖的分支点主要位于己糖(甘露糖和半乳糖)上;侧链主要为葡萄糖;糖链末端为木糖;硫酸基主要连接于岩藻糖的2位或3位;多糖链不存在三股螺旋[5]。王培培等[13]采用稀酸水解和柱色谱分离获得一系列不同聚合度的杂合硫酸寡糖片段,并确定了其硫酸根位置及结构序列。
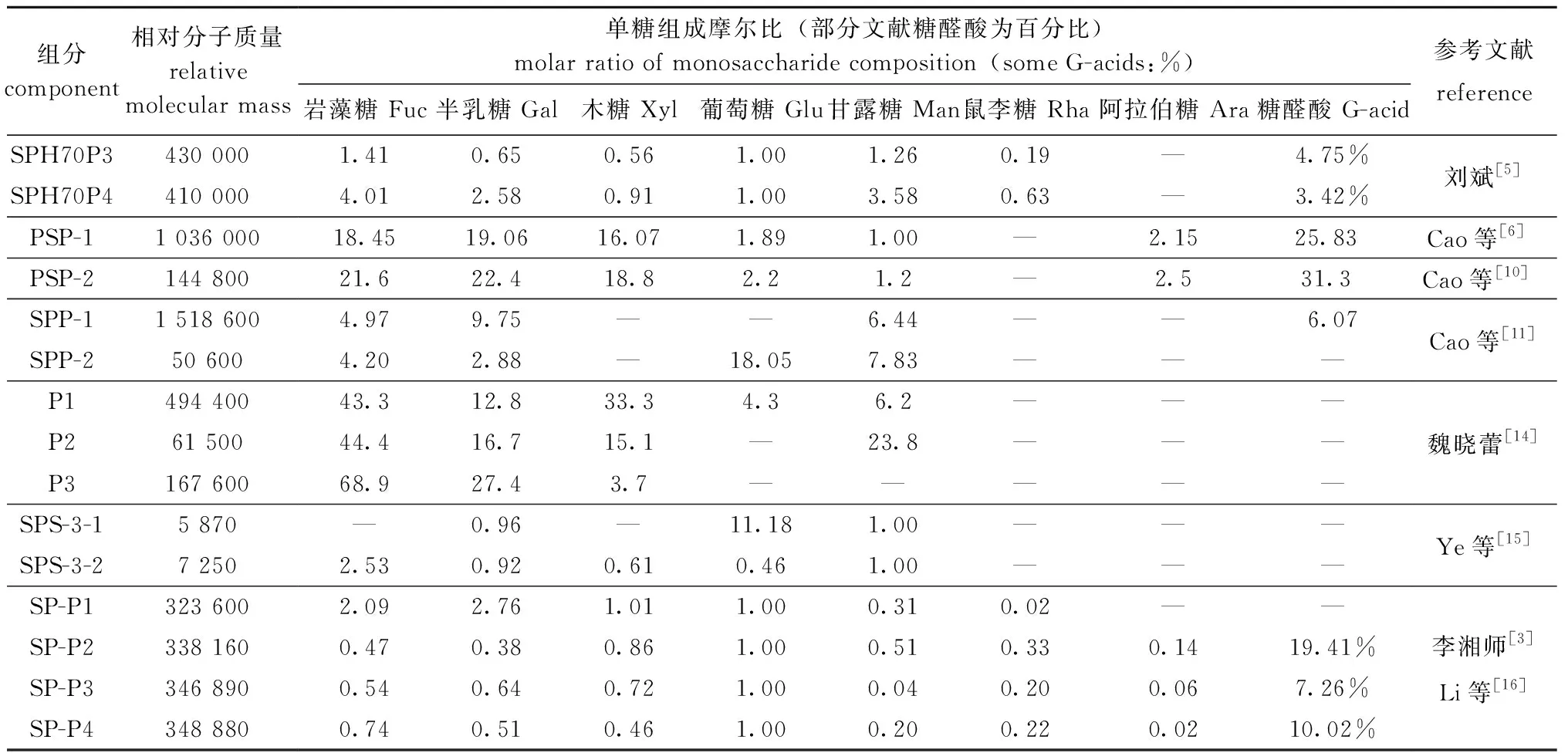
表1 海蒿子多糖不同分离组分的组成Tab.1 Different components of polysaccharides from sea weed Sargassum pallidum
2 海蒿子多糖提取方法
常见的海蒿子多糖提取方法有水提法、酸提法、超声辅助提取法和超声波-微波协同提取法(表2)。在提取之前,通常将海蒿子按照以下方法进行脱脂和脱色处理:将海蒿子干粉与体积分数为95%的乙醇在 70 ℃下回流2次,每次回流3 h;过滤后,将残渣在50 ℃烘箱中干燥48 h,干燥后的残渣[17]备用;或使用氯仿进行预处理操作[18-19]。
海蒿子粗多糖含量和提取率的差异与提取方法密切相关,不同提取方法提取得到的多糖含量及提取率见表3。根据文献报道,海蒿子粗多糖提取物中多糖含量最高为38.00%,为海蒿子干粉经热水抽提、乙醇沉淀所得粗多糖含量[28]。如方飞等[21]将海蒿子水提多糖后,用三氯乙酸去除蛋白质,得到海蒿子粗多糖提取率最高(7.2%);扶雄等[23]比较了水提法、酸提法和超声辅助提取法,发现采用柠檬酸提取法多糖得率最高,得率为5.31%±0.21%,原因是柠檬酸是一种弱酸,在该弱酸中,细胞、细胞壁充分溶胀而破裂,使胞间和胞内的多糖溶出,提高了得率,而超声辅助提取法并未增加多糖得率,可能是超声浸提仅20 min,多糖未完全溶出所致。
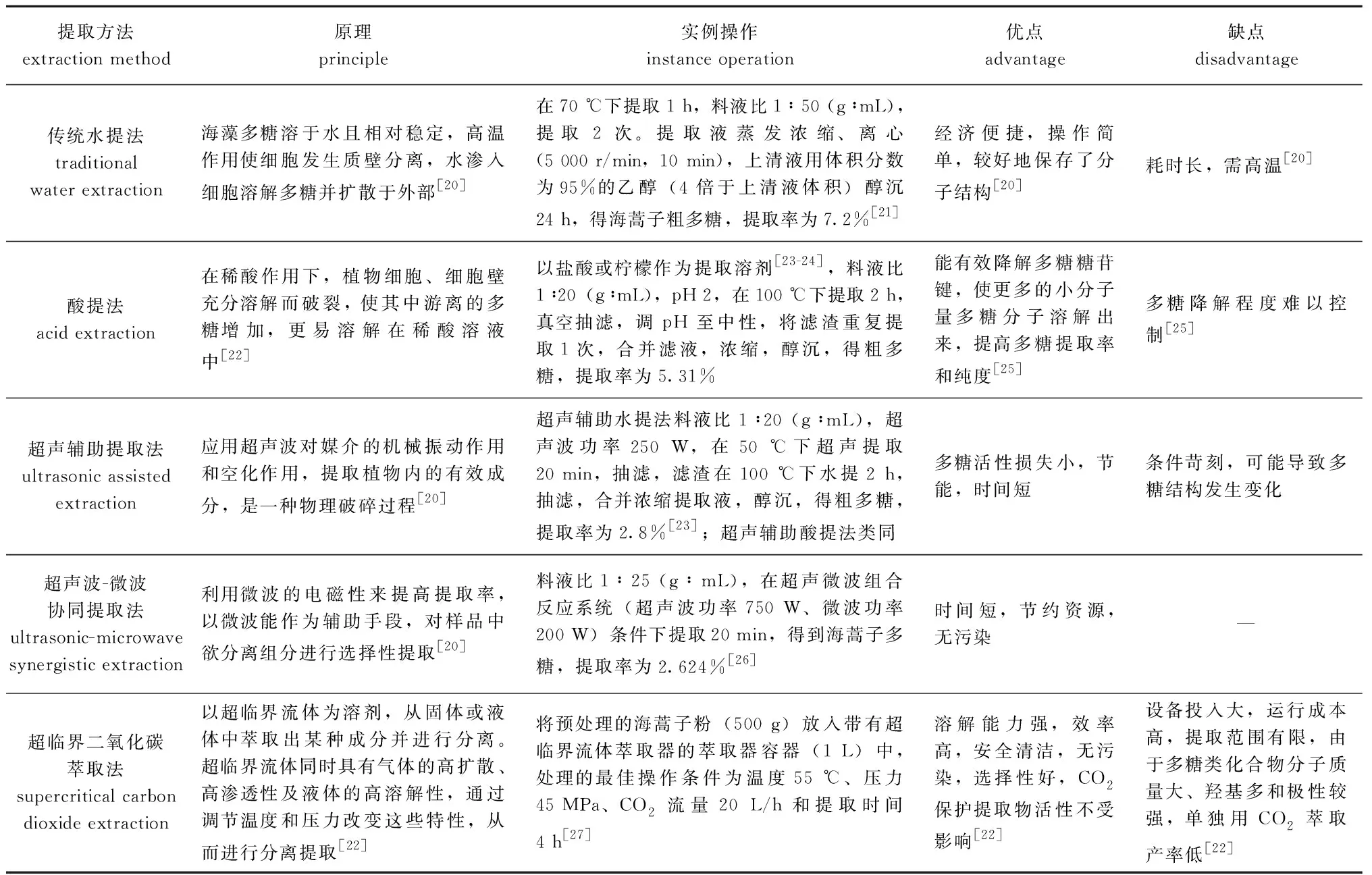
表2 海蒿子多糖不同提取方法的比较Tab.2 Comparison of different extraction method of polysaccharide from sea weed Sargassum pallidum
海蒿子多糖提取方法不同,多糖提取物的生物活性也不同。不同方式提取的海蒿子多糖均可有效清除DPPH自由基,表现出抗氧化作用[23]。对自由基的清除呈显著的量效关系,清除率随多糖含量的升高而升高。酸提法和超声处理可引起多糖链结构断裂,破坏多糖结构的完整性,造成多糖硫酸基的损失,而多糖硫酸基含量与抗氧化活性显著相关,因此,传统水提取法具有更好的抗氧化活性[23]。水提法提取的海蒿子多糖对胃癌大鼠有显著的免疫功能和抗氧化活性[8];经抗癌活性筛选鉴定,水提海蒿子多糖均具有抗白血病活性[28]。
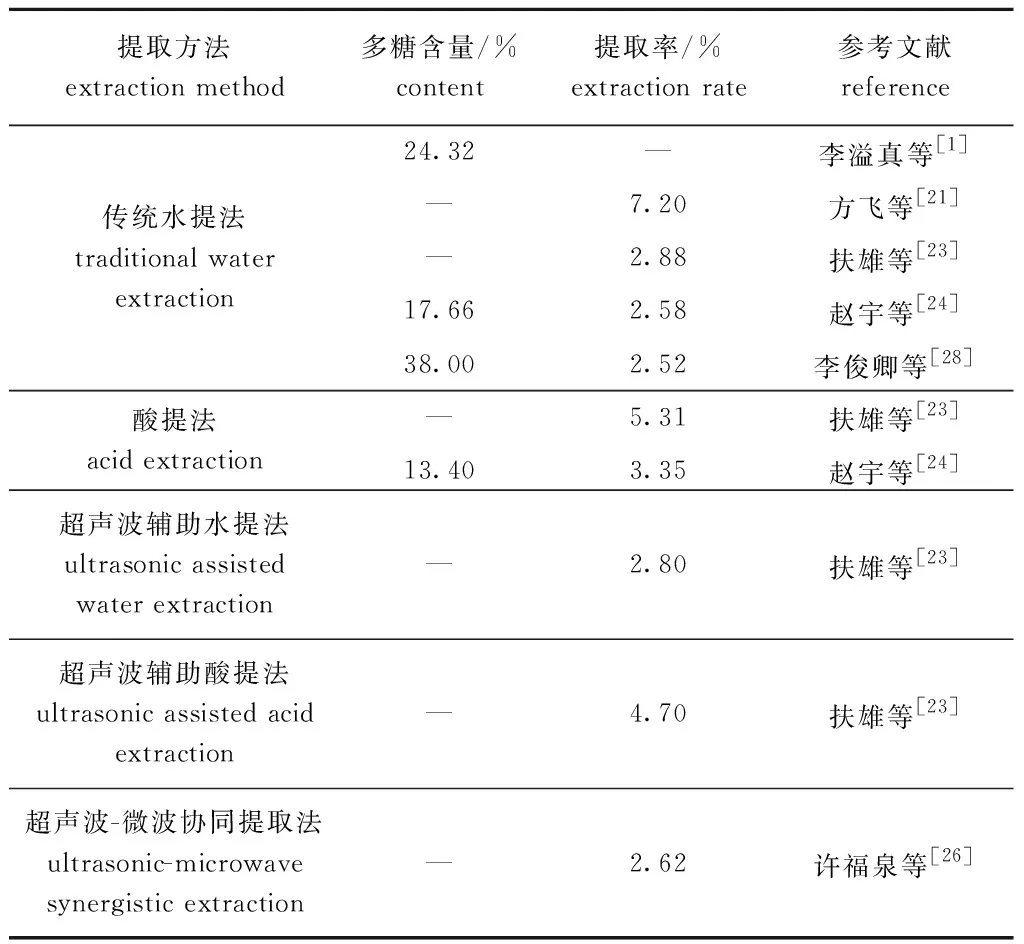
表3 不同提取方法所得粗多糖中多糖含量及提取率比较
3 海蒿子多糖的纯化方法
采用上述各种提取方法得到的粗多糖除含有褐藻糖胶外,还含有水溶性褐藻胶、褐藻淀粉、蛋白质、色素及其他杂质,需要进一步纯化[29],通过一种或数种分离纯化方法,可得到均一多糖组分,而均一多糖组分的获得是结构解析的前提。因此,要对多糖结构有清晰认识,还要借助于分离纯化方法的发展及应用[30]。目前,海蒿子多糖纯化的常用方法主要有沉淀法、柱色谱法和双水相萃取法等,以及几种方法联用。海蒿子多糖去除蛋白质、去除小分子及分级纯化的方法见表4。

表4 海蒿子多糖的纯化方法实例操作Tab.4 Purification method of polysaccharide from sea weed Sargassum pallidum
不同分离纯化方法可单独使用,也可联合使用。如三氯乙酸-Sevage结合法[14],先用三氯乙酸法去除提取液中的蛋白质,经透析后再用Sevage法继续去除蛋白质。Sevage-酶-三氯乙酸-透析结合法,将样品先重复多次Sevage法去除蛋白质,接着用中性蛋白酶水解,再用三氯乙酸法去除蛋白质,经浓缩、透析和冻干得纯化多糖[8]。 三氯乙酸-膜分离技术结合法,通过添加三氯乙酸去除提取液中的蛋白质,并以5 000 r/min离心15 min,将上清液的pH调节至7,并置于冰箱中进行膜分离[27]。可见,多种纯化方法合理使用,可实现海蒿子粗多糖的进一步分离纯化。
赵宇[18]通过硅胶柱和凝胶柱纯化海蒿子多糖得到的BⅠ、BⅡ、DE-Ⅰ组分,总糖含量显著增加,最大值可从粗提取物总糖含量38.0%增加至52.4%。利用DEAE-Sepharose Fast Flow层析柱对海蒿子多糖进行分离纯化,用浓度为0~0.5 mol/L的NaCl溶液梯度洗脱,纯化后总糖组分中最高含量达80.19%[3]。对酸提法提取的粗多糖宜采用乙醇沉淀法进行纯化,对水提法提取的粗多糖宜采用CaCl2沉淀法进行纯化[14]。魏晓蕾[14]比较了三氯乙酸法、Sevage法和三氯乙酸-Sevage结合法,发现3种方法去除蛋白质效果依次增加。可见,多糖的提取率与纯度可通过选择适宜的纯化方法来提高。
4 海蒿子多糖药理活性
大多数海藻多糖为硫酸化多糖,结构影响其功能。岩藻多糖具有较强的药理活性,其活性与分子量、硫酸根含量和位置等结构因素密切相关[37];低浓度的硫酸化多糖提取物具有较好的自由基清除活性[38]。海蒿子多糖的抗氧化、降血糖、抗肿瘤、降血脂和调节免疫等方面的生物学活性被大量报道,海蒿子多糖的药理活性与硫酸基含量有显著关联[5,17]。因此,确定多糖的完整结构,包括糖苷键的构型、糖苷键的位置、单糖的序列、分支点的位置及结构-功能关系,在相关研究中具有重要的意义[27]。
4.1 抗氧化作用
海蒿子多糖对卵黄脂蛋白(LPO)、羟基自由基(·OH)及超氧阴离子自由基(O2-·)均有一定的清除作用,且清除率随多糖质量浓度的增加而增加,只是增加的幅度不同,当海蒿子多糖质量浓度达到200 μg/mL时,对LPO的抑制率为40%,对·OH的清除率为26%,对O2-·的清除率为80%[21]。硫酸酯化程度越高,多糖的抗氧化功能就越好[3,5,21]。硫酸化修饰导致海蒿子多糖的化学成分、分子量和单糖组成发生了一些变化,表现出最好的DPPH和2,2′-联氮双(3-乙基苯并噻唑啉-6-磺酸)(ABTS)自由基清除活性[39]。王雪等[40]发现,相同浓度不同品种的海藻多糖对·OH清除率效果依次为昆布多糖(91.52%)>海蒿子多糖(83.85%)>羊栖菜多糖(67.52%),对O2-·清除效果依次为海蒿子多糖(15.66%)>昆布多糖(15.26%)>羊栖菜多糖(2.81%)。对抗氧化作用测定表明,海蒿子多糖提取物PSP-1具有良好的DPPH自由基清除、·OH自由基清除、细胞抗氧化和活性氧抑制活性[6]。通过对胃癌大鼠的抗氧化作用研究发现,海蒿子水提物通过抑制黏膜中的脂质过氧化作用,保持正常的抗氧化酶活性[8]。
4.2 降血糖作用
海蒿子多糖提取物具有良好的α-淀粉酶和α-葡萄糖苷酶抑制活性,可以显著增强胰岛素抵抗性HepG2细胞的葡萄糖消耗、糖原合成,以及丙酮酸激酶和己糖激酶的活性[6]。此外,海蒿子多糖还可以通过上调胰岛素受体底物1(IRS-1)、糖原合酶、磷酸肌醇-3-激酶(PI-3-K)和葡萄糖转运蛋白-4的表达水平,从而改善胰岛素抵抗。因此,海蒿子多糖可能是预防和治疗2型糖尿病的潜在候选药物[10]。海蒿子多糖提取物SPP-1和SPP-2表现出良好的α-淀粉酶和α-葡萄糖苷酶抑制活性,显著提高胰岛素抵抗性细胞的葡萄糖消耗。值得注意的是,SPP-1表现出比SPP-2更强的α-葡萄糖苷酶抑制活性,甚至与阿卡波糖相当[11]。所有硫酸化的衍生物均具有比天然海蒿子多糖更好的降血糖能力,硫酸化海蒿子多糖表现出较好的抑制α-葡萄糖苷酶活性和促进胰岛素抵抗性细胞葡萄糖消耗作用。硫酸化海蒿子多糖可作为降血糖剂的替代衍生物[39]。
4.3 抗肿瘤作用
海篙子是中药海藻的一种,为复方海藻抗癌制剂的君药。《外科正宗》记载道:“治瘿瘤初起,或肿或硬,或赤或不赤,但未破者”[41]。软煎散结汤由4种草药组成,包括半夏、夏枯草、山慈菇和海蒿子,传统上用于软化硬块并解决硬组织肿块。多糖的抗肿瘤机制有两种方式,即对癌细胞的毒性[28]和免疫系统的增强[8]。研究表明,软煎散结汤对瑞士白化病小鼠中的艾氏腹水癌和裸鼠中的乳腺癌异种移植物具有抗肿瘤活性[42]。郭立民等[43]利用小鼠乳腺癌细胞,以细胞周期抑制和细胞凋亡诱导及坏死性细胞毒活性为指标,发现海蒿子粗提物有较强的坏死性细胞毒活性,其抑制浓度IC50为0.50 μmol/L,亦显示细胞周期(G0/G1期)抑制活性。刘斌[5]采用MTT法研究发现,硫酸基含量最高的海蒿子多糖组分对肿瘤细胞的生长抑制活性最强;而海蒿子多糖组分SP-3-1和SP-3-2对HepG2细胞、A549细胞和MGC-803细胞具有显著的体外抗肿瘤活性,这可能与其低分子量和高硫酸根含量(22.6%)有关[27]。
4.4 降血脂作用
中药多糖通过抑制三酰甘油与总胆固醇合成通路、提高胆汁酸合成、调控与脂代谢相关因子表达和改善胰岛素抵抗作用等途径发挥降血脂作用[44]。研究表明,海蒿子多糖具有明显降低高血脂、限制高血脂小鼠体质量快速增加及降低高脂乳剂毒性的作用[7]。
4.5 免疫功能调节作用
通过评估海蒿子多糖对鸡模型免疫反应的影响及检查鸡免疫后的抗体效价和淋巴细胞增殖,发现海蒿子多糖在新城疫(ND)、传染性支气管炎(IB)和禽流感(AI)中有佐剂作用。使用油佐剂疫苗作为对照,给鸡施用含有10、30、50 mg/mL海蒿子多糖的ND、IB和AI灭活疫苗,结果表明,在30 mg/mL海蒿子多糖下,ND、IB和AI抗体滴度和淋巴细胞增殖得到增强。可见,适当剂量的海蒿子多糖可能是安全有效的免疫刺激候选物,适用于制成疫苗进行早期和持续的预防[45]。通过研究海蒿子水提物对胃癌大鼠免疫功能的影响,发现口服海蒿子水提取物,治疗剂量为400、600、800 mg/kg体质量时,可提供剂量依赖性保护作用,以抵抗N-甲基-N-硝基-亚硝基胍(MNNG)引起的免疫损伤,降低肿瘤坏死因子-α的水平,增强胃癌大鼠的免疫力[8]。
4.6 其他作用
硒化作用对海蒿子多糖的理化和生物学特性有明显的影响。采用亚硒酸钠/稀硝酸法合成了硒含量为2 419 μg/g的海蒿子多糖硒化衍生物(Se-SPP)。物化特性表明,硒化修饰导致多糖的化学组成、单糖组成、分子量和表面形态发生了一些变化。Se-SPP在非竞争性抑制类型中表现出对α-葡萄糖苷酶活性更明显的抑制作用。Se-SPP可作为开发功能性食品中的新型硒补充成分[46]。
5 存在问题与展望
5.1 海蒿子多糖研究中存在的问题
海蒿子作为褐藻的典型代表,是中国自古以来就使用的中药材之一,在史书中也多有记载;海蒿子成分丰富,含有大量的蛋白质、海藻多糖和无机元素等。海蒿子多糖是主要的活性成分,对海蒿子多糖提取纯化和药理作用的研究较多,但仍然存在以下问题。
1)来源限制。对中药海藻海蒿子的研究,与同类海藻相比较少,其原因可能是大量海蒿子作为干燥药材流入市场,导致新鲜海蒿子购买困难。
2)海蒿子多糖提取率过低。对海蒿子多糖的提取、纯化方法的考察不全面,已有的大量优化研究方法以传统的溶剂提取法和沉淀纯化为主,未见优化新型提取纯化方法的报道。
3)海蒿子多糖制剂有待研究。海蒿子多糖的药理作用未得到临床应用,也无相应制剂问世。
4)对海蒿子多糖结构研究不足。对于海蒿子多糖的结构分析还较为粗浅,海蒿子多糖的精细结构尚不清楚。
5)除多糖外对海蒿子其他成分研究不足。海蒿子中与其主治功能相吻合的有效成分还不完全清楚,现有的化学成分和药理活性研究与其广泛应用的现状也不相称。
5.2 未来重点研究方向
1)进一步开展海蒿子多糖提取纯化方法的优化研究。通过对海蒿子多糖提取纯化方法的单因素与多因素考察,可优化提取纯化条件,以提高海蒿子多糖的提取率与纯度。
2)加大海蒿子多糖制剂的研发力度。许多制剂新技术可以提高多糖药物的稳定性和生物利用度,且在疾病治疗中具有靶向性好、生物相容性高等优势,可用于多糖制剂的研发,如微囊/微球、纳米粒、脂质体等。
3)深入开展海蒿子多糖精细结构的研究。借助多样化的多糖结构分析方法,如红外光谱、质谱等,能够确定其精细结构特征,为海蒿子多糖的精准功能分析和应用奠定基础。
4)广泛开展海蒿子其他成分的研究。海蒿子中含有丰富的营养物质,如无机元素、蛋白质、脂类、多酚类等成分,在医药健康领域有望发挥积极作用。

