高糖、高脂饲料中添加丁酸钠对鲤生长、生化指标和肠道结构的影响
张媛媛,吕硕,卢正义,崔培,孙金辉,乔秀亭,程镇燕
(天津农学院 水产学院,天津市水产生态与养殖重点实验室,天津 300392)
在饲料原料价格不断上涨的背景下,尽可能地节约养殖成本是目前水产业中亟待解决的问题。在饲料中添加一些成本较低的脂肪或糖类物质代替成本较高的蛋白质,是降低成本的普遍方法[1]。但高脂、高糖饲料会改变鱼类肠道内微生物的菌群组成与结构,造成肠道菌群失调[2],导致鱼类代谢紊乱、脂肪沉积,以及生长减缓、肝脏受损等[3]。
研究表明,饲料中添加有机酸有利于动物的生长、免疫和肠道健康[4-8],乙酸、丙酸、丁酸或其混合物均可降低机体体脂含量,增加能量消耗,并提高葡萄糖耐受能力,从而抵抗日粮诱导的肥胖[9]。有机酸还具有无污染、无残留和无耐药性等特点,故其也成为较具潜力的抗生素替代品之一[10]。对水产动物的研究表明,丁酸作为一种饲料添加剂,能有效调节鱼类肠道微生态平衡、重组肠道黏膜层、促进生长等。近年来的研究证实,丁酸钠在动物肠道内不仅能为肠黏膜细胞提供能量,促进细胞的代谢、生长[11],还能降低肠内环境pH值,减少有害菌的生长,防止肠道功能紊乱[12],更可抑制促炎因子的生成,对肠道炎症反应起到抑制作用[6,13]。研究表明,在饲料中添加包膜丁酸钠,可提高鲫Carassiusauratus生长和肠道发育水平[10],在饲料中添加丁酸钠,能显著提高美洲鳗鲡Anguillarostrata的生长性能和抗氧化能力[14]。然而,对于因摄食高糖、高脂饲料引起的鱼类生长缓慢、脂肪沉积、脂肪肝等问题,丁酸钠是否能够起到缓解作用还未可知。
鲤Cyprinuscarpio是世界上养殖最为广泛的鱼类,其产量约占世界养殖鱼类总产量的40%,鲤也是中国传统的淡水养殖品种之一,鲤在生长速度、成活率、单位产量等方面与其他养殖鱼类相比均有较大优势。近年来,由于存在养殖密度过高、投饲频率增加、能量过剩、饲料高糖或高脂等问题,养殖鱼类体脂过度沉积的现象也越来越多,使用高糖、高脂饲料,除造成鱼体脂沉积、肝脏组织产生明显损伤外,还会引发一系列代谢障碍,对宿主的健康产生影响。本研究中,以鲤为研究对象,在高糖、高脂饲料中添加丁酸钠,探究其是否能解决高糖、高脂饲料带来的负面影响,以期为丁酸钠在水产饲料中的应用提供数据支撑。
1 材料与方法
1.1 材料
试验用鲤苗购自天津宝坻区天津泽海水产养殖有限公司,为同一批繁殖的健康苗种,800尾左右,初始体质量为(44.74±0.34)g。试验于2020年6月在天津农学院水产学院实验基地(晨辉水产养殖基地)开展。
1.2 方法
1.2.1 试验饲料配制 试验设置6个饲料组,即对照组、高糖组(7.5%糊精,HCD)、高脂组(10%脂肪,HLD)、对照+0.5%丁酸钠(SB)组、高糖+0.5%丁酸钠组和高脂+0.5%丁酸钠组,分别记为D0、D1、D2、D3、D4和D5。各组饲料组成与营养水平见表1。将各组原料粉碎并过245 μm孔径的筛,逐级混合后,用环模颗粒机制成直径为2.0 mm的硬颗粒沉性饲料,晾干备用。
1.2.2 试验设计及养殖管理 对鲤苗进行消毒后,于养殖车间暂养7 d,待其适应环境后,选取体质量接近、健康状况良好的鲤360尾,随机分为6个组,每组设置4个平行,每个平行放15尾鲤苗,分别投喂对应的6种试验饲料,养殖期为70 d。正式试验在室内循环养殖系统(80 cm×60 cm×50 cm)中进行,日投饲量为鲤苗体质量的3%~5%,每日投喂3次。养殖期间,水温为26.5~30.5 ℃,pH为7.0~8.0,溶氧量为5~6 mg/L。
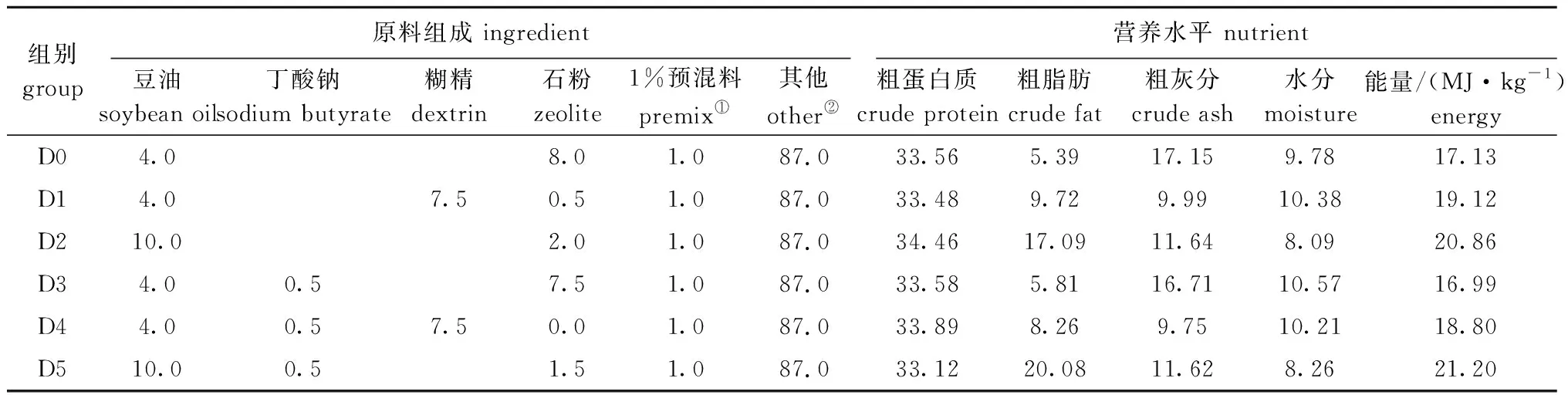
表1 饲料组成及营养水平(干物质基础)Tab.1 Ingredient and nutrient composition of experimental diets (dry mass basis) w/%
1.2.3 样品采集与处理 养殖试验结束后,将鱼禁食24 h,将每个水箱的鱼全部计数并称重,从每箱随机取6尾鱼,分别测量其体长、体质量,使用2 mL注射器从尾部静脉抽血,于4 ℃下以4 000 r/min离心15 min,取上清液,置于-80 ℃超低温冰箱中保存待测。采血后解剖取其肝胰脏、肠道,置于-80 ℃超低温冰箱中保存待测。
1.2.4 生长性能指标测定 试验开始前和结束时,测定并记录试验鱼的体质量、体长;试验过程中,记录鱼的死亡情况及饲料的投喂量。养殖结束时解剖鱼并将其肝胰脏称重。生长性能指标计算公式为
存活率=Nt/N0×100%,
增重率=(Wt-W0)/W0×100%,
特定生长率=(lnWt-lnW0)/t×100%,
饲料系数=F/(Wt-W0),
肝体比=Wg/Wt×100%,
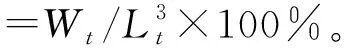
其中:W0、Wt分别为试验开始和试验结束时鱼体质量(g);N0、Nt分别为试验开始和试验结束时活鱼数量(ind.);Wg为试验结束时鱼肝胰脏质量(g);F为摄入饲料干质量(g);Lt为试验结束时鱼体长(cm);t为试验时间(d)。
1.2.5 饲料和全鱼营养成分测定 分别采用恒重恒压干燥法(GB/T6432)、杜马斯燃烧法(GB/T6433)、索氏抽提法(GB/T6438)、灼烧重量法(GB/T6435)测定饲料样品及鱼体的水分、蛋白质、粗脂肪、粗灰分含量。
1.2.6 肝胰脏组织和血清指标测定 采用南京建成生物工程研究所试剂盒测定血清葡萄糖(Glu)、高密度蛋白胆固醇(HDL-C)、低密度蛋白胆固醇(LDL-C)、甘油三酯(TG)、总胆固醇(CHOL)含量,以及肝胰脏和血清中丙二醛(MDA)、过氧化氢酶(CAT)和超氧化物歧化酶(SOD)含量。
1.2.7 肠道黏膜形态测定 从每个平行中随机选取2尾鱼,解剖取出肠道,用生理盐水冲洗肠道内容物,用白色棉线定位前后肠,然后放入固定液(醋酸、95%乙醇、甲醛、H2O的体积比为1∶3∶2∶3)中,按常规组织切片程序进行脱水、石蜡包埋、切片(连续横断切片,厚为6 μm)和伊红染色(H.E);用显微镜观察并拍照,在放大40倍的切片中,用显微镜测量绒毛长度,各指标取其平均值作为测定数据。
1.3 数据处理
试验结果以平均值±标准差(mean±S.D.)表示,采用SPSS 20.0软件进行双因素方差分析(two-way ANOVA),采用Duncan法进行组间多重比较,显著性水平设为0.05。
2 结果与分析
2.1 高糖、高脂饲料中添加丁酸钠对鲤生长性能和饲料利用率的影响
从表2可见:各处理组间鲤的成活率、肝体比和肥满度均无显著性差异(P>0.05);摄食高糖、高脂饲料后,各生长指标均有所下降,但与对照组无显著性差异(P>0.05);在高糖、高脂饲料中添加丁酸钠后,鲤生长性能有明显提高,但与对照组无显著性差异(P>0.05)。从主体间效应来看,与不添加丁酸钠组相比,添加丁酸钠后,鲤的体质量、增重率和特定生长率分别提高了11.28%、25.48%和14.89%,饲料系数则降低了8.72%(P<0.05)。双因素方差分析表明,饲料中分别添加高糖、高脂或丁酸钠均对饲料系数有显著性影响(P<0.05),高脂饲料的饲料系数显著高于对照饲料和高糖饲料(P<0.05)。
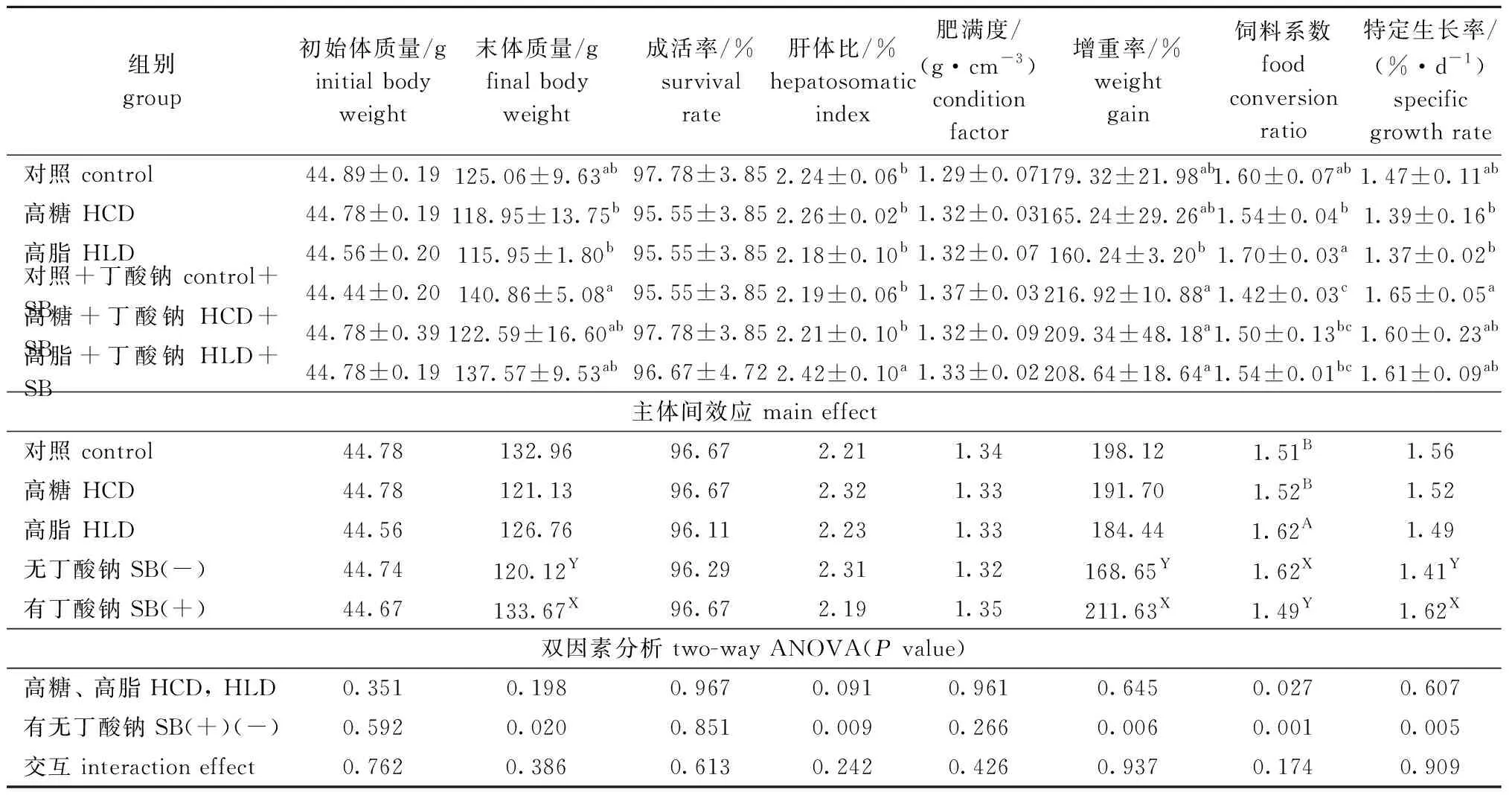
表2 丁酸钠对鲤生长性能和饲料利用率的影响Tab.2 Effects of sodium butyrate(SB) on growth and feed utilization of common carp Cyprinus carpio
2.2 饲料中添加丁酸钠对鲤体成分的影响
从表3可见:摄食高糖、高脂饲料后,全鱼的水分显著低于对照组(P<0.05),而添加丁酸钠后全鱼水分含量有所升高(P>0.05);与对照组和高糖组相比,摄食高脂组饲料后全鱼粗脂肪含量显著升高(P<0.05);全鱼粗蛋白质和粗灰分含量在各处理组间无显著性差异(P>0.05)。从主体间效应来看,添加丁酸钠后,鱼体脂肪含量有下降趋势,但与未添加丁酸钠组相比无显著性差异(P>0.05)。高糖、高脂与丁酸钠的交互作用,仅对鱼体脂肪含量有显著性影响(P<0.05),尤其是高脂组,添加丁酸钠后鱼体脂肪含量显著降低(P<0.05)。
2.3 饲料中添加丁酸钠对鲤血清生化指标的影响
从表4可见:摄食高糖、高脂饲料后,显著影响了血清的GLU、TG、T-CHO含量,与对照组相比,高糖组GLU含量显著升高(P<0.05),高脂组TG含量显著升高(P<0.05),两组的T-CHO含量显著升高(P<0.05)。从主体间效应来看,添加丁酸钠后,血清GLU含量显著降低(P<0.05),TG、T-CHO、LDL-C含量显著升高(P<0.05)。高糖、高脂与丁酸钠的交互作用,对鱼血清GLU、TG含量有显著性影响(P<0.05)。
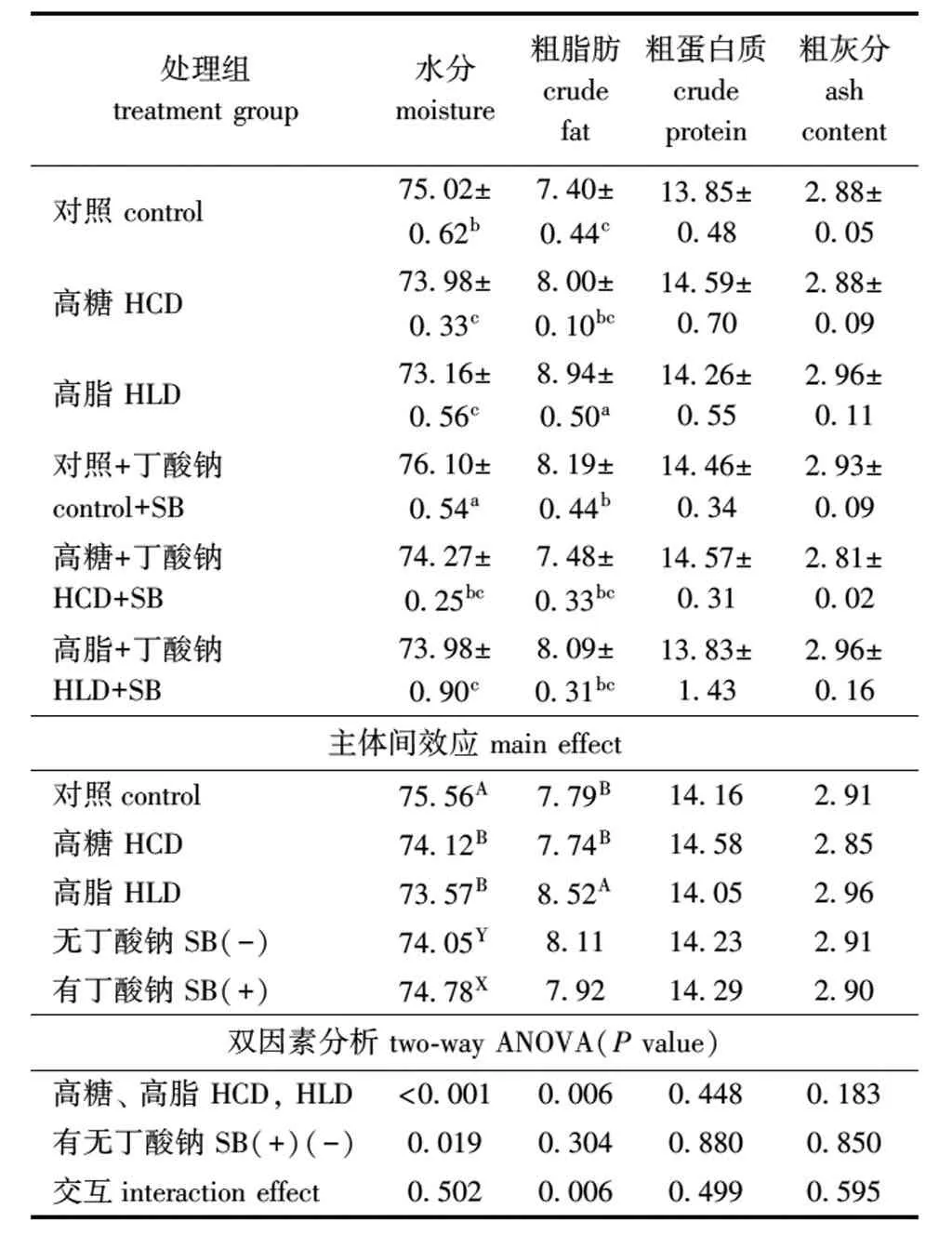
表3 丁酸钠对鲤体成分的影响

表4 丁酸钠对鲤血清生化指标的影响Tab.4 Effects of sodium butyrate on serum biochemical indices of common carp Cyprinus carpio mmol/L
2.4 饲料中添加丁酸钠钠对鲤抗氧化功能的影响
从表5可见:与对照组相比,摄食高糖、高脂饲料后,血清CAT、SOD活性呈下降的趋势,肝胰脏MDA含量呈升高的趋势(P<0.05),高糖组血清和肝胰脏中的MDA含量显著升高(P<0.05),而高脂组血清中的CAT活性显著降低(P<0.05)。从主体间效应来看,添加丁酸钠后显著影响了鲤的抗氧化功能,表现为鲤血清CAT和SOD活性显著升高(P<0.05),血清MDA含量显著降低(P<0.05)。高糖、高脂与丁酸钠的交互作用,仅显著影响了血清SOD活性(P<0.05),对其余指标无显著性影响(P>0.05)。
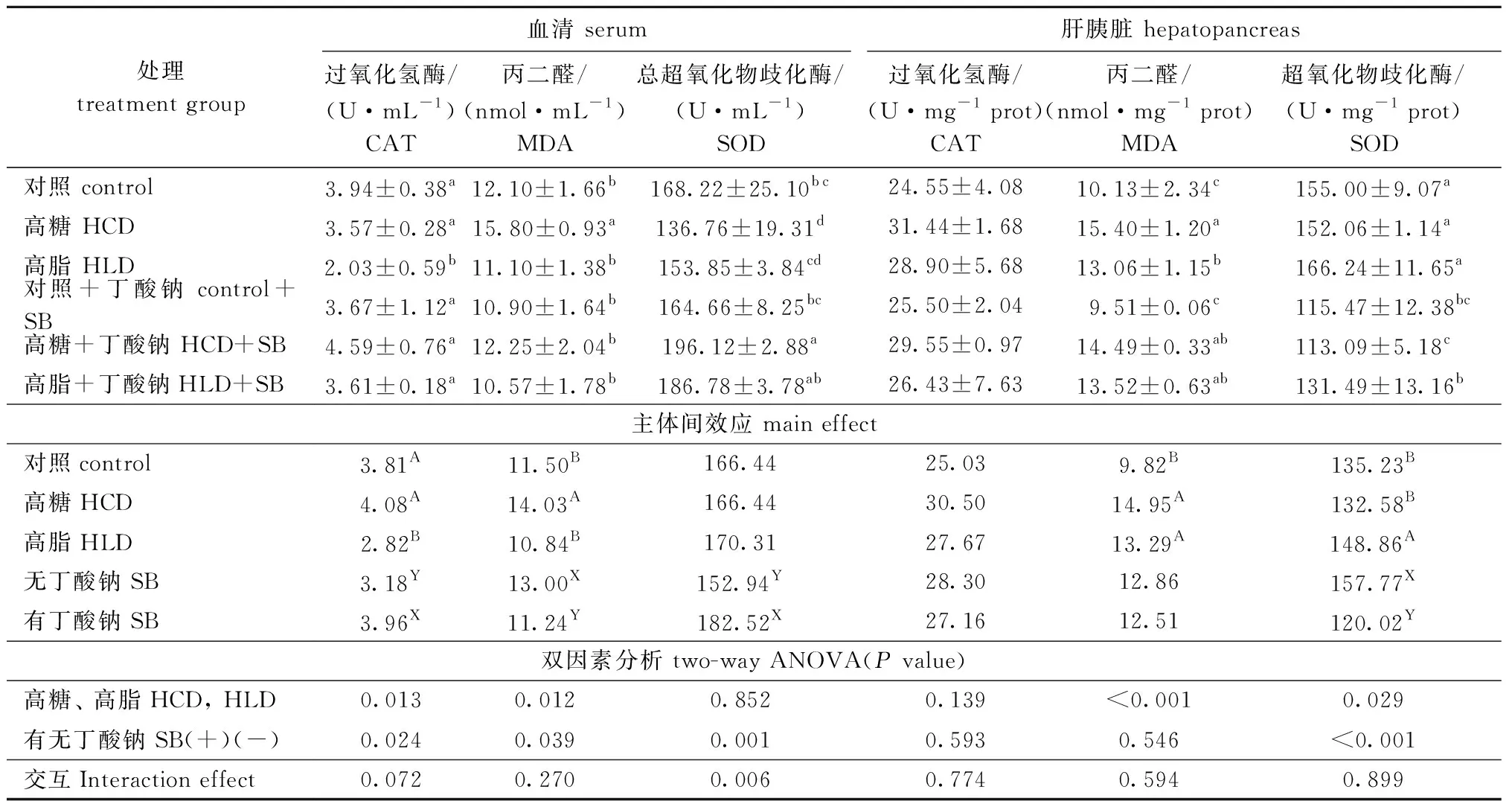
表5 丁酸钠钠对鲤抗氧化酶活性的影响Tab.5 Effects of sodium butyrate on antioxidant enzyme activity of common carp Cyprinus carpio
2.5 饲料中添加丁酸钠对鲤肠道黏膜形态的影响
从表6可见,与对照组相比,摄食高糖、高脂饲料后,前、中、后肠绒毛长度有下降的趋势,其中,高脂组前肠绒毛长度显著降低(P<0.05)。从主体间效应来看,与未添加丁酸钠组相比,添加丁酸钠后对鲤前、中、后肠绒毛长度有显著性影响(P<0.05),分别升高了19.51%、27.68%和26.59%。高糖、高脂与丁酸钠的交互作用,对中、后肠绒毛长度有显著性影响(P<0.05)。高脂饲料中添加丁酸钠对鲤后肠道黏膜形态的影响见图1。
3 讨论
3.1 丁酸钠对摄食高糖、高脂饲料的鲤生长性能和饲料利用率的影响
有研究表明,高糖饲料会抑制鱼类的生长发育,造成鱼肝胰脏受损[15]。而本试验中,摄食高糖、高脂饲料使鲤生长指标有所下降,但无显著性差异,这可能与养殖对象的食性密切相关,一般来说,肉食性鱼类对高糖饲料的耐受能力较差,而鲤作为杂食性鱼类,其对高糖、高脂饲料有一定的耐受性,且饲料中含有适当的糖脂可起到节约蛋白质的作用[16],但长时间投喂高糖、高脂饲料也会引起脂肪肝,从而造成鱼生长缓慢,饲料系数上升,抗应激能力下降,影响鱼类的正常生理功能和免疫能力[17],因此,本试验中设计了在高糖、高脂饲料中添加丁酸钠,通过研究丁酸钠对鲤生长和生化指标的影响,证实了丁酸钠对鲤生长的促进作用,这与许多已有研究结果相似,如对大菱鲆[8]、罗非鱼和鲤[18]、斑马鱼[4]的研究表明,饲料中添加丁酸钠可以促进鱼的生长。此外,本研究中还发现,在高糖、高脂饲料中添加丁酸钠后,鲤的生长性能得到改善,饲料利用率显著提高,饲料丁酸钠促进了鲤肠道黏膜的发育(表6)。这与添加丁酸钠可能提高了肠道对营养物质的吸收能力[19],从而促进动物生长的观点相吻合。
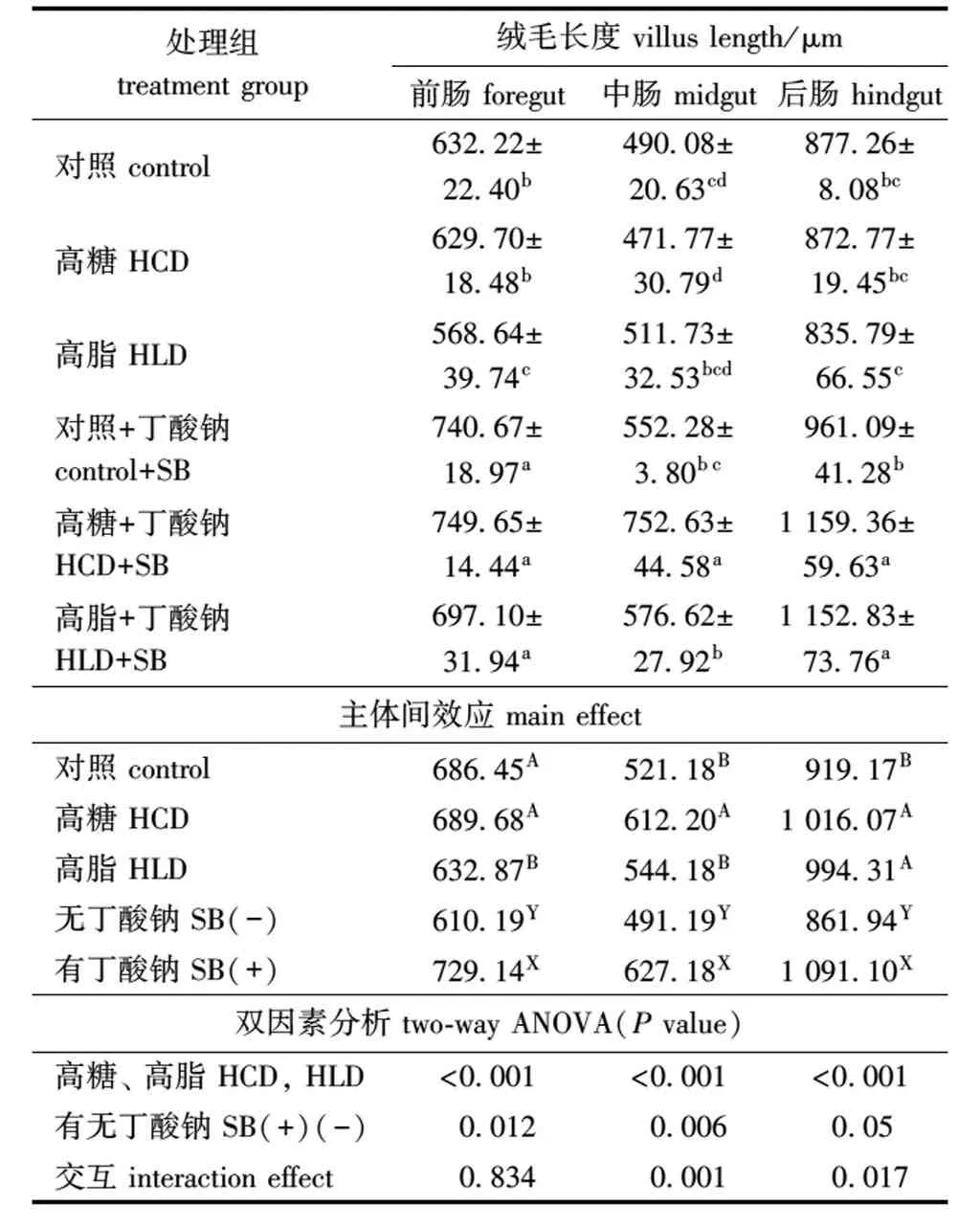
表6 丁酸钠对鲤肠道黏膜形态的影响

图1 高脂饲料中添加丁酸钠对鲤后肠道黏膜形态的影响Fig.1 Effects of dietary sodium butyrate on hindgut mucosa of common carp Cyprinus carpio fed diet containing high levels of lipid
3.2 丁酸钠对摄食高糖、高脂饲料的鲤体成分的影响
本研究中,鲤摄食高糖、高脂饲料后,鱼体水分含量显著降低,摄食高脂饲料后粗脂肪含量显著升高,这与对鲤[20]、珍珠龙胆石斑鱼Epinepheluslanceolatus♂×Epinephelusfuscoguttatus♀[21]的研究结果一致。本研究中,鲤摄食了添加丁酸钠的饲料后,对鱼体粗蛋白质和粗脂肪无显著性影响。与此相似,翟秋玲等[22]研究表明,饲料中添加丁酸钠类似物三丁酸甘油酯后,对菊黄东方鲀Takifuguflavindus的粗蛋白质和粗脂肪含量无显著性影响。然而,也有研究表明,丁酸或其混合物均可降低机体体脂含量,增加能量消耗,并提高葡萄糖耐受能力,从而抵抗饲料诱导的肥胖[9]。本试验中发现,在高脂组饲料中添加丁酸钠后,鱼体脂肪含量显著降低,这与上述研究结果一致,但对照组添加丁酸钠后脂肪含量却有升高的趋势,原因有待进一步分析。丁酸钠对脂类代谢是否具有双重调节作用,Hara等[23]研究表明,短链脂肪酸的重要受体GPCR43是一个膳食过剩的能量传感器, 对于维持能量平衡起关键作用,可以控制身体能量的利用率,对能量稳态和脂质代谢具有重要作用。故可以推测,当机体摄入过多脂肪后,通过添加丁酸钠,可起到降低体脂的作用,但具体机理还有待进一步研究。
3.3 丁酸钠对摄食高糖、高脂饲料的鲤血清生化指标的影响
一般来说,水产动物的血清葡萄糖含量随饲料糖水平升高而升高。本研究中也发现,摄食高脂、高糖饲料后鲤血糖水平高于对照组,而饲料中添加丁酸钠后,鲤血糖水平显著低于未添加丁酸钠组。相似地,对罗非鱼的研究也表明,饲料中的丁酸钠能增加血糖耐受水平和肠道利用葡萄糖的能力[24]。对陆生动物的研究表明,丁酸钠作为胃肠道快速的能量来源,可为动物胃肠道提供能量,减缓组织中糖原分解,致使血糖水平降低,同时也加速了动物机体对血脂的吸收[25]。但本研究中,在高糖、高脂饲料中添加丁酸钠后,虽然血糖水平降低,但是血清甘油三酯、总胆固醇和低密度脂蛋白胆固醇含量显著升高,这与对许多哺乳动物的研究结果不同,降低的血糖是作为能量被消耗掉还是转化为血脂,还需要进一步研究。对斑马鱼的研究表明,乙酸钠能够降低斑马鱼血糖含量,但会促进肝脏脂肪蓄积[26],而对肉鸡的研究表明,丁酸钠对机体脂肪沉积的影响具有剂量依赖性,表现为低浓度的丁酸钠可抑制脂肪沉积,而高浓度的丁酸钠则可促进脂肪沉积[27]。短链脂肪酸对水产动物血脂的影响是否也有剂量依赖性,还有待进一步研究。
有研究表明,丁酸钠可通过调节机体免疫和抗氧化功能来增强机体清除自由基的能力,减少组织和细胞损伤[25]。本研究中,鲤摄食高糖饲料后,血清和肝胰脏MDA含量显著升高,鲤摄食高脂饲料后,肝胰脏MDA含量也显著升高,饲料中添加丁酸钠后,显著提高了血清CAT和SOD活性,降低了血清MDA含量,这与对凡纳滨对虾[28]、团头鲂[29]的研究结果相似,均表明饲料中含适量的丁酸钠能提高机体的非特异性免疫力,降低氧化应激损伤。
3.4 丁酸钠对摄食高糖、高脂饲料的鲤肠道黏膜形态的影响
肠道是鱼类的主要消化器官,其中,发挥主要作用的是肠道黏膜上的绒毛,绒毛的长度可以直接影响机体的吸收能力[10]。Liu等[30]研究表明,丁酸盐可以刺激结肠内水和钠离子的吸收,减轻肠黏膜损伤,同时加速细胞内mRNA和蛋白质的合成,增加肠绒毛数量,从而提高机体对养分的消化吸收能力。本研究中,从主体间效应来看,与未添加丁酸钠的饲料相比,饲料中添加丁酸钠后鲤前、中、后肠绒毛长度有显著增加。相似地,对鲫[10]的研究结果也发现,丁酸钠可以增加肠绒毛长度。对育肥猪[11]的研究表明,丁酸钠作为肠道上皮的直接能量来源,为肠道细胞的有丝分裂提供能量,诱导表皮细胞增生和成熟,增加黏膜血流量,改善肠黏膜形态,促进上皮细胞的代谢、生长。对黄鳝Monopterusalbus的研究也表明,饲料中补充丁酸钠可能提供肠道上皮细胞生长所需要的能量[31]。上述研究结果,合理地解释了本试验中补充丁酸钠后,通过改善肠道绒毛结构从而促进摄食高糖、高脂饲料后鲤健康生长的机理。
4 结论
1)在高糖、高脂饲料中添加适量的丁酸钠在一定程度上提高了鲤的生长性能,显著降低饲料系数,这对缓解由高糖、高脂饲料造成的鲤生长下降起到了积极作用。
2)鲤摄食高糖、高脂饲料后,血糖水平升高,但添加丁酸钠后,血糖含量显著降低,增加了机体对葡萄糖的耐受能力。
3)在高糖、高脂饲料中添加丁酸钠后,显著增加了鲤前、中、后肠绒毛长度,促进了肠道发育水平,改善了消化道结构。
综上所述,鲤摄食高糖、高脂饲料后,会造成生长下降,血糖及鱼体脂肪升高,但摄食添加适量丁酸钠的饲料能够在一定程度上缓解这些负面影响,显著提高鲤的生长性能、抗氧化能力并改善肠道健康。

