天麻素对坐骨神经痛模型大鼠TNF-α/STAT3通路及痛觉敏感性的影响①
胡 焓 冯 丹 田佳玉 童胜雄 张书力(武汉市第一医院疼痛科,武汉 430022)
坐骨神经痛(sciatica)是以椎间盘突出、腰椎退行性病变引起的一种外周神经病理性疼痛,以阵发性、持续性麻木疼痛为主要临床症状,其疼痛剧烈,发病率高达40%,严重影响患者生活质量[1-2]。坐骨神经痛的病因及发病机制复杂且不明确,目前研究发现,炎症细胞浸润、星型胶质细胞活化、神经损伤等是导致坐骨神经痛等神经疼痛的关键因素[3]。炎症介质TNF-α不仅可以增加神经节中钠通道电流的产生,加剧啮齿动物模型机械异常疼痛,还可通过激活转录激活因子3(signal transducer and activator of transcription 3,STAT3)通路表达来激活星形胶质细胞、炎症反应等,介导神经病理性疼痛进程[4-6]。但TNF-α/STAT3通路的调控机制在坐骨神经痛过程中的研究较少。天然药物天麻中的天麻素在临床上常用于头痛、癫痫、神经衰弱等中枢神经系统疾病的治疗,且近来研究发现,天麻素对长春新碱诱导的外周神经病理性疼痛有较好的镇痛效果,但其镇痛机制还不甚明确[7-8]。本研究建立大鼠坐骨神经痛疼痛模型,从TNF-α/STAT3通路探讨天麻素的镇痛机制,以期阐明坐骨神经痛疼痛的分子生物学机制,为临床合理用药提供参考。
1 材料与方法
1.1 材料
1.1.1 实验动物 清洁级SD大鼠60只,7~8周龄,体质量220~240 g,由浙江维通利华实验动物技术有限公司提供,生产许可证号:SCXK(浙)2020-0002。所有大鼠于武汉大学动物实验中心动物房中常规饲养。动物实验按照国际疼痛学会(IASP)纲领和要求实施,并经武汉市第一医院动物伦理委员会批准,批号:IACUC-01(20190917)。
1.1.2 主要试剂及仪器 天麻素标准品购自上海宝曼生物科技有限公司,货号:D1355,规格:20 mg;HE染色试剂盒购自上海联迈生物工程有限公司,货 号:LMO105;前 列 腺 素E2(prostaglandin E2,PGE2)及降钙素基因相关肽(calcitonin gene-related peptide,CGRP)等ELISA试剂盒购自上海圻明生物科技有限公司及浙江羽翔生物科技有限公司,货号:R31545、EYX-DD02605;鸡抗胶质纤维酸性蛋白(GFAP)、小鼠抗TNF-α、兔抗电压门控钠通道亚型(voltage-gated sodium channel subtype,Nav1.6)、鸡抗微管相关蛋白2(microtubule-associated protein 2,MAP2)购 自 美 国Abcam公 司,货 号:ab134436、ab109322、ab68153、ab5392;TNF-α、STAT3、Nav1.6、IL-6、环氧化酶-2(COX-2)、趋化因子配体2(CCL2)等抗体购自美国Abcam公司,货号:ab109322、ab68153、ab230654、ab208113、ab179800、ab25124。蛋白电泳仪(型号:1659001)购自美国Bio-Rad公司;免疫荧光共聚焦显微镜(型号:DM2500)购自德国徕卡公司;Von Frey电子测痛仪(型号:BIOEVF4)购自深圳市瑞沃德生命科技有限公司;热辐射刺激器(型号:BME-410C)购自天津伯尔尼科技有限公司。
1.2 方法
1.2.1 模型建立及分组给药 参照文献[9]掀开大鼠L6硬脊膜置入PE-10导管,行坐骨神经结扎手术构建坐骨神经痛模型。术后2 d观察大鼠行为,若大鼠出现激惹行为且机械痛敏阈值(paw withdrawal latency,PWL)及热刺激反应潜伏期(paw withdrawal threshold,PWT)检测结果异常,视为造模成功。共造模成功50只,随机分为模型组、天麻素组(120 mg/kg)、TNF-α过表达的重组腺病毒组(Ad-TNF-α,4µl/只)、空腺病毒组(Ad-GFP,4µl/只)、天麻素+Ad-TNF-α组(120 mg/kg+4µl/只),每组10只;另取10只大鼠,只暴露L6硬脊膜不结扎,其余操作同模型组,作为假手术组。各组大鼠均于术后第3天开始给药,天麻素组参照文献[10]设置剂量并用生理盐水稀释成浓度为12.00 mg/ml的混悬液,按10 ml/kg的容积经腹腔注射给药,1次/d;Ad-TNF-α及Ad-GFP参照文献[11]经脊髓鞘内注射,4µl/只,2次/周;天麻素+Ad-TNF-α组腹腔注射天麻素的同时,经鞘内注射Ad-TNF-α溶液;模型组和假手术组注射等剂量生理盐水,各组连续给药14 d。
1.2.2 大鼠一般行为观察 各组大鼠均于给药期间观察饮食、活动及精神状态。
1.2.3 大鼠PWT及PWL检测 各组大鼠于末次给药12 h后,参照文献[10]用Von Frey电子测痛仪及热辐射刺激器测定各组大鼠PWT及PWL值。
1.2.4 大鼠背根神经节标本采集 各组大鼠检测完PWT及PWL后,麻醉处死大鼠,迅速解剖手术同侧的L4、L6、L5段背根神经节,剪取约3 cm组织置于-80℃冰箱保存,其余组织迅速置于4%多聚甲醛中固定24 h后备用。
1.2.5 大鼠背根神经节痛觉敏感相关物质CGRP及PGE2水平检测 取1.2.4项下-80℃冰箱保存的背根神经节,用组织匀浆研磨器匀浆、研磨后,离心取上清液,按CGRP及PGE2试剂盒说明书方法检测CGRP及PGE2水平。
1.2.6 各组大鼠脊髓HE染色 取1.2.4项下4%多聚甲醛固定的背根神经节组织,常规处理并切成20µm厚的切片。取部分切片按HE试剂盒说明书染色、封片后,置于光学显微镜下观察组织病理变化。
1.2.7 免疫荧光双标记法检测TNF-α与GFAP共表达水平 取1.2.6项下部分切片,室温风化及0.5%曲拉通(Triton X-100)透化后,加入一抗(小鼠抗TNF-α、鸡抗GFAP,稀释倍数均为1∶500)4℃孵育过夜后加入二抗(TRITC标记的山羊抗小鼠IgG、FITC标记的山羊抗鸡IgG,稀释倍数为1∶200)孵育显色后,置于荧光显微镜下观察、拍照。
1.2.8 免疫荧光双标记法检测TNF-α、Nav1.6与MAP2共表达水平 取1.2.6项下部分切片,室温风化及0.5%曲拉通(Triton X-100)透化后,加入一抗(小鼠抗TNF-α、兔抗Nav1.6、鸡抗MAP2,稀释倍数均为1∶500)4℃孵育过夜后加入二抗(TRITC标记的山羊抗小鼠IgG、TRITC标记的山羊抗兔IgG、FITC标记的山羊抗鸡IgG,稀释倍数为1∶200),DAPI复染孵育显色后,置于荧光显微镜下观察、拍照。
1.2.9 Western blot检测背根神经节组织TNF-α、STAT3、Nav1.6、CCL2、IL-6、COX-2蛋白相对表达水平 取1.2.4项下-80℃冰箱保存的背根神经节组织,于4℃解冻后剪碎,加入RIPA裂解液,用组织匀浆器置于冰上研磨、裂解、离心后取上清液,BCA试剂盒测定蛋白浓度。取50µg蛋白进行电泳、转膜、封闭反应后,加入抗体(TNF-α、STAT3、Nav1.6、CCL2、IL-6、COX-2抗体,稀释倍数均为1∶800,内参β-actin,1∶2 000)4℃孵育过夜,加入1∶1 000兔抗鼠二抗溶液,室温孵育及漂洗后,用增强化学发光法显色并拍照,并以Image J软件分析各组蛋白相对表达。
1.3 统计学分析 以SPSS22.0软件对实验数据进行统计分析,计量资料以±s表示,组间比较采用单因素方差分析,进一步两组间比较行SNK-q检验,P<0.05表示差异有统计学意义。
2 结果
2.1 天麻素对大鼠一般行为的影响 假手术组大鼠进食、饮水及精神活动正常;模型组大鼠进食、饮水及活动量减少,精神萎靡,易激惹行为增多;天麻素组大鼠易激惹行为减少,活动量有所增加;Ad-TNF-α组大鼠易激惹行为进一步增多;天麻素+Ad-TNF-α组、Ad-GFP组大鼠上述行为活动变化与模型组相似。
2.2 天麻素对大鼠PWL、PWT的影响 与假手术组相比,模型组大鼠PWL、PWT降低(P<0.05)。与模型组相比,天麻素组大鼠PWL、PWT升高(P<0.05);Ad-TNF-α组大鼠PWL、PWT降低(P<0.05)。与天麻素组相比,天麻素+Ad-TNF-α组大鼠PWL、PWT降低(P<0.05)。Ad-GFP组与模型组比较上述指标差异无统计学意义(P>0.05),见表1。
表1 各组大鼠PWT、PWL结果比较(±s)Tab.1 Comparison of PWT and PWL results of rats in each group(±s)
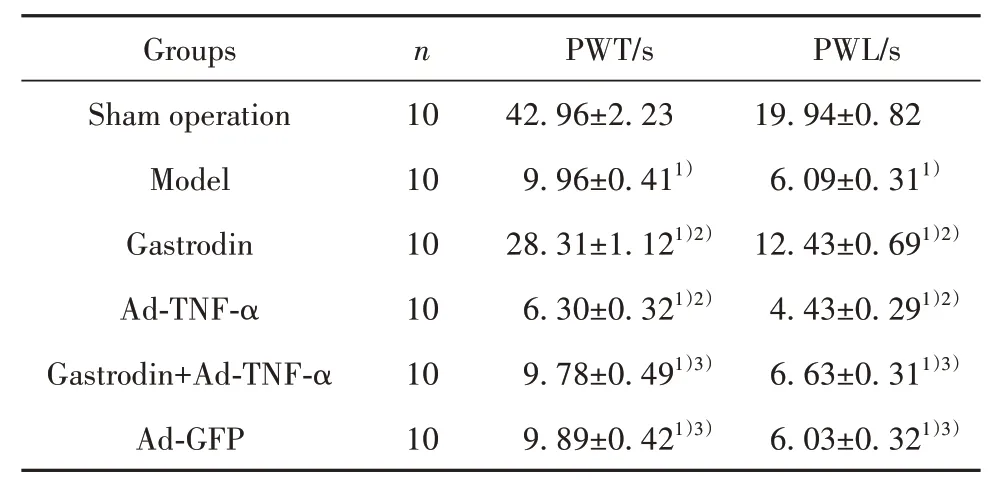
表1 各组大鼠PWT、PWL结果比较(±s)Tab.1 Comparison of PWT and PWL results of rats in each group(±s)
Note:Compared with sham operation group,1)P<0.05;compared with model group,2)P<0.05;compared with gastrodin group,3)P<0.05.
Groups Sham operation Model Gastrodin Ad-TNF-α Gastrodin+Ad-TNF-α Ad-GFP n 10 10 10 10 10 10 PWT/s 42.96±2.23 9.96±0.411)28.31±1.121)2)6.30±0.321)2)9.78±0.491)3)9.89±0.421)3)PWL/s 19.94±0.82 6.09±0.311)12.43±0.691)2)4.43±0.291)2)6.63±0.311)3)6.03±0.321)3)
2.3 天麻素对大鼠痛觉敏感相关物质CGRP、PGE2表达水平的影响 与假手术组相比,模型组大鼠背根神经节CGRP、PGE2水平升高(P<0.05)。与模型组相比,天麻素组大鼠背根神经节CGRP、PGE2水平降低(P<0.05);Ad-TNF-α组大鼠PWL、PWT背根神经节CGRP、PGE2水平升高(P<0.05)。天麻素+Ad-TNF-α组上述指标高于天麻素组(P<0.05)。Ad-GFP组与模型组比较上述指标差异无统计学意义(P>0.05),见表2。
表2 各组大鼠背根神经节CGRP、PGE2水平比较(±s)Tab.2 Comparison of CGRP and PGE2 levels in dorsal root ganglion of rats in each group(±s)
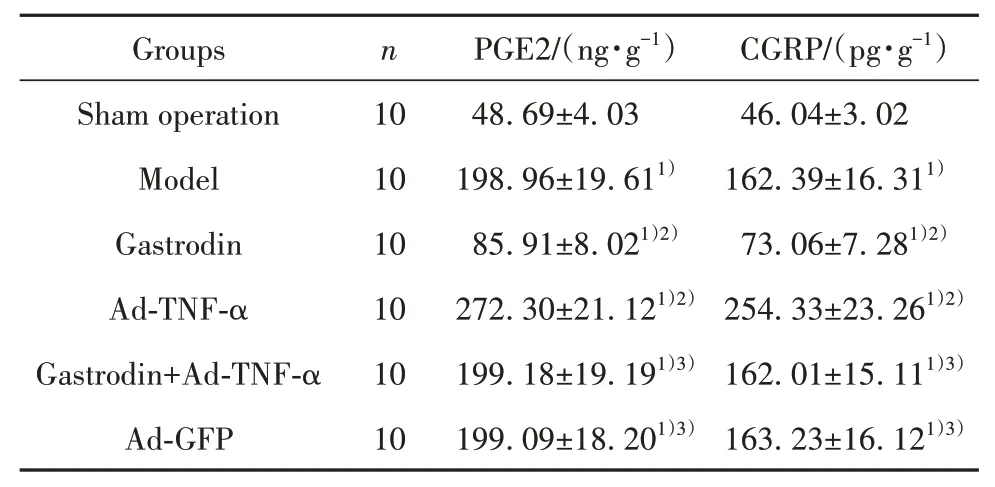
表2 各组大鼠背根神经节CGRP、PGE2水平比较(±s)Tab.2 Comparison of CGRP and PGE2 levels in dorsal root ganglion of rats in each group(±s)
Note:Compared with sham operation group,1)P<0.05;compared with model group,2)P<0.05;compared with gastrodin group,3)P<0.05.
Groups Sham operation Model Gastrodin Ad-TNF-α Gastrodin+Ad-TNF-α Ad-GFP n 10 10 10 10 10 10 PGE2/(ng·g-1)48.69±4.03 198.96±19.611)85.91±8.021)2)272.30±21.121)2)199.18±19.191)3)199.09±18.201)3)CGRP/(pg·g-1)46.04±3.02 162.39±16.311)73.06±7.281)2)254.33±23.261)2)162.01±15.111)3)163.23±16.121)3)
2.4 天麻素对大鼠背根神经节病理形态的影响假手术组大鼠背根神经节神经纤维排列整齐致密,结构正常。模型组大鼠神经纤维排列紊乱、轴突及髓鞘崩解、雪旺细胞破坏较多,郎飞结构重叠、模糊不清。天麻素组大鼠可见神经纤维排列较为规则,雪旺细胞增殖分化及郎飞结构新生明显。Ad-TNF-α组大鼠神经纤维结构排列紊乱、轴突及髓鞘崩解、雪旺细胞及郎飞结构破坏进一步加重。天麻素+Ad-TNF-α组、Ad-GFP组大鼠上述病理变化与模型组相近,见图1。
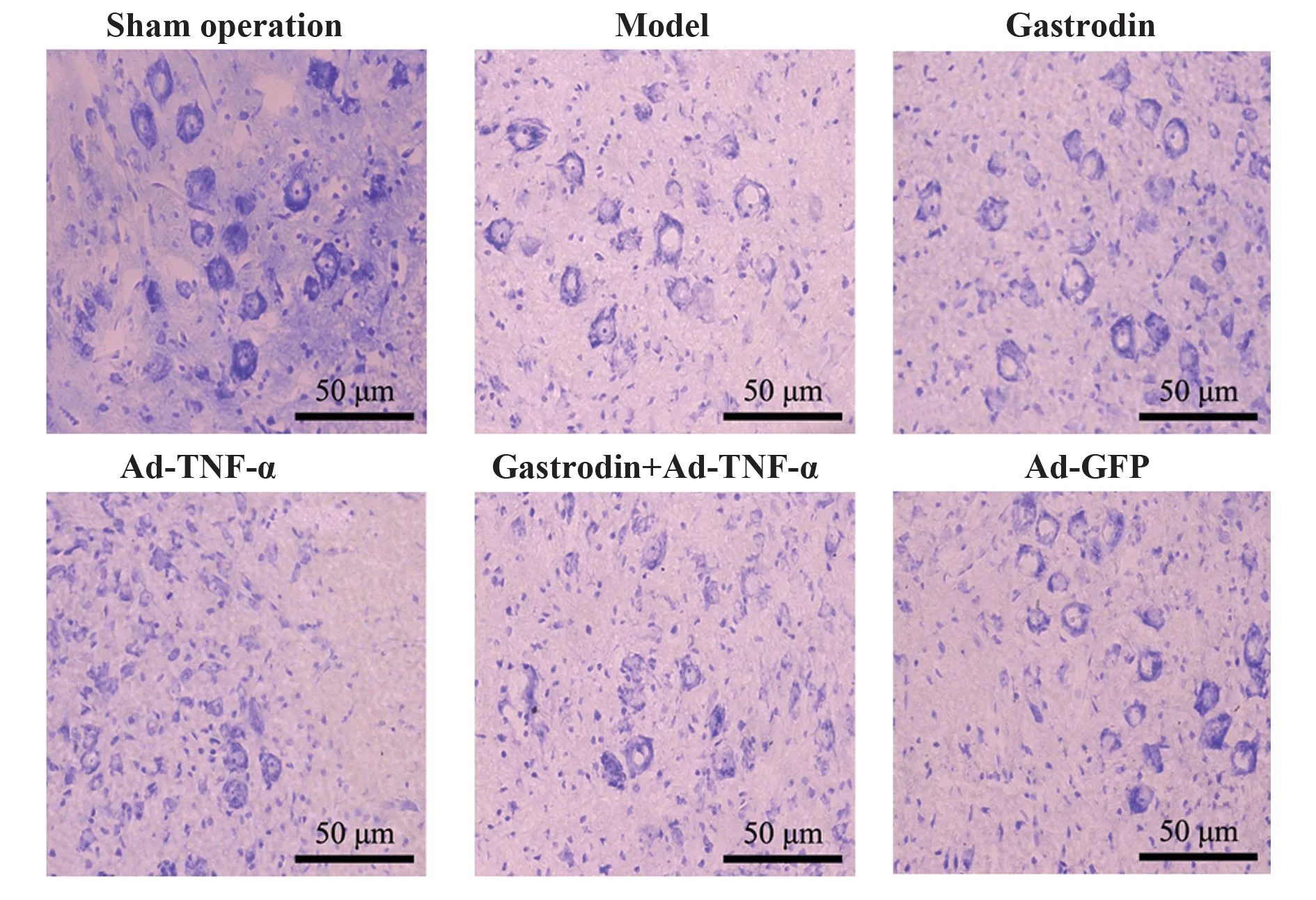
图1 背根神经节组织HE染色图(×200)Fig.1 HE staining of dorsal root ganglion tissue(×200)
2.5 天麻素对大鼠TNF-α、GFAP阳性共表达的影响 与假手术相比,模型组大鼠TNF-α与GFAP阳性共表达水平升高(P<0.05);与模型组相比,天麻素组大鼠TNF-α与GFAP阳性共表达水平降低(P<0.05);Ad-TNF-α组大鼠TNF-α与GFAP阳性共表达水平升高(P<0.05)。天麻素+Ad-TNF-α组上述指标高于天麻素组(P<0.05)。Ad-GFP组与模型组比较上述指标差异无统计学意义(P>0.05)。见图2、表3。
表3 各组大鼠背根神经节组织TNF-α与GFAP阳性共表达水平比较(±s)Tab.3 Comparison of TNF-αand GFAP positive co-expression levels in dorsal root ganglion tissues of rats in each group(±s)
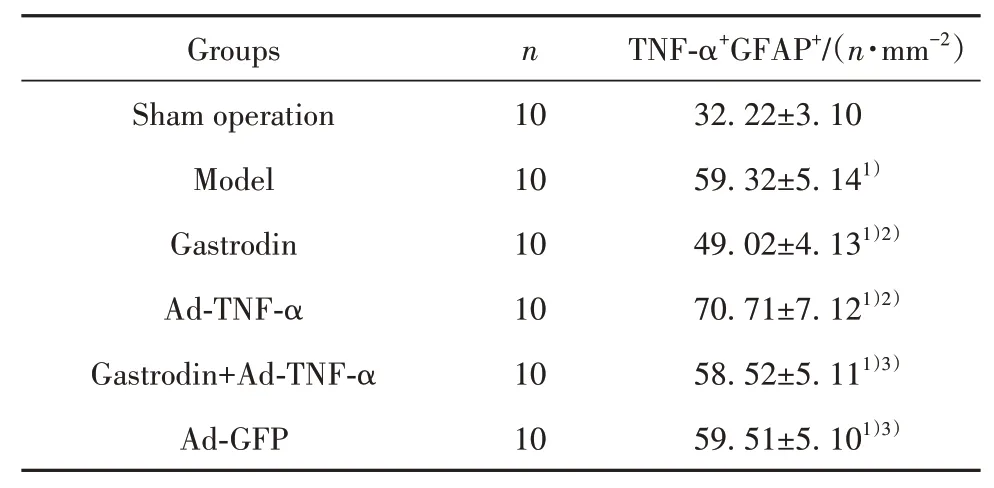
表3 各组大鼠背根神经节组织TNF-α与GFAP阳性共表达水平比较(±s)Tab.3 Comparison of TNF-αand GFAP positive co-expression levels in dorsal root ganglion tissues of rats in each group(±s)
Note:Compared with sham operation group,1)P<0.05;compared with model group,2)P<0.05;compared with gastrodin group,3)P<0.05.
Groups Sham operation Model Gastrodin Ad-TNF-α Gastrodin+Ad-TNF-α Ad-GFP n 10 10 10 10 10 10 TNF-α+GFAP+/(n·mm-2)32.22±3.10 59.32±5.141)49.02±4.131)2)70.71±7.121)2)58.52±5.111)3)59.51±5.101)3)
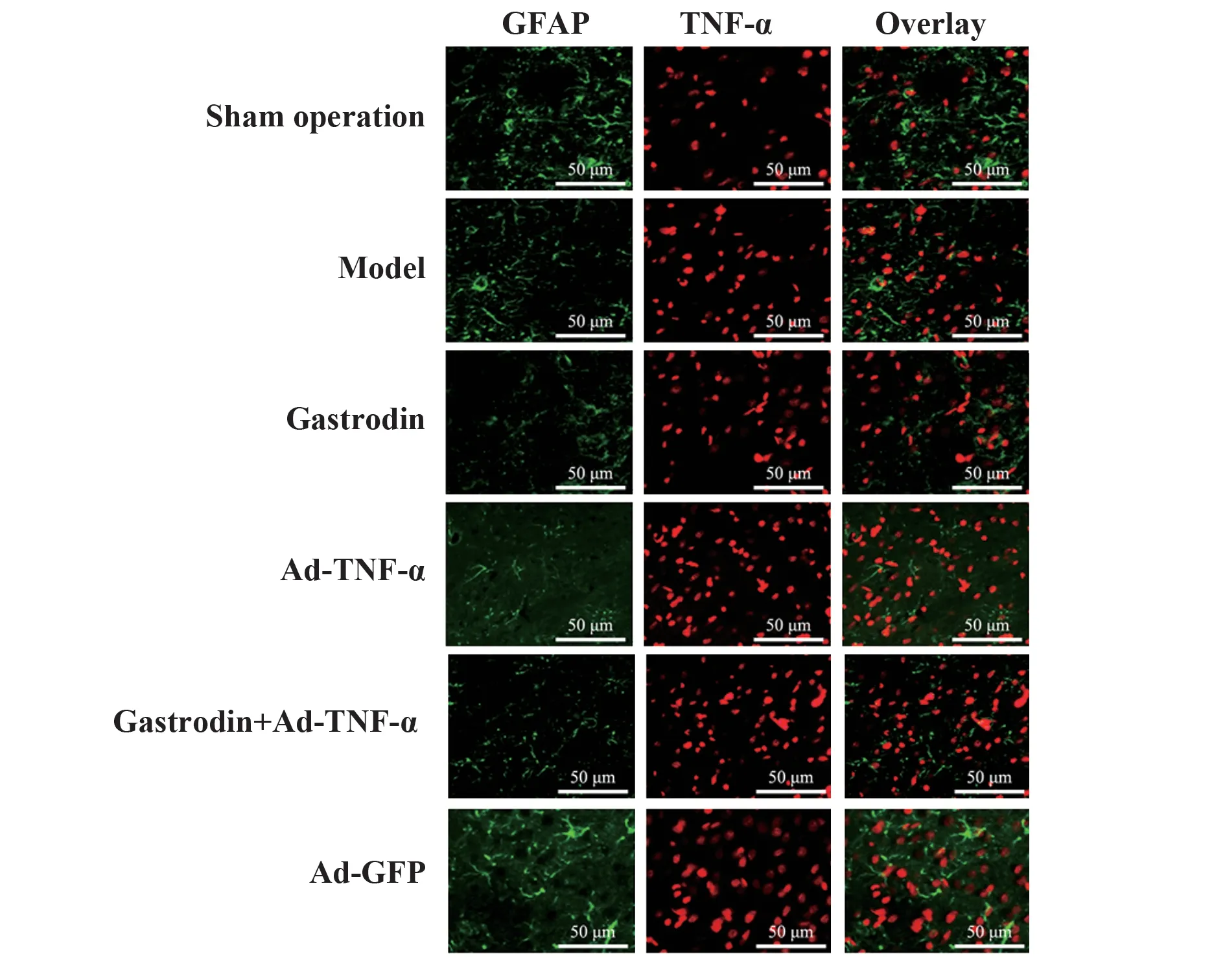
图2 背根神经节组织TNF-α与GFAP免疫荧光染色图(×400)Fig.2 Immunofluorescence staining of TNF-αand GFAP in dorsal root ganglion tissue(×400)
2.6 天麻素对大鼠TNF-α、Nav1.6及MAP2阳性共表达的影响 与假手术相比,模型组大鼠TNF-α与MAP2、Nav1.6与MAP2阳性共表达水平均升高(P<0.05);与模型组相比,天麻素组大鼠TNF-α与MAP2、Nav1.6与MAP2阳性共表达水平降低(P<0.05);Ad-TNF-α组大鼠TNF-α与MAP2、Nav1.6与MAP2阳性共表达水平升高(P<0.05)。天麻素+Ad-TNF-α组上述指标变化与天麻素组相反,且差异有统计学意义(P<0.05)。Ad-GFP组与模型组比较上述指标差异无统计学意义(P>0.05)。见图3、图4、表4。
表4 各组大鼠TNF-α、Nav1.6及MAP2阳性共表达水平比较(±s)Tab.4 Comparison of positive co expression levels of TNF-α,Nav1.6 and MAP2 of rats in each group(±s)
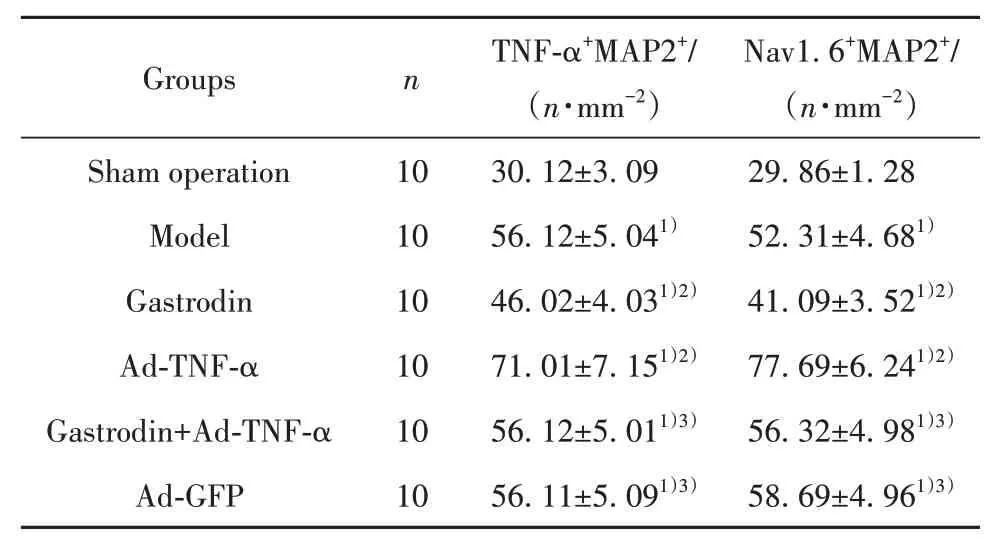
表4 各组大鼠TNF-α、Nav1.6及MAP2阳性共表达水平比较(±s)Tab.4 Comparison of positive co expression levels of TNF-α,Nav1.6 and MAP2 of rats in each group(±s)
Note:Compared with sham operation group,1)P<0.05;compared with model group,2)P<0.05;compared with gastrodin group,3)P<0.05.
Groups Sham operation Model Gastrodin Ad-TNF-α Gastrodin+Ad-TNF-α Ad-GFP n 10 10 10 10 10 10 TNF-α+MAP2+/(n·mm-2)30.12±3.09 56.12±5.041)46.02±4.031)2)71.01±7.151)2)56.12±5.011)3)56.11±5.091)3)Nav1.6+MAP2+/(n·mm-2)29.86±1.28 52.31±4.681)41.09±3.521)2)77.69±6.241)2)56.32±4.981)3)58.69±4.961)3)

图3 背根神经节组织TNF-α与MAP2免疫荧光染色图(×400)Fig.3 Immunofluorescence staining of TNF-αand MAP2 in dorsal root ganglion tissue(×400)
2.7 天麻素对大鼠背根神经节TNF-α、STAT3、Nav1.6蛋白表达的影响 与假手术组相比,模型组大 鼠TNF-α、STAT3、Nav1.6蛋 白 表 达 升 高(P<0.05);与模型组相比,天麻素组大鼠TNF-α、STAT3、Nav1.6蛋白表达降低(P<0.05);Ad-TNF-α组大鼠TNF-α、STAT3、Nav1.6蛋白表达升高(P<0.05)。天麻素+Ad-TNF-α组上述指标变化与天麻素组相反,且差异有统计学意义(P<0.05)。Ad-GFP组与模型组比较上述指标差异无统计学意义(P>0.05),见图5、表5。
表5 各组大鼠背根神经节TNF-α、STAT3、Nav1.6蛋白表达比较(±s,n=10)Tab.5 Comparison of TNF-α,STAT3 and Nav1.6 protein expressions in dorsal root ganglion of rats in each group(±s,n=10)

表5 各组大鼠背根神经节TNF-α、STAT3、Nav1.6蛋白表达比较(±s,n=10)Tab.5 Comparison of TNF-α,STAT3 and Nav1.6 protein expressions in dorsal root ganglion of rats in each group(±s,n=10)
Note:Compared with sham operation group,1)P<0.05;compared with model group,2)P<0.05;compared with gastrodin group,3)P<0.05.
Groups Sham operation Model Gastrodin Ad-TNF-α Gastrodin+Ad-TNF-α Ad-GFP TNF-α/β-actin 1.18±0.11 2.36±0.211)1.61±0.161)2)2.91±0.291)2)2.31±0.211)3)2.40±0.221)3)STAT3/β-actin 1.23±0.10 2.48±0.201)1.52±0.161)2)2.92±0.281)2)2.46±0.211)3)2.45±0.201)3)Nav1.6/β-actin 1.01±0.11 2.26±0.221)1.41±0.141)2)2.89±0.291)2)2.21±0.211)3)2.20±0.221)3)
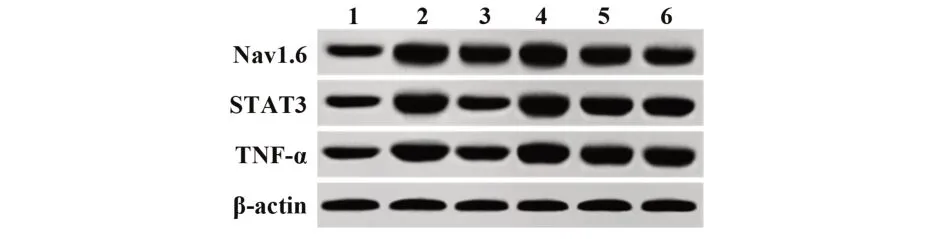
图5 各组大鼠背根神经节TNF-α、STAT3、Nav1.6蛋白表达Fig.5 TNF-α,STAT3 and Nav1.6 protein expressions in dorsal root ganglion of rats in each group
2.8 天麻素对大鼠背根神经节CCL2、IL-6、COX-2蛋白表达结果 与假手术相比,模型组大鼠CCL2、IL-6、COX-2蛋白表达升高(P<0.05);与模型组相比,天麻素组大鼠CCL2、IL-6、COX-2蛋白表达降低(P<0.05);Ad-TNF-α组大鼠CCL2、IL-6、COX-2蛋白表达升高(P<0.05)。天麻素+Ad-TNF-α组上述指标变化与天麻素组相反,且差异有统计学意义(P<0.05)。Ad-GFP组与模型组比较上述指标差异无统计学意义(P>0.05),见图6、表6。

图6 各组大鼠背根神经节CCL2、IL-6、COX-2蛋白表达Fig.6 CCL2,IL-6 and COX-2 protein expressions in dorsal root ganglia of rats in each group
表6 各组大鼠背根神经节CCL2、IL-6、COX-2蛋白表达水平(±s,n=10)Tab.6 Protein expression levels of CCL2,IL-6 and COX-2 in dorsal root ganglia of rats in each group(±s,n=10)

表6 各组大鼠背根神经节CCL2、IL-6、COX-2蛋白表达水平(±s,n=10)Tab.6 Protein expression levels of CCL2,IL-6 and COX-2 in dorsal root ganglia of rats in each group(±s,n=10)
Note:Compared with sham operation group,1)P<0.05;compared with model group,2)P<0.05;compared with gastrodin group,3)P<0.05.
Groups Sham operation Model Gastrodin Ad-TNF-α Gastrodin+Ad-TNF-α Ad-GFP CCL2/β-actin 1.19±0.10 2.01±0.251)1.56±0.161)2)2.85±0.291)2)2.09±0.231)3)2.01±0.201)3)IL-6/β-actin 1.01±0.12 2.19±0.231)1.32±0.151)2)2.76±0.111)2)2.18±0.201)3)2.19±0.201)3)COX-2/β-actin 0.96±0.13 2.35±0.211)1.89±0.171)2)2.95±0.291)2)2.39±0.221)3)2.32±0.211)3)
3 讨论
坐骨神经痛疼痛常呈放射性,疼痛常分布在臀部大腿及小腿后外侧、足外侧等,其疼痛症状常由坐骨神经压迫、损伤、炎症等因素刺激所致[12]。本研究采用压迫坐骨神经法建立坐骨神经痛模型,发现大鼠易激惹行为增多,且足底PWT、PWL降低,大鼠出现疼痛及疼痛敏感性增强症状,提示造模成功。另外,机体CGRP及PGE2变化与疼痛关系密切。ZHANG等[13]发现具有感受伤害信号的神经介质CGRP在三叉神经痛患者血浆中表达升高,且CGRP表达增多可导致痛觉敏感提高,并长时间维持伤害性疼痛及炎症性疼痛状态,加重患者疼痛感。PINTO等[14]发现PGE2与炎症性疼痛产生有关,能够通过调控非特异性阳离子通道瞬态受体电位香草酸1、嘌呤能受体、电压门控钙或钠通道等伤害感受器中的通道蛋白表达,导致痛觉过敏,加重疼痛感。本研究在坐骨神经痛大鼠坐骨神经节中也检测到CGRP及PGE2表达水平升高,进一步表明造模成功。
大量研究证实炎症细胞因子TNF-α在慢性疼痛的建立和维持中发挥重要作用[15]。KANDA等[16]发现脊髓中活化的胶质细胞可分泌促炎介质TNF-α、IL-6、COX-2等刺激神经兴奋,促进机体对伤害刺激的敏感性,而鞘内注射TNF-α抑制剂可迅速降低血管中COX-2表达,减轻神经损伤后的机械性异常疼痛,并推测TNF-α是参与疼痛敏化,导致神经病理性疼痛的重要促炎细胞因子。本研究在坐骨神经痛坐骨神经节中检测到TNF-α与MAP2共表达神经元、TNF-α与GFAP共表达星形胶质细胞均显著增加,且鞘内注射TNF-α重组腺病毒,进一步激活TNF-α在神经元及活化胶质细胞中表达后,大鼠足底PWT、PWL减少及痛觉过敏相关物质CGRP、PGE2表达进一步升高,证实了TNF-α与疼痛敏化关系密切。
另外电压门控钠通道Nav1.6及STAT3活化参与痛觉敏化过程。ZHANG等[4]及ZYBURA等[17]发现在调节神经元兴奋和放电模式中起关键作用的电压门控钠通道亚型Nav1.6表达升高,可调控神经元的动作电位和放电特性,并助长神经性疼痛的发生。廖维勇等[18]及MATSUMOTO等[19]证实STAT3及磷酸化水平增加,可促进炎症介质如CCL2、TNF-α表达增加,而抑制STAT3通路活化可降低星形胶质细胞活化及炎症介质释放,减弱大鼠机械异常性疼痛和热痛觉过敏。近来有研究发现,Nav1.6及STAT3活化与TNF-α的调控有关。DING等[11]发现Nav1.6、STAT3及TNF-α可重叠表达于背根神经节神经元,TNF-α抑制剂可抑制Nav1.6表达的上调及STAT3通路的激活,推测TNF-α降低大鼠神经病理性疼痛的痛觉敏化过程可能与抑制Nav1.6及STAT3有关。本研究发现TNF-α在坐骨神经痛模型大鼠及Ad-TNF-α组表达升高的同时,Nav1.6及STAT3、CCL2、IL-6、COX-2蛋白表达也随之升高,提示TNF-α可能通过介导Nav1.6及STAT3通路活化参与坐骨神经痛大鼠疼痛敏化过程。
抗抑郁药、抗炎药、局麻药、辣椒素、阿片物质等是目前治疗坐骨神经痛等神经病理性痛的常用药物,但这些药副作用较大,且长期应用易发生耐受性和成瘾性[3]。天麻素为来源于天麻的活性成分,临床上常用其治疗三叉神经痛、偏头疼等中枢神经疼痛[7]。但坐骨神经痛等外周神经疼痛与外周神经及脊髓神经元兴奋及异位自发放电活动关系密切,且因不受血脑屏障保护而不同于中枢神经病理性疼痛[20-21]。QIU等[22]发现天麻素可抑制酸敏感离子通道介导的质子门控电流改变大鼠背根神经节神经元兴奋及去极化动作电位数量,从而减轻大鼠疼痛症状,提示天麻素对外周神经疼痛具有一定的治疗效果。本研究发现,天麻素可抑制坐骨神经痛大鼠足底PWT、PWL减少及痛觉过敏相关物质CGRP、PGE2增多,并降低TNF-α介导的Nav1.6及STAT3通路在背根神经节中的表达,且上述作用可被Ad-TNF-α逆转,提示天麻素降低坐骨神经痛大鼠痛觉敏感性作用,可能与抑制TNF-α/STAT3/Nav1.6通路有关。
综上所述,天麻素可能通过抑制TNF-α/STAT3通路激活下调Nav1.6表达,降低坐骨神经痛模型大鼠痛觉敏感性,为临床治疗坐骨神经痛和阐明天麻素发挥镇痛的可能机制提供一定参考。但TNF-α/STAT3通路与痛觉敏感性的靶向调控关系复杂,且TNF-α/STAT3与疼痛相关通路的内在作用机制仍有待深入探讨。

