D-二聚体联合急性主动脉夹层风险评分对急性主动脉夹层的诊断价值
王云浩,丁春阳,方洋洋,徐秋旻
东南大学医学院附属南京同仁医院急诊医学科,江苏 南京 211102
急性主动脉夹层(acute aortic dissection,AAD)是一种少见且极其凶险的心血管疾病,可表现为剧烈的胸痛、腹痛或背部疼痛,致死率高[1]。发病率在不同的研究中差异较大。日本的一项研究显示,AAD的总发病率约为79/100 000[2]。瑞典的一项研究显示,2000—2004年,AAD的总体发病率约为每年2.4/100 000[3]。一项基于急诊患者的临床研究显示,A型AAD的发生率为5.93/100 000~24.92/100 000[4]。中国缺少类似的研究数据,但从国内文献报道可以看出,AAD的发生率越来越高[5-7]。随着临床医师对AAD认识的提高及影像学诊断技术的发展,及时对疑似AAD的患者进行影像学检查可使大部分AAD获得明确诊断[8-9]。但存在两个问题,第一,这些影像学检查均具有时间长、费用高、需转运至检查室及潜在过敏的风险,难以于急诊第一时间使用;第二,这些影像学检查可能会导致对部分低危患者的过度医疗,从而造成医疗资源挤兑。因此,近年来,探索一些较为简便的方法具有重要意义,其可用于急诊时快速识别高危患者,从而进行针对性的检查,避免医疗资源浪费。研究发现,急性主动脉夹层风险评分(aortic dissection detection risk score,ADDRS)整合了高危易感因素、高危疼痛特征和高危体征等进入急诊后可迅速获得的信息,对AAD具有一定的诊断价值[10-11]。亦有研究显示,D-二聚体(D-dimer,D-D)对AAD也具有一定的诊断价值,而且可在急诊室快速获得[12-14]。将D-D与ADDRS联合使用可能有利于更加准确地评估患者发生AAD的风险。本研究分析了D-D联合ADDRS对急诊AAD患者的诊断价值,现报道如下。
1 资料与方法
1.1 一般资料
收集2017年1月至2021年12月于东南大学医学院附属南京同仁医院就诊的疑似AAD患者的临床资料。纳入标准:(1)年龄≥18岁;(2)具有胸痛、腹痛、背部疼痛、休克、晕厥等症状;(3)急性(≤7天)起病;(4)临床及影像学检查资料完整;(5)有急诊D-D检测结果;(6)经计算机断层扫描(computer tomography,CT)、磁共振成像等影像学检查明确诊断。排除标准:(1)合并急性创伤;(2)合并恶性肿瘤;(3)孕妇;(4)7天内接受过抗栓(抗凝、溶栓)治疗。根据纳入、排除标准,最终共纳入361例疑似AAD患者。
1.2 急诊室床旁D-D水平检测
患者于急诊室诊断为疑似AAD后立即采集随机静脉血,采用免疫比浊法测定D-D水平,D-D水平的正常值范围为0~0.5 mg/L。D-D>0.5 mg/L为阳性,D-D≤0.5 mg/L为阴性。
1.3 急诊室床旁ADDRS评分
ADDRS包含3个方面:(1)高危易感因素,包括马方综合征、主动脉疾病家族史、已知的主动脉瓣疾病、已知的胸主动脉瘤、曾行主动脉介入或外科操作;(2)高危疼痛特征,包括突发疼痛,剧烈难以忍受,撕裂样、刀割样尖锐痛,新发主动脉瓣杂音;(3)高危体征,包括动脉搏动消失或无脉,四肢血压差异明显,局灶性神经功能缺失,低血压或休克[15]。评分为0~3分,评分越高表示ADD风险越高。
1.4 数据收集及观察指标
从电子病历系统中提取患者的临床信息,包括性别、年龄、身高、体重、既往史、不良嗜好、急诊化验结果、影像学检查结果。比较两组患者的D-D水平和ADDRS,分析D-D与ADDRS对AAD诊断结果的一致性。以CT、磁共振成像等影像学检查为金标准,分析不同ADDRS时D-D对AAD的诊断效能(灵敏度、特异度、阳性预测值、阴性预测值)。
1.5 统计学方法
应用SPSS 23.0软件对数据进行统计分析,计量资料以(±s)表示,组间比较采用两独立样本t检验。计数资料以n(%)表示,组间比较采用χ2检验。一致性以Kappa值评估,0.8<Kappa值≤1.0为优,0.6<Kappa值≤0.8为良,0.4≤Kappa值≤0.6为中,Kappa值<0.4为差。P<0.05为差异有统计学意义。
2 结果
2.1 病理诊断结果
361例疑似AAD患者中,病理检查结果显示,AAD患者82例(AAD组),非AAD患者279例(对照组)。AAD组中,男性67例,女性15例;年龄49~73岁,平均(53.7±5.1)岁;高血压70例,糖尿病8例,冠心病5例,吸烟史24例,饮酒史17例。对照组中,男性218例,女性61例;年龄46~77岁,平均(54.6±4.8)岁;高血压163例,糖尿病35例,冠心病14例,吸烟史87例,饮酒史72例。两组患者的高血压情况比较,差异有统计学意义(P<0.05);两组患者的性别、年龄等临床特征比较,差异均无统计学意义(P>0.05)。
2.2 两组患者D-D水平、ADDRS的比较
急诊室床旁检测结果显示,AAD组D-D水平及其超过正常值范围的患者比例均明显高于对照组患者,ADDRS≥1分的患者比例均明显高于对照组患者,差异均有统计学意义(P<0.01)。(表1)
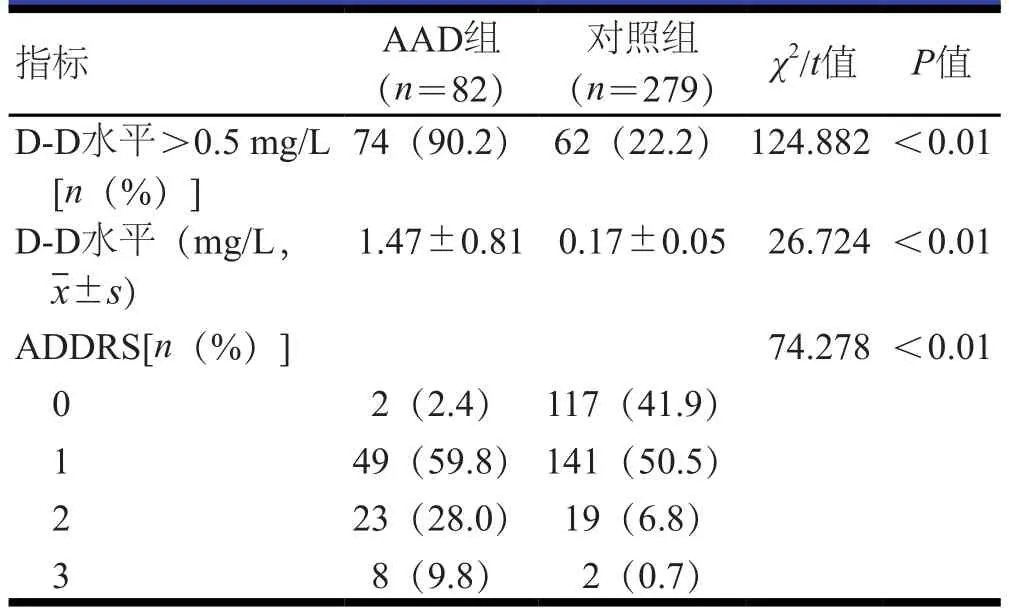
表1 两组患者D-D水平、ADDRS的比较
2.3 D-D与ADDRS对AAD诊断结果的一致性分析
ADDRS为0分的119例患者中,仅5例患者的D-D水平升高,其中ADD组2例,对照组3例;ADDRS为1分的190例患者中,82例患者的D-D水平升高,其中ADD组42例,对照组40例;ADDRS为2分以上的52例患者中,49例患者的D-D水平升高,其中ADD组30例,对照组19例。一致性分析结果显示,D-D水平与ADDRS在ADD的诊断中具有较好的一致性(Kappa=0.407,P<0.01),符合率为0.679。(表2)

表2 D-D与ADDRS对AAD诊断结果的一致性分析
2.4 不同ADDRS时D-D对AAD的诊断效能
D-D联合ADDRS诊断AAD的效能按照不同ADDRS时D-D对AAD的诊断效能进行分析,结果显示,其对于ADDRS评分为0~1分的AAD具有较高的灵敏度和特异度。(表3~表4)

表3 不同ADDRS时D-D检测对AAD的诊断结果
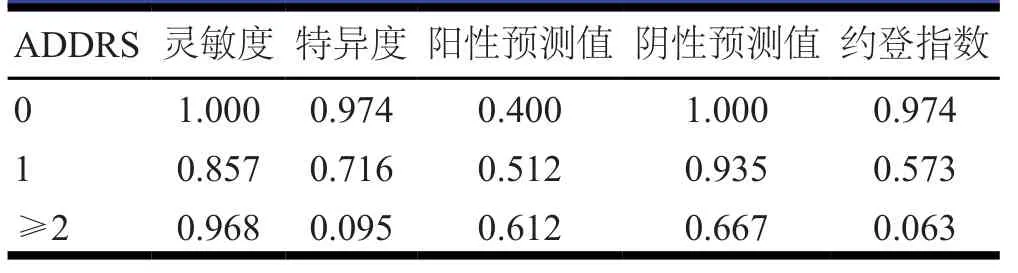
表4 D-D联合ADDRS对AAD的诊断效能
3 讨论
本研究中,在361例急诊疑诊AAD患者中,最终82例明确诊断AAD,且AAD患者的D-D水平和ADDRS均明显高于非AAD患者;一致性分析结果显示,D-D水平和ADDRS在AAD的诊断中具有较好的一致性。两者联合使用时,D-D对不同ADDRS时的AAD均具有较高的灵敏度,同时对于ADDRS为1分以下的AAD具有较高的特异度。
AAD通常起病较急,主动脉内血流经内膜破裂处进入血管壁,较高的流体压力造成血管壁撕裂,患者感到剧烈疼痛,逐渐发展可累及主要脏器的供血动脉,造成脏器血流中断而致死[16-17]。因此,AAD的诊断和治疗决策必须迅速、准确[18]。然而,目前临床常用的金标准诊断方式包括CT血管造影(computer tomography angiography,CTA)、三维重建、核磁共振血管成像,但这些检查耗时且不方便,不仅不利于对AAD患者的紧急救治,还会造成潜在的抢救风险[19]。因此,如何在急诊室床旁快速识别AAD是目前急诊科医师较为关注的问题。
ADDRS对急诊室中疑似AAD患者具有一定的预测价值。Zaschke等[20]的回顾性研究纳入了350例A型AAD患者,通过分析发现采用ADDRS可以减少为了明确诊断而造成的外科手术延误。然而,后续的一些研究发现,ADDRS对AAD的诊断具有一定的局限性。Nazerian等[21]的研究发现,1分以上的ADDRS诊断AAD的灵敏度高(85.7%),但特异度较低(32.7%)。在另外一项研究的139例患者中,超过75%的患者的ADDRS≥1分,主要是因为大部分患者存在严重的疼痛感,但这些患者并未出现主动脉夹层,而在非特异性胸痛患者中,由ADDRS评分结果驱动的D-D测试次数增加了280%,CT主动脉造影比率增加了2200%[22]。在AAD患病率较低的人群中,Ohle等[23]的研究发现,ADDRS≥1分时对AAD的敏感度为100%,但特异度仅为12.3%。由于存在上述局限性,有研究逐渐发现D-D联合ADDRS可以显著提高对AAD的诊断效能。一项多中心、前瞻性、观察性的研究纳入了2014—2016年4个国家6家医院1850例患者,其中,438例(24%)患者的ADDRS为0分,1071例(58%)患者的ADDRS为1分,341例(18%)患者的ADDRS超过1分,AAS患者共241例,D-D诊断AAS的灵敏度为96.7%,特异度为64%;294例ADDRS为0分同时D-D阴性的患者中,AAS患者1例。在924例ADDRS≤1分同时D-D阴性的患者中,AAS患者3例,提示D-D联合ADDRS可对AAD患者进行有效排除[24],与本研究结果基本一致。Gottlieb等[25]的Meta分析发现,ADDRS≥1分时,D-D对AAD诊断的失败率为0.05%;ADDRS≥2分时,D-D对AAD诊断的失败率为0.1%;ADDRS≥1分可单独在患病率较低的人群中筛查AAD;对于高危人群,D-D与ADDRS联合使用可能更有利于及时识别AAD患者。
本研究的不足之处:本研究为单中心、回顾性、小样本研究,病例的差异性导致临床研究存在病例选择偏倚;选择CT、磁共振成像等影像学检查结果作为诊断ADD的金标准,可能与实际手术结果仍然存在一定的差异。期待未来开展多中心的前瞻性研究,进一步观察ADDRS联合D-D对AAD的诊断效能。
综上所述,D-D联合ADDRS对于急性AAD具有较好的诊断效能,可在临床中适当推广并进一步深入研究。

