貉源细小病毒(RDPV)HeB17株的分离鉴定及基因组序列分析
王振军,罗国良,程悦宁,冯二凯,刘利芳,郭 利,于清平,朱先鹏,邓旭明,王建锋*
(1.吉林大学 动物医学学院,吉林 长春 130062;2.中国农业科学院 特产研究所,吉林 长春 130122;3.通化县农业综合行政执法大队,吉林 通化 134100;4.柳河县农业综合行政执法大队,吉林 柳河 135300)
近年,貉源细小病毒(RDPV)在我国主要貉养殖地区(东北三省、河北、山东)普遍流行,尤以夏季(6-7月份)仔貉分窝时最为严重,病貉主要表现 为严重的腹泻、脱水、消瘦等胃肠炎症状,严重者以死亡告终[1]。该病发病及死亡率均较高,对我国貉养殖业造成严重损失。因RDPV感染貉主要表现为肠炎症状,故称该病为RDPV性肠炎。
RDPV性肠炎是由RDPV引起的一种急性、烈性、高度接触性传染病。该病1982年由NEUVONEN等[2]首次报道犬细小病毒(CPV)感染貉,此后国外和我国黑龙江地区也偶见相关报道[3-4],起初普遍认为是CPV跨种传播感染貉[5-7],直到1988年由夏咸柱等[8]从病貉中分离出RDPV才确认RDPV在我国的流行。长期以来,国内外科研人员对RDPV性肠炎的报道及相关研究相对较少,但近年来,尤其2015年之后,RDPV性肠炎有区域性集中暴发的趋势,对我国貉养殖业造成严重损失,这引起了科研人员对RDPV的再次关注[9-10]。
RDPV为细小病毒科细小病毒属成员,是单链DNA病毒[11]。其基因结构与细小病毒属其他成员结构类似,与CPV、水貂细小病毒(MEV)、猫细小病毒(FPV)有较高的同源性,甚至与犬细小病毒灭活苗和水貂细小病毒灭活苗存在一定交叉保护[12]。本研究从疑似RDPV感染的貉肠道及其内容物中成功分离1株病毒,进一步对分离得到的病毒进行PCR鉴定、病毒分离培养及形态学观察、猪红细胞凝集试验、基于VP2基因建立的系统发生树分析、同源性分析、动物回归试验等方法的鉴定并对其VP2基因组进行了克隆测序分析[13-14],以期了解河北地区RDPV性肠炎的流行趋势,为进一步研发RDPV性肠炎疫苗及相关诊断试剂提供资源和参考。
1 材料与方法
1.1 主要试验材料病料样品取自河北某貉养殖场的发病貉,采集病貉的肠道及其内容物用于RDPV的分离、培养和鉴定。F81猫肾细胞购自上海细胞库,传代后保存于中国农业科学院特产研究所。
M.M培养基购自美国Gibco公司;胎牛血清由长春西诺生物科技有限公司提供;ExTaq DNA聚合酶、dNTP、pMD18-T载体均购自宝生物工程(大连)有限公司;DNA提取试剂盒、胶回收试剂盒、质粒提取试剂盒购自江苏康为世纪生物科技有限公司;DNA Marker购自北京全式金生物科技有限公司;其他化学试剂均为分析纯,购自国药化学试剂。
10只2~12月龄的健康试验貉,抗RDPV HI抗体效价≤1∶8,购自中国农业科学院特产研究所毛皮动物试验基地。
1.2 病料样品处理取肠道及内容物加入MEM充分研磨后制成10%的悬液,研磨过程中反复冻融3次,加入等体积氯仿混匀,静置30 min。经10 000 r/min 4℃离心30 min取上清,通过0.22 μm的滤膜过滤。加入每毫升1 000 U双抗4℃过夜,-70℃保存。
1.3 病料样品PCR鉴定取处理的病料悬液用DNA提取试剂盒提取其基因组,根据康洪涛等[15]设计RDPV检测引物进行PCR检测,PCR产物经琼脂糖凝胶电泳鉴定。
1.4 病毒分离、培养及形态学检验将处理好的病料样品按2%的比例同步接种于生长良好的F81细胞,设立正常细胞对照,置于37℃、5%CO2条件下培养并逐日观察细胞生长状态,当80%细胞出现CPE时收获接毒细胞,连续培养3~6代,保存在-70℃以下;取第6代病毒细胞培养物反复冻融数次后经4℃、10 000 r/min离心10 min,取上清液经0.5%磷钨酸负染后进行电镜观察病毒形态。
1.5 猪红细胞凝集试验取第1~6代病毒培养物进行猪红细胞凝集试验鉴定分离毒株的血凝特性。
1.6 病毒理化性质测定选取第6代病毒培养物,分别对其进行乙醚敏感性试验、耐酸性试验、耐热性试验同时设立对照组,以测定其理化性质。具体操作如下:取病毒液1.6 mL,加乙醚0.4 mL,振荡10 min,置于2~8℃冰箱24 h。次日去除水相并使乙醚完全挥发,测定乙醚处理前和处理后病毒含量变化,判定病毒对乙醚的敏感性;取病毒液2 mL,先用酸将其pH调至3.0,在37℃作用1 h后,再用碳酸氢钠将pH调至7.2,然后测定每毫升病毒含量的变化,判定病毒对酸的耐受性;取病毒液2 mL,56℃水浴1 h,测定每毫升病毒含量的变化,判定病毒对热的耐受性。
1.7 病毒核酸的提取及VP2基因的扩增通过DNA提取试剂盒提取病毒DNA,根据GenBank中已登录的RPDV序列,设计合成其VP2序列引物:RDPV-F:5′-GCCGGTGCAGGACAAGTA-3′;RDPV-R:5′-CAACCCACACCATAACAACA-3′。利用设计的引物扩增病毒的VP2序列,预计扩增产物长度为1 755 bp。
1.8 病毒VP2基因的遗传进化分析及同源性分析将扩增得到的VP2基因进行测序后获得病毒VP2基因序列,利用生物信息学软件DNAStar、Mega 5.0分析分离病毒以及GenBank中登录的其他参考株序列的同源性,构建分离病毒VP2基因及参考序列的遗传进化树并分析其遗传进化关系。
1.9 动物回归试验选取10只健康貉并对其进行分组,试验组5只,对照组5只。用第6代病毒细胞培养物对试验貉进行人工感染试验,接种途径为灌服,接种剂量为5 mL(HA效价210、含5×107TCID50),对照组接种相应体积的正常细胞培养物,隔离饲养,连续观察14 d,逐日对试验貉的精神、食欲、体温、粪便情况进行记录,同时采集试验貉的粪便样品进行猪红细胞凝集试验检测。
2 结果
2.1 病料样品PCR鉴定结果病料样品经RDPV检测引物PCR鉴定后,结果显示,扩增出长度近573 bp的特异性条带,与预期的目的片段长度一致(图1)。结果表明,该病料样品中含有RDPV。
2.2 病毒分离、培养及形态学观察结果将处理的病料按照2%的比例同步接种于生长良好的F81细胞,连续盲传3代,传至第3代72 h后,细胞出现脱落、拉网、聚集等明显的CPE,而对照组细胞生长状态正常,未见异常变化(图2)。继续传至第6代后对其进行标记并保存在-70℃以下;对病毒进行负染后在电镜下观察,可见直径约25 nm的球状、无囊膜、无纤突的病毒样粒子,这与细小病毒粒子的大小相符(图3)。结果表明,分离到的病毒株为细小病毒。
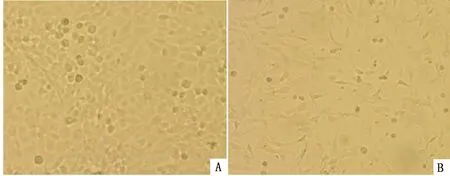
A.正常F81细胞;B.病料样品接种F81细胞后72 h出现的CPE
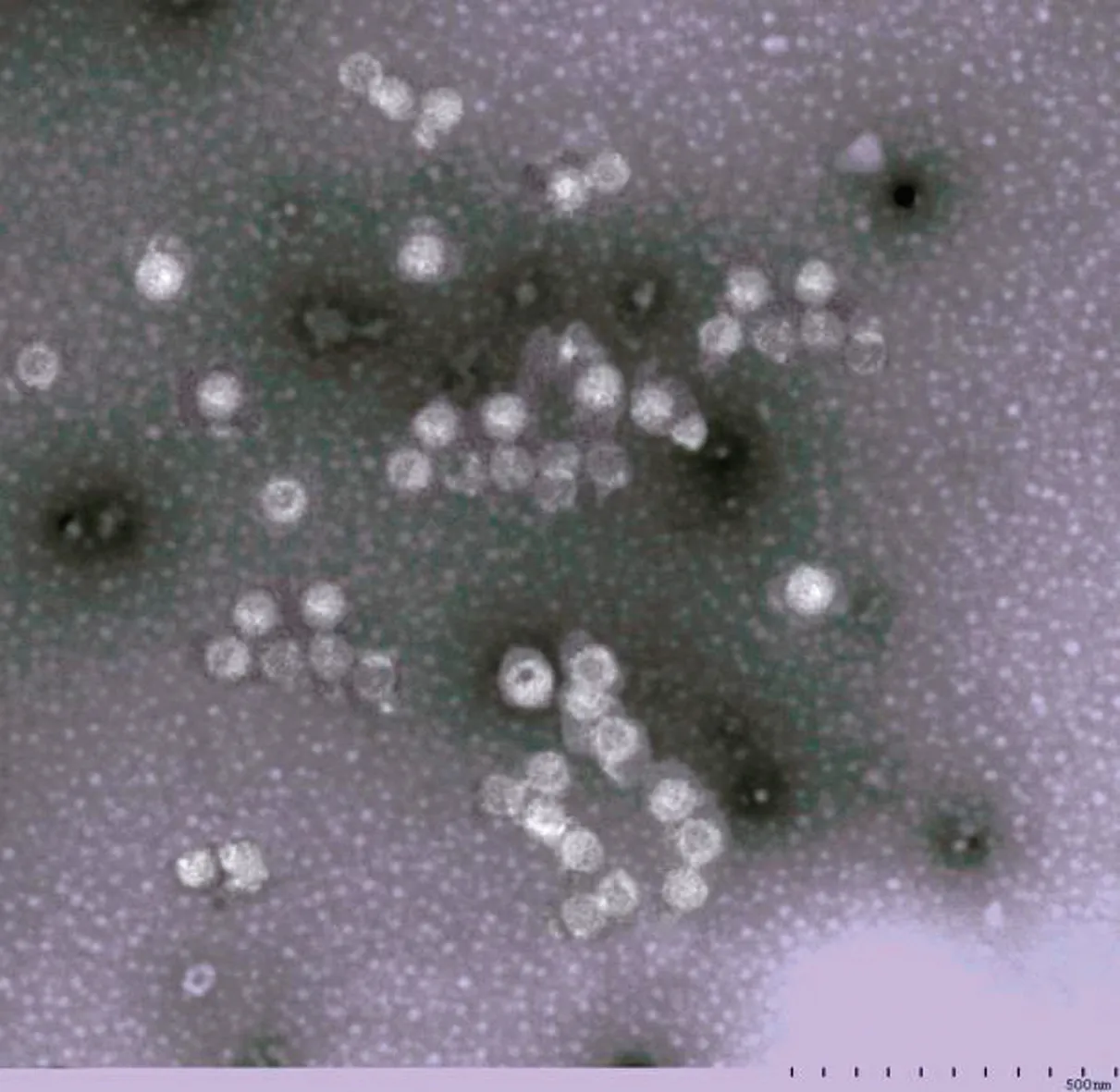
图3 电镜下的病毒粒子(40 000×)
2.4 猪红细胞凝集试验结果以第1~6代病毒的细胞培养物进行血凝-血凝抑制试验,结果显示,第1~6代病毒的血凝价分别为1∶512,1∶512,1∶1 024,1∶1 024,1∶1 024和1∶1 024(图4)。结果表明,所分离的细小病毒具有猪红细胞凝集特性。

1~6.第1~6代病毒的细胞培养物;7~8.正常细胞对照
2.5 病毒理化性质测定结果第6代毒种培养物经乙醚处理、酸处理和56℃高温处理后,试验组和对照组病毒效价无明显差异(表3)。结果表明,分离的病毒能耐受乙醚、酸和热处理。

表1 病毒培养物理化特性试验结果 TCID50/mL
2.6 病毒分子生物学鉴定、序列分析及同源性比对结果分离株VP2基因PCR扩增结果(图5),显示,在1 755 bp处有目的条带,片段大小符合预期,进一步证实分离株为RDPV。分离株VP2序列测序后与GenBank中具有代表性的CPV、FPV、MEV以及RDPV等20余株病毒的VP2基因进行对比并建立进化树(图6),结果显示,分离株VP2基因序列与CPV-b2毒株VP2序列相似度较高,位于同一分支上,表明分离株VP2序列与CPV-b2毒株亲缘关系最近;CPV-b2毒株VP2基因序列与RDPV-HLJ11-1、RDPV-LN-10-1、RDPV-HeB-10-1、Abashiri/MEV以及CU-4/FPV毒株VP2基因序列相似性均较高,位于同一分支且在这些序列的上游,表明以上参考株在遗传关系上较近,提示RDPV、MEV、FPV均与CPV-b2有关,但是否是由CPV适应不同宿主后形成的新类型仍需更多数据的证实。
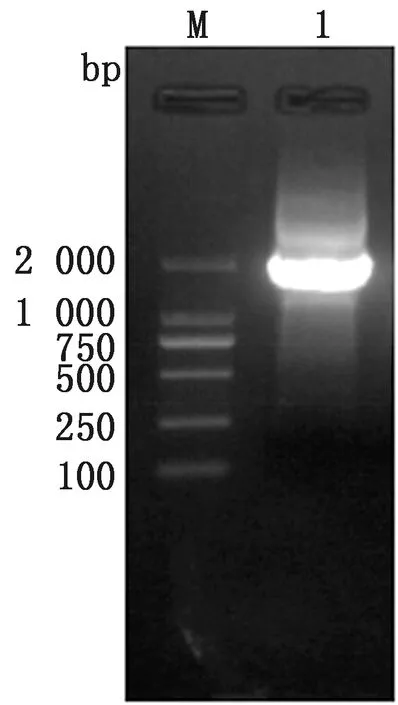
M.DL2000 Marker;1.VP2基因扩增结果

图6 RDPV-HeB17分离株VP2基因序列进化树
与参考毒株VP2序列进行同源性比对,结果显示,其同源性在98.4%~99.5%之间,其中与CU-4-FPV株同源性最低为98.4%,与CPV-b-2株同源性最高为99.5%。此外,本研究中的分离株与国内参考序列对比发现其同源性要高于国外序列参考株,由此可推测,该分离株在我国可能有相同的起源。
2.7 动物回归试验结果对健康试验貉分组后进行人工感染试验,结果显示,4只试验组貉分别在攻毒后第5和6天开始出现精神不振、食欲减退、腹泻、便血等严重的肠炎临床症状,但是体温并无显著升高;随着病情发展出现食欲废绝、消瘦脱水、个别病情严重的病貉出现死亡;采集粪便样品处理后进行红细胞凝集试验,结果显示对猪红细胞血凝(HA)效价均>1∶128(表2)。对死亡试验貉剖检可见典型的肠炎症状:胃表面苍白,胃黏膜发红,肠系膜淋巴结肿大,肠黏膜出血,肠内有血样内容物,肝脾肿大(图7),对照组试验貉无任何临床症状。以上结果表明,所分离病毒可对试验貉造成再次感染,动物回归试验成立。将所分离病毒株命名为RDPV-HeB17。

表2 动物回归试验结果(第9天)

图7 攻毒后照片(粪便、脏器病变)
3 讨论
RDPV自20世纪80年代分离鉴定以来一直鲜有报道。但随着我国貉养殖数量不断增加,地区间频繁引种以及貉养殖环境治理欠佳,RDPV近年时有暴发,多位科研人员对该病均有报道,使貉养殖业遭受严重的经济损失。针对RDPV,目前尚无有效疫苗产品问世,加强RDPV流行病学及致病机制的研究及其疫苗的研发投入对RDPV的防控至关重要。
本研究对所分离RDPV进行PCR鉴定、病毒分离培养及形态学观察、猪红细胞凝集试验、基于其VP2基因建立系统发生树、同源性分析,并以CPV、FPV、MEV以及RDPV进行参考,结果显示所分离RDPV-HeB17与RDPV-HLJ、RDPV-LN亲缘关系较近,调查这些毒株的来源可知,这些毒株的地缘关系也非常近(分别位于河北、黑龙江、辽宁),根据对以上地区貉养殖场的走访得知,这些地区之间存在频繁的引种,这或许对该病的流行起到了促进作用。进化分析还显示该分离株与CPV、猫泛白细胞减少症病毒(FPV)、水貂肠炎病毒(MEV)也处于同一分支,且CPV处于分支的上游,说明CPV、FPV、MEV、RDPV这些肉食兽细小病毒亲缘关系较近,这也再次验证了RDPV极有可能是由CPV变异而来,但使用CPV疫苗免疫貉又不能使貉获得完全保护,也证实了通过长时间的自然选择和环境压力,已经逐渐形成了一个新的适应在貉体内增长繁殖的细小病毒。
分离株VP2基因与参考毒株VP2基因序列同源性比对结果显示,与CU-4-FPV株同源性最低为98.4%,与CPV-b-2株同源性最高为99.5%。氨基酸对比结果显示,分离株VP2蛋白序列与RDPV-HeB10-1、RDPV-LN10-1、RDPV-HLJ11-1相比有3处突变,第27位氨基酸残基由丝氨酸(S)突变为苏氨酸(T),第297位氨基酸残基由丝氨酸(S)突变为丙氨酸(A),第562位氨基酸残基由缬氨酸(V)突变为亮氨酸(L)。有报道表明第562位氨基酸突变对RDPV宿主范围有一定程度影响[10],但第27位、第297位氨基酸突变对病毒的影响还不清楚,有待进一步研究。
本研究从发病貉肠道及内容物中成功分离到1株病毒,并对其进行了一系列鉴定,证实该分离株为RDPV,命名为RDPV-HeB17。该毒株的分离对RDPV的进一步研究奠定了基础,也为其疫苗的研制提供了材料。

