鸡源大肠杆菌ΔcpxR的构建及生物学特性研究
刘志欢,宋雪艳,谢翠萍,陶梦珂,张鲁星,李苗苗,刘建华
(河南农业大学 动物医学院,河南 郑州 450000)
禽致病性大肠杆菌可引起禽的多种大肠杆菌疾病,如气囊炎、心包炎、败血症,给养禽业带来巨大损失,又因为其与引起新生儿脑膜炎的大肠杆菌和引起尿道致病性的大肠杆菌基因具有高度同源性,开展相关研究具有较强的公共卫生意义[1-2]。大肠杆菌的血清型众多,疫苗交叉保护性较差,需要药物预防和治疗,但是在不合理使用抗生素的情况下,极易导致大肠杆菌产生耐药性。
细菌内部存在着许多复杂的调控网络来应对周围环境的变化,以适应生存。双组分调控系统是组氨酸激酶活性的膜定位传感器和细胞质反应调节器组成的表达调节系统,已经发现具有调控细菌耐药性的有CpxAR、PhoPQ和BaeSR等[3-4]。CpxAR是典型的双组分调控系统,部分细菌还具有附属调节蛋白cpxP,组氨酸蛋白激酶cpxA通过感受外界变化使自身磷酸化,再将信号传导给反应调节蛋白cpxP[5],从而使细菌适应外界环境。最早认为该系统作用于细菌膜结构蛋白,后来又有研究发现,感知细菌膜表面的压力信号,调控菌毛和分泌系统,有助于细菌快速适应环境,进而调控细菌的生存机制[6]。
本实验室在大肠杆菌标准菌株中,成功构建了cpxR基因缺失株,在此基础上,本研究通过Red同源重组技术,构建临床鸡源大肠杆菌E41 cpxR基因缺失株和回补株,比较与其野生株E41的部分生物学差异,从而为更好地研究双组分系统在临床耐药菌株中的作用提供实验依据。
1 材料与方法
1.1 菌株和质粒
鸡源大肠杆菌E41由本实验室分离鉴定,并进行全基因组测序(Genebank ID:CP069707.1);大肠杆菌DH5α感受态细胞购自南京诺唯赞生物科技股份有限公司;pKD4是具有FRT位点的卡那霉素抗性基因的辅助性质粒、pKD46经L-阿拉伯糖诱导后能表达同源重组酶、pCP20用于消除FRT位点的卡那霉素抗性基因、pBAD/HisA用于构建回补株中的过表达载体,具有氨苄青霉素抗性,以上质粒由本实验室保存。
1.2 主要试剂与仪器
质粒小量提取试剂盒购自美国OMEGA试剂公司;PrimeSTAR Max Premix、限制性核酸内切酶购自宝生物工程(大连)有限公司;T4 DNA Ligase购自南京诺唯赞生物科技股份有限公司;氨苄青霉素、卡那霉素、L-阿拉伯糖购自北京索莱宝科技有限公司;PCR仪购自苏州东胜兴业科学仪器有限公司;电转化仪和电泳仪购自Bio-Rad公司;凝胶成像系统购自英国Syngene公司。
1.3 引物设计
根据E41中cpxR基因及其上下游序列设计相关引物。P1、P2作为打靶片段引物,5′末端的部分序列与cpxR两侧序列同源,3′末端部分序列与pKD4中kanr基因两侧序列互补;P3、P4为缺失鉴定引物;P5、P6为检测重组子菌株插入的kanr基因;另外,组合引物P3和P5验证kanr基因插入位点上游片段,约1700 bp;组合引物P4和P6验证kanr基因的插入位点下游片段,约1300 bp;P7、P8扩增cpxR的全基因长片段;P9、P10是带有双酶切位点的完整开放阅读框。

表1 本研究所用引物
1.4 cpxR基因缺失株构建
参考Red同源重组方法[8],将pKD46质粒以电转的方式转入到E41感受态细胞中,得到E41-pKD46。以pKD4质粒为模板,引物P1、P2扩增,胶回收得到cpxR基因的打靶片段。将打靶片段电转到E41-pKD46感受态细胞中,过夜培养挑取阳性克隆子ΔcpxR:kan。然后将pCP20质粒电转到阳性克隆子中,扩增培养后,用缺失鉴定引物鉴定克隆子,并送测序。阳性克隆子鉴定并命名为ΔcpxR。
1.5 cpxR基因回补株构建
以E41的DNA为模板,引物P7、P8扩增cpxR的全基因长片段。再以PCR产物为模板,用P9、P10引物扩增含有Sac I和Hind III双酶切位点的cpxR完整开放阅读框。对PCR产物和pBAD/HisA质粒分别进行双酶切。胶回收酶切产物,然后用T4 DNA Ligase 4 ℃过夜连接。连接产物用化学转化的方法转入到DH5α感受态细胞中,提取重组子质粒双酶切验证。将阳性克隆子电转到ΔcpxR感受态细胞中,即得到回补菌株CΔcpxR。
1.6 生长曲线和运动能力测定
分别挑取E41、ΔcpxR、CΔcpxR单菌落培养至D600=0.6,以1∶100的比例转接到肉汤中,37 ℃,200 r/min条件下振荡培养,每隔1 h测定D600值。待D600=1.0左右时,各取5 μL菌液垂直滴加在含有0.5%琼脂的半固体LB平板上,37 ℃培养12 h后,测量菌圈直径。
1.7 生物被膜形成能力测定
将新鲜菌液稀释至D600=0.1[9],取200 μL加入到96孔培养板中,28 ℃培养48 h。小心弃去培养基,用PBS轻洗3次后加入200 μL的结晶紫溶液染色20 min。弃去结晶紫溶液,用去离子水清洗3遍,然后用95%乙醇充分溶解,在酶标仪上测定D580的值。
1.8 缺失株稳定性测定
挑取缺失株ΔcpxR单菌落于LB肉汤中[10],每隔5 d传一次代,一直持续15 d。将每次传代的菌液提取DNA,用缺失鉴定引物P3、P4扩增后,电泳检测缺失株ΔcpxR稳定性。
1.9 各菌株MIC的测定
根据微量肉汤稀释法[11]测定12种常用抗菌药物对E41、ΔcpxR、CΔcpxR的最小抑菌浓度。以大肠杆菌ATCC25922为质控菌株,每个平行重复3次。在37 ℃ 培养箱中培养 16 h,观察结果,读取最小抑菌浓度。
2 结果与分析
2.1 缺失株ΔcpxR的鉴定
分别用缺失鉴定引物P3和P4、P5和P6,组合引物P3和P5、P4和P6进行PCR扩增验证,均出现预期大小的目的条带(图1),将得到的重组子标记为ΔcpxR:kanr,再以ΔcpxR:kanr、ΔcpxR的DNA为模板,缺失鉴定引物P3、P4扩增cpxR基因,得到符合大小的目的条带(图2),表明成功构建出缺失株ΔcpxR。

图1 菌株ΔcpxR:kanr的PCR鉴定结果

图2 菌株ΔcpxR和临床野生株E41的PCR鉴定结果
2.2 回补株CΔcpxR的鉴定
将cpxR的完全开放阅读框连接到pBAD/HisA载体并通过化学转化的方式转入DH5α感受态细胞中,提取重组子质粒,进行双酶切验证,证实得到cpxR-pBAD/HisA重组质粒(图3)。将阳性克隆子电转到ΔcpxR感受态细胞中,即得到回补菌株CΔcpxR。

图3 cpxR重组质粒的双酶切鉴定
2.3 生长曲线和运动性测定
E41、ΔcpxR、CΔcpxR在37 ℃、200 r/min的情况下震荡培养,每隔1 h测D600的值,绘制成图4。用游标卡尺测量各菌株在半固体LB琼脂上的菌圈直径,绘制成图5。上述结果显示,cpxR基因缺失不影响E41的生长速度和运动能力。

图4 各菌株生长曲线

图5 各菌株的运动距离
2.4 生物被膜形成能力
在最适温度28 ℃中培养48 h后,用酶标仪检测D580处的吸光度。根据测定结果绘制成图6。结果显示,cpxR基因缺失对其生物被膜的形成能力影响不显著。

图6 生物被膜形成能力测定
2.5 缺失株稳定性
利用缺失鉴定引物扩增传代缺失株,不同时间传代菌株均可扩增出目的条带,未发生异常突变,表明缺失株具有良好的传代稳定性。
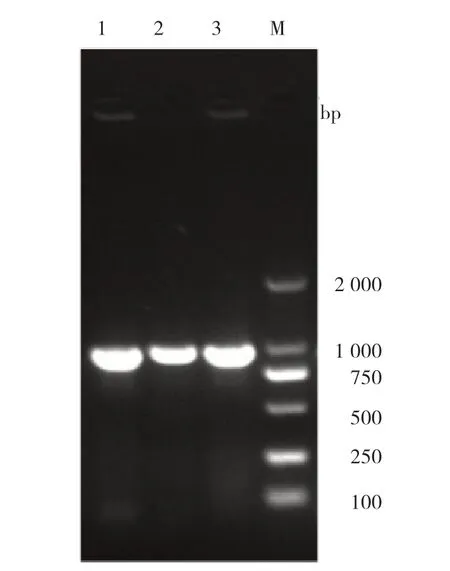
图7 缺失株稳定性测定
2.6 cpxR基因对药物敏感性的影响
根据欧盟药敏试验标准判定实验结果,结果显示,与E41相比,缺失株ΔcpxR对链霉素和多西环素的MIC值提高2倍,对氟苯尼考的MIC降低至原来的1/2。回补株CΔcpxR对多西环素和氟苯尼考恢复至E41一致水平。以上结果表明,cpxR基因参与了细菌对以上药物敏感性的调控。

表2 各菌株对抗生素的MIC测定结果 μg/mL
3 讨论
鸡源大肠杆菌主要引起家禽呼吸系统和消化系统疾病,也会与其他病原菌共同作用,造成家禽混合感染,给养殖业带来巨大损失。人们发现了许多调控系统参与了感染过程,如双组分调控系统、群体感性系统以及外排泵系统等。其中,双组分调控系统可以感应外界环境变化,通过激酶和响应调节器传导相关信号,调节细菌生理代谢、应激反应和致病性等[12],有利于细菌生存。作为典型的双组分调控系统,CpxAR双组分调控系统可以调控革兰氏阴性杆菌的细胞膜抗逆性、细胞壁完整性、细菌耐药性及调控毒力基因[13-15]。本研究利用Red同源重组技术构建cpxR基因缺失株和cpxR回补株,探究cpxR基因对禽源大肠杆菌的生物学特性和耐药性的影响。
本研究发现,cpxR基因的缺失不影响鸡源大肠杆菌的生长速度、运动能力以及生物被膜形成能力。冯芬芬[16]发现cpxR基因的缺失不影响副猪嗜血杆菌的生长速度和生物被膜形成能力,另外,吴同垒等[17]发现缺失cpxR基因不影响沙门菌的生长速度。Matter等[18]在研究中指出,高水平的磷酸化cpxR可能抑制鞭毛和运动基因的转录,当cpxR基因缺失时,这种抑制作用就得不到表达,导致缺失株和回补株在运动能力、生物被膜形成能力上无明显差异,本研究的结果与以上结果基本一致。
cpxR基因可以影响细菌对某些药物的敏感性,例如当沙门菌缺失cpxR基因后,对氨基糖苷类和β-内酰胺类药物的敏感性升高[19]。在本次研究中发现了类似的现象,cpxR基因缺失后,对链霉素敏感性发生了变化。Masi等[20]认为CpxAR双组分系统调控的外膜蛋白受到了影响,因此氨基糖苷类药物链霉素的敏感性发生了变化。Kurabayashi等[21]研究发现cpxR基因参与了细菌对磷霉素的调控,认为缺乏磷酸酶活性的cpxA突变体会激活cpxR导致磷霉素耐药,对多西环素和氟苯尼考敏感性的机制还需进一步探究。
通过对野生株E41、缺失株ΔcpxR、回补株CΔcpxR的比较,发现cpxR基因的缺失不影响野生株E41的生物学特性,但是影响了对抗生素的敏感性。本研究成功构建了鸡源大肠杆菌cpxR基因缺失株,为接下来在临床野生株中构建其他基因缺失株提供参考,也为后续研究cpxR基因功能提供了工程菌株。
——一道江苏高考题的奥秘解读和拓展

