MTHFR基因多态性与儿童原发性高血压的相关性研究
王慧 刘岩岩 张裕 陈晓丽 石琳,
(1.北京协和医学院/中国医学科学院/首都儿科研究所,北京 100020;2.首都儿科研究所附属儿童医院心血管内科,北京 100020;3.首都儿科研究所遗传研究室,北京 100020)
近年来儿童原发性高血压的发病率不断增加[1],已成为重要的公共卫生问题,除肥胖、压力及不良生活方式等影响因素外,遗传易感性同样不容忽视。研究表明,亚甲基四氢叶酸还原酶(methylenetetrahydrofolate reductase,MTHFR)基因多态性与高血压的发生密切相关[2-3],且存在显著的地区和种族分布差异[4],然而目前针对MTHFR基因的研究多集中于成年高血压患者,C677T 是MTHFR基因最常见的突变位点,该位点多态性在中国儿童高血压患者中的分布尚不明确。基于此,本研究通过分析我院原发性高血压儿童MTHFR基因C677T多态性分布特征,比较不同基因型组高血压儿童的临床资料,探讨基因多态性与儿童H 型高血压的相关性,为日后儿童高血压的精准治疗提供依据和指导。
1 资料与方法
1.1 研究对象
选取2021 年1~7 月在首都儿科研究所附属儿童医院心血管内科住院且初次诊断未经治疗的原发性高血压患儿为研究对象。入选标准:(1)年龄:10~18 岁;(2)籍贯为北京且常居籍贯所在地;(3)汉族;(4)高血压诊断依据《中国高血压防治指南(2018 年修订版)》[5]:连续3 个时间点的收缩压和/或舒张压均大于或等于同年龄、性别和身高儿童血压的第95 百分位数。排除标准:(1)患继发性高血压者;(2)合并严重心血管、肝肾功能、恶性肿瘤及内分泌异常疾病者;(3)近期使用过叶酸或维生素B12者。
该研究已通过首都儿科研究所附属儿童医院伦理委员会批准(SHERLL2019003),受试对象监护人及受试者对相关检查知情同意并签署知情同意书。
1.2 临床资料采集
回顾性收集患儿年龄、性别、体重指数(body mass index,BMI)、家族史及血压水平等一般资料,以及血清同型半胱氨酸(homocysteine,Hcy)、叶酸、维生素B12水平等实验室指标。并对靶器官损伤情况进行评估[6],包括超声心动图、心电图、肾功能及眼底检查等。
1.3 血清Hcy水平检测
患儿至少空腹10 h,用不含抗凝剂的真空采血管抽取外周静脉血4 mL,经3000 r/min离心15 min(离心机半径10 cm),分离上层血清用酶循环法检测血清Hcy浓度,按照说明书进行操作,Hcy检测试剂盒购自美国西门子医学诊断股份有限公司。
1.4 基因多态性检测
用EDTA抗凝管采集患儿外周静脉血2 mL,采用聚合酶链式反应-限制性片段长度多态性方法按照T5 Direct PCR Kit(Blood)(北京擎科生物科技有限公司)说明书操作提取基因组DNA 并配制PCR 扩增体系,用ABI3730xl 测序仪(美国Applied Biosystems公司)进行Sanger测序,测序结果由Mutation Surveyor V5.1.2 软件分析和判读,确定MTHFRC677T位点基因型。
1.5 H型高血压诊断标准及分组
鉴于高同型半胱氨酸血症与高血压在脑卒中风险中的显著协同作用,我国H 型高血压定义为伴有血清Hcy≥10 μmol/L 的高血压[7],但高同型半胱氨酸血症的判定尚存在争议,儿童中亦无明确定义。本研究采用的Hcy检测试剂盒的正常范围为3.7~13.9 μmol/L,因此将伴血清Hcy>13.9 μmol/L的原发性高血压患儿分为H 型高血压组,其余分为单纯高血压组。
1.6 统计学分析
采用SPSS 25.0 软件对数据进行统计学分析。符合正态分布的计量资料用均数±标准差(±s)表示,两组间比较采用两样本t检验,多组间比较采用ANOVA 分析;非正态分布的计量资料以中位数(四分位数间距)[M(P25,P75)]表示,两组间比较采用Wilcoxon 秩和检验,多组间比较采用Kruskal-WallisH检验,事后成对比较采用Bonferroni法校正显著性水平。计数资料以例数和率(%)表示,率的比较采用χ2检验。采用单因素和多因素logistic 回归分析计算优势比(odds rations,OR)和95%置信区间(confidence interval,CI),以评估基因多态性与H 型高血压的关联性。样本代表性采用Hardy-Weinberg平衡检验。P<0.05为差异有统计学意义。
2 结果
2.1 Hardy-Weinberg平衡检验
研究期间共收治高血压患儿179 例,其中2 例为继发性高血压,5 例年龄小于10 岁,47 例非北京籍贯,4 例拒绝参加研究,因此共纳入121 例原发性高血压患儿,其中男性95 例(78.5%),女性26 例(21.5%), 平 均 年 龄(13.5±1.5) 岁,MTHFR基因C677T位点多态性符合Hardy-Weinberg平衡(χ2=0.578,P=0.749),表明该研究样本人群具有较好的群体代表性。
2.2 基因分布特征
121 例原发性高血压儿童MTHFR基因C677T位点CC、CT 和TT 基因型频率分别为15.70%(19例),42.15%(51例)和42.15%(51例),C、T等位基因频率分别为36.78%和63.22%,T 等位基因突变频率高于北京地区健康成年人群[8]和中国汉族成年人群[9](P<0.001)。见表1。
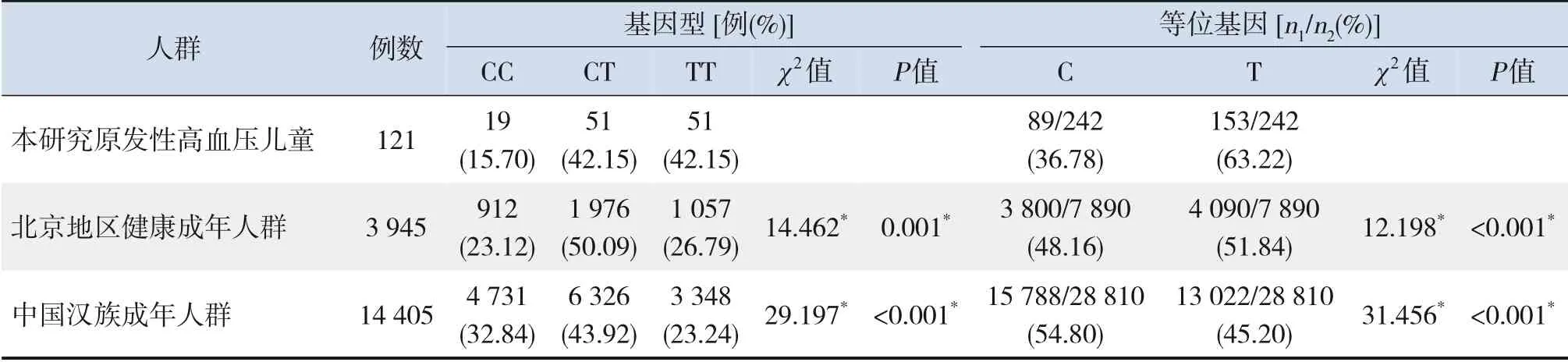
表1 原发性高血压儿童与成年人群MTHFR基因C677T位点多态性分布比较
2.3 不同基因多态性原发性高血压患儿的临床特征分析
CC 型组、CT 型组、TT 型组患儿间性别、年龄、BMI、收缩压及舒张压水平比较差异均无统计学意义(P>0.05),但血清Hcy 水平差异有统计学意义(P<0.001)。经组间两两比较发现,TT 型组患儿血清Hcy 水平高于CC 和CT 型组(P<0.001),但CT型组和CC型组血清Hcy水平比较差异无统计学意义(P>0.05)。见表2。
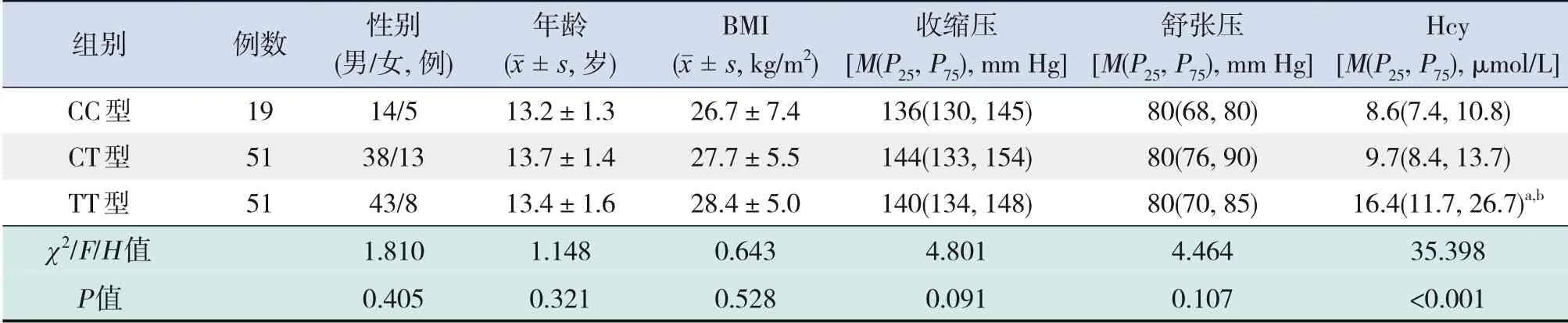
表2 不同基因型组原发性高血压儿童临床资料比较
2.4 H型高血压与单纯高血压患儿临床特征比较
H 型高血压组年龄大于单纯高血压组,血清Hcy 水平高于单纯高血压组(P<0.05);2 组间MTHFR基因C677T 多态性分布差异有统计学意义(P<0.001)。2 组间靶器官损伤发生率差异无统计学意义(P>0.05),但H型高血压组有12例为单脏器损害(心脏损伤2例,肾脏损伤9例,眼底损伤1 例),有5 例同时存在2 个脏器损害(心脏+肾脏损伤3 例,心脏+眼底损伤1 例,肾脏+眼底损伤1例),而单纯高血压组17例均为单脏器损害(心脏损伤7 例,肾脏损伤8 例,眼底损伤2 例)。见表3。
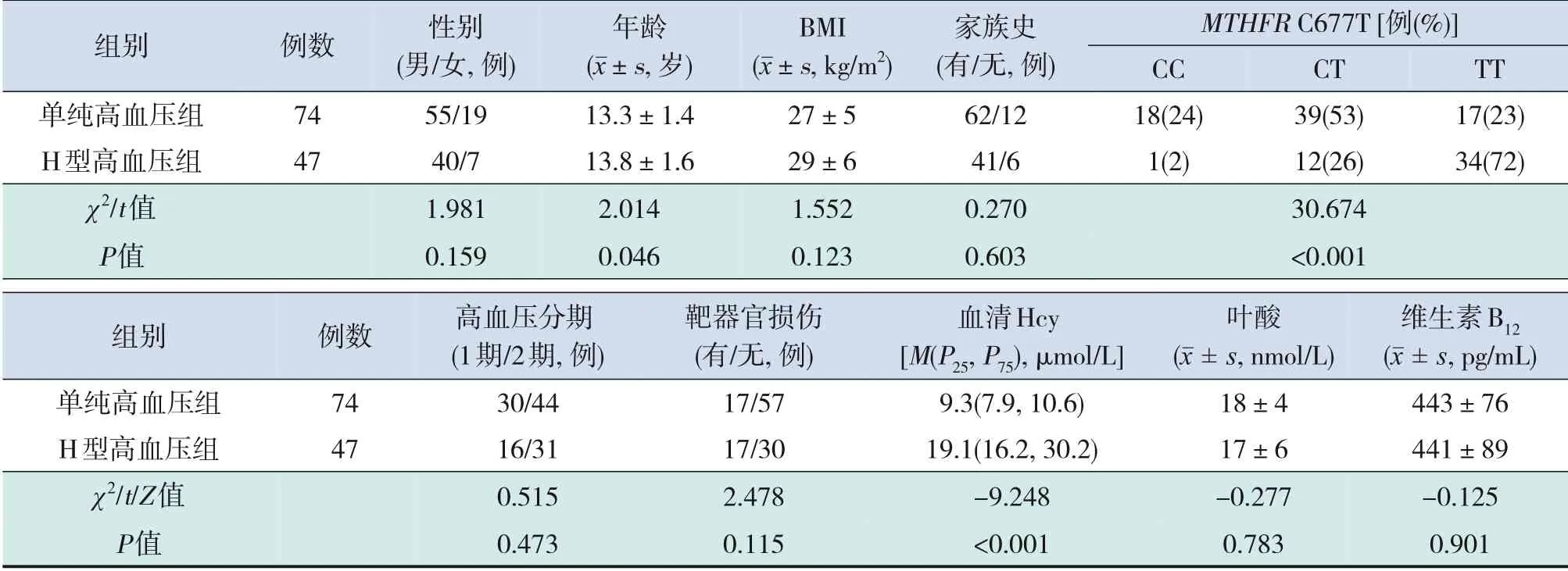
表3 H型高血压组与单纯高血压组儿童临床资料比较
2.5 基因多态性与H型高血压相关性
以是否发生H型高血压为因变量(是=1,否=0),纳入年龄、性别、BMI、家族史和基因型进行多因素logistic 回归分析。在调整了年龄、性别、BMI、家族史后,结果提示TT 型与H 型高血压发生存在相关性(OR=12.71,95%CI:4.81~33.53,P<0.001)。见表4。
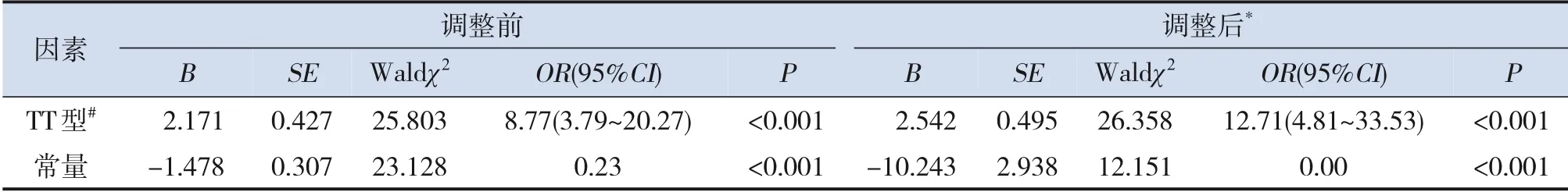
表4 基因多态性与H型高血压关联的logistic回归分析
3 讨论
对于个体而言,基因多态性碱基顺序终生不变,因此开展基因检测,按照基因多态性提供针对性治疗,将会更符合精准诊疗的要求。MTHFR是调节叶酸代谢的关键酶,主要将四氢叶酸还原为5-甲基四氢叶酸,参与体内DNA 合成和甲基化反应[10]。目前成人MTHFR基因多态性的研究对象多为育龄期妇女或脑卒中病人,而儿童该基因位点的相关研究多集中在孤独症谱系障碍、急性淋巴细胞白血病和支气管哮喘等,目前少有儿童高血压相关的研究报道。
MTHFR基因位于1 号染色体短臂末端(1p36.3),由11 个外显子和10 个内含子组成,C677T 是MTHFR基因最常见的突变位点,其4 号外显子第677 位的碱基胞嘧啶被替换为胸腺嘧啶,导致丙氨酸被缬氨酸替代而影响酶活性[11],在中国人群中该位点T 等位基因的突变频率高达45%[12],显著高于其他国家,而本研究发现原发性高血压儿童T 等位基因突变频率高达63.2%,说明原发性高血压儿童多存在不同程度的MTHFR基因缺陷和酶活性降低。同时我们发现原发性高血压儿童T等位基因突变频率明显高于北京地区健康成年人群和中国汉族成年人群,提示儿童高血压的高发病率可能和MTHFR基因C677T 多态性具有一定相关性。而进一步比较不同基因型原发性高血压患儿的临床资料可以发现,TT 型组血清Hcy水平显著高于CT型组和CC型组,说明原发性高血压儿童的血清Hcy 水平与MTHFR基因C677T 位点T等位基因具有一定关联,由于等位基因C突变为T,降低了MTHFR酶活性,使得Hcy再甲基化途径受阻,继而导致血清Hcy水平升高,这与目前国内外相关研究[13-14]结果基本一致。综合上述结果,我们考虑MTHFR基因多态性导致高血压发生的机制可能主要与高同型半胱氨酸血症相关,高同型半胱氨酸血症可通过氧化应激损伤血管内皮细胞、降低一氧化氮生物利用度导致内皮功能紊乱、增加血管紧张素转换酶活性及降低血管弹性等[15-16]多种机制引起血压升高;此外,高同型半胱氨酸血症还可导致DNA低甲基化,间接激活肾素-血管紧张素-醛固酮系统,参与高血压的发生发展[17-18]。
我国高血压患者中约75%伴有高同型半胱氨酸血症,而高血压与高同型半胱氨酸血症在导致心脑血管事件上存在显著协同作用,因此寻找合适的预警因素对H 型高血压的早期预防及改善预后具有重要的临床意义。向海卿等[19]研究发现,MTHFR基因C677T TT 型是连南瑶族自治县人群H型高血压发生的危险因素;Tang等[20]研究也认为MTHFR基因C677T TT型可能是H型高血压的重要遗传因素。而Huang 等[21]研究则认为广西壮族H型高血压发生风险与MTHFR基因C677T 多态性无关。本研究结果显示,H型高血压组与单纯高血压组MTHFR基因C677T 多态性分布具有显著差异,H 型高血压患儿多数为TT 型,而单纯高血压患儿以CT型为主,TT型儿童发生H型高血压的风险是CC/CT 型儿童的12.71 倍,提示MTHFR基因C677T TT型可能是儿童H型高血压发生的独立危险因素。
儿童原发性高血压症状多隐匿,但亚临床靶器官损伤并不少见,是儿童高血压预后评估的要点。成人高血压的不良预后多为心肌梗死、脑卒中等,而儿童期多以心血管、肾脏、眼底等靶器官早期损伤为主。本研究中有34 例患儿在初次就诊时即已出现靶器官损伤,尽管2组患儿的靶器官损伤发生率未见明显差异,但H 型高血压患儿中有5例同时存在2个脏器受累,提示H型高血压儿童可能早期即存在更高程度的靶器官损伤,结合2组患儿血压水平并无明显差异,考虑这可能与高同型半胱氨酸血症的协同作用有关。本课题组既往研究也表明H型高血压患儿血Hcy水平与血压变异性呈正相关[22],而血压变异性与原发性高血压儿童的心室肥厚和肾脏早期损伤有密切关系[6]。因此临床工作中对高血压儿童应重视血清Hcy 和MTHFR基因C677T 多态性的检测,H 型高血压患儿在控制血压的同时应积极降低血清Hcy水平,有望改善靶器官损伤程度,防止心脑血管恶性事件的发生。然而本研究样本量相对较少,不能代表儿童原发性高血压群体,今后需扩大样本量开展多中心研究以进一步探索基因多态性在儿童高血压诊疗中的价值。
综上所述,原发性高血压儿童MTHFR基因C677T 位点分布有自身特点,T 等位基因突变率高且与血清Hcy 水平具有一定关联,TT 基因型是儿童H 型高血压的独立危险因素,与早期靶器官损伤严重程度可能相关。因此临床诊疗中应对高血压儿童进行MTHFR基因检测,筛选叶酸代谢能力异常的高危人群,根据遗传特点提供针对性治疗,对儿童H 型高血压的早期预防和预后改善具有重要意义。

