鸢尾黄素衍生物的制备及抗其病毒活性研究
陈帅 袁崇均,* 罗森 张磊 汤依娜 袁明铭 竹敏 王笳
(1 四川省中医药科学院,成都 610041;2 成都中医药大学附属生殖妇幼医院,成都 610041)
川射干为鸢尾科植物鸢尾(Iris tectorumMaxim.)的干燥根茎,具有清热解毒、祛痰、利咽之功效,用于热毒痰火郁结证,如咽喉肿痛、痰浊壅盛、咳嗽气喘者[1],其主要药效成分为异黄酮类物质[2-3],而鸢尾黄素就是其中的主要有效成分。鸢尾黄素又名射干苷元,5,7,4'-三羟基-6-甲氧基异黄酮,现代研究表明鸢尾黄素具有C6-C3-C6母核结构,也有α、β核不饱和吡喃酮以及C7-OH、C4'-OH等活性中心存在,具有清除自由基、抗脂质过氧化损伤和降低血糖,防止动脉粥样硬化以及防止血管内皮细胞损伤作用,亦有对心肌梗死小鼠心脏有保护作用,还有抗炎、抗菌、抗肿瘤、抗病毒、雌激素类作用 等[4-7]。由于鸢尾黄素水溶性和脂溶性较差,肠道吸收较少和C-5、C-7位羟基在体内易被糖基化的原因,使活性显著降低,因此对鸢尾黄素进行结构修饰,对于获得高效、低毒的新型抗病毒候选药物具有重要意义。
本研究基于鸢尾黄素的抗病毒作用,以鸢尾黄素为先导化合物[8],采用甲氧基或者乙氧基取代C-7位的羟基,采用磺酸基取代了C-5'的氢,得到3个鸢尾黄素衍生物,分别为鸢尾黄素-5'-磺酸钠、4',7-二乙基鸢尾黄素、4',7-二乙基鸢尾黄素-5'-磺酸钠,显著的改善了化合物的水溶性或脂溶性。本合成工艺操作简单、收率高、适用于工业化大生产,路线见图1。并采用细胞培养法[9]实验,考察其衍生物的抗流感病毒[10]、腺病毒[11]、呼吸道合胞病毒[12]和柯萨奇病毒[13-14]作用,初步探讨其药理作用,以期开发新型抗病毒的单体成分药物。

图1 化合物的合成路线Fig.1 The synthetic route of the compound
1 试剂与仪器
1.1 试验药物
鸢尾黄素(陕西绿清生物工程有限公司,含量:98.86%,批号:20200502);鸢尾黄素-5'-磺酸钠、4',7-二乙基鸢尾黄素、4',7-二乙基鸢尾黄素-5'-磺酸钠,含量均≥98%,本实验室自制,批号分别为:20200503、20200702和20200601,试验前用生理盐水配制成所需浓度的液体备用;利巴韦林注射液(成都平原药业有限公司),规格为1 mL×10只,批准文号:国药准字H20043330,生产批号:190801。
1.2 细胞与病毒
HeLa细胞株(卫生部药品与生物制品检定所);流感病毒(甲型H3N2病毒毒株);腺病毒(ADV3病毒毒株);呼吸道合胞病毒(RSV病毒毒株);柯萨奇病毒(CVB3病毒毒株),由四川省人民医院病毒室提供。
1.3 试剂
氢氧化钠、盐酸、乙醇、硫酸二乙酯、浓硫酸和氯化钠(成都市科龙化工试剂厂,分析纯,批号分别为2020120401、2020010111、2020010201、2020080912、2020120304、2020020301);RPMI-1640培养基(GibcoBRL公司,批号1865063);噻唑蓝(Sigma公司,批号C0009)。
1.4 仪器
RRLC-6410液质联用仪(Agilent公司);AVⅡ核磁共振波谱仪(Bruker公司);UV-2401PC紫外分光光度仪(Shimadzu公司);FTIR8300红外检测仪(Shimadzu公司);WRS-2微机熔点测定仪(上海易测仪器设备有限公司);CPA225D电子天平型号(赛多利斯公司);超纯水系统(Millipore公司);MCO-15AC CO2培养箱(三洋公司);细胞培养瓶和96孔细胞培养板(Corning公司);XDS-1B生物倒置显微镜(重庆光学仪器厂);CKX41倒置显微镜(奥林巴斯公司);酶联免疫检测仪(Thermo Fisher公司);微量移液器(GILSON公司)。
2 方法
2.1 化合物的制备
2.1.1 合成路线1
取鸢尾黄素500 g,加2000 mL硫酸,搅拌溶解,反应2 h,倾入20 L NaCl饱和溶液中,边加边搅拌,析出沉淀,放置过夜,过滤,沉淀用水煮沸溶解,趁热过滤,放置,析晶,过滤,重结晶一次,过滤,60℃减压干燥,得化合物1(600 g,含量>98%,收率为89.55%)。取化合物1 200 g,加NaOH 40 g,混匀,加95%乙醇600 mL于4 L圆底烧瓶中,于水浴中加热沸腾5 min,再加400 mL硫酸二乙酯,反应30 min,取出,立即用盐酸调pH至2~5,加水搅拌放冷。过滤,得淡黄色粉末,用95%乙醇搅拌均匀,过滤,反复洗涤至滤出液近无色,60℃减压干燥,得化合物3(176 g,含量>98%,收率77.24%)。
2.1.2 合成路线2
取鸢尾黄素500 g,加NaOH 100 g,混匀,加95%乙醇1500 mL于10 L圆底烧瓶中,于水浴中加热沸腾5 min,再加1000 mL硫酸二乙酯,反应30 min,取出,立即用盐酸调pH至2~5,加水搅拌放冷。过滤,得淡黄色粉末,用95%乙醇搅拌均匀,过滤,反复洗涤至滤出液近无色,60℃减压干燥,得化合物2(455 g,含量>98%,收率76.69%)。取化合物2 200 g,加800 mL浓硫酸,搅拌溶解,反应2 h,倾入8 L NaCl饱和溶液中,边加边搅拌,析出沉淀,放置过夜,过滤,沉淀用水煮沸溶解,趁热过滤,放置,析晶,过滤,重结晶一次,过滤,60℃减压干燥,得化合物3(230 g,含量>98%,收率89.39%)。
2.2 鸢尾黄素及其衍生物溶解度考察
按照中国药典2015版一部凡例21的溶解度实验方法进行了溶解度对比试验:称取3个化合物和鸢尾黄素适量,研成细粉,置于(25℃±2℃)一定量的溶剂中,每隔5 min强力振摇30 s;观察30 min内的溶解情况,并根据药典对各种溶解性能的定义进行判断。
2.3 化合物抗病毒实验
2.3.1 组织半数感染量TCID50效价测定
将收集的含病毒的培养液做连续10倍稀释,共14个浓度,分别加入培养有HeLa单层细胞的96孔板中,每浓度做3复孔。37℃、5%CO2培养3 d,观察细胞病变情况,记录结果,并采用Reed-Muench公式计算TCID50。
2.3.2 药物的细胞毒性实验
用RPMI-1640将各化合物配制为10.00 mg/mL,溶解后过滤除菌。同法将鸢尾黄素及利巴韦林注射液配制为10.00 mg/mL,过滤除菌后备用。将配制好的各化合物、鸢尾黄素和利巴韦林注射液做连续对倍稀释,共7个浓度(10.00、5.00、2.50、1.25、0.63、0.31和0.16 mg/mL),然后分别加入培养的HeLa细胞中,各浓度做3复孔,37℃、5%CO2培养3 d,观察细胞病变情况,记录结果,实验重复3次。
2.3.3 受试药物配制
根据受试药物细胞毒性实验结果,将各化合物的实验起始浓度设定为4.00 mg/mL,然后再用RPMI-1640做连续对倍稀释,共7个浓度(4.00、2.00、1.00、0.50、0.25、0.13和0.06 mg/mL),将配制好的药液经过滤除菌后备用。根据药物细胞毒性实验结果和便于比较,将鸢尾黄素及利巴韦林注射液的实验起始浓度也设定为4.00 mg/mL,然后再用RPMI-1640做连续对倍稀释,共7个浓度(4.00、2.00、1.00、0.50、0.25、0.13和0.06 mg/mL),将配制好的药液经过滤除菌后备用。
2.3.4 体外抗病毒实验
待HeLa细胞在96孔板中培养生长成片,加入100×TCID50各病毒液0.1 mL,37℃、5% CO2吸附2 h,吸出未吸附病毒。分别加入稀释好的各化合物、鸢尾黄素和利巴韦林注射液各浓度药液,每个浓度做3复孔。37℃、5%CO2继续培养,同时设立病毒对照组和细胞对照组,观察细胞病变情况,记录结果,实验重复3次。
3 结果
3.1 化合物的结构鉴定
鸢尾黄素 浅黄色针晶(EtOH);mp.214~216℃;UVλmaxnm:266;IR(KBr)νmax3410,1160,1520,1480,1250,1050 cm-1;ESI-MS:m/z299.05 [M-H]-1;1H NMR(DMSO,400 MHz)δ:13.09(1H,s,5-OH),10.77(1H,s,7-OH),9.58(1H,s,4'-OH),8.34(1H,s,H-2),7.37(2H,d,J=8.5Hz,H-2′,H-6′),6.82(2H,d,J=8.5Hz,H-3′,H-5′),6.44(1H,s,H-8),3.74(3H,s,6-OCH3);上述理化性质和光谱数据与文献[2]报道一致,确定此商品为鸢尾黄素。
化合物1 淡黄色针晶(H2O),HCl-Mg反应阴性;AlCl3显色呈淡黄色;mp.166~168℃;UVλmaxnm:264;IR(KBr)νmax3465,1654,1652,1575,1494,1465,1278,1165,1070 cm-1;ESI-MS:m/z379.04 [M-Na]-1;1H NMR(DMSO,400 MHz)δ:12.84(1H,s,5-OH),7.88(1H,s,H-2),7.74(1H,d,J=2.0Hz,H-6′),7.25(1H,dd,J=2.0,8.5Hz,H-2′),6.94(1H,d,J=8.5Hz,H-3′),6.21(1H,s,H-8),3.70(3H,s,6-OCH3);上述理化性质和光谱数据与文献[15]报道一致,确定此化合物为鸢尾黄素-5'-磺酸钠。
化合物2 淡黄色结晶性粉末(EtOH),HCl-Mg反应阴性;AlCl3显色呈淡黄色;mp.163℃~166℃;UVλmaxnm:268;IR(KBr)νmax3465,1654,1608,1577,1490,1465,1290,1180,1074 cm-1;ESI-MS:m/z357.20 [M+H]+;1H NMR(DMSO,400 MHz)δ:12.80(1H,s,5-OH),7.86(1H,s,H-2),7.43(2H,d,J=8.5Hz,H-2′,H-6′),6.95(2H,d,J=8.5Hz,H-3′,H-5′),6.43(1H,s,H-8),4.15(2H,q,4′-OCH2-),4.06(2H,q,7-OCH2-),3.90(3H,s,6-OCH3),1.51(3H,t,4′-CH3),1.43(3H,t,7-CH3);上述理化性质和光谱数据与文献[16]报道一致,确定此化合物为4',7-二乙基鸢尾黄素。
化合物3 淡黄色针晶(H2O),HCl-Mg反应阴性;AlCl3显色呈淡黄色;mp.166~168℃;UVλmaxnm:264;IR(KBr)νmax3475,1658,1602,1579,1498,1467,1265,1174,1052 cm-1;ESI-MS:m/z481.1 [M+Na]+;1H NMR(DMSO,400 MHz)δ:12.82(1H,s,5-OH),7.83(1H,s,H-2),7.74(1H,d,J=2.0Hz,H-6′),7.25(1H,dd,J=2.0,8.5 Hz,H-2′),6.95(1H,d,J=8.5Hz,H-3′),6.17(1H,s,H-8),4.08(2H,q,4′-OCH2-),3.72(2H,q,7-OCH2-),3.57(3H,s,6-OCH3),1.31(3H,t,4′-CH3),1.14(3H,t,7-CH3);13C-NMR(DMSO,100 MHz)δ:180.7(C-4),154.5(C-7),154.2(C-4′),153.4(C-2),152.7(C-9),152.4(C-5),133.5(C-2′),132.1(C-6),130.4(C-5′),125.6(C-1′),123.4(C-3),120.5(C-6′),115.3(C-3′),106.3(C-10),90.9(C-8),64.8(7-OCH2-),64.3(4′-OCH2-),60.7(6-OCH3),14.8(7-CH3),14.6(4′-CH3),确定此化合物为4',7-二乙基鸢尾黄素-5'-磺酸钠。
3.2 溶解度试验结果
按2.2项下规定,进行溶解度试验,结果见表1。

表1 溶解度试验结果Tab.1 Solubility test results
结果显示,相比鸢尾黄素,化合物1和化合物3在甲醇中的溶解度均有所增加;化合物2在氯仿中溶解度显著提高,达到易溶;化合物1和化合物3在水中溶解度大幅提高,达到溶解,有利于提高化合物在体内吸收和生物利用度。
3.3 TCID50效价结果
HeLa细胞感染病毒后,细胞出现肿涨变圆、脱落,细胞间隙变大,部分细胞贴壁能力下降并脱落、破碎。根据细胞病变效应结果,计算组织半数感染量(TCID50),结果见表2。

表2 各病毒对HeLa细胞的TCID50(n=3)Tab.2 TCID50 of virus on HeLa cells(n=3)
3.4 药物的细胞毒性实验结果
将不同浓度的药物分别加入培养的HeLa细胞后,有药物组细胞形态发生改变,出现细胞破碎、脱落,细胞内遮光性颗粒多,细胞稀疏,表示该药物组均出现细胞毒性。根据病变效应结果,采用MTT法在570 nm波长下测定A值,根据A值计算细胞存活率和病变率,运用SPSS 19.0 Probit回归分析法计算得出各化合物、鸢尾黄素和利巴韦林注射液对HeLa细胞的半数毒性浓度(TC50),结果见表3。
表3 药物对HeLa细胞的TC50(n=3,±s)Tab.3 TC50 of drugs on HeLa cells(n=3,±s)

表3 药物对HeLa细胞的TC50(n=3,±s)Tab.3 TC50 of drugs on HeLa cells(n=3,±s)
药物TC50(mg/mL)化合物1 4.939±0.632化合物2 4.835±0.556化合物3 5.512±0.508利巴韦林9.743±0.645鸢尾黄素4.186±0.352
结果表明,化合物1、2、3对HeLa细胞毒性作用与利巴韦林比较无显著性差异(P>0.05),与射干苷元比较无显著性差异(P>0.05),TC50结果也显示化合物1、2、3细胞毒性弱于射干苷元,证实其具有更小的细胞毒性,较高的浓度也不会出现细胞病变。
3.5 体外抗病毒实验结果
在感染100 TCID50各病毒情况下,各药物组和病毒对照组均出现了细胞形态改变、融合、坏死、脱落等,但是各药物组细胞病变程度均低于病毒对照组,随着各药物组浓度的增加,对病毒抑制率增加,细胞病变率降低,细胞对照组无细胞病变。根据细胞病变效应结果,采用MTT法在570 nm波长下测定A值,根据A值计算细胞存活率和病变率,运用SPSS 19.0 Probit回归分析法计算各化合物、鸢尾黄素和利巴韦林注射液的半数抑制浓度(IC50)和抗病毒指数(TI=TC50/IC50),结果见表4。
表4 化合物对病毒的IC50和TI(n=3,±s)Tab.4 IC50 and TI of compounds to virus(n=3,±s)
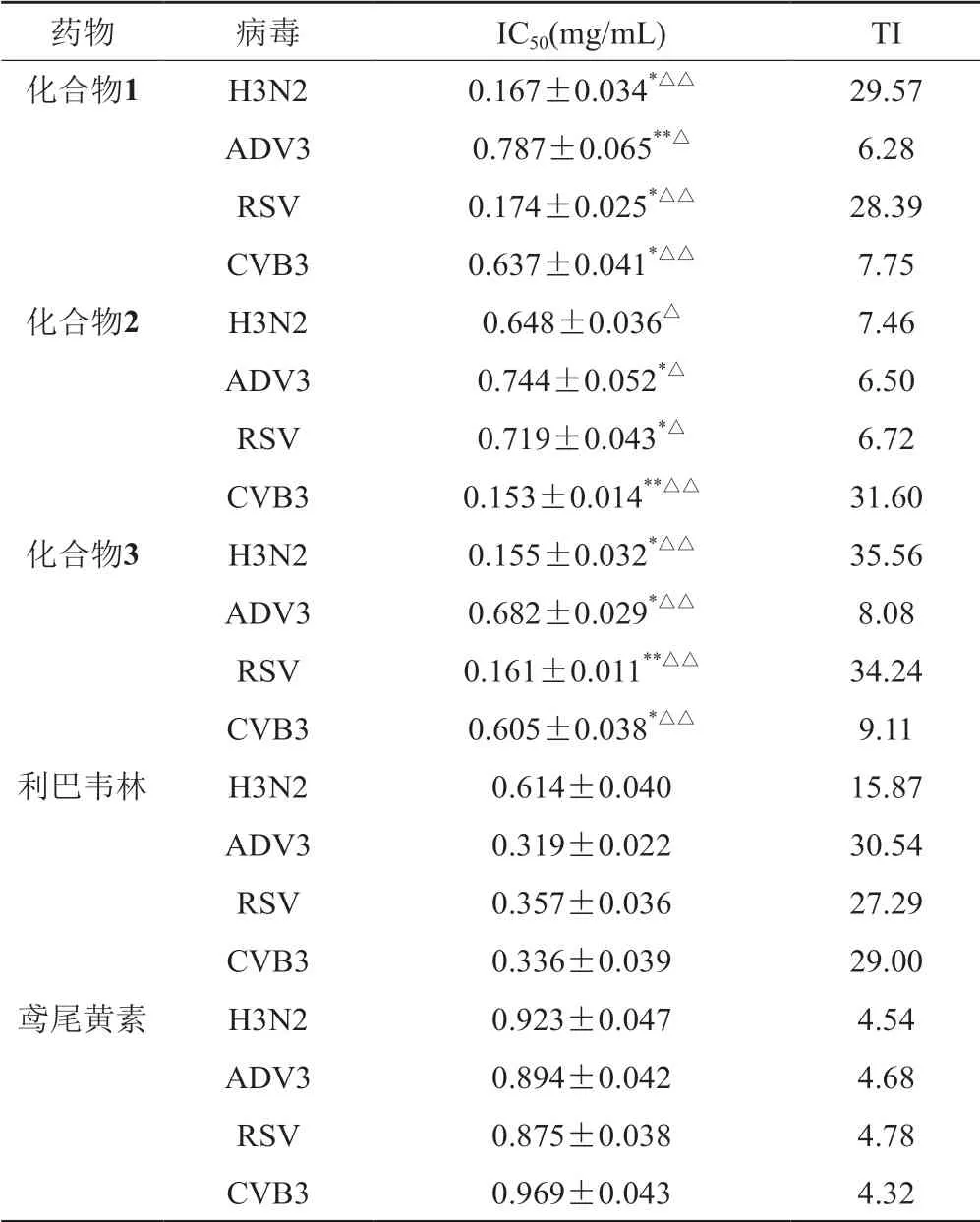
表4 化合物对病毒的IC50和TI(n=3,±s)Tab.4 IC50 and TI of compounds to virus(n=3,±s)
与利巴韦林组比较,*P<0.05,**P<0.01;与鸢尾黄素组比较,ΔP<0.05,ΔΔP<0.01
药物病毒IC50(mg/mL)TI化合物1 H3N20.167±0.034*△△29.57 ADV30.787±0.065**△6.28 RSV0.174±0.025*△△28.39 CVB30.637±0.041*△△7.75化合物2 H3N20.648±0.036△7.46 ADV30.744±0.052*△6.50 RSV0.719±0.043*△6.72 CVB30.153±0.014**△△31.60化合物3 H3N20.155±0.032*△△35.56 ADV30.682±0.029*△△8.08 RSV0.161±0.011**△△34.24 CVB30.605±0.038*△△9.11利巴韦林H3N20.614±0.04015.87 ADV30.319±0.02230.54 RSV0.357±0.03627.29 CVB30.336±0.03929.00鸢尾黄素H3N20.923±0.0474.54 ADV30.894±0.0424.68 RSV0.875±0.0384.78 CVB30.969±0.0434.32
结果表明,各化合物组在不同剂量时对H3N2、ADV3、RSV、CVB3病毒均有不同程度的抑制作用,和鸢尾黄素比较差异有显著性或十分显著的统计学意义(P<0.05,P<0.01),IC50远小于同等剂量的鸢尾黄素组,说明较小药物浓度就能更好地抑制病毒,证实了结构改造的可行性和必要性。
化合物1对RSV病毒有明显的抑制作用,与利巴韦林比较有十分显著性的统计学意义(P<0.05),抗RSV病毒指数略强于利巴韦林;对H3N2病毒有明显的抑制作用,与利巴韦林比较有显著性的统计学意义(P<0.05),抗H3N2病毒指数强于利巴韦林;化合物2对CVB3有明显的抑制作用,与利巴韦林比较有十分显著性的统计学意义(P<0.01),抗CVB3病毒指数略强于利巴韦林;化合物3对RSV病毒有明显的抑制作用,与利巴韦林比较有十分显著性的统计学意义(P<0.01),抗RSV病毒指数略强于利巴韦林;对H3N2病毒有明显的抑制作用,与利巴韦林比较有十分显著性的统计学意义(P<0.05),抗H3N2病毒指数(35.56)远强于利巴韦林(15.87),证明其具有很高的安全性和有效性。
4 讨论
结构改造是现代药学重要组成部分,从中药或天然植物来源的化合物,由于疗效不理想、有毒副作用或水溶性差等问题,很少直接应用于临床,需要对某些官能团进行结构修饰、改造,以达到改变疗效、降低毒副作用及增加生物利用度的目的。鸢尾黄素由于近似平面结构,脂溶性、水溶性均较差,影响其生物活性,可以通过结构改造来达到增效的目的。袁崇均[17]通过对鸢尾黄素开环形成查尔酮衍生物,证实其对HCT116、MCF-7、A549、SGC7901和SK-ov-3细胞株显示出较强的抗肿瘤活性;通过对鸢尾黄素脱甲基形成为6-OH染料木素,证实其对H2O2诱导PC12细胞损伤有显著的保护作用[18];陈帅通过鸢尾黄素8位活泼H形成Mannich碱,证实其对H22肝癌荷瘤小鼠有很强的抗肿瘤作用[19];郭常亮提供一种梭菌AUH-JLC39及其在鸢尾黄素转化中的应用,解决了二氢鸢尾黄素的微生物生物合成问题及其资源匮乏问题[20-21]。
在药物研发中,抗病毒药物的研究起步较晚,临床上能有效地治疗病毒性疾病的药物十分有限,主要是因为抗病毒药物在发挥药效杀死体内病毒的同时,会损伤自身细胞,往往具有较高的毒副作用,其临床应用多具有一定限制。利巴韦林具有广谱的抗病毒作用[10-14],广泛用于治疗病毒感染,但临床研究表明,长期服用利巴韦林会使白细胞水平降低,产生骨髓抑制等不良反应[22]。因此从天然植物中寻找抗病毒药物,筛选高效低毒的抗病毒药物是当今抗病毒研究热点之一。
TI通常称为治疗指数(therapeutic index),表示药物的安全性结果,用在抗病毒方面称为抗病毒指数,由药物的半数毒性浓度(TC50)/半数抑制浓度(IC50)得到,通常半数毒性浓度越大,半数抑制浓度越小,药物就越安全有效。H3N2流感是一种由甲型H3N2流感病毒引起的呼吸系统疾病,可以通过呼吸道传播,患者多表现出普通流行性感冒的症状,目前对甲流病毒尚缺乏特效药物,常洋通过研究证实牛黄清感胶囊对甲型H3N2流感病毒具有显著抑制作用,TI为27[10];李爽等[23]证实空心莲子草有效部位提取物对流感病毒有明显抗病毒生物合成作用,其TI为2.43。本研究所合成的化合物3,TC50与利巴韦林相当(P>0.05),对H3N2病毒的IC50为0.155±0.032 mg/mL,TI为35.56,具有广谱高效、安全低毒的抗病毒活性,具有较高的开发利用价值,下一步将研究化合物3构效关系,寻找其抗H3N2病毒的靶点,从分子机制方向探讨其抗病毒原理。
致谢:NMR光谱、MS由四川大学分析测试中心完成,部分活性试验由四川大学华西医学中心完成。

