艰难类梭菌耐药机制及其适应性代价的研究进展
刘晓璇 王伟刚 赵建宏
(河北医科大学第二医院 河北省临床检验中心,石家庄 050000)
艰难类梭菌(Clostridioides difficile,C.difficile)是一种革兰阳性、产芽胞的专性厌氧菌,是抗生素相关性腹泻最常见的病原菌[1]。2016年,Lawson等[2]将原属于梭菌科、梭菌属(Clostridium)的艰难梭菌重新归类为消化链球菌科、类梭菌属(Clostridiodes)。随后,ICSP和CLSI相继发布公告,将艰难梭菌更名为艰难类梭菌[3]。
艰难类梭菌感染(Clostridioides difficileinfection,CDI)患者的临床症状可由自限性腹泻发展为结肠炎、中毒性巨结肠,甚至死亡[1]。2000年,获得氟喹诺酮耐药性的高产毒株RT027型艰难类梭菌在欧美地区暴发流行,CDI发病率和死亡率迅速升高,引起世界范围的广泛关注[4]。近年来,随着抗菌药物的广泛应用,艰难类梭菌的耐药率不断攀升[5-6]。临床分离菌株对常规治疗药物,如:甲硝唑、万古霉素和非达霉素等敏感性降低的现象时有发生,CDI治疗无效率及复发率逐年递增,给全球公共健康带来了严重威胁[7-8]。通常,细菌获得耐药性后易产生适应性代价(fitness cost),即生长传播速度、定植能力、毒力等降低[9]。当环境中缺乏抗菌药物选择压力时,敏感菌株便呈现生长优势,耐药菌株可逐渐被清除[10]。然而多数耐药艰难类梭菌缺乏适应性代价,这极大地增加了耐药菌株的传播风险[11-12]。因此,本文对艰难类梭菌的耐药机制及其适应性代价进行综述,旨在为减少耐药性、开发新疗法提供理论参考。
1 可诱发CDI的抗生素
滥用广谱抗生素是CDI的主要危险因素。正常情况下,肠道共生菌能通过定植占位或竞争营养等机制,阻止病原菌在肠道定植。长期使用抗生素会导致菌群失调,艰难类梭菌产毒菌株过度增殖,引发CDI[13]。几乎所有抗菌药物都与CDI发生相关,尤其克林霉素、头孢菌素、氟喹诺酮以及四环素具有更高的诱发风险[4,14-16]。
1.1 大环内酯类酰胺链霉素
大环内酯类酰胺链霉素B(macrolide-lincosamidestreptogramin B,MLSB)与细菌核糖体的50S亚基结合,干扰蛋白质的合成。MLSB家族中,与CDI密切相关的是克林霉素和红霉素。克林霉素是第一个被证实与CDI发生相关的抗生素,它的滥用引起了美国早期CDI的大面积暴发[15]。美国纵向监测结果显示,近年来艰难类梭菌对克林霉素的耐药率为30.1%~56.8%,呈现上升趋势[17]。我国各地区的克林霉素耐药率普遍较高,介于53.7%~94.8%之间,北京耐药率高达94.8%,见表1。
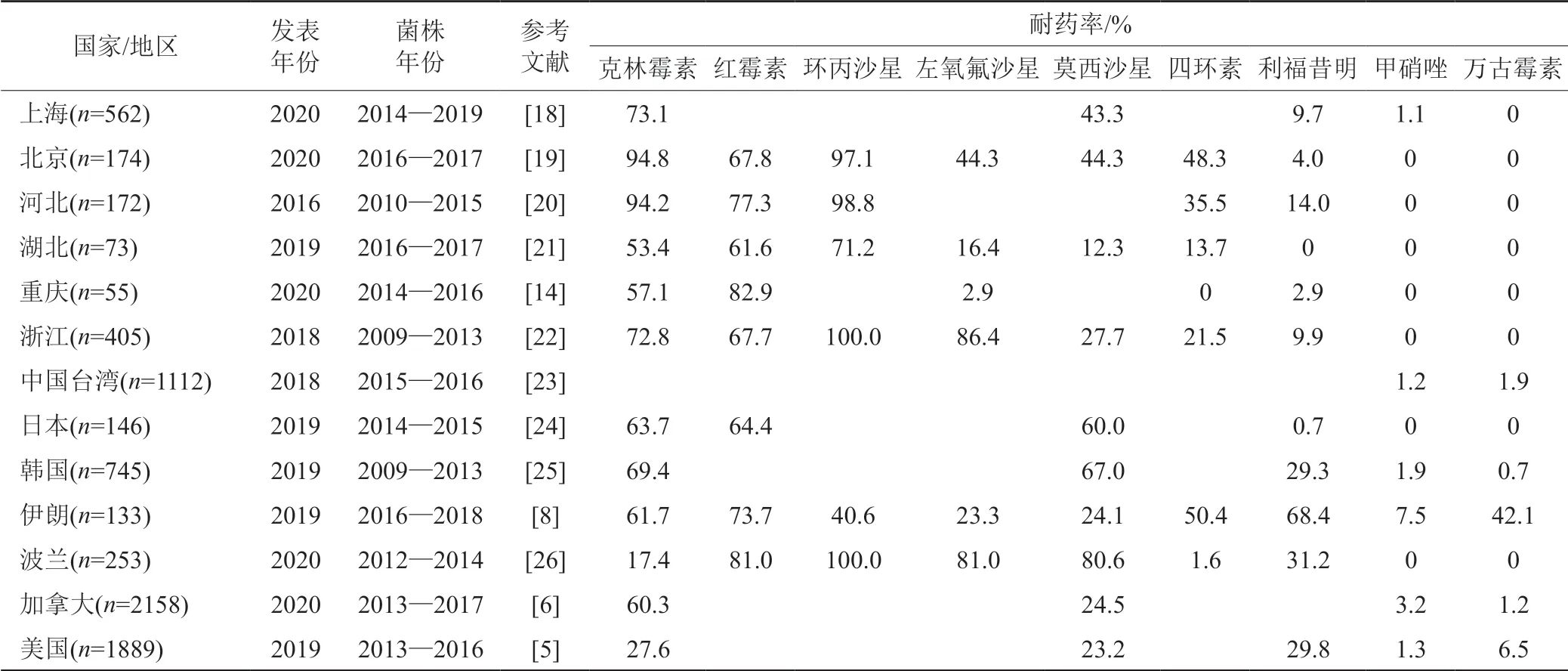
表1 不同国家/地区艰难类梭菌临床分离株的耐药率Tab.1 The antimicrobial resistance patterns of C.difficile isolates at different sites
红霉素和克林霉素的耐药机制相似,erm基因是艰难类梭菌产生耐药的首要原因,其次是cfr基因[27-28]。二者各自编码位于不同可移动遗传元件的23S rRNA甲基转移酶(前者由转座子Tn6194、Tn6215、Tn5398和Tn5398样携带;后者常由转座子Tn916样携带),通过基因水平转移的方式传播[29-30]。erm基因有多种亚型,最常见的是ermB,可导致艰难类梭菌对红霉素、克林霉素高水平耐药(MIC>256mg/L)[27]。虽然携带ermB基因的可移动元件会使艰难类梭菌产生适应性代价,但在传播能力和艰难类梭菌固有遗传特性等多种因素的共同作用下,这些遗传元件仍然能够在艰难类梭菌中广泛存在[29]。
1.2 β-内酰胺类抗生素
β-内酰胺类抗生素是一类具有β-内酰胺环的抗菌药物,通过抑制细菌细胞壁合成发挥抗菌作用,主要包括头孢菌素、青霉素以及碳青霉素烯类抗生素[31]。艰难类梭菌对β-内酰胺类抗生素耐药的机制主要包括产生抗生素降解酶(β-内酰胺酶)和/或产生抗生素靶点保护蛋白(青霉素结合蛋白)[32]。
头孢菌素耐药是20世纪80年代医院获得性CDI发病率上升的关键因素。近年来,有学者提出头孢菌素可以抑制芽胞形成,与万古霉素联合用药可预防CDI复发[33]。但头孢菌素对肠道正常菌群有明显的抑制作用,是CDI发生的危险因素,因此该提议存在较大争议[14,34]。此外,艰难类梭菌对头孢菌素耐药的现象十分普遍,不同国家及地区的头孢菌素耐药率介于26.7%至100.0%之间。艰难类梭菌固有的D类β-内酰胺酶使其对头孢菌素耐药,耐药水平的高低与启动子的表达效率有关,部分学者认为艰难类梭菌对头孢菌素天然耐药[35]。
1.3 氟喹诺酮
氟喹诺酮类抗菌药物(fluoroquinolones,FQs)作用于细菌的DNA回旋酶或/和拓扑异构酶Ⅳ,通过抑制细菌DNA合成发挥杀菌效应。“氟喹诺酮时代”来临前,RT027型艰难类梭菌曾是北美地区一种非常罕见的克隆株,氟喹诺酮耐药性的获得使其在欧美地区暴发流行[4]。北京一项多中心研究显示,当地优势菌株RT369/ST81型艰难类梭菌对氟喹诺酮耐药率为100.0%(46/46),显著高于其他RT/ST型,推测该菌株的流行与氟喹诺酮耐药有关。因此,亟需严格控制氟喹诺酮类抗菌药物的使用,同时密切监控RT369/ST81型艰难类梭菌的出现,防止其大面积暴发流行[19]。
我国各地区艰难类梭菌分离株对氟喹诺酮普遍耐药(表1)。其中,环丙沙星耐药率最高,浙江地区分离株的耐药率甚至高达100.0%,左氧氟沙星、莫西沙星次之,该差异可能与药物的使用频率有关。
艰难类梭菌没有拓扑异构酶IV基因,DNA回旋酶亚单位GyrA或/和GyrB的突变是其对氟喹诺酮耐药的主要原因,突变位点多发生于A亚单位67~106密码子位点的喹诺酮耐药决定区(quinolone-resistance determining region,QRDR)。据报道,GyrA的常见突变有D71V、D81N、T82I、T82V、F86Y、A83V、Ala118V和A118T,其中以T82I最为常见;GyrB的常见突变有S366A,R377G、S416A、D426N、D426V、R447K、E466V,其中以D426N和D426V最为常见[21,26,36-37]。然而,Lachowicz等[26]在氟喹诺酮敏感菌株中发现也了S366A、S416A、D426N和D426V,因此这些突变可能在氟喹诺酮耐药性中并未发挥关键作用。此外,ABC转运蛋白(ATP-binding cassette transporter,ABC)编码基因cd2068的过表达可发挥外排泵作用,导致艰难类梭菌对多种抗菌药物,如:氨苄西林、头孢西丁、万古霉素、左氧氟沙星和环丙沙星的敏感性降低,产生多重耐药性[38]。
1.4 四环素
四环素(tetracycline,TET)通过特异性结合细菌核糖体30S亚基的A位,抑制细菌合成蛋白质[31]。四环素的选择压力是RT078型艰难类梭菌(可引起人畜共患病的流行株)通过食物链迅速引发国际传播的关键因素[16]。目前我国已陆续发现该型菌株,耐药率为20.7%~75.9%[23]。
艰难类梭菌对四环素的耐药机制主要与tet基因有关。该基因簇有多种亚型,分别通过不同的机制介导细菌对四环素的耐药[16,39]:①TET特异性外排蛋白(Tet40、TetA(P));②核糖体保护蛋白(TetM、TetW、TetB(P)、TetO)。其中TetM是艰难类梭菌对四环素耐药的最常见原因,其次是TetW。在产气荚膜梭菌中,tetA(P)和tetB(P)通常由质粒pCW3携带,而在艰难类梭菌中,该基因则位于基因组DNA[40]。其余基因由多个转座子,如:Tn5397、Tn916、Tn916-like和Tn6164)携带,可在艰难类梭菌间或艰难类梭菌与枯草芽胞杆菌、肠球菌间水平传播[41-42]。tetX编码黄素依赖性单加氧酶,该酶可使包括替加环素在内所有的四环素修饰失活。近期He等[43]通过数据库挖掘和回顾性筛选分析发现携带TetX3或TetX4的质粒在大肠埃希菌临床菌株中广泛存在。艰难类梭菌尚未见该基因的相关报道。
2 常用的CDI治疗药物
近30年来,甲硝唑和万古霉素一直是治疗CDI的主要药物,而新型窄谱抗生素——非达霉素(fidaxomicin,FDX)的出现改变了这一局面。2017年,美国临床实践指南将万古霉素和非达霉素作为CDI的一线治疗药物[1]。甲硝唑因其疗效逊于万古霉素且存在神经毒性,不再推荐使用[44]。但对于轻度CDI患者,甲硝唑的治疗效果与万古霉素无差异,仍可将其作为治疗首次CDI的备选方案。此外,非达霉素在许多国家(包括中国)尚未获得监管部门的批准,因此并未得到广泛应用,利福昔明作为其替代方案,可用于治疗复发性艰难类梭菌感染(recurrenceClostridioides difficileinfection,rCDI)[1]。
2.1 万古霉素
万古霉素(vancomycin,VAN)是一种糖肽抗生素,作用于脂质Ⅱ的D-丙氨酸-D-丙氨酸(D-Ala-DAla),可干扰细菌肽聚糖细胞壁的合成,发挥杀菌效应[31]。近年来,全球各地陆续出现艰难类梭菌对万古霉素耐药的相关报道(表1)。该耐药菌在伊朗发生大规模流行暴发,重灾区耐药率可达42.1%,我国目前仅在台湾地区发现对万古霉素耐药的艰难类梭菌。
νan基因簇是常见的万古霉素耐药机制[45]。该基因簇编码合成D-丙氨酸-D-乳酸(D-Ala-D-Lac)或D-丙氨酸-D-丝氨酸(D-Ala-D-Ser)的连接酶,可取代D-Ala-D-Ala,使万古霉素丧失作用靶点。其中部分νan基因簇(νanA,νanB,νanD,νanG,νanL,νanM)的表达受调控基因νanR和νanS的控制。当环境中存在万古霉素时,位于膜上的传感器激酶VanS检测到该信号,发生自我磷酸化,并将信号传递给细胞质中的调节蛋白VanR,VanR~P激活νanG的表达,继而使细菌产生耐药。2006年,研究人员在艰难类梭菌630中发现一个与粪肠球菌BM4518的νanG具有高度一致性的类νanG基因(νanGCd),而后证实85%的艰难类梭菌中存在该基因[46]。与肠球菌不同,万古霉素诱导νanSCd表达产生的D-Ala-D-Ser连接酶的浓度对敏感性降低的影响十分微弱,不足以使艰难类梭菌对万古霉素产生耐药性[47]。但是当VanSRCd发生氨基酸替换突变(R314L、G319D、S313F和T349I)时,其磷酸酶活性增强,使νanGCd表达上调,导致耐药[48]。
酰胺酶(Ami1)可以降低结核分枝杆菌对靶向细胞壁的抗生素的敏感性[49]。质粒pX18-498携带有一个推定的酰胺酶基因pX18-498_006,其编码蛋白与Ami1有23%的序列一致性。艰难类梭菌获得质粒pX18-498后,对万古霉素的敏感性降低了8倍,并且在小鼠体内实验中表现出更强的致病力[49]。
Leeds等[50]在两株耐药菌中分别发现RpoC突变(D244Y);MurG/CD2725突变(P108L)、CD3659突变(E327stop)以及SdaB/CD3222缺失(A292-295)。MurG参与肽聚糖细胞壁的合成,其突变可能会导致细菌对万古霉素耐药。此外,万古霉素的选择压力能促进艰难类梭菌形成生物膜,膜屏障的物理保护作用及膜内细菌生理状态的改变,也可能导致艰难类梭菌对药物敏感性降低[51]。
2.2 非达霉素
非达霉素是一种作用于σ因子的窄谱抗生素,可在转录的早期阶段抑制细菌RNA聚合酶活性,达到杀菌效果[31]。相比于万古霉素和甲硝唑,非达霉素对肠道菌群作用温和,同时还能够破坏艰难类梭菌的生物膜,抑制艰难类梭菌产芽胞、产毒,降低CDI复发率,是当前治疗rCDI的首选药物[52-53]。艰难类梭菌对非达霉素耐药的现象十分罕见,但敏感性降低的现象时有发生,为抗生素治疗埋下了隐患[9]。
艰难类梭菌在体外对非达霉素敏感性降低主要与rpoB突变相关[54]。Leeds等[50]通过体外诱导实验获得非达霉素耐药突变株,并在其中检测到rpoB或CD22120(多重耐药相关转录调控因子marR的同源物)突变。随后Kuehne[54]和Schwanbeck[9]分别利用定点突变技术证实RpoB氨基酸替换突变V1143D、V1143G、V1143F会造成艰难类梭菌对非达霉素耐药。携带V1143D突变的临床分离株Goe-91(MIC>64 mg/L),是目前非达霉素耐药水平最高的突变菌株[9]。
2.3 甲硝唑
甲硝唑(metronidazole,MTZ)为硝基咪唑衍生物,其硝基在无氧环境中被还原成氨基,产生细胞毒性,发挥抗厌氧菌作用。丙酮酸-铁/黄素氧还蛋白氧化还原酶(PFOR)、铁氧还蛋白、氢化酶等几种参与电子传递的蛋白质在甲硝唑激活过程中发挥重要作用[55]。甲硝唑治疗CDI失败与甲硝唑异质性耐药有关[7]。该耐药性不稳定,具有介质依赖性,传代或低温贮藏会导致耐药性丧失[56]。最近的两项研究表明,血红素对甲硝唑中介艰难类梭菌的鉴定至关重要,在培养基中添加新鲜血红素能使具有介质依赖性的甲硝唑耐药性保持稳定[57-58]。此外,甲硝唑药代动力学不足,口服后未能在肠腔达到有效抑菌浓度也会导致治疗失败,并促进耐药性的发展[55]。不同国家/地区艰难类梭菌对甲硝唑的耐药率差异较大,介于0~7.5%(表1)。甲硝唑耐药艰难类梭菌在我国较为罕见。
艰难梭菌对甲硝唑耐药的机制十分复杂,可能由多因素共同作用,主要涉及硝基还原酶、铁代谢、DNA修复能力、电子传递链和能量代谢的改变[56,59-60]。研究表明,5-硝基咪唑还原酶Nim、铁摄取调节剂基因(fur)突变或过表达、DNA修复蛋白RecA过表达、氧化还原过程和电子转移链的破坏可造成厌氧菌对甲硝唑耐药[56,59]。Lynch[56]和Chong[59]分别通过全基因组测序及蛋白质组学分析,发现耐甲硝唑的艰难类梭菌除上述改变外还存厌氧粪卟啉氧化酶基因(hemN)和及硫胺素生物合成相关基因(thH)突变。其中Nim作为艰难类梭菌对甲硝唑耐药的机制尚存争议。虽然耐甲硝唑的艰难类梭菌中有47.5%存在nimA[61],但是在敏感菌株中也发现了该基因[62]。此外,伊朗某医院81.5%(53/65)的艰难类梭菌对甲硝唑高水平耐药(MIC≥256 mg/L),但均未检测到nim[41]。因此,nim并非甲硝唑耐药的决定因素,高水平的Nim可以降低艰难类梭菌对甲硝唑的敏感性,但无法使其产生高水平耐药[55,63]。
铁代谢与氧化还原反应酶之间的上位效应导致艰难类梭菌对甲硝唑耐药。Deshpande等[60]通过敲除DNA错配修复基因,构建了一株具有高突变率的艰难类梭菌,以此研究甲硝唑耐药性在体外的演变过程。研究结果显示,铁转运体FeoB1最先发生突变,接着PFOR、黄嘌呤脱氢酶(Xdh)、铁硫调节剂(IscR)相继突变,MIC从最初的0.25 mg/L增加至32 mg/L[60]。Xdh和IscR突变虽然突变无法单独介导甲硝唑耐药性,但其与PFOR和FeoB1突变之间可发挥协同作用,进一步提高艰难类梭菌的耐药水平[60]。
Boekhoud等[63]在耐甲硝唑的艰难类梭菌(4.1%,23/563)中,发现一个可水平传播的质粒pCDMETRO,该质粒介导了艰难梭菌对甲硝唑耐药,可能与甲硝唑治疗失败有关。随后,Arcay等[64]在对甲硝唑高水平稳定耐药(MIC>256mg/L)的艰难类梭菌中,检测到上述质粒以及HemN(E317K)和NimA(Y130S)点突变,并发现该质粒在甲硝唑耐药中发挥主导作用。然而,目前尚不清楚pCDMETRO(包含8个开放阅读框,分别编码与代谢相关的蛋白)中哪些基因是造成耐药的直接原因,需继续深入研究。此外,与万古霉素类似,生物膜也可以降低艰难梭菌对甲硝唑的敏感性,促使CDI治疗失败或复发[65-66]。
2.4 利福霉素
利福霉素(rifamycins,RFs)能够特异性结合rpoB基因编码的RNA聚合酶β亚基,抑制细菌增殖。用于治疗CDI的利福霉素主要是利福平和利福昔明,尤其利福昔明口服不易吸收,可在肠腔达到高浓度,与万古霉素联合用药能有效防治rCDI[1]。利福昔明与利福平存在交叉耐药,艰难类梭菌对二者的敏感性存在相关性,利福平的药敏结果能有效预测艰难类梭菌对利福昔明的耐药性[67]。
利福霉素耐药性多见于RT017型艰难类梭菌,该型别为亚太地区的流行型菌株[20,68]。在美国,临床上约有29.8%(563/1889)的艰难类梭菌对利福霉素耐药[5]。2017—2018年石家庄市的耐利福昔明艰难类梭菌的检出率为19.0%(38/200),较过去5年增长了5个百分点[20,69]。我国各地区艰难类梭菌对利福霉素的耐药率在0~19.0%之间[20-21,69],整体耐药率略高于亚太地区平均水平(6.7%)[70]。
RpoB突变是艰难类梭菌对利福霉素产生耐药的主要原因。如图1所示,此类突变多集中于507-533密码子位点的81bp核心区域,即利福平耐药决定区(rifamycin resistance-determining region,RRDR),其中以R505K最为常见。

图1 大肠埃希菌与艰难类梭菌的利福平耐药决定区序列比对Fig.1 Sequence alignment spanning RIF resistance-determining regions(RRDRs)of the E.coli and C.difficile RpoB of RNAP
此外,临床分离耐药菌株还涉及H502N&R505K、H502D&D590V、H502Y&L487F、R505K&I548M、R505K&S498T、R505K&D492N等双替换突变[20,72-73,76]。此类突变未提高艰难类梭菌的耐药水平,推测其可能与细菌的适应性有关,即联合突变菌株的适应性高于单独突变。研究人员在耐药决定区之外陆续发现新的突变,如E573A、L584F、E603N,但其与耐药性的关联仍需进一步验证[11,36]。
3 耐药艰难类梭菌的适应性代价
细菌耐药的主要机制包括:获得携带耐药基因的移动遗传元件,染色体基因突变。尤其细菌的关键基因发生耐药突变后会影响其正常的生理功能,即产生适应性代价(fitness cost)。主要体现在突变菌株的生长传播速度、定植及产毒能力降低[9]。当环境中缺乏抗菌药物选择压力时,耐药菌株的生存能力下降,敏感菌株便呈现生长优势,耐药菌株可逐渐被清除[10]。因此,适应性代价的高低在一定程度上决定了耐药菌的传播能力。当耐药突变株具有较高的适应性代价时,可在其发生补偿性进化(compensatory evolution)前,通过停药控制耐药菌株的传播,消除耐药性。然而多数耐药艰难类梭菌缺乏适应性代价(表2),极大地增加了耐药菌株的传播风险和治疗难度。
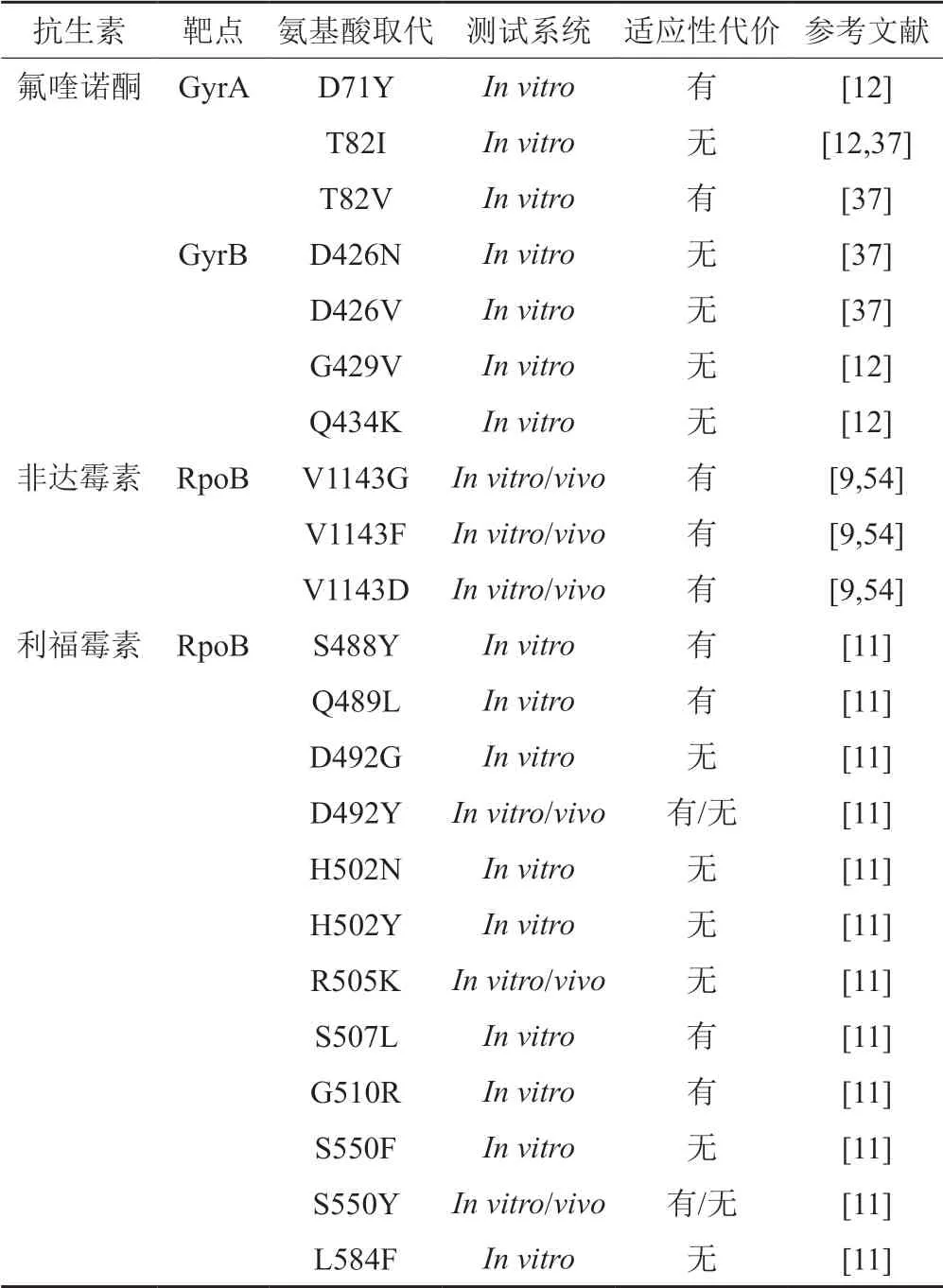
表2 艰难类梭菌染色体耐药突变的适应性代价Tab.2 The fitness cost of antimicrobial resistance C.difficile with target-altering chromosomal mutations
DNA回旋酶是一种Ⅱ型拓扑异构酶,由GyrA、GyrB两个亚单位组成,在基因复制和转录过程中发挥重要作用。GyrA和/或GyrB的氨基酸替换突变可使艰难类梭菌对氟喹诺酮耐药。2000年,氟喹诺酮耐药性的获得使RT027型艰难类梭菌在欧美地区暴发流行[15]。2007年,英国限制使用氟喹诺酮类药物以期降低CDI发病率。该措施的实施取得显著成效,在随后的几年里CDI发病率明显降低[77]。然而,艰难类梭菌目前已进化出GyrA T82I突变型,该突变可使其对氟喹诺酮高水平耐药但不会产生适应性代价,即便环境中没有抗菌药物选择压力,艰难类梭菌依然可以维持耐药性状[12]。此外,GyrB分别发生D426N和D426V突变的耐药菌株的适应性有所提高,但相较于GyrA突变该突变型在临床并不常见[37]。
rpoB基因编码细菌RNA聚合酶β亚基,是高度保守的单拷贝基因。该基因的关键位点突变会赋予细菌利福霉素或非达霉素耐药性,同时rpoB突变会降低细菌的转录效率,使其产生适应性代价[78]。为提高适应性,耐药菌株通常会伴随rpoA、rpoB或rpoC的补偿性突变[79]。然而Dang等[11]发现,在rpoB突变的耐利福昔明艰难类梭菌中,包括最常见的R505K突变株,大部分突变株缺乏适应性代价。由于该研究是通过体外诱导实验获得耐药菌株,并且仅检测利福霉素作用靶点RpoB的突变情况,不排除耐药菌在连续传代过程中发生补偿性突变的可能。并且,在该研究的体外竞争实验中,适应性分别降低20%和33%的D492Y和S550Y突变菌株在小鼠体内并未表现出适应性代价,研究人员认为可能是由于黄金地鼠对艰难类梭菌的易感染性使得耐药菌株的适应性代价的细微差异无法在体内环境中得到体现[11]。
Kuehne等[54]利用定点突变技术构建了对非达霉素耐药的RpoB突变株(V1143D、V1143G、V1143F)并通过体内、外的竞争实验分别证实这些突变给艰难类梭菌造成适应性代价,使其生长传播速度减慢、芽胞生成和产毒能力降低,这可能是临床环境中非达霉素耐药株少见的原因之一。然而,同样具有RpoB V1143D突变的临床分离株Goe-91并未出现生长速度减缓的现象,仅毒力和生成芽胞的能力降低,适应性代价低于预期[9]。造成这一现象的原因可能是艰难类梭菌的遗传背景弥补了突变引起的生长减缓,亦或是在小鼠体内增殖过程中发生了补偿性突变,但具体机制仍需进一步研究。
Leónidas等[80]发现具有链霉素(RpsL K43T),利福平(RpoB H526Y)耐药突变以及双取代突变(RpsL K43T&RpoB H526Y)的大肠埃希菌在无菌小鼠中均具有较高的适应性代价,而在单独饲养的SPF小鼠中,由于每只小鼠的肠道菌群具有个体差异,耐药菌株表现出不同程度的适应性代价,甚至出现适应性提高的现象。因此,体外竞争实验无法代替动物实验,而在哺乳动物复杂的肠道微生态中,耐药菌的适应性代价并未研究透彻,仍需深入研究。
4 总结与展望
综上所述,艰难类梭菌的耐药率在不同国家及地区之间存在较大差异(表1)。总体来说,艰难类梭菌对克林霉素、氟喹诺酮、头孢菌素普遍耐药,并且这些抗菌药物具有更高的诱发CDI的风险,临床使用时应警惕腹泻的发生,一旦出现相关症状应立即停用。对于CDI一线治疗药物(甲硝唑、万古霉素和非达霉素等),绝大多数菌株敏感性较高,部分菌株出现敏感性降低的现象应引起高度重视。对此,我国亟需在全国范围内进行大规模的CDI流行病学调查以及艰难类梭菌耐药检测;同时严格规范抗菌药物的使用,预防多重耐药菌的出现及流行。艰难类梭菌的耐药机制十分复杂,目前的研究虽已取得一些新的进展,但仍有许多耐药机制至今尚未明确,需进一步研究。此外,耐药突变产生的适应性代价较低也是耐药菌株暴发流行的原因之一。对此,应当对低适应性代价的机制进行深入研究,设计降低细菌适应性、抑制耐药性进化的抗菌药物,与一线治疗药物联合应用,增加细菌对药物的敏感性,延长药物的使用寿命。

