植物内生真菌Talaromyces sp.的次级代谢产物研究
李思瑶 张杨 车永胜
(1 天津中医药大学,天津 300193;2 军事科学院军事医学研究院毒物药物研究所,抗毒药物与毒理学国家重点实验室,北京 100850;3 中国医学科学院北京协和医学院药物生物技术研究所,北京 100050)
植物内生真菌(endophytic fungi)是指一类在寄主植物的健康器官或组织内度过全部或部分生命周期,而通常不使寄主表现出明显感染症状的真菌,该类真菌可能存在于植物的各种组织器官如根、茎、叶、花、果实或种子中[1-2]。植物内生真菌既是植物微生态系统的重要组成部分,也是一类非常重要的微生物资源。目前,从植物内生真菌发酵物中分离得到的次级代谢产物的结构类型包括聚酮、萜类、肽类和生物碱等,部分化合物具有抗菌、抗病毒、抗肿瘤和抗氧化等生物活性[3-4]。植物内生真菌既能够独立产生各种结构类型的次级代谢产物,又能够参与宿主植物次级代谢产物的生物合成,或对其进行生物转化,是活性天然产物的重要来源之一[5-6]。来源于植物内生真菌的活性天然产物在生物制药[3-4,7]、农业生产和工业发酵等方面均具有广阔的应用前景[8]。
篮状菌(Talaromycessp.)广泛分布于植物、土壤和海洋生物如海绵中[9],篮状菌属的次级代谢产物种类丰富,部分化合物具有较好的生物活性。从该属真菌中分离得到蒽醌[10]、吲哚生物碱[11]和萜类[12-14]等不同结构类型的化合物。本研究选取一株采集自南京市郊青檀叶片上的内生真菌进行研究,通过形态观察和ITS序列分析,该菌株被鉴定为Talaromycessp.。采用稻米培养基发酵,乙酸乙酯提取获得提取物,采用多种色谱分离方法,从发酵提取物中分离得到11个化合物(化合物1~11),通过对比核磁、质谱等数据,化合物1~11的结构鉴定为:1-deoxyrubralactone(1)[15]、alternariol(2)[16]、alternariol 4-methyl(3)[17]、altenuisol(4)[18]、3-hydroxyalternariol-5-O-methyl ether(5)[19]、(2'R,4'R,5'R)-altenuene(6)[20]、(2'S,4'R,5'R)-isoaltenuene(7)[20]、(2'R,4'R,5'R)-altenuene-2-acetoxyester(8)[21]、7-hydroxy-3,5-dimethyl-isochromen-1-one(9)[22]、腾毒素(10)[23]和二氢腾毒素(11)[23],结构式见图1。

图1 化合物1~11的化学结构Fig.1 The structures of compounds 1~11
1 材料与方法
1.1 仪器与试剂
仪器:EYELAN-1100旋转蒸发仪(东京理化);LX-200小型离心机(北京佳航博创科技有限公司);AL-204万分之一电子分析天平(瑞士Mettler Toledo公司);600 MHz核磁共振波谱仪(美国Varian Mercury公司);Agilent 6500高分辨质谱(美国Agilent公司);Agilent 1260高效液相色谱仪(美国Agilent公司);LC-6AD岛津高效液相色谱仪(日本Shimadzu公司);JASCO-J-815圆二色光谱仪(日本Jasco公司);RP-C18色谱柱4.6 mm×150 mm(美国Agilent公司);Agilent Zorbax SB-C18column半制备色谱柱10.0 mm× 250 mm(美国Agilent公司);Kromasil 100-5-C18column 色谱柱10.0 mm×250 mm(瑞典Akzo Nobel公司);Combi Flash®Rf+中压制备色谱仪(美国Teledyne ISCO公司);超低温冰箱(日本Sanyo公司)。
试剂:甲醇(色谱纯)、乙腈(色谱纯)、石油醚(AR)、乙酸乙酯(AR)、无水甲醇(AR)和甲酸(AR)为研究院试剂库领取;氘代试剂购自北京百灵威公司;丙酮(色谱纯)购自美国Thermo Fisher Scientific公司;薄层层析硅胶购自新诺有限公司;酵母提取物购自Sigma-Aldrich公司;麦芽糖购自Sigma-Aldrich公司;蛋白胨购自英国Oxoid公司;琼脂购自北京微生物培养基制品厂。
1.2 菌株发酵
1.2.1 菌株
植物内生真菌T.sp.(组内编号RCN134)由南京师范大学陈双林教授提供,于2006年10月采集自江苏省南京市郊的青檀叶片,菌株保存于中国科学院微生物所普通微生物保存中心,ITS基因序列已提交NCBI基因库(Genbank Accession No.ON261385)。
1.2.2 菌株发酵
种子液配制:将菌种涂布于PDA平板上,在平板上生长5~7 d。待平板上长满一定量的菌落后,将连同培养基在内的4个1 cm2大小的菌块接种到500 mL 的锥形瓶中(内含200 mL麦芽汁液体培养基)。种子液的配方为葡萄糖4.0 g、麦芽汁10.0 g、酵母提取物 4.0 g、蒸馏水1 L,按配方混合并搅拌均匀,将培养液pH值调至6.5,封口,在121℃灭菌30 min后冷却备用。将接种完成的锥形瓶置于摇床上培养5 d后(培养温度:25℃;转速:200 r/min),用无菌水将种子培养液稀释至浓度约1×106个/mL的菌悬液。
固体培养基配制:将80 g大米和120 mL蒸馏水加入到500 mL锥形瓶中,封口膜封口,待大米被蒸馏水浸泡24 h后,在121℃的高压灭菌锅中灭菌25 min。待固体培养基冷却后,量取5 mL菌悬液接种到固体发酵培养基上,接种40瓶,室温培养40 d。
1.3 提取与分离
稻米培养基发酵40 d后,加入乙酸乙酯(350 mL× 40瓶)浸泡24 h并搅拌均匀,重复4次,合并提取液,减压蒸干溶剂得到粗提取物20.8 g,粗提物以1:1的比例拌100~200目硅胶拌样,石油醚/乙酸乙酯/甲醇体系梯度洗脱(每个梯度800 mL)。
组分3(石油醚:乙酸乙酯=4:1洗脱,1400 mg)经中压反相柱色谱分离(25%~100%甲醇-水,梯度洗脱)。其中组分3.1(25%甲醇-水洗脱,500 mg)经半制备高效液相色谱(48%乙腈-水50 min;2 mL/min)制备得到化合物9(2.1 mg;tR49.0 min)。组分3.2(30%甲醇-水洗脱,500 mg)经半制备高效液相色谱(51%乙腈-水75 min;2 mL/min)制备得到化合物1(1.8 mg;tR40.0 min)和化合物2(7.3 mg;tR59.0 min);组分3.3(40%甲醇-水,70 mg)经半制备高效液相色谱(29%乙腈-水100 min;2 mL/min)制备得到化合物5(3.5 mg;tR95.0 min);组分3.4(55%甲醇-水,50 mg)经半制备高效液相色谱(72%甲醇-水37.5 min;2 mL/min)制备得到化合物3(7.1 mg,tR34.5 min)。
组分4(石油醚:乙酸乙酯=5:2洗脱,1000 mg)经中压反相柱色谱分离(30%-100%甲醇-水,梯度洗脱)。其中组分4.2(40%甲醇-水,130 mg)经半制备高效液相色谱(32%乙腈-水90 min;2 mL/min)制备得到化合物8(2.1 mg,tR84.0 min)和化合物4(1.1 mg,tR74.0 min)。
组分6(石油醚:乙酸乙酯=3:7洗脱,700 mg)经中压反相柱色谱分离(30%-100%甲醇-水,梯度洗脱)。其中组分6.1(30%甲醇-水,250 mg)用半制备高效液相色谱(25%乙腈-水40 min;2 mL/min)制备得到化合物6(2.0 mg,tR35.0 min)和化合物7(3.3 mg,tR33.5 min)。
组分7(石油醚:乙酸乙酯=0:1洗脱,500 mg)经中压反相柱色谱分离(40%~100%甲醇-水,梯度洗脱)。其中组分7.2(50%甲醇-水,50 mg)用半制备高效液相色谱(28%乙腈-水110.0 min;2 mL/min)制备得到化合物10(17.6 mg,tR90.0 min)和化合物11(5.3 mg,tR100.0 min)。
1.4 活性测试
1.4.1 供试品的配置
配制样品初始浓度为10 mg/mL二甲基亚砜溶液作为母液,用时将母液用PBS缓冲液稀释不同倍数。
1.4.2 MTT法
96孔板中接入细胞密度约为104/孔,培养24 h后并除去培养液,然后加入样品溶液(溶液为含有0.2%二甲基亚砜的50 μL培养基溶液或合适浓度的化合物样品溶液(0.1~100 µmol/L)。37℃下连续孵育4 h,避光条件下将原培养基更换为DMEM培养基,继续孵育48 h。以无血清培养基或PBS培养基溶解MTT,调整MTT浓度为0.5 mg/mL,96孔板中加入50 μL MTT溶液,继续孵育3 h。去除MTT培养基后,每孔加入100 μL二甲基亚砜溶液,设定转速为60 r/min,震荡 5 min使沉淀溶解并除去气泡。采用酶标仪测定 540 nm下的吸光度值,重复3次。按下式计算细胞抑制率:细胞抑制率(%)=(1-试验组吸收值A/对照组吸收值A)×100%。
2 结果
2.1 结构鉴定
化合物1:淡黄色粉末;E S I-M Sm/z:261.1[M+H]+;1H NMR(600 MHz,acetone-d6)δH:11.32(1H,s,6-OH),6.93(1H,d,J=2.3 Hz,H-9),6.77(1H,d,J=2.3 Hz,H-7),4.02(3H,s,8-OCH3),3.60(1H,pd,J=6.9,1.3 Hz,H-1),2.95(1H,dd,J=18.8,6.5 Hz,H-2),2.26(1H,dd,J=18.8,1.3 Hz,H-2),1.47(3H,d,J=7.0 Hz,H-10);13C NMR(150 MHz,acetone-d6)δC:195.7(C-3),168.0(C-8),166.1(C-6),165.7(C-5),149.1(C-3a),145.3(C-10a),136.1(C-9a),104.0(C-7),103.6(C-9),102.7(C-5a),56.7(8-OCH3),43.3(C-2),25.7(C-1),21.0(C-10)。以上波谱数据与文献[15]对照基本一致,因此鉴定为1-deoxyrubralactone。
化合物2:淡黄色粉末;E S I-M Sm/z:259.1[M+H]+;1H NMR(600 MHz,DMSO-d6)δH:11.76(1H,s,3-OH),7.23(1H,d,J=2.0 Hz,H-6),6.71(1H,d,J=2.5 Hz,H-5'),6.63(1H,d,J=2.5 Hz,H-3'),6.35(1H,d,J=2.0 Hz,H-4),2.70(3H,s,H-8);13C NMR(150 MHz,DMSO-d6)δC:165.9(C-7),164.7(C-5),164.0(C-3),158.4(C-4'),152.6(C-2'),138.3(C-6'),138.1(C-1),117.5(C-5'),109.0(C-1'),104.5(C-6),101.6(C-3'),100.9(C-4),97.1(C-2),25.2(C-8)。以上波谱数据与文献[16]对照基本一致,因此鉴定为alternariol。
化合物3:淡黄色粉末;E S I-M Sm/z:273.1[M+H]+;1H NMR(600 MHz,DMSO-d6)δH:7.23(1H,d,J=2.6 Hz,H-6),6.73(1H,d,J=2.2 Hz,H-5'),6.65(1H,d,J=2.2 Hz,H-3'),6.63(1H,d,J=2.6 Hz,H-4),3.91(3H,s,5-OCH3),2.74(3H,s,H-8);13C NMR(150 MHz,DMSO-d6)δC:166.2(C-7),164.7(C-5),164.1(C-3),158.6(C-4'),152.6(C-2'),138.5(C-6'),137.8(C-1),117.6(C-5'),108.8(C-1'),103.4(C-6),101.6(C-3'),99.2(C-4),98.5(C-2),55.8(5-OCH3),25.0(C-8)。以上波谱数据与文献[17]对照基本一致,因此鉴定为alternariol 5-methyl ether。
化合物4:褐色无定型粉末;ESI-MSm/z:275.1[M+H]+;1H NMR(600 MHz,acetone-d6)δH:11.67(1H,s,3-OH),7.56(1H,s,H-6'),7.05(1H,brs,H-4),6.83(1H,s,H-3'),6.49(1H,d,J=1.8 Hz,H-6),3.99(3H,s,5-OCH3);13C NMR(150 MHz,acetone-d6)δC:168.0(C-7),166.7(C-5),165.4(C-3),149.6(C-2'),145.9(C-4'),144.3(C-5'),138.6(C-1),110.8(C-6'),109.4(C-1'),104.3(C-3'),100.7(C-4),99.8(C-2),98.8(C-6),56.3(5-OCH3)。以上波谱数据与文献[18]对照基本一致,因此鉴定为altenuisol。
化合物5:黄色无定型粉末;ESI-MSm/z:289.1[M+H]+;1H NMR(600 MHz,DMSO-d6)δH:11.91(1H,s,3-OH),7.24(1H,d,J=2.2 Hz,H-6),6.73(1H,s,H-5'),6.63(1H,d,J=2.2 Hz,H-4),3.91(3H,s,5-OCH3),2.66(3H,s,H-8);13C NMR(150 MHz,DMSO-d6)δC:166.1(C-7),164.6(C-5),164.1(C-3),147.0(C-4'),141.5(C-2'),138.4(C-1),131.2(C-3'),126.4(C-6'),116.9(C-5'),109.1(C-1'),103.4(C-6),99.2(C-4),98.3(C-2),55.8(5-OCH3),24.5(C-8)。以上波谱数据与文献[19]对照基本一致,因此鉴定为3-hydroxyalternariol 5-O-methyl ether。
化合物6:白色无定型粉末;ESI-MSm/z:293.1[M+H]+;[α]25D-3.0(c1.0,MeOH);CD(c1×10-3mol/L,MeOH)λmaxnm(Δε):237(+2.7),280(-1.0),325(-0.1)。1H NMR(600 MHz,acetone-d6)δH:11.44(1H,s,3-OH),6.71(1H,d,J=2.3 Hz,H-6),6.46(1H,d,J=2.4 Hz,H-4),6.31(1H,d,J=2.9 Hz,H-6'),4.12(1H,dd,J=5.5,2.9 Hz,H-5'),3.92(3H,s,5-OCH3),3.85(1H,ddd,J=8.9,5.5,3.8 Hz,H-4'),2.40(1H,dd,J=14.3,3.7 Hz,He-3'),2.01(1H,dd,J=14.3,8.9 Hz,Ha-3'),1.53(3H,s,H-8);13C NMR(150 MHz,acetone-d6)δC:169.6(C-7),167.2(C-5),164.8(C-3),140.4(C-1),133.7(C-1'),131.6(C-6'),103.1(C-6),101.5(C-4),101.4(C-2),82.0(C-2'),71.9(C-5'),70.5(C-4'),56.2(5-OCH3),40.3(C-3'),28.0(C-8)。以上波谱数据与文献[20]对照基本一致,通过与文献的CD数据[(c1.7 mmol/L,MeOH)λmaxnm(Δε):231(+25.2),278(-17.2),321(-2.0)]比对,数据基本一致,因此鉴定其为(2'R,4'R,5'R)-altenuene。
化合物7:白色无定型粉末;ESI-MSm/z:293.1[M+H]+;[α]25D+14.00(c1.0,MeOH);CD(c1× 10-3M,MeOH)λmaxnm(Δε):237(-1.1),280(+1.7),325(+0.2)。1H NMR(600 MHz,acetone-d6)δH:11.47(1H,s,3-OH),6.70(1H,d,J=2.3 Hz,H-6),6.47(1H,d,J=2.3 Hz,H-4),6.25(1H,d,J=2.4 Hz,H-6'),4.26(1H,dd,J=7.9,2.4 Hz,H-5'),3.92(3H,s,5-OCH3),3.78(1H,ddd,J=12.7,7.9,3.7 Hz,H-4'),2.27(1H,m,He-3'),2.09(1H,brs,Ha-3'),1.56(3H,s,H-8);13C NMR(150 MHz,acetone-d6)δC:169.0(C-7),167.2(C-5),165.0(C-3),138.9(C-1),133.0(C-1'),131.1(C-6'),103.0(C-6),101.8(C-4),101.1(C-2),83.1(C-2'),74.2(C-5'),71.9(C-4'),56.3(5-OCH3),44.3(C-3'),26.8(C-8)。以上波谱数据与文献[20]对照基本一致,通过与文献的CD数据[(c3.4 mmol/L,MeOH)λmaxnm(Δε):231(-4.9),278(+3.2),321(+0.5)]比对,数据基本一致,因此鉴定为(2'S,4'R,5'R)-isoaltenuene。
化合物8:白色无定型粉末;ESI-MSm/z:335.1[M+H]+;[α]25D-25.0(c1.0,MeOH);CD(c1× 10-3M,MeOH)λmaxnm(Δε):237(+2.7),280(-1.0),325(-0.1)。1H NMR(600 MHz,DMSO-d6)δH:11.29(1H,s,3-OH),6.53(1H,d,J=2.3 Hz,H-6),6.46(1H,d,J=2.3 Hz,H-4),6.04(1H,d,J=2.7 Hz,H-6'),5.24(1H,dd,J=5.9,2.7 Hz,H-5'),4.10(1H,m,H-4'),3.86(3H,s,5-OCH3),2.56(1H,dd,J=14.6,4.1 Hz,Ha-3'),2.14(3H,s,H-10),2.08(1H,dd,J=14.6,8.9 Hz,He-3'),1.56(3H,s,H-8);13C NMR(150 MHz,DMSO-d6)δC:171.0(C-9),168.5(C-7),166.2(C-5),164.2(C-3),138.3(C-1),136.1(C-1'),124.6(C-6'),103.1(C-6),101.2(C-4),100.5(C-2),80.5(C-2'),73.8(C-5'),67.4(C-4'),55.8(5-OCH3),39.6(C-3'),27.9(C-8),21.1(C-10)。以上波谱数据与文献[21]对照,比对化合物8与化合物6的CD数据,二者基本一致,因此化合物8鉴定为(2'R,4'R,5'R)-altenuene-5'-acetoxyester。
化合物9:白色粉末;E S I-M Sm/z:191.1[M+H]+;1H NMR(600 MHz,methanol-d4)δH:6.64(1H,d,J=2.5 Hz,H-8),6.63(1H,d,J=2.5 Hz,H-6),6.00(1H,s,H-4),2.71(3H,s,H-10),2.32(3H,s,H-9);13C NMR(150 MHz,methanol-d4)δC:182.0(C-1),166.6(C-3),163.2(C-8a),161.5(C-7),143.6(C-5),118.0(C-6),115.6(C-4a),111.4(C-4),101.7(C-8),23.1(C-10),19.8(C-9)。以上波谱数据与文献[22]对照基本一致,因此鉴定为7-hydroxy-3,5-dimethyl-isochromen-1-one。
化合物10:白色无定型粉末;ESI-MSm/z:415.2[M+H]+;1H NMR(600 MHz,CDCl3)δH:7.74(1H,s,H-20),7.41(5H,brs,H-2',H-3',H-4',H-5',H-6'),5.19(1H,d,J=12.8 Hz,H-9),4.36(1H,s,H-6),4.20(1H,brs,H-3),3.58(1H,d,J=12.8 Hz,H-9),3.19(3H,s,H-13),2.81(3H,s,H-19),1.66(1H,m,H-14),1.53(3H,d,J=7.1 Hz,H-18),1.30(1H,m,H-15),1.25(1H-s-H-14)-0.63(3H,d,J=6.4 Hz,H-16),0.52(3H,s,H-17)。13C NMR(150 MHz,CDCl3)δC:171.5(C-2),171.5(C-8),170.1(C-5),164.6(C-11),136.9(C-20),133.0(C-1'),131.9(C-12),130.8(C-4'),129.7(C-2',C-6'),129.4(C-3',C-5'),56.9(C-6),49.9(C-3),44.5(C-9),40.7(C-14),35.4(C-13),30.2(C-19),24.6(C-15),22.3(C-16),22.1(C-17),15.6(C-18)。以上波谱数据与文献[23]对照基本一致,因此鉴定为腾毒素。
化合物11:白色无定型粉末;ESI-MSm/z:417.2[M+H]+;1H NMR(600 MHz,CDCl3)δH:7.73(1H,s,10-NH),7.29(2H,d,J=7.5 Hz,H-3',H-5'),7.22(2H,m,H-2',H-6'),7.20(1H,m,H-4'),4.92(1H,t,J=14.7 Hz,H-9),4.61(1H,dd,J=11.3,3.5 Hz,H-3),4.26(1H,d,J=8.3 Hz,H-6),3.68(1H,d,J=14.8 Hz,H-20),3.50(1H,d,J=14.7 Hz,H-9),2.87(1H,m,H-20),2.83(3H,s,H-13),2.77(3H,s,H-19),1.67(1H,dt,J=13.8,6.7 Hz,H-14),1.54(3H,d,J=6.5 Hz,H-18),1.38(1H,m,H-15),1.24(1H,m,H-14),0.82(3H,d,J=6.5 Hz,H-16),0.76(3H,d,J=6.5 Hz,H-17)。13C NMR(150 MHz,CDCl3)δC:172.2(C-2),171.6(C-8),170.6(C-5),170.1(C-11),137.0(C-1'),129.0(C-3',C-5'),128.2(C-2',C-6'),127.1(C-4'),62.9(C-12),57.3(C-6),48.4(C-3),44.5(C-9),41.0(C-14),34.3(C-20),30.6(C-13),30.1(C-19),24.5(C-15),22.6(C-16),22.3(C-17),15.6(C-18)。以上波谱数据与文献[23]对照基本一致,因此鉴定为二氢腾毒素。
2.2 化合物生物活性测试
采用MTT法评价化合物对SKBR3(人乳腺癌细胞株)、A549(人非小细胞肺癌细胞株),J82(人膀胱癌细胞株)和Huh7(人肝癌细胞株)4种肿瘤细胞株的细胞毒活性。化合物1~11及阳性对照顺铂在100 µmol/L和10 µmol/L浓度下对4种细胞的抑制率见表1,在100 µmol/L的浓度下,化合物2和3对J82细胞具有一定抑制活性,抑制率分别为56.9%和59.7%;其中化合物3对SKBR3及J82细胞的IC50值分别为62.0和83.1 µmol/L; 阳性对照顺铂对四株细胞的IC50值分别为3.7、6.6、0.6和5.1 µmol/L。评价结果表明,化合物1~11对所选4种细胞的细胞毒活性较弱。
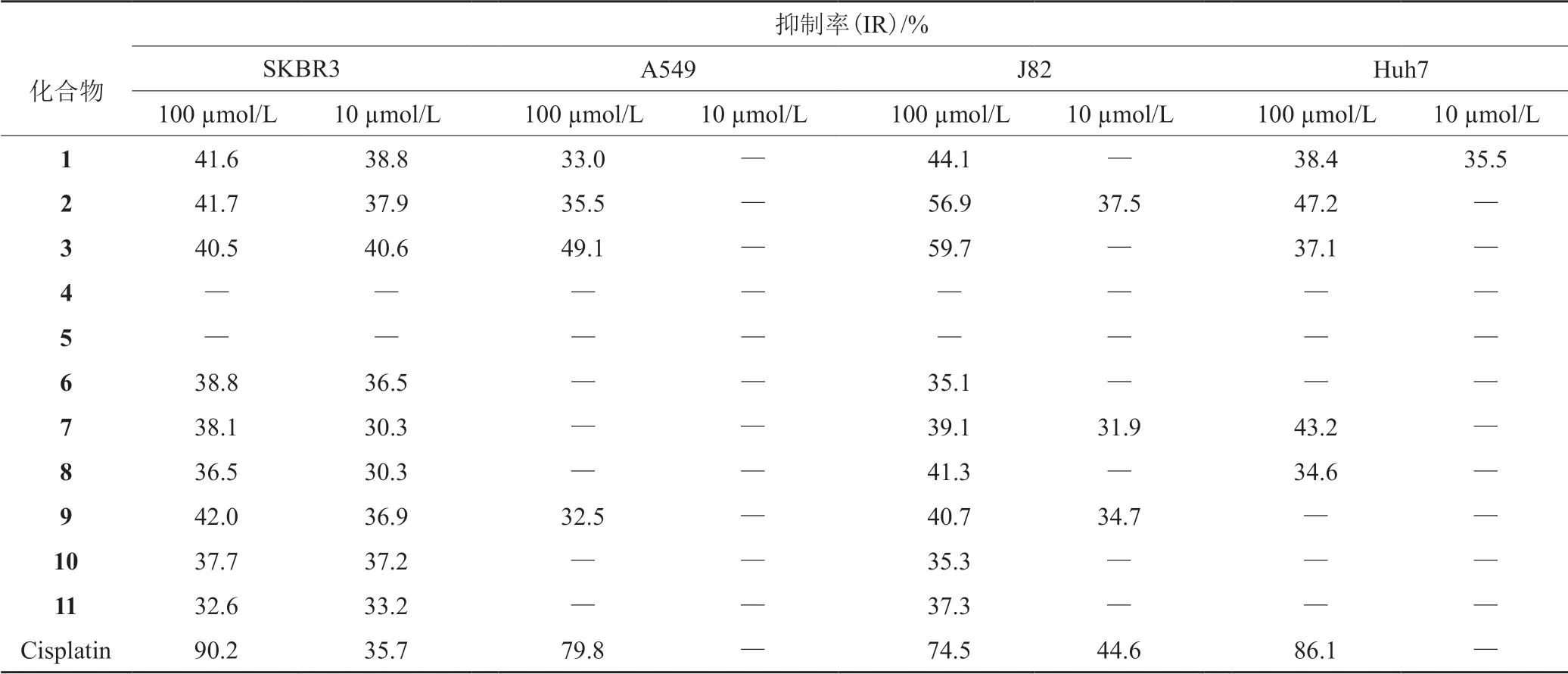
表1 化合物1~11在100和10 µmol/L浓度下对四种细胞株的抑制率Table 1 Inhibition rates of compounds 1~11 against four cell lines at 100 and 10 µmol/L
3 结论
青檀Pterocelti tatarinowii为我国特有的单种属第三纪孑遗植物,作为一种古老的植物,在长期进化过程中,与其内生菌群形成了稳定的适应关系,文献报道对来自不同采集地的青檀枝条、叶片内生真菌菌群的多样性研究结果表明,拟茎点霉属Phomopsis和交链孢属Alternaria真菌为青檀内生真菌的优势菌群[24-25]。
本研究对青檀叶片内生真菌T.sp.的次级代谢产物开展研究,分离得到11个化合物,通过核磁、质谱以及CD数据对比,确定了11个化合物的结构。
化合物1为聚酮类化合物,文献报道该化合物为DNA聚合酶抑制剂,对大鼠DNA聚合酶β和人DNA聚合酶κ的IC50值分别为11.9和59.8 µmol/L[15]。
化合物2~8属于交链孢酚类化合物,结构上的区别主要在于6H-benzo[c]chromen-6-one母核上取代基种类、位置和芳环部分氢化程度不同。文献报道,化合物2在10 µg/mL浓度下对小鼠淋巴瘤细胞株L5178Y的抑制率为11.8%[16];化合物3由红树林内生真菌No.2240中分离得到,对人口腔上皮癌细胞株KB及其多药耐药细胞株KBv200的IC50值分别为4.82 和4.94 µg/mL[17];化合物4从植物病原菌Alternariasp.中分离得到,为一种植物毒素[18];化合物5由蓼属药用植物Polygonum senegalense的内生真菌Alternariasp.中分离得到,对小鼠淋巴瘤细胞L5178Y的IC50值为7.8 µg/mL,并且对ARK5等多种肿瘤相关蛋白激酶具有抑制作用[19];化合物6和7为立体异构体,由地衣内生真菌Nigrosporasp.中分离得到[20];化合物8由植物内生真菌Alternaria alternata中分离得到,为化合物7的5'羟基乙酰化衍生物,对葡萄球菌(Staphylococcus aureusATCC 25923)和白色念珠菌(Candida albicansATCC 24433)的MIC80值分别为15.4和48.8 µg/mL[21];化合物9由植物内生真菌Ulocladiumsp.中分离得到,对白念珠菌(Candida albicansSC 5314)的IC50值为97.93 µmol/L[22]。
化合物10和11属于环肽类化合物,由L-亮氨酸,L-苯丙氨酸,甘氨酸和L-丙氨酸缩合形成,文献报道腾毒素(10)是由链格孢霉产生的一种霉菌毒素,能够通过降低植物细胞内ATP酶活性抑制光合磷酸化[26]。
目前已从Talaromyces属真菌中分离得到200余种次级代谢产物,包括萜类、甾体、聚酮、异香豆素、醌类、生物碱和肽类等多种结构类型[9]。文献调研结果表明,未见化合物1、化合物3~11从Talaromyces属菌株中分离的报道。本研究初步阐明了青檀叶片内生真菌T.sp.的化学成分,为进一步研究青檀叶片内生真菌与宿主植物的相互作用及其生态学意义奠定了基础。
致谢:感谢南京师范大学陈双林教授为本研究提供菌株。

