黄连根腐病病原菌的分离鉴定及其拮抗菌筛选
廖海浪 钟芙蓉 柯汶佳 李娜 马云桐,*
(1 成都中医药大学药学院,成都 611137;2 四川省农业科学院经济作物育种栽培研究所,成都 611300;3 西南特色中药资源国家重点实验室,成都 611137)
黄连(COPTIDIS RHIZOMA,Huanglian)为毛茛科植物黄连Coptis chinensisFranch.、三角叶黄连C.deltoideaC.Y.Cheng et Hsiao或云连C.teetaWall.的干燥根茎,具有清热燥湿,泻火解毒等功效[1]。由于市场需求量大,野生资源被过度采挖,野生黄连原植物已处于濒危的状态。商品药材主要来源于毛茛科植物黄连的栽培品。目前,生产中出现两大急需解决的问题,一是根腐病的防治;二是“连作障碍”的问题。黄连连作也多导致根腐病暴发,黄连大面积腐烂死亡。根腐病多发生在黄连种植2~4年后,且不易被发现,一旦发生将造成极大的经济损失。生产上常采用拔除病株,高锰酸钾溶液灌根等方法处理,但效果不佳,缺乏有效的防治药物。目前黄连根腐病的研究主要集中于病原菌分离鉴定等方面,但根腐病作为一种典型的土传病害,通常可以分离获得多种病原菌[2],目前文献报道的黄连根腐病的主要病原菌包括F.solani[3]、F.carminascens[4]、尖孢镰刀菌(F.oxysporum)[5]、三线镰刀菌(F.tricinctum)[5]、F.aνenaceum[6]和Diaporthe eres[7]。课题组前期研究表明黄连根腐病可能是由多种病原菌导致的,其中主要包括Fusarium、Volutella、Exophiala、Cylindrocarpon等多种真菌[8]。明确黄连根腐病病原菌,是认识和解决黄连根腐病的第一步。本研究采用经典的柯赫氏法则进行黄连根腐病病原菌分离和致病性测定,通过分子和形态对其进行鉴定,并对其致病过程进行研究,为黄连根腐病发生的微生态机制验证奠定基础,也为黄连根腐病的防治奠定一定基础。
植物微生物组作为植物的扩展基因组,在植物生长发育过程中发挥重要作用。越来越多的证据表明,宿主积极塑造自己的微生物群来抑制疾病发生[9],微生物群在植物健康生长过程中产生积极影响。通过健康黄连根际根内微生物网络分析发现,健康黄连根际根内有大量的微生物与病原微生物呈负相关,表明健康黄连根际根内存在大量的有益微生物,对病原微生物具有一定的拮抗作用,对于维持黄连植株的健康具有至关重要的作用[8]。本研究通过多种筛选培养基,对黄连根际根内微生物进行分离,采用平板拮抗实验筛选具有拮抗作用的微生物,为开发黄连根腐病的生物防治制剂奠定基础,也为黄连根腐病微生物防治提供微生物资源。
1 实验材料、试剂及仪器
1.1 实验材料
2018年11 月于洪雅县瓦屋山药业有限公司黄连种植基地(四川省眉山市洪雅县高庙镇黑山村2组,29°29′10.91″ N,103°9′39.9″ E)采集健康黄连和感染根腐病黄连的带土根系作为实验材料。
1.2 培养基
病原菌分离培养基选择常用的马铃薯葡萄糖琼脂培养基(potato glucose agar medium,PDA),拮抗菌的分离选择常用的真菌培养基包括PDA,察氏培养基(Czapek-Dox medium,CZ),马丁氏琼脂培养基(Martin's agar medium,M)和细菌培养基常用培养基包括土壤浸出液琼脂培养基(soil extract agar medium,TR)[10],酵母提取物甘露醇培养基(yeast extract mannitol medium,YEM),M408培养基(M408),自来水酵母提取物培养基(tap water yeast extract medium,TWYE),酵母培养基(yeast medium,JM)。部分细菌培养基配方来源于16S rDNA数据预测培养基(https://komodo.modelseed.org/growrec.htm),主要培养基包括营养琼脂培养基(nutrient agar medium,NA,ID:DSMZ_Medium1),肉膏蛋白胨培养基(Luria-Bertani medium,LB,DSMZ_Medium381),内生固氮菌培养基(diazotrophic medium,RBA,ID:DSMZ_medium441),非自养培养基H3P(heterotrophic medium H3P,H3P,ID:DSMZ_Medium428),胰酪胨大豆肉汤培养基(trypticase soy broth agar,535,ID:DSMZ_Medium535),R2A培养基(R2A medium,830,ID:DSMZ_Medium830),链霉菌培养基GYM(GYM Streptomyces medium,GYM,ID:DSMZ_Medium65),胰蛋白胨大豆琼脂培养基CASO(CASO agar,CASO,ID:DSMZ_Medium220)。
2 实验方法
2.1 病原菌分离
采用组织分离法[53],取感病黄连植株根茎及须根,自来水下冲洗干净,75%乙醇消毒30 s,2%次氯酸钠消毒10 min,无菌水漂洗3~5次,用滤纸吸干,用无菌剪刀剪取病健交界处,在无菌条件下接种于含青霉素100 mg/L的PDA培养基中,温度设置为25℃,在培养箱中暗培养5~7 d。每天早晚各观察1次,待有新的肉眼可见的菌落,立即采用划线稀释法进行纯培养,将纯培养菌落接种于PDA斜面培养基,编号并记录,25℃长至菌落布满整个培养基,于4℃保存菌种。
2.2 病原菌鉴定
2.2.1 病原菌系统发育分析
在PDA培养基上分别活化4℃冰箱中的保存的疑似病原菌,在25℃培养箱中暗培养5~7 d,取适量孢子或菌丝至2 mL的EP试管中,再用真菌基因组DNA快速抽提试剂盒进行DNA提取,按照试剂盒说明书操作。
选用通用引物ITS1(5'-TCCGTAGGTGAACCTGC GG-3')和ITS4(5'-TCCTCCGCTTATTGATATGC-3')对ITS 序列进行扩增,通用引物EF-1(5'-CATCGAGAAGTT CGAGAAGGTT-3')和EF-2(5'-CATGTTCTTGATGAA -3')对EF-1α基因[11]进行扩增。
25 μL PCR反应体系为:2×TaqPCR Master Mix溶液、10 μmol/L上下游引物各1 μL、模板2 μL,补充ddH2O至25 μL。扩增程序为:94℃预变性5 min; 94℃变性30 s,ITS 52℃退火30 s,EF-1α 56℃退火30 s,72℃延伸1 min,34个循环;72℃总延伸7 min,4℃保存。
扩增产物用1.5%的琼脂糖凝胶进行电泳监测,将PCR扩增后的产物送样至擎科生物技术有限公司进行测序。所得到的核苷酸序列在GenBank进行同源性比较。用系统发育分析软件PAUP* 4.0 Beta 10运行相关文件,执行最大简约法的分析运算[12]。
2.2.2 病原菌形态学鉴定
将纯化后的菌株接种于PDA培养基上进行活化,25℃倒置培养,观察菌落特征。使用插片培养法对病原菌的形态进行鉴定,即将无菌的盖玻片以45°斜插入培养基中,紧靠接种物,使菌体沿盖玻片生长,置25℃培养箱培养3~5 d。培养完毕后,取出盖玻片放在载玻片上,直接用低倍镜观察病原真菌的自然生长个体形态。观察记录解剖镜下菌落特征、产孢结构及孢子形态。
2.2.3 病原菌致病性测定
随机选取2年生黄连,每组10株,自来水下冲干净,锡箔纸包裹地上部分,无菌操作台上对根部进行灭菌,依次用75%乙醇消毒30 s,2%次氯酸钠消毒10 min,无菌水漂洗3~5次,用滤纸吸干表面水分。分别在浓度为106CFU/mL的各种真菌孢子混悬液中浸根30 min,另外在0.5%吐温20磷酸缓冲液中浸根相同时间作为空白对照,单株放置于50 mL无菌离心管中,管口用无菌的湿棉花保持根部湿润,离心管用锡箔纸包裹遮光,置于人工气候室培养7~10 d,观察并记录各组幼苗生长变化情况。待黄连发病后,从接种发病的黄连须根上再次分离病原菌,完成柯赫氏法则验证,则能确认为黄连根腐病原菌。
2.3 病原菌侵染过程观察
取健康黄连根系,洗净,自来水下冲洗1 h,按照无菌操作法,转移至无菌瓶中,75%乙醇浸泡30 s,2%次氯酸钠溶液消毒10 min,无菌水清洗5次,每次1 min。分别置垫有滤纸保湿的容器中,每个容器置3个样品。用移液枪取上述孢子悬浮液分别滴加在不同的样品上,以滴加0.5%吐温20磷酸缓冲液和1%绿豆汤培养基的样品为空白对照。每个处理重复3次,将容器置于25℃培养箱中黑暗培养。分别于接种后0.5、1、2、3、4、5、6 和7 d随机选取3根黄连根系用于固定。用手术解剖刀将黄连根系样本切成0.5~ 1 cm长的小段,将样品置入pH6.8、2.5%戊二醛固定液中,进行前固定并存放于4℃冰箱中冷藏2 h左右。将固定液吸出,使用pH6.8、0.1mol/L PBS缓冲液冲洗样品3次,每次10 min。使用乙醇(其浓度为50%、70%和90%)进行梯度浓度脱水,10 min/次,再用浓度为100%的乙醇脱水,15 min/次,重复2次。加入50 % 叔丁醇的乙醇溶液置换1次,再用纯叔丁醇置换2次,每次15 min。将样品取出黏附于导电碳胶带上,置超临界CO2干燥仪中进行干燥。用Gressington 108型自动溅射镀膜机在样品表面镀上一层厚10.0~15.0 nm的金属膜,置于SEM电镜下观察。
2.4 黄连根际根内微生物分离
2.4.1 接种菌悬液制备
将黄连根系自土块中取出,轻轻抖动除去松散的附在根上的土粒。称取约l0 g根系,置盛l00 mL无菌磷酸缓冲液(PBS)的三角瓶中,振荡15 min,以洗下的土制成根际土悬液,离心得根际土。用无菌镊子取出根系,用无菌滤纸吸干,用75%乙醇浸泡30 s,2%次氯酸钠溶液消毒10 min,无菌水漂洗3~5次,取出后用无菌滤纸吸干,再用无菌剪刀将根剪成小段,即得黄连无菌根系。分别称取根际土和无菌根系约1.0 g于无菌研钵中磨碎,然后加10 mL无菌磷酸缓冲液(PBS,Na2HPO41.44 g,KH2PO40.24 g,KCl 0.2 g,NaCl 8.00 g,溶解后定容至1 L,调pH至7.4,121℃灭菌15 min)搅拌混匀即得根内菌悬液。以10倍稀释法分别稀释成一系列的稀释液(10-2~10-8)。
2.4.2 黄连根际微生物分离
稀释涂布法:取上述不同稀释浓度的根际土菌悬液100 μL分别接种于上述培养基表面,用无菌涂布器涂布均匀。每个培养基,每个稀释浓度各重复10次。培养条件,菌株纯化保存同上。
2.4.3 黄连根内微生物分离
外植体接种法:将灭菌的黄连根系小段,接种于平板培养基上,细菌采用37℃培养,真菌采用25℃培养。待有新的菌落长成之后,挑取菌落到相应培养基平板上经过划线稀释法获得单一菌落,挑取单一菌落至斜面培养基上培养并短时间保存。
稀释涂布法:取上述不同稀释浓度的根内菌悬液100 μL分别接种于上述培养基表面,用无菌涂布器涂布均匀。每个培养基,每个稀释浓度各重复10次。培养条件,菌株纯化保存同上。
2.5 黄连根腐病生防菌筛选
2.5.1 生防细菌筛选
参照Hussein等[13]的平板对峙法,将黄连根腐病病原菌在PDA培养基平板上活化4 d,待长出菌丝后,打孔器打孔菌饼(直径7 mm)置于另一新鲜PDA培养基平板中央,将分离得到的细菌以划线的方式接种于病原菌菌块东南西北4个方向各1株待筛细菌,距离2.5 cm,菌株划线长度约2 cm,28℃培养3 d后,观察病原菌与拮抗细菌之间是否有拮抗现象(明显的拮抗带或明显的生态位占领),每组设3个平行。在对照组PDA平板中间接种病原菌琼脂块,28℃培养4 d,病原菌铺满整个平板[14]。采用两侧划线同一拮抗细菌进行复筛,培养7 d后测量拮抗半径并计算抑菌率[15]。
2.5.2 生防真菌筛选
采用平板对峙法并略作修改,将黄连根腐病病原菌和待筛选真菌在PDA培养基平板上活化4 d,待长出菌丝后,打孔器打孔菌饼置于另一新鲜PDA培养基平板中央,25℃下继续培养2 d。将分离出的待选拮抗菌株点种于病原菌菌饼周围,每皿接种4个点,4个点接种不同待筛真菌,25℃恒温条件下培养,根据有无抑菌圈及抑菌带的大小判断其拮抗效果。同时对具有拮抗作用的菌株进行二次对峙实验,筛选出拮抗能力较强的菌株以备后续实验[16]。采用3点杯碟平板对峙生长速率法,培养7 d后测量拮抗半径并计算抑菌率[15]。

2.6 拮抗菌分子鉴定
4℃保存的拮抗细菌先于NA培养基上分别活化,细菌在37℃培养箱中暗培养5~7 d,细菌在25℃培养箱中暗培养5~7 d,取适量菌体至2 mL的EP试管中,再用细菌基因组DNA快速抽提试剂盒进行DNA提取,按照试剂盒说明书操作。
选用通用引物:27F(5'-AGAGTTTGATCCTGGCT CAG-3')和1429R(5'-GGTTACCTTGTTACGACTT-3')对16S序列进行扩增。
选用通用引物:ITS1(5'-TCCGTAGGTGAACCTG CGG-3')和ITS4(5'-TCCTCCGCTTATTGATATGC-3')对ITS序列进行扩增。
25 μL PCR反应体系为:2 ×TaqPCR Master Mix溶液、10 μmol/L上下游引物各1 μL、模板2 μL,补充ddH2O至25 μL。扩增程序为:94℃预变性5 min;94℃变性45 s,56℃退火45 s,72℃延伸90 s,34个循环;72℃延伸7 min,4℃保存。
扩增产物用1.5%的琼脂糖凝胶进行电泳监测,将PCR扩增后的产物送样至擎科生物技术有限公司进行测序。
所得到的核苷酸序列在GenBank进行同源性比较。选取标准菌株和原序列一起,采用在线的MAFFT(https://mafft.cbrc.jp/alignment/server/index.html)进行多序列比对[17]。采用Mesquite[18]将获得的fasta格式序列转换为phy格式。进入ATGC网站(http://www.atgc-montpellier.fr/),选择在线工具PhyML进行最大似然发育树构建[19]。
2.7 离体根上4株芽胞杆菌与2种病原菌的拮抗情况
以无菌水作为阴性对照(CK),用鉴定出的4株芽胞杆菌属细菌:B.νelezensisGJ-JM-1、B.subtilisGJTR-064、B.mycoidesGJ-LB-021、B.pseudomycoidesGJ-YEM-005。测定离体根的拮抗能力。选取约10 cm长的须根,将病原体的孢子悬浮液(2.1×107CFU/mL,100 μL)接种在最右侧(顶端)10 mm的须根内,将相应的芽胞杆菌菌株(A600=1、100 μL)接种在最左侧(基部)10 mm的须根内。湿润培养7 d后,观察离体根病原菌侵染的距离和侵染率。
3 实验结果
3.1 病原菌分离鉴定
3.1.1 病原菌系统发育分析
通过病原菌分离,共获得12株疑似病原菌,经过NCBI数据库BLAST比对,挑选合适菌株,基于供试菌株的ITS、EF-1α基因序列构建联合系统发育树。如图1所示,供试菌株CC-2-1,CC-2-2,CC-2-3,CC-2-4,CC-JING-1,CC-JING-2,CC-5-1和CC-5-2与菌株F.solaniMAFF 840046和F.solaniTH03-1聚集于一支,且支持率达100%,供试菌株CC-4-1,CC-4-2,CC-4-3和CD-4-1与F.aνenaceumRIFA-7和F.aνenaceumCC32聚集于一支,且支持率达100%。

图1 基于ITS和EF-1α串联序列的进化树Fig.1 Phylogenetic tree based on ITS and EF-1α concatenated sequences
3.1.2 病原菌形态学鉴定
CC-2-1,CC-2-2,CC-2-3,CC-2-4,CCJING-1,CC-JING-2,CC-5-1和CC-5-2在PDA形成白色稀疏菌丝体,在琼脂中不产生色素。分生孢子较宽,直而粗壮,有3~5个隔膜。顶端细胞钝而圆,足细胞几乎没有切口,鉴定为F.solani。(图2 A、C、E)CC-4-1,CC-4-2,CC-4-3和CD-4-1在PDA形成了丰富的白色菌丝体,并在琼脂中产生玫瑰色素。大型分生孢子长而细,直至稍弯曲,有1~3个隔膜,细胞顶端逐渐变细和弯曲,鉴定为F.aνenaceum(图2B、
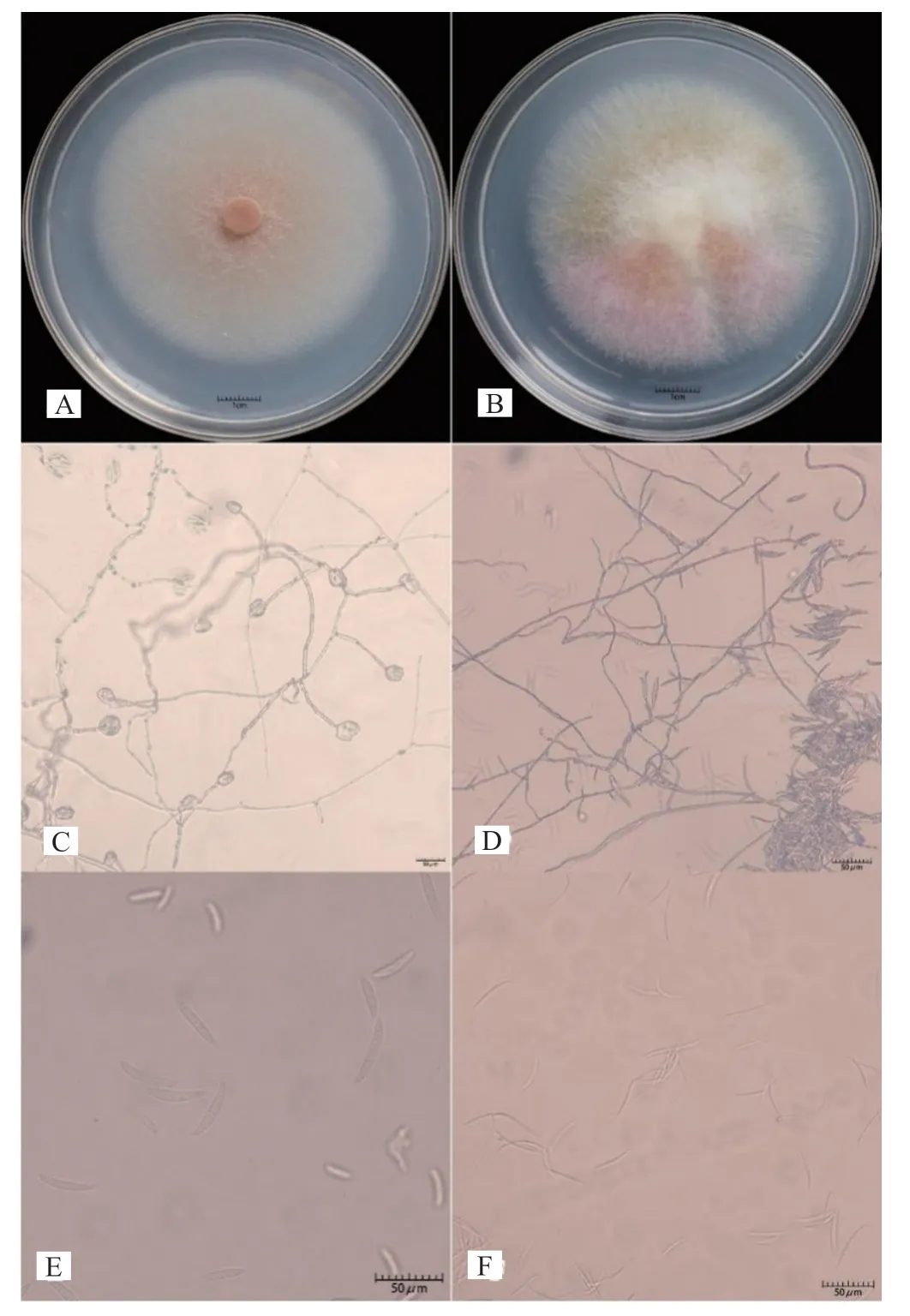
图2 代表病原菌的形态鉴定Fig.2 Morphological identification of representative pathogens
D、F)。
3.1.3 致病性测定及病原菌致病过程
各株病原菌回接后,黄连植株均表现为须根变黑,腐烂,须根病健交界处出现大量白色菌丝,叶片出现明显的枯萎现象。选取腐烂根系病健交界处进行再次分离,仍然能100%分离得到所用菌株(图3)。

图3 代表菌株致病性与大田黄连根腐病症状Fig.3 Pathogenicity of representative strains and symptoms of root rot of Coptis chinensis in field
两种黄连根腐病病原菌侵染黄连根系过程基本一致,病原菌孢子在0.5 d内便可黏附于黄连根系表面(图4A和E),于0.5~1 d内开始萌发,2 d后菌丝黏附于黄连根系并迅速生长(图4B和F),寻找黄连根系受损部位入侵黄连根系内部(图4C和G),6~7 d遍布整个黄连根系并产生大量的孢子(图4D和H)。

图4 F.solani和F.aνenaceum侵染黄连根系过程Fig.4 Root infection process of by F.solani and F.aνenaceum in C.chinensis
3.2 黄连根际根内微生物分离
采用多种培养基对黄连根系微生物进行分离,不同培养基收集到的菌株数目见表1。健康黄连根际共获得358株细菌和69株真菌,根内共获得170株细菌和175株真菌。
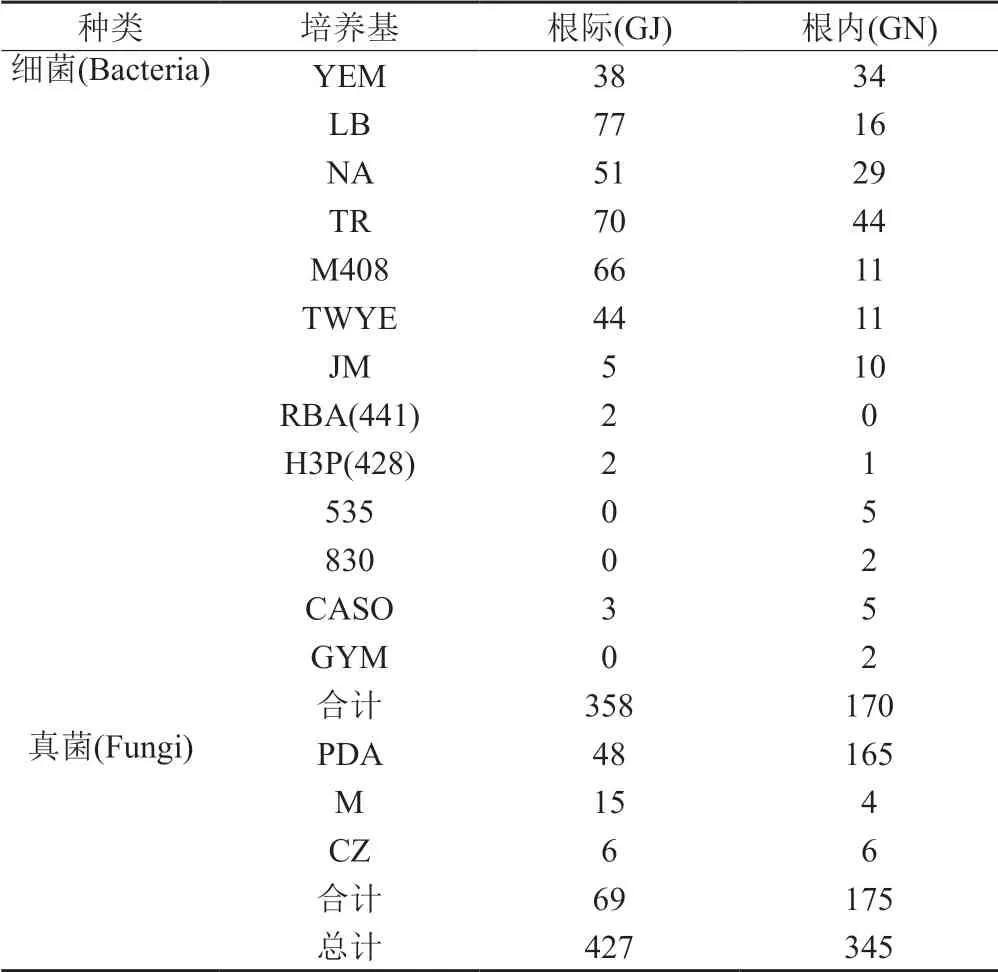
表1 健康黄连根际、根内微生物分离统计Tab.1 Isolation and statistics of microorganisms in rhizosphere and endosphere of healthy C.chinensis
3.3 拮抗菌活性评价及分子鉴定(表2~3和图5~6)

图5 拮抗细菌与病原菌的平板拮抗活性Fig.5 The antagonistic activities of four representative antagonistic bacteria and pathogens
对筛选到的具有拮抗活性的细菌和真菌分别进行DNA提取、16S区域和ITS区域进行扩增测序,所得到的核苷酸序列在GenBank进行同源性比较。选取标准菌株和原序列一起,采用在线的MAFFT进行多序列比对。采用Mesquite软件将获得的fasta格式序列转换为phy格式。进入ATGC网站选择在线工具PhyML进行最大似然发育树构建。拮抗细菌系统发育树见图7~8,拮抗真菌系统发育树见图9。拮抗菌拮抗活性及菌株汇总见表2,拮抗细菌汇总见表~3。本实验共获得77株拮抗菌,其中拮抗细菌58株,分布于7属15种,拮抗真菌19株,分布于4属5种。

图7 拮抗细菌系统发育树Fig.7 Phylogenetic tree of antagonistic bacter
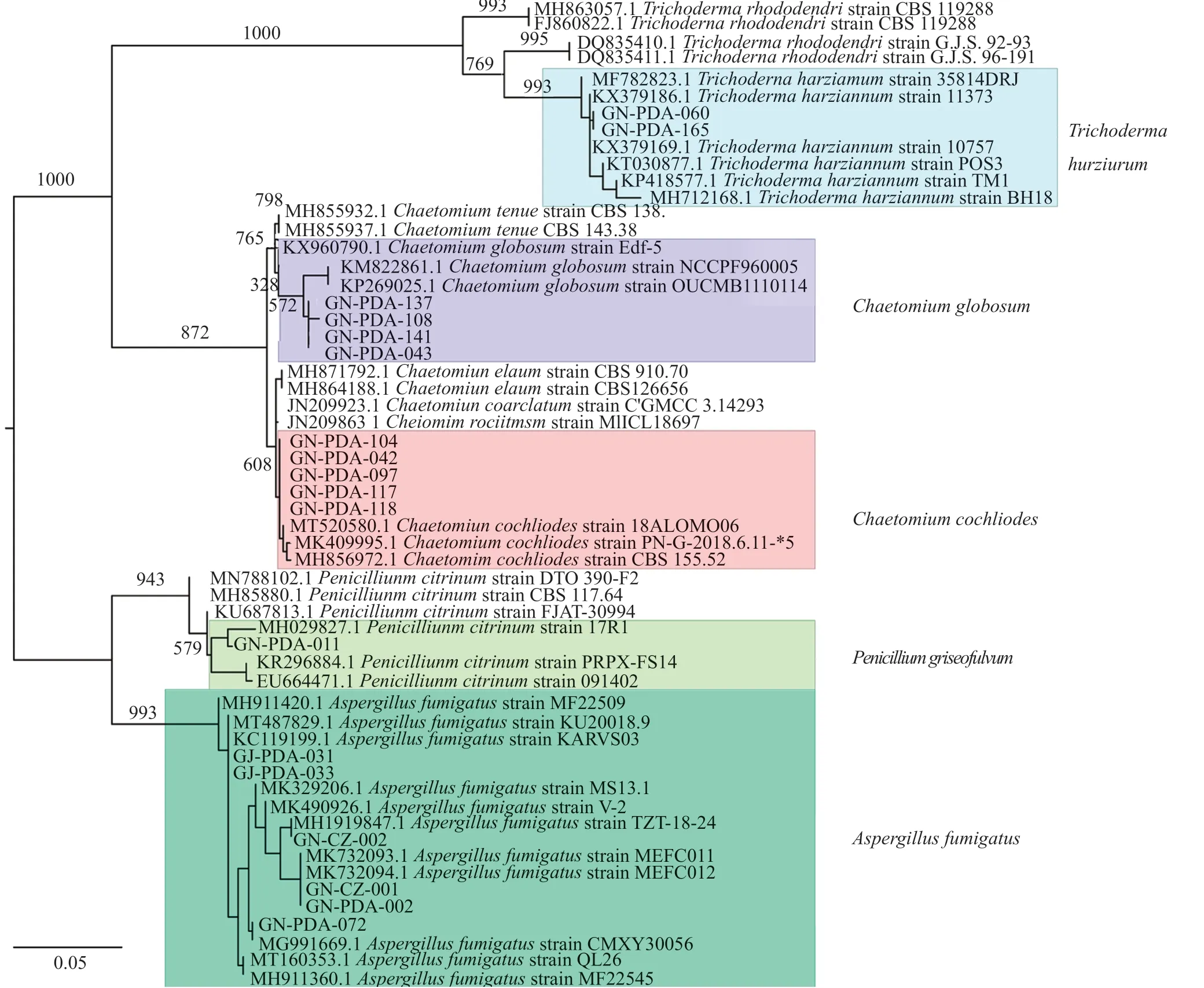
图9 拮抗真菌系统发育树Fig.9 Phylogenetic tree of antagonistic fungi

表2 拮抗细菌汇总表Tab.2 Summary of antagonistic bacteria
3.4 离体根上4株芽胞杆菌与2种病原菌的拮抗情况
如图10所示,在离体黄连根系上,4株芽胞杆菌属细菌与2种病原菌均具有一定的拮抗活性。4株芽胞杆菌属细菌能在一定程度上抑制2种病原菌在黄连离体根上的菌丝蔓延。

图10 离体根上4株芽胞杆菌与2种病原菌的拮抗情况Fig.10 Antagonism of 4 Bacillus strains against 2 pathogens on in detached roots
4 讨论
根据扩增子分析结果发现感病黄连根内腐生型(saprotroph)真菌显著高于健康黄连根内,感病黄连根内动物病原菌(animal pathogen)、土壤腐生菌(soil saprotroph)、植物腐生菌(plant saprotroph)、木质腐生菌(wood saprotroph)显著高于健康植株根内[8]。感病黄连植株根际植物病原菌(plant pathogen)显著高于健康黄连植株根际,这些真菌可能是黄连根腐病主要病原菌。相关性分析和指示物种Indicator分析表明黄连根腐病可能是由多种病原菌导致的,其中主要包括Fusarium、Volutella、Exophiala和Cylindrocarpon[8]。但本研究仅分离得到12株病原菌,均属于镰刀菌属真菌,这可能与取样和分离条件有关,需要进一步的研究。

续表2

表3 拮抗真菌汇总表Tab.3 Summary of antagonistic fungi
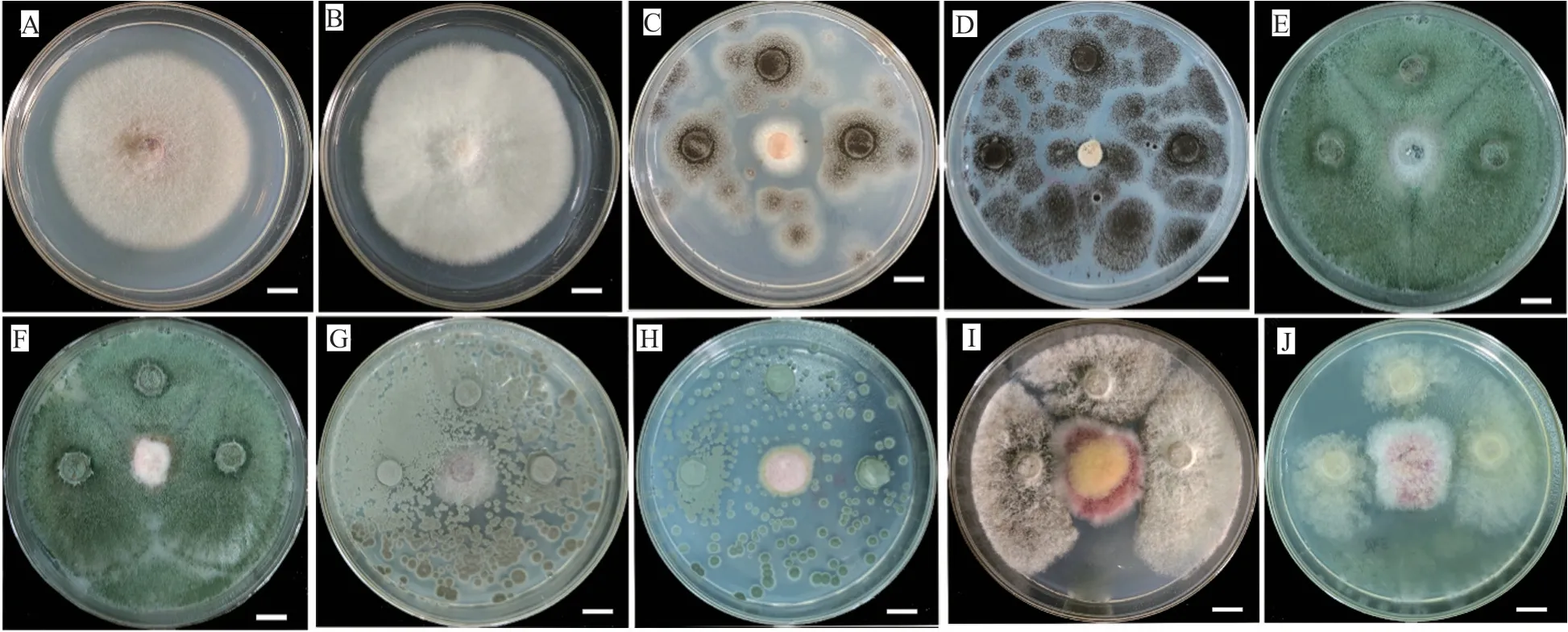
图6 拮抗真菌与病原菌的平板拮抗活性Fig.6 The antagonistic activities of four representative antagonistic fungi and pathogens
扩增子测序分析发现黄连根际根内具有丰富多样的微生物,微生物网络分析表明,黄连根系存在的大量微生物与黄连根腐病病原菌镰刀菌属细菌具有拮抗作用。本实验采用多种培养基对黄连根际根内微生物进行分离培养,最终获得427株根际菌,345株根内菌,其中包括358株根际细菌,170株根内细菌,69株根际真菌,175株根内真菌。经过平板拮抗实验共获得77株拮抗菌,其中拮抗细菌58株,拮抗真菌19株。细菌主要分布于芽胞杆菌属(Bacillus)、假单胞菌(Pseudomonas)和寡养单胞菌属(Stenotrophomonas)等。真菌主要分布于虫草菌属(Cordyceps)、曲霉菌属(Aspergillus)、毛壳菌属(Chaetomium)、间座壳属(Diaporthe)、木霉菌属(Trichoderma)、青霉属(Penicillium)和炭疽菌属(Colletotrichum)。

图8 拮抗细菌系统发育树(芽胞杆菌属)Fig.8 Phylogenetic tree of antagonistic bacteria(Bacillus Sp.)
据文献报道,芽胞杆菌属细菌,包括多种从本草中分离得到的B.s u b t i l i s[20-21]、B.p s e u d o m y c o i d e s[22]、B.m y c o i d e s[23]、B.ν e l e z e n s i s[24-25]、B.w i e d m a n n i i[26]、B.thuringiensis[27-28]、B.toyonensis[29-30]、B.cereus[31]、B.aryabhattai[29,32-33]等细菌对多种植物病虫害具有防治作用,对宿主还有一定的促生作用。氯仿假单胞菌(P.chlorographis)能产生广谱的抗真菌因子(AFFs),包括疏水化合物吩嗪-1-甲酰胺(PCN)、氰化氢、几丁质酶和蛋白酶,被用作番茄根腐病病原菌Fusarium oxysporumf.sp.radicis-lycopersici的生物防治剂[34]。增加假单胞菌的多样性,通过加剧资源竞争和对病原菌的干扰,能够显著提高假单胞菌对病原菌的抑制作用,降低宿主发病率[35]。S.rhizophila对植物病原性真菌例如黄萎病菌(Erticillium dahliae),茄子根瘤菌(Rhizoctonia solani),菌核盘菌(Sclerotinia sclerotiorum)和人致病性真菌白念珠菌(Candida albicans)具有拮抗活性[36]。
毛壳菌(Chaetomium)被报道为一种广谱生物杀菌剂,用于防治枯萎病等植物病害[37]。C.globosum能够产生chaetoviridins A和B,chaetoviridins A处理可抑制稻瘟病和小麦叶锈病的发生超过80%[38]。从马铃薯干腐病罹病薯块上分离得到的Acrostalagmus luteo-albus对马铃薯块没有致病性,对硫色镰刀菌(F.sulphureum)、草莓鲜壳孢(Zythia fragariae)、西瓜壳二孢(Ascochyta citrullina)、立枯丝核菌(Rhizoctonia solani)、茄链格孢(Alternaria solani)、嗜果刀孢(Clasterosporium carpophilum)及芸薹生链格孢(A.brassicicola)有明显的抑菌或溶菌作用[39]。A.νersicolor[40]、T.harzianum[41-42]具有一定的抗真菌活性,木霉菌属(Trichoderma)[43]可以通过产生抗生素、调节茉莉酸/水杨酸(SA)相关的防御途径和形成生物膜来保护植物。这些真菌可以作为黄连或者其他植物镰刀菌病害防治的候选菌株。
但是A.fumigatus[44]被报道能不同程度地引起植物发生病变。而在本实验的平板对峙实验中表明A.fumigatus对F.solani和F.aνenaceum具有一定的抑制作用,本文推测可能是能源物质和生态位竞争促使A.fumigatus对黄连根腐病致病菌产生一定的拮抗作用。以上拮抗菌筛选结果仅为初步定性和文献推测结果,其拮抗机制和实际应用有待进一步研究。
在黄连根腐病拮抗初筛平板拮抗实验中,多种因素可能会导致假阳性,课题组选择其中4株在离体根和平板上均具有较强拮抗活性的芽胞杆菌[BCA,B.νelezensisGJ-JM-1,B.subtilisGJTR-064,B.mycoidesGJ-LB-021,B.pseudomycoidesGJ-YEM-005]。于大田环境下,采用人工接种F.solaniCC-JING-1诱导黄连根腐病发生,提前7 d接种或接种Fs后在接种4株芽胞杆菌的混合菌液,评价BCA对黄连根腐病的预防和作用。结果发现BCA对黄连根腐病具有一定的防治作用。后期课题组将对4株芽胞杆菌对黄连根腐病的防治作用进行进一步的评价及应用研究。

