云南不同富营养化程度湖泊中产毒蓝藻藻毒素基因多样性研究
陈 彤,王志龙,刘 丽
(昆明理工大学 生命科学与技术学院,云南 昆明 650500)
0 引 言
淡水湖泊水体富营养化引发的蓝藻水华及有毒蓝藻产生的藻毒素,对水体生态、人类和动物的健康构成了重大风险[1-2].蓝藻毒素是产毒蓝藻的次级代谢产物,种类繁多,包括肝毒素、神经毒素和皮肤毒素,其中肝毒素和神经毒素对人类的健康危害最为严重[3].具有肝毒性的环肽类微囊藻毒素是分布最为广泛,研究最为深入的蓝藻毒素,主要由微囊藻属(Microcystis)、鱼腥藻属(Anabaena)、念珠藻属(Nostoc)、浮丝藻属(Planktothrix)、费氏藻属(Fischerella)等蓝藻产生.鱼腥藻毒素和麻痹性贝类毒素是两种与动物急性中毒有关的淡水神经毒素[4].鱼腥藻毒素由鱼腥藻属、束丝藻属(Aphanizomenon)、拟柱孢藻属(Cylindrospermopsis)等藻类产生,主要包括鱼腥藻毒素-a、同型鱼腥藻毒素-a和鱼腥藻毒素-a(s)三种类型.麻痹性贝类毒素由亚历山大藻属(Alexandrium)、鱼腥藻属等藻类产生,具有超过50种类似物,主要包括石房蛤毒素、新石房蛤毒素等.
常用的检测藻毒素的方法有高效液相色谱的化学法[5]和酶联免疫测定的生化法[6],主要用于检测已释放至环境中的蓝藻毒素种类及浓度.而基于蓝藻的分子生物学的研究发现,不同蓝藻毒素的生物合成受到不同藻毒素合成酶基因簇的调控,如:mcy(microcystin synthesis gene)基因簇参与微囊藻毒素的合成[7]、ana(anatoxin synthesis gene)基因簇参与鱼腥藻毒素的合成[8],sxt(saxitoxin synthesis gene)基因簇参与麻痹性贝类毒素的合成[9].产毒蓝藻细胞基因组中含有的藻毒素合成酶基因可对毒素的产生进行调控,无毒藻株中则不含有藻毒素合成酶基因,这为特异性地研究产毒蓝藻提供了重要的方法手段[10].同时,通过蓝藻毒素合成酶相关基因簇的分子检测[11]可用于鉴别有毒与无毒藻株,具有快速简便、特异性及灵敏度高的特点,对预测预警有毒藻华的发生具有重要作用.Lee等[12]基于已知的mcyA基因引物设计的新型引物探针可准确捕捉且量化湖泊环境中的mcyA基因,并区分该基因的系统发育起源.Liu等[13]基于PCR技术将Cy5标记的dCTPs引入反应体系中以进行荧光修饰,并利用特异性ssDNA探针实现了准确并迅速地在混合样品中检测到产毒微囊藻.John等[14]运用巢式PCR技术,对澳大利亚维多利亚州67个地点的地表水进行anaC基因的检测,并通过系统发育分析,发现该地区蓝藻anaC基因与Cuspidothrix、颤藻属(Oscillatoria)、长孢藻属(Dolichospermum)、鱼腥藻属和束丝藻属同源性较高(90%~100%).Grachev等[15]对流入贝加尔湖的伊尔库茨克水库及安加拉河流域的石房蛤毒素的研究发现,该流域内sxtA基因与束丝藻属、鱼腥藻属和长孢藻属同源性较高(99%~100%).
地处中国西南部云贵高原的抚仙湖,是中国第二深的湖泊,其淡水储量占全国湖泊总储量的9%,综合水质达到Ⅰ类,是最重要的一级饮用水源之一.紧邻抚仙湖的星云湖,因其独特的地理位置在工农业生产中起到重要作用,但因污染严重,其水质为劣(Ⅴ类)[16],并且自2000年起,星云湖中每年夏秋季节会爆发以微囊藻为主的大规模蓝藻水华.在不同富营养化湖泊中蓝藻种群、产毒蓝藻种类均存在差异,并且藻毒素种类与产毒蓝藻种类直接相关.目前,对于两个湖泊中产毒蓝藻的种类及藻毒素基因的多样性研究尚未见研究报道,因此,本研究基于常规PCR技术检测不同富营养化湖泊中产毒蓝藻藻毒素基因的多样性,目的在于研究不同富营养化湖泊中产毒蓝藻的多样性,建立有毒蓝藻水华预警方法,降低其危害,补充中国淡水湖泊在产毒蓝藻及藻毒素方面的相关研究,保护湖泊水质健康和生态安全.
1 材料与方法
1.1 样品采集与处理
分别于2019年丰水期(7月)、平水期 (10月)、2020年枯水期 (1月)的每月中旬在星云湖XY-1(102°48′21″E,24°23′6″N)、XY-2(102°46′43″E,24°22′43″N)、XY-3(102°45′55″E,24°21′17″N)、XY-4(102°45′28″E,24°18′42″N)、XY-5(102°47′57″E,24°18′58″N)、XY-6(102°48′11″E,24°20′37″N)这6个采样点和抚仙湖FX-1(102°50′29″E,24°33′29″N)、FX-2(102°51′41″E,24°27′16″N)、FX-3(102°49′26″E,24°23′35″N)、FX-4(102°52′51″E,24°22′48″N)、FX-5(102°56′18″E,24°31′11″N)、FX-6(102°56′49″E,24°36′43″N)这6个采样点分别采集 0.5 m 处表层水和 2 m 处底层水样各 2 L,各采样点位置如图1所示.为全面探究湖泊中产毒蓝藻藻毒素基因多样性,将采集到的表层水与底层水混合均匀后经 0.45 μm 和 0.22 μm 孔径的纤维滤膜过滤以收集藻细胞,滤膜存于 -80 ℃ 以备后续实验.
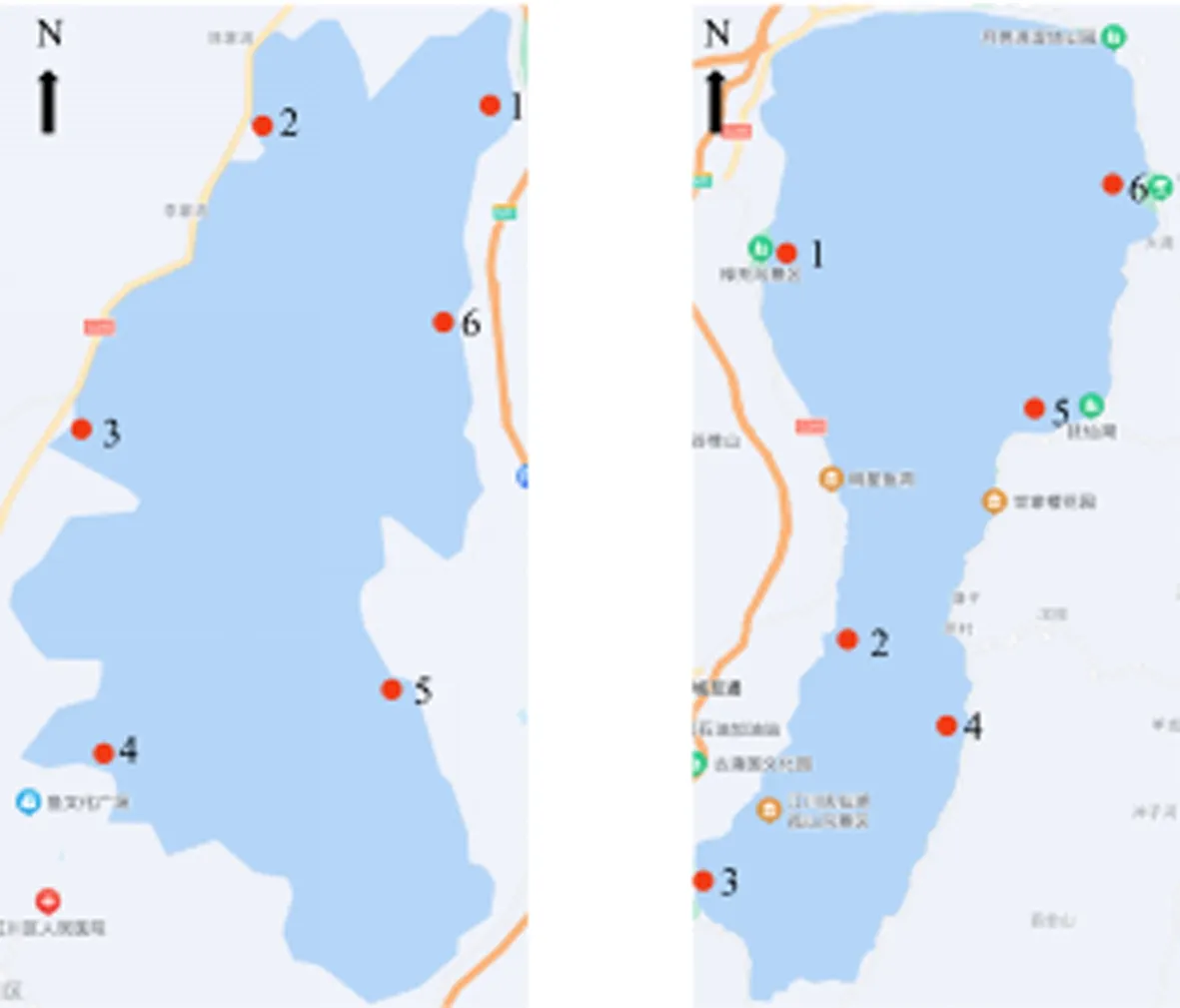
(a) 星云湖 (b) 抚仙湖图1 星云湖和抚仙湖采样点位置图Fig.1 Location of sampling sites in Xingyun Lake and Fuxian Lake
使用活塞式底泥采样器进行各采样点表层沉积物(0~20 cm)样本采集,重复采集3次,混匀后迅速低温避光保存,运送至实验室后,置于 -80 ℃ 冰箱保存.
1.2 藻细胞基因组DNA提取及PCR扩增测定
将 0.45 μm 与 0.22 μm 滤膜四等分后,使用E.Z.N.A.R ® Water DNA Kit试剂盒(OMEGA)提取水体样品藻类总DNA;将新鲜沉积物样品称取 0.25 g 分装到 1.5 mL 无酶离心管中,使用DNeasy Power Soil Kit试剂盒(QIAGEN)提取沉积物中的基因组DNA.采用微囊藻毒素合成酶基因mcyA、鱼腥藻毒素合成基因anaC.以及麻痹性贝类毒素合成酶基因sxtA,对提取的DNA进行PCR检测,引物序列以及退火温度见表1.PCR反应体系为Premix Taq(2×)(TaKaRa) 10.0 μL,正、反向引物各 1 μL(10 μmol/L),ddH2O 5.0 μL,模板DNA 3.0 μL,总体积 20 μL.反应条件为 95 ℃ 预变性 5 min,95 ℃ 变性 30 s,退火 30 s,72 ℃ 延伸 60 s,40个循环,72 ℃ 延伸 7 min.使用1.5%琼脂糖凝胶电泳测定目的片段.
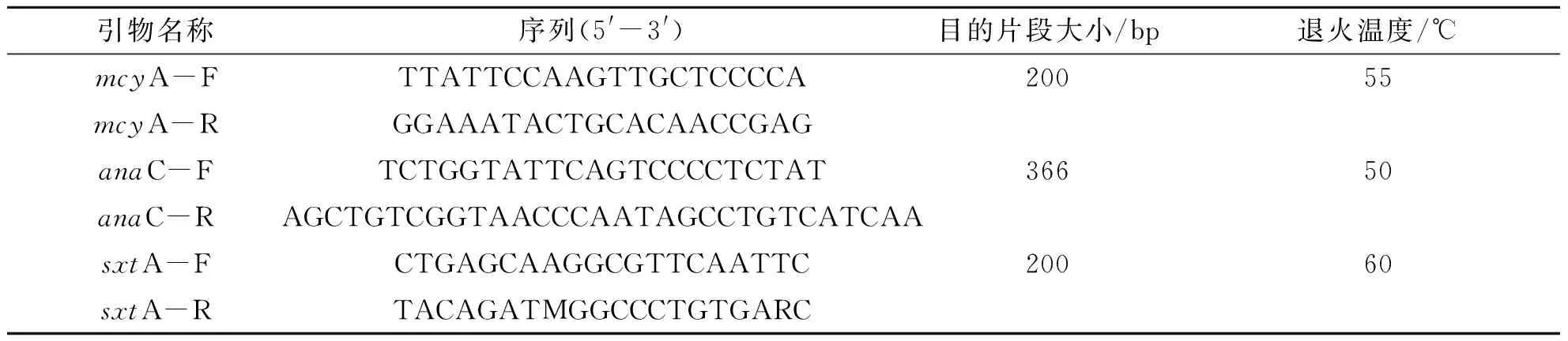
表1 藻毒素合成酶基因引物序列
1.3 胶回收、TA克隆及测定序列
使用TIANgel Purification Kit胶回收试剂盒(TIANGEN)纯化扩增后的目的片段,采用pEASYR-T1 Cloning Kit(TransGen Biotech)将载体与目的片段连接并转化入感受态细胞中,于LB平板上隔夜培养后挑取单克隆菌落震荡培养,并对菌液进行PCR阳性重组子菌落鉴定,将阳性菌液送至昆明硕擎生物科技有限公司进行测序.
1.4 系统进化分析
将测序得到的序列经NCBI BLAST比对后,使用Mega 6.0软件中的ClastalW分别对得到的mcyA、anaC、sxtA基因序列以及各自的参考序列进行比对,运用NJ法构建mcyA、anaC、sxtA基因的系统进化树进行遗传多样性分析.
2 结果与分析
2.1 PCR扩增及克隆测序星云湖和抚仙湖藻毒素基因
从星云湖和抚仙湖水体及沉积物样品中提取藻细胞DNA进行普通PCR扩增.图2为水体样品中的各藻毒素基因的凝胶电泳,mcyA、anaC和sxtA基因分别在 200 bp、366 bp 和 200 bp 处有单一且明亮的条带,与目的基因片段大小相符.两个湖泊不同采样点均能成功扩增出藻毒素合成酶基因,表明mcyA、anaC和sxtA基因广泛存在于星云湖及抚仙湖水体中.对湖泊沉积物样品的检测发现,三种藻毒素基因在抚仙湖沉积物样品中均未被检出,在星云湖沉积物样品中仅检测到的mcyA基因(图3).在抚仙湖和星云湖水体样品中分别获得mcyA、anaC和sxtA基因有效序列各18条,星云湖沉积物样品中共获得18条mcyA基因有效序列.
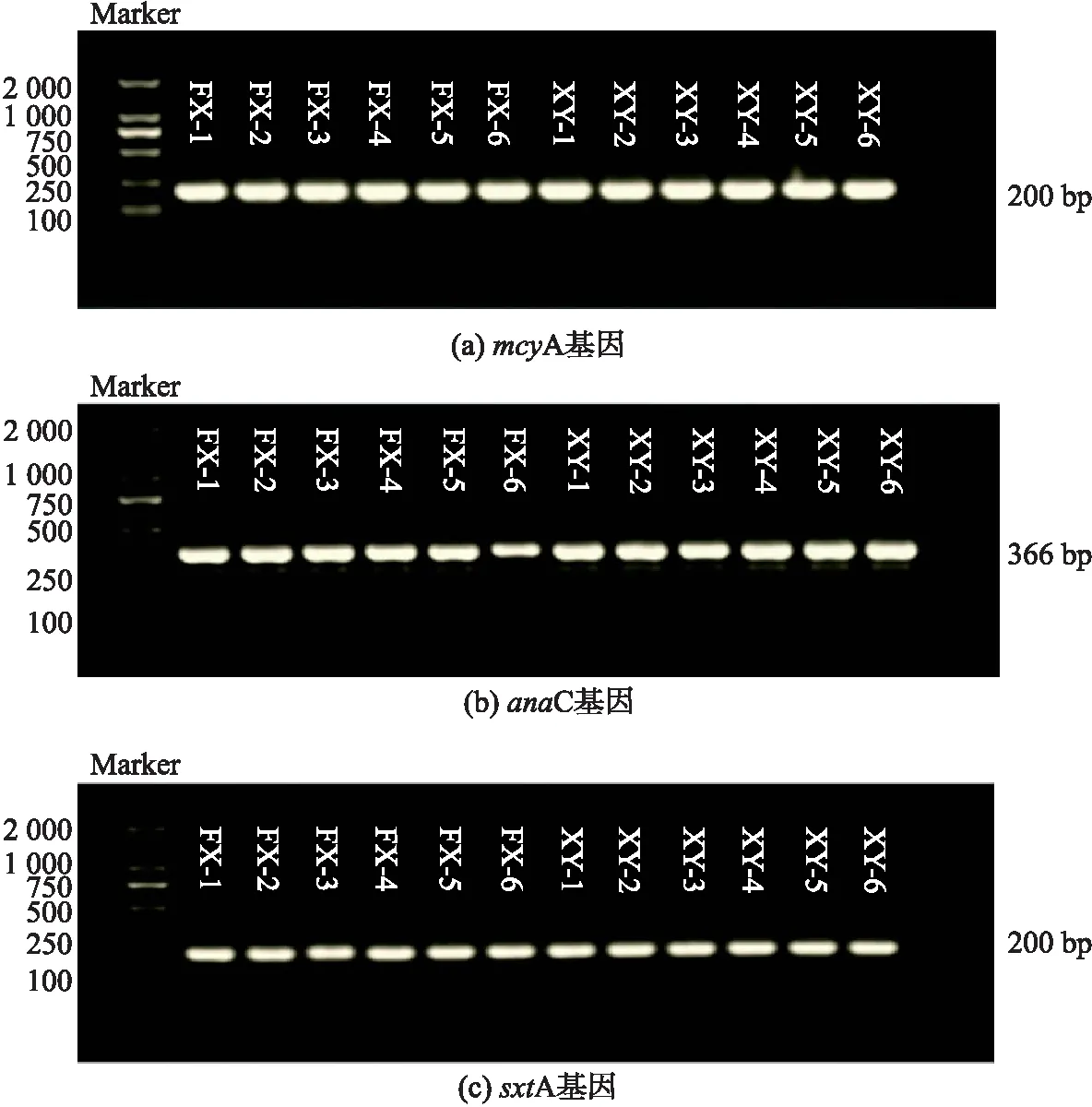
图2 水体中各类藻毒素基因琼脂糖凝胶电泳图 Fig.2 Agarose gel electrophoresis of cyanobacteria toxin genes for water samples
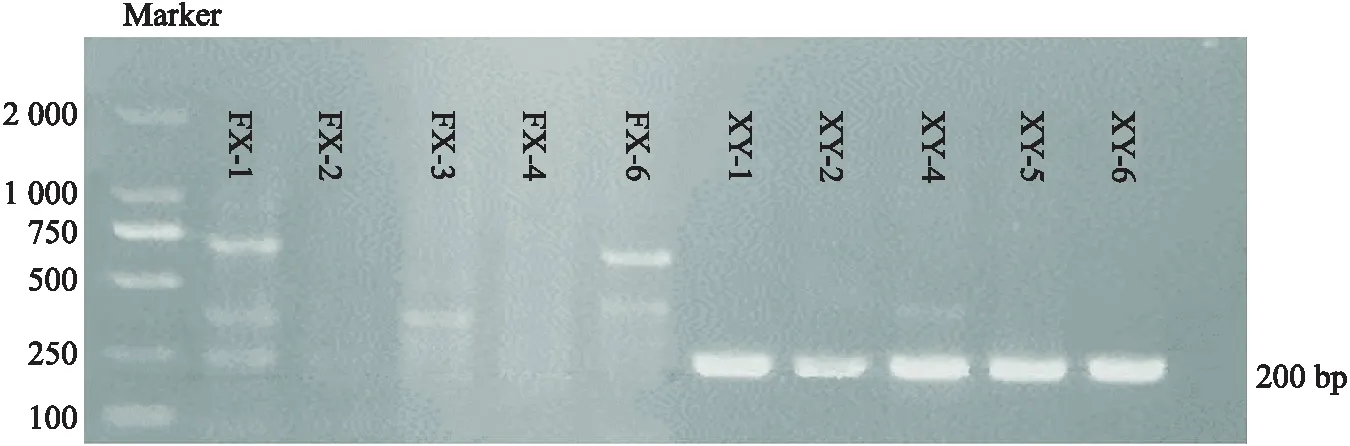
图3 沉积物样品中mcyA基因琼脂糖凝胶电泳图Fig.3 Agarose gel electrophoresis of mcyA gene for sediment samples
2.2 星云湖和抚仙湖藻毒素基因多样性分析
抚仙湖以FX为标记,星云湖以XY为标记,丰水期、平水期和枯水期的水体样品以W07、W10和W01作为标记,沉积物以S07、S10和S01作为标记.
2.2.1 产微囊藻毒素mcyA基因多样性分析
将获得的样品mcyA基因序列与代表性mcyA基因参考序列在核苷酸水平上构建系统进化树(图4).所有序列可划分为2个进化簇(Cluster Ⅰ和Cluster Ⅱ).包括微囊藻属的mcyA基因参考序列(序列号为:MG573265.1、 AB110104.1、 KU867770.1、 KU867767.1 KU867672.1、 JF799859.1、 JF799858.1和AF139343.1),以及本研究所获得的mcyA基因序列均聚集在Cluster Ⅰ.Cluster Ⅱ包括的mcyA基因参考序列有念珠藻属(序列号为:AJ515475.1和JX644441.1)、鱼腥藻属(序列号为:AJ515463.1、AJ515466.1、GQ466581.1和GQ466582.1)、席藻属(Phormidium)(序列号为:JQ771633.1和JQ771633.1)和浮丝藻属(序列号为:AJ515474.1和AJ515468.1),但不包含样本序列.推测抚仙湖和星云湖水体及沉积物中mcyA基因多样性较为单一,主要由微囊藻属产毒蓝藻产生,且在丰水期、平水期和枯水期三个时期普遍存在.

图4 产毒蓝藻mcyA基因系统进化树Fig.4 The phylogenetic tree of mcyA gene in toxic cyanobacteria
2.2.2 产鱼腥藻毒素anaC基因多样性分析
将获得的样品anaC基因序列与代表性anaC基因参考序列在核苷酸水平上构建系统进化树(图5).所有序列可划分为2个进化簇(Cluster Ⅰ和Cluster Ⅱ)和4个亚簇(A、B、C和D).抚仙湖的水体样本以及星云湖XY2水体样本中的anaC基因序列与颤藻属参考序列(序列号为:JF803654.1)聚集在Cluster Ⅰ的A亚簇中,星云湖其他采样点水体样本的anaC基因序列与束丝藻属(序列号为:JF803655.1)以及未培养的蓝藻属(Unculturedcyanobacterium)参考序列(序列号为:KR813877.1、KR813879.1和KR813869.1)聚集在Cluster Ⅱ的D亚簇中.B亚簇和C亚簇分别包含颤藻属(序列号为:F803651.1和JF803656.1)、席藻属(序列号为:KX016041.1和KX016040.1)、束丝藻属(序列号为:KP718897.1和KP718896.1.)和鱼腥藻属(序列号为:JF803657.1 、JF803646.1和JF803647.1)的anaC基因参考序列.推测抚仙湖中的anaC基因主要由颤藻属蓝藻产生,星云湖中的anaC基因则主要由束丝藻属及颤藻属产生,且在丰水期、平水期和枯水期三个时期普遍存在.
2.2.3 产麻痹性贝类毒素sxtA基因多样性分析
将获得的样品sxtA基因序列与代表性sxtA基因参考序列在核苷酸水平上构建系统进化树(图6).所有序列可划分为4个进化簇(Cluster Ⅰ-Ⅳ).抚仙湖和星云湖水样中的sxtA基因序列与鱼腥藻属(序列号:EU629178.1和EU629176.1)、束丝藻属(序列号:MH113429.1、HQ157715.1、HQ157716.1、MH113429.1和JN837673.1)、长孢藻属(序列号:HQ157701.1和MH464587.1)的参考序列聚集在Cluster Ⅰ中,Cluster Ⅱ中包括拟柱胞藻属的sxtA基因参考序列(序列号:EU629178.1和MN417330.1),Cluster Ⅲ包括伪枝藻属(Scytonema)(序列号:JQ182302.1)和Heteroscytonema(序列号:MG976919.1)的sxtA基因参考序列,Cluster Ⅳ包括鞘丝藻属(Lyngbya)的sxtA基因参考序列(序列号:EU603711.1和EU629174.1).本研究的样本序列未分布在Cluster Ⅱ-Ⅳ中,推测抚仙湖和星云湖中的sxtA基因主要由鱼腥藻属、束丝藻属、长孢藻属产生,且在丰水期、平水期和枯水期三个时期普遍存在.
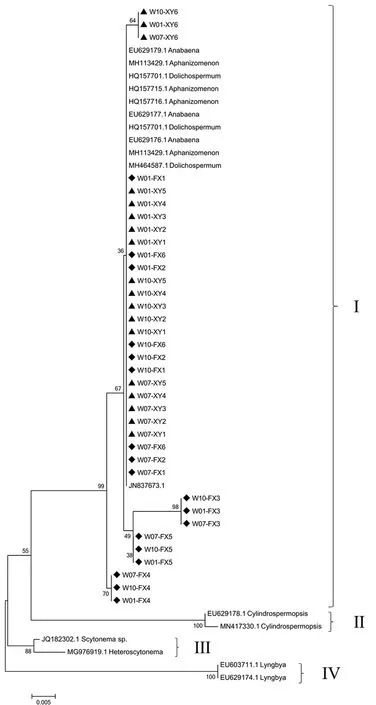
图6 产毒蓝藻sxtA基因系统进化树Fig.6 The phylogenetic tree of sxtA gene in toxic cyanobacteria
3 讨 论
运用常规PCR技术以mcyA、anaC、sxtA蓝藻毒素合成酶基因为靶基因,对两个不同营养型湖泊水体和沉积物进行产毒蓝藻多样性分析.结果表明,在贫营养的抚仙湖和富营养化的星云湖水体样品中均可检测到这三种蓝藻毒素合成酶基因,仅在星云湖的沉积物样品中检测到产微囊藻毒素mcyA基因.抚仙湖水体中叶绿素含量低,藻类生物丰度低,且由于蓝藻具有趋光性且可使用IV型菌毛直接向光源移动[17],致使在贫营养化湖泊抚仙湖的沉积物中蓝藻生物吸附及含量低,故在沉积物样品中未检测到蓝藻毒素合成酶基因.富营养化湖泊中,水体表面水华可以阻止光线到达湖泊底层,从而影响底栖的初级生产者,并且在以微囊藻为优势蓝藻的水体中,微囊藻会吸附到悬浮颗粒物上[18]并沉降至水体底部.富营养化的星云湖中常年爆发以微囊藻为优势藻种的蓝藻水华[19],微囊藻通过吸附等作用沉降于沉积物中,故在星云湖的沉积物样品中检测到了mcyA基因.通过构建mcyA基因系统进化树分析发现,两个湖泊中的mcyA基因序列均与微囊藻属的基因参考序列相似度较高.Li等[20]对太湖和阳澄湖中的微囊藻毒素mcyA基因的多样性研究发现同一区域的两个湖泊中mcyA基因序列较为相似且存在高度保守性.Bukowska等[21]对波兰东北部的8个湖泊中mcyA基因多样性的研究发现,在该区域内mcyA基因多样性较为单一,这与本研究结果一致,因此推测在同一地区的湖泊内,mcyA基因同源性较高.
目前对藻毒素的研究主要集中于微囊藻毒素,加强对其他藻毒素的研究是大势所趋.鱼腥藻毒素和麻痹性贝类毒素都属于神经毒素类,对人类的生产生活有较大的负面影响.截止2020年已经确定了有41种藻类物种可产生鱼腥藻毒素以及15种藻类物种可产生麻痹性贝类毒素[4].将两个湖泊中获得的鱼腥藻毒素anaC基因序列与参考序列构建进化树发现,抚仙湖anaC序列和星云湖XY2采样点获得的anaC序列与颤藻属的基因参考序列相似度较高,而星云湖其他采样点的anaC序列则与束丝藻属的基因参考序列相似度较高.John等人[14]对澳大利亚维多利亚州地表水中检测得到的23条anaC序列进行系统发育分析,结果发现同一区域内不同水体样本的anaC序列同源性具有一定差异,这与本研究结果一致.推测同一地区不同湖泊中anaC基因序列会存在差异是与湖泊本身的理化性质、蓝藻群落组成等因素相关.sxtA基因编码麻痹性贝类毒素生物合成的第一步骤,并且高度保守[22],本研究中的sxtA基因与鱼腥藻属、束丝藻属、长孢藻属的sxtA基因序列同源性较高,表明在抚仙湖和星云湖中sxtA基因由上述藻属的蓝藻产生.本研究对于藻毒素合成酶基因的定性检测发现,在星云湖和抚仙湖中均存在着不同的产毒蓝藻藻种.刘玉珊等[23]对同处于云贵高原滇池中产毒蓝藻产毒基因的多样性研究表明在滇池海埂水域中蓝藻产毒基因多样性较为单一,mcyE基因主要由微囊藻属藻类产生,anaC和sxtA基因主要由束丝藻属藻类产生,这与本研究中对于星云湖样品的研究结果类似,推测在云南省富营养化程度严重的湖泊中,蓝藻毒素基因多样性受到湖泊中优势蓝藻的影响.在氮、磷元素含量丰富的富营养化水体中,蓝藻以及产毒蓝藻会过量繁殖并产生藻毒素,从而形成有毒蓝藻水华,蓝藻毒素合成酶基因丰度会受到湖泊内产毒蓝藻含量的影响.本研究组基于三种藻毒素基因的定量检测结果表明,虽在贫营养化的抚仙湖和富营养化的星云湖水体中均检测到mcyA、anaC、sxtA蓝藻毒素合成酶基因,但其丰度在两个湖泊中存在显著差异,由于富营养化的星云湖中存在较高的蓝藻生物量,各类藻毒素基因丰度显著高于贫营养化的抚仙湖,并且在蓝藻水华爆发的丰水期,星云湖中藻毒素基因丰度会达到峰值.
4 结 论
有毒蓝藻水华严重威胁水生生态环境甚至影响人类健康,对于产毒蓝藻藻毒素基因的分子检测有利于预警有毒蓝藻水华的发生,为建立准确、快速、有效的预测有毒蓝藻水华及产毒藻种的方法,需分析不同富营养型湖泊中产毒蓝藻种类以及藻毒素类型.本研究发现:
1) 同处于云南省玉溪市的抚仙湖和星云湖富营养化状态具有显著差异,仅在富营养化程度高的星云湖沉积物样本中检测到mcyA基因,而在两个湖泊的水体样本中均能检测到mcyA、anaC、sxtA基因,但各类藻毒素合成酶基因丰度存在差异.
2) 不同湖泊中藻毒素合成酶基因分属于不同的产毒蓝藻,mcyA基因在两个湖泊中的主要生产者是微囊藻属,anaC基因在贫营养化的抚仙湖中主要由颤藻属产生,在富营养化的星云湖中主要由束丝藻属产生,sxtA基因主要由鱼腥藻属、束丝藻属、长孢藻属产生.
3) 贫营养化湖泊中同样存在产毒蓝藻并具有生产藻毒素的潜力.
本研究综合分析了不同富营养化湖泊中存在的产毒蓝藻及潜在的产毒能力,对建立快速检测湖泊中产毒蓝藻的方法及预警有毒蓝藻水华的发生具有重要意义,在实际应用中可通过结合酶联免疫吸附试验(ELISA)等具体毒素含量测定方法来了解产毒蓝藻产生藻毒素机理,分析产毒机制,为水生生态环境治理提供技术支撑.

